Перейти к:
Оценка разработанной модели экспериментального ринита у лабораторных крыс: доклиническое экспериментальное рандомизированное исследование
https://doi.org/10.25207/1608-6228-2023-30-1-78-87
Аннотация
Введение. Среди повреждающих факторов, воздействующих на мукоцилиарную систему полости носа, особую актуальность в практике оториноларинголога имеет операционная травма. Определенные трудности в клинике возникают при оценке состояния регенерации мукоцилиарной системы, так как применение прижизненного морфологического исследования слизистой оболочки носа у пациентов травматично. Поэтому весьма актуальным для изучения патоморфологических изменений мукоцилиарной системы в динамике, оценки регенерации эпителия остается разработка моделей экспериментальных ринитов на лабораторных животных.
Цель исследования: оценка разработанной модели экспериментального ринита у лабораторной крысы путем изучения клинических, морфологических и биохимических изменений при воспалительном процессе.
Методы. Модель экспериментального ринита была разработана и апробирована на 60 половозрелых крысах-самцах линии Wistar. Все животные были рандомизированы в две группы: экспериментальная группа 1 (n = 30) — крысы, у которых выполнялось моделирование экспериментального ринита, и группа 2 (n = 30) контрольная, интактные животные. В ходе эксперимента в обеих группах для оценки динамики воспалительной реакции у крыс исследовали содержание СРБ в крови, оценивали лейкоформулу, проводили морфологическое исследование слизистой оболочки перегородки носа на 2, 5, 10-й дни после травмы. Статистическую обработку результатов исследования проводили с помощью программы Statistica 8.0 (StatSoft, Inc., США).
Результаты. После травмы у крыс в экспериментальной группе 1 развивается острый ринит, который клинически проявляется выделением из ноздрей слизистого или слизисто-гнойного секрета, чиханием с расчесыванием носа. В крови в сравнении с контрольной группой отмечается повышение уровня СРБ, палочкоядерных и сегментоядерных нейтрофилов, снижение лимфоцитов. Микроскопическая характеристика изменений слизистой оболочки носовой перегородки показала, что острая фаза экссудативного воспаления развивается на вторые сутки: на фоне очагов некроза эпителия наблюдается полнокровие сосудов, отек, нейтрофильная воспалительная инфильтрация подслизистого слоя. К пятым суткам в воспалительном инфильтрате возрастает доля лимфоцитов и макрофагов, к десятым наблюдаются начальные признаки восстановления целостности эпителиальной ткани — появление недифференцированного регенерирующего эпителия.
Заключение. Результаты исследования показали, что была получена адекватная экспериментальная модель острого ринита у лабораторных животных. Клинические проявления и изменения в показателях крови характерны для острого воспалительного процесса. У экспериментальных животных после нанесения хирургической травмы в слизистой оболочке перегородки носа развиваются характерные деструктивные и репаративнопролиферативные изменения.
Ключевые слова
Для цитирования:
Берест И.Е., Тананакина Т.П., Телешова О.В., Бургело Е.В., Паринов Р.А., Корецкий А.В. Оценка разработанной модели экспериментального ринита у лабораторных крыс: доклиническое экспериментальное рандомизированное исследование. Кубанский научный медицинский вестник. 2023;30(1):78-87. https://doi.org/10.25207/1608-6228-2023-30-1-78-87
For citation:
Berest I.Ye., Tananakina T.P., Teleshova O.V., Burgelo E.V., Parinov R.A., Koretsky A.V. Evaluating the Developed Model of Experimental Rhinitis in Laboratory Rats: Pre-Clinical Experimental Randomized Study. Kuban Scientific Medical Bulletin. 2023;30(1):78-87. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-1-78-87
ВВЕДЕНИЕ
Воспаление, возникающее в слизистой оболочке (СО) верхних дыхательных путей в ответ на воздействие разнообразных повреждающих факторов, является защитно-приспособительной реакцией организма, которая характеризуется развитием альтеративно-дистрофических, сосудисто-экссудативных и пролиферативных реакций. Среди повреждающих факторов, воздействующих на мукоцилиарную систему (МЦС) полости носа, особую актуальность в практике оториноларинголога (ЛОР-практике) имеют патогенная флора, травма, в частности операционная, и химический фактор (длительное бесконтрольное воздействие медикаментозных препаратов на СО носа) [1–5].
Определенные трудности в клинике возникают при оценке состояния регенерации МЦС, так как применение прижизненного морфологического исследования СО носа у пациентов травматично. Поэтому весьма актуальным для изучения состояния МЦС остается разработка моделей экспериментальных ринитов на лабораторных животных [6–10].
При анализе литературных данных обращает на себя внимание, что в структуре факторов, вызывающих экспериментальный ринит, преобладает химический фактор с последующим введением патогенной флоры, что связано с тем, что одним из актуальных вопросов экспериментальной фармакологии в отношении дыхательной системы являются инфекционные (гнойные) заболевания. Экспериментальные риносинуситы вызывались введением в носовую полость и околоносовые пазухи носа растворов формалина, нашатырного спирта, взвеси вирусов и бактерий [11–17].
Однако в связи с интенсивным развитием малоинвазивной хирургии актуальным остается вопрос изучения основных звеньев патогенеза нарушений регенерации МЦС носа при воспалительной реакции СО после оперативных вмешательств. На сегодня недостаточно изучен характер патоморфологических изменений СО в процессе заживления, а также основные причины нарушения репарации, способствующие стойкой морфологической трансформации СО [18–25]. На наш взгляд, оптимальным решением данной проблемы может стать разработка и использование методик экспериментального ринита у лабораторных животных.
Цель исследования — разработать и оценить модель экспериментального ринита у лабораторной крысы путем изучения клинических, морфологических и биохимических изменений при воспалительном процессе.
МЕТОДЫ
Экспериментальные животные
Экспериментальное исследование проведено на 60 половозрелых крысах-самцах линии Wistar, массой 250–300 г, полученных из вивария государственного учреждения Луганской Народной Республики «Луганский государственный медицинский университет имени Святителя Луки» (ГУ ЛНР «ЛГМУ им. Святителя Луки»).
Размещение и содержание
Животные содержались в условиях вивария с обеспечением стандартных условий: 12-часовой световой день, свободный доступ к воде и пище, стандартный пищевой и водный рацион, температурный режим 18–25 °C. Содержание и проведение экспериментов осуществлялось в соответствии с нормативными документами: Приказ Министерства здравоохранения РФ от 1 апреля 2016 г. № 199 н «Об утверждении Правил надлежащей лабораторной практики», ГОСТ 33215–2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур», ГОСТ 33044–2014 «Принципы надлежащей лабораторной практики» (утвержден Приказом Федерального агентства по техрегулированию и метрологии № 1700-ст от 20 ноября 2014 г.), Директива 2010/63/EU Европейского парламента и совета Европейского союза по охране животных, European Conventionforthe Protectionof Vertebrate Animals Usedfor Experimentalandother Scientifi c Purposes (ETS 123), Strasbourg, 1986.
Дизайн исследования
Было проведено рандомизированное контролируемое исследование. Сравнивались две группы: экспериментальная группа (n = 30) — крысы, у которых выполнялось моделирование экспериментального ринита, и контрольная группа (n = 30), интактные животные. Дизайн исследования представлен на рисунке 1.
Исследование выполнялось на базе лаборатории кафедры физиологии ГУ ЛНР «ЛГМУ им. Святителя Луки». Морфологические исследования были проведены в отделении патогистологии и иммуногистохимии общества с ограниченной ответственностью (ООО) «Молекулярная диагностика плюс» г. Луганска.
Объем выборки
Было обследовано 70 крыс-самцов, из них 7 не соответствовали критериям включения. Оставшихся животных распределили на две группы: экспериментальная группа 1 (n = 32) — крысы, у которых выполнялось моделирование экспериментального ринита, и группа 2 (n = 31), контрольная, интактные животные. В экспериментальной группе 2 животных (из-за осложнений после наркоза) и 1 животное в контрольной группе (из-за нанесения себе случайной травмы) не закончили протокол исследования в полном объеме.
Критерии включения и исключения
Критерии включения
В исследование включались только самцы крыс массой 250 ± 50 г в возрасте от 6 месяцев до года; без видимой патологии развития и признаков заболеваний.
Критерии невключения
В эксперимент не включались животные, вес которых отличался более чем на 50 г, возраст менее 6 месяцев и более 1 года, с заболеваниями верхних и нижних дыхательных путей, а также не включались особи женского пола.
Критерии исключения
Развитие у животных осложнений после наркоза, нанесение себе дополнительной произвольной травмы и развитие гнойных осложнений нижних дыхательных путей после травмы носа.
Рандомизация
Рандомизация проводилась методом «конвертов».
Обеспечение анонимности данных
При оценке результатов и анализе полученных данных информацией о распределении животных на группы владел только руководитель исследования.
Итоговые показатели (исходы исследования)
Итоговыми показателями, позволившими провести оценку разработанной модели экспериментального ринита, явились изменения лейкоформулы крови, С-реактивного белка (СРБ), морфологическая верификация воспалительной реакции СО на макро- и микропрепаратах носовой перегородки.
Экспериментальные процедуры
Травма СО полости носа наносилась под эфирным наркозом (из расчета 3–5 мл на 1 кг веса) через маску в смеси с атмосферным воздухом. Для травмирования СО полости носа использовали крючок из набора для микроскопических операций на ухе.
Инструмент вводили в каждую ноздрю на глубину до 1,5–1,8 см, развернув крючком к носовой перегородке, и производили линейный разрез на перегородке носа поступательным движением кпереди.
Экспериментальное вмешательство на лабораторных животных проводилось в асептических условиях.
В ходе исследования проводился ежедневный внешний осмотр животных, регистрировались признаки ринита. Для подтверждения развития воспалительной реакции у животных контрольной и экспериментальной групп исследовали лейкоформулу и С-реактивный белок крови методом латекс-усиленной иммунотурбидиметрии. Для изучения морфологических изменений производился забой животных, забор СО носовой перегородки. Полученные образцы фиксировали в 10% растворе формалина, осуществляли проводку в спиртах с возрастающей концентрацией и заливку в парафин. С каждого блока с тканью СО носовой полости животного изготавливали серийные срезы толщиной 5 мкм. Препараты окрашивали гематоксилином и эозином. Микроскопическое исследование выполнялось при увеличении ×100, ×400 с помощью микроскопа PrimoStar (CarlZeiss, ФРГ).
Забор крови, материала для гистоморфологического исследования проводили на 2, 5 и 10-е сутки. Подготовка и оценка микропрепаратов проводилась в течение двух недель.
Уход за животными и мониторинг
Наблюдение за состоянием животных после нанесения травмы носовой перегородки производилось в течение 10 дней. Во время проведения исследований животные имели свободный доступ к пище и воде. В соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях, от 22 сентября 2010 г. животных эвтаназировали помещением в СО2-камеру, в условиях постепенного заполнения камеры диоксидом углерода. Данный вид эвтаназии животных сопровождается минимумом боли, страдания и дистресса.
Статистические процедуры
Принципы расчета размера выборки
Предварительный расчет выборки не производился.
Статистические методы
Статистическую обработку результатов исследования проводили с помощью программы Statistica 8.0 (StatSoft, Inc., США). Гипотеза нормальности распределения в выборках проверялась с помощью критерия W Шапиро — Уилка. Описание количественных данных отличного от нормального распределения проводили с помощью медианы (Me), интерквартильного размаха (25 процентиль / 75 процентиль). Различия между количественными параметрами независимых групп оценивали с помощью непараметрического критерия Манна — Уитни, между зависимыми группами — критерия Вилкоксона. Различия во всех случаях считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
В контрольной группе крыс при забое СО перегородки носа была розовая, без отека, влажная, покрыта прозрачным слизистым секретом (рис. 2).
При гистологическом исследовании также не отмечалось признаков ее воспаления, травмы: цельный реснитчатый эпителий на всем протяжении с четко визуализированными реснитчатыми, базальными и бокаловидными клетками, базальной мембраной и собственной соединительнотканной пластинкой (рис. 3).
Непосредственно после нанесения травмы у крыс экспериментальной группы отмечалось кратковременное необильное носовое кровотечение. На 2-е сутки после травмы при забое в полости носа крыс отмечалось мутное геморрагическое отделяемое, сгустки крови, СО перегородки носа с кровоизлияниями, выраженной инъекцией сосудов, отечна, покрыта геморрагическим экссудатом, определяется линейный дефект носовой перегородки (рис. 4).
На микропрепаратах определяется десквамация и некроз эпителия, кровоизлияния, утолщение субэпителиального слоя за счет отека и нейтрофильной инфильтрации (рис. 5).
На вторые сутки после травмы в крови крыс отмечалось достоверное увеличение уровня СРБ — 0,67; 0,65/0,73 мг/дл в сравнении с контрольной группой — 0,35; 0,35/0,43 мг/дл, увеличение сегментоядерных нейтрофилов и уменьшение лимфоцитов в лейкоформуле (табл.).
Начиная с 3–4-х суток эксперимента у всех крыс в группе 1 наблюдались симптомы острого ринита в виде выделения из ноздрей слизистого или слизисто-гнойного секрета, чихания, хрюканья носом, что сопровождалось периодическим расчесыванием носа.
На 5-й день эксперимента в полости носа крыс определялся вязкий слизисто-гнойный секрет, слизистая оболочка перегородки носа гиперемирована, отечна (рис. 6).
При микроскопическом исследовании на 5-й день нарастают воспалительные изменения: десквамация реснитчатого эпителия и инфильтрация нейтрофильными лейкоцитами, лимфоцитами с примесью макрофагов отмечается на более обширных участках. Базальная мембрана отечна, наблюдается диффузное утолщение субэпителиального слоя за счет нейтрофильной инфильтрации клеток (рис. 7).
В крови крыс экспериментальной группы на 5-й день эксперимента продолжает нарастать уровень СРБ — до 1,220; 1,150/1,230 мг/дл (р < 0,05). Также отмечается повышение уровня палочкоядерных нейтрофилов до 7; 7/7%, сохраняется повышенный уровень сегментоядерных нейтрофилов (42; 39/44%) в сравнении с контрольной группой 33; 32/33%, отмечается снижение лимфоцитов до 45; 40/47% (контроль — 59,5; 55/60%).
К 10-му дню у крыс после травмы дефект на перегородке носа за счет уменьшения отека выглядит более четко, слизистая оболочка в сравнении со 2-м днем более бледная, дефект очищается от детрита. Отделяемое из носа слизистого или слизисто-гнойного характера (рис. 8).
На микропрепаратах отмечаются признаки пролиферации (участки недифференцированного регенерирующего эпителия) на фоне субэпителиальной воспалительной инфильтрации нейтрофилами, макрофагами, лимфоцитами. Базальная мембрана отечна, отмечается полнокровие сосудов (рис. 9).
В крови крыс экспериментальной группы 1 на 10-й день сохраняются признаки воспалительного процесса: повышен уровень СРБ (1,900; 0,457/4,325 мг/дл), сдвиг лейкоформулы влево: повышен уровень палочкоядерных нейтрофилов — 4; 2/6% (в контрольной группе –1,5; 1/2%), статистически значимо в сравнении с 5-м днем эксперимента продолжается повышение сегментоядерных нейтрофилов до 54; 48/56%.
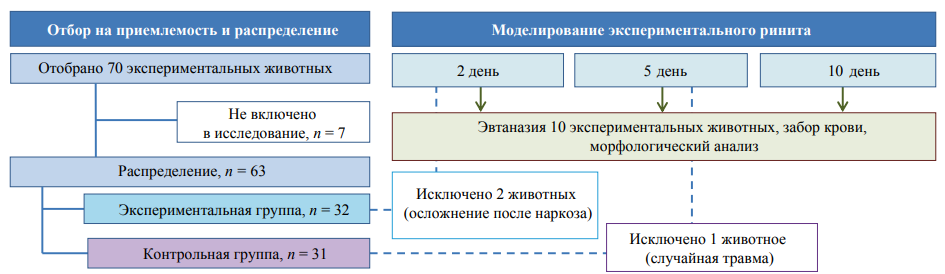
Рис. 1. Блок-схема дизайна исследования.
Примечание: Блок-схема согласно рекомендациям ARRIVE заполнена авторами.
Fig. 1. Study schematic diagram.
Note: the flow-chart according to the recommendations of ARRIVE .
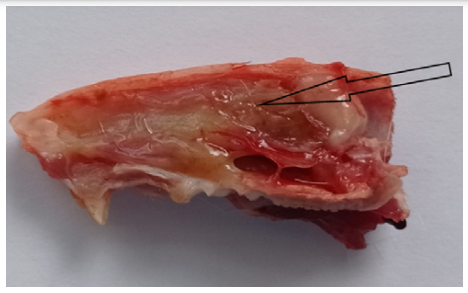
Рис. 2. Носовая перегородка у крысы контрольной группы: слизистая оболочка розовая, без отека, покрыта слизистым секретом (обозначено стрелкой).
Примечание: фотография сделана авторами.
Fig. 2. Nasal septum of a control rat: pink mucous membrane, no edema, covered with mucosal secretion (arrow).
Note: photo taken by the authors.

Рис. 3. Микропрепарат носовой перегородки у крысы контрольной группы, окраска гематоксилин-эозином, коронарная проекция; увеличение ×100: 1 — реснитчатый эпителий; 2 — базальная мембрана; 3 — собственная соединительнотканная пластинка.
Примечание: фотография сделана авторами.
Fig. 3. Nasal septum microslides from a control rat, hematoxylin-eosin staining, coronary projection; (×100): 1 — mucociliary epithelium; 2 — basement membrane; 3 — native connective lamina.
Note: photo taken by the authors.
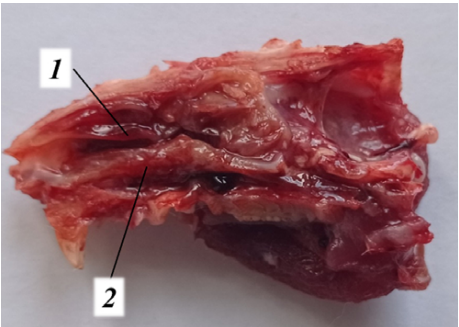
Рис. 4. Носовая перегородка у крысы экспериментальной группы на 2-й день: 1 — кровоизлияние; 2 — инъекция сосудов.
Примечание: фотография сделана авторами.
Fig. 4. Nasal septum in a rat of the experimental group on day 2: 1 — hemorrhage; 2 — vascular injection.
Note: photo taken by the authors.
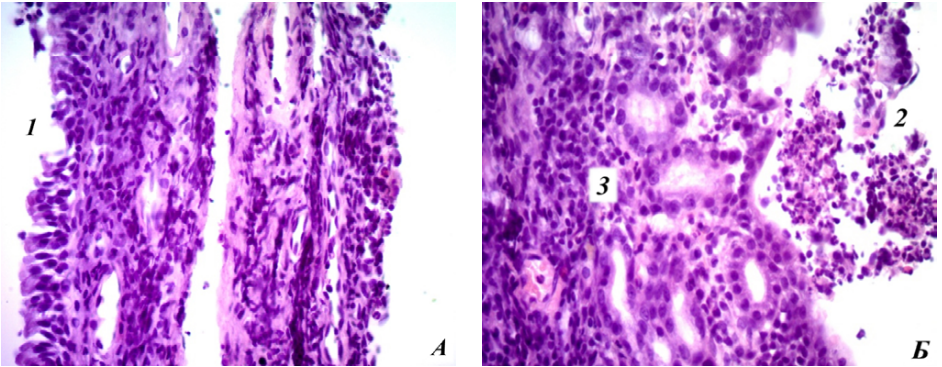
Рис. 5. Микропрепараты носовой перегородки у крысы экспериментальной группы после травмы на 2-й день, окраска гематоксилин-эозином, коронарная проекция: А — увеличение ×100: 1 — десквамация эпителия; Б — увеличение ×400: 2 — диапедезное кровоизлияние; 3 — нейтрофильная инфильтрация.
Примечание: фотографии сделаны авторами.
Fig. 5. Nasal septum microslides from an experimental rat on day 2 after injury, hematoxylin-eosin staining, coronary projection: A (×100): 1 — desquamation of epithelium; Б (×400): 2 — diapedetic hemorrhage; 3 — neutrophil infiltration.
Note: photo taken by the authors.
Таблица. Показатели крови у крыс
Table. Blood parameters in rats
Параметры | Группа 1 (экспериментальная) n = 30 | Группа 2 (контрольная) n = 30 | ||||
Сроки выведения из эксперимента (дни) | ||||||
2-й | 5-й | 10-й | 2-й | 5-й | 10-й | |
Me; 25/75% | Me; 25/75% | Me; 25/75% | Me; 25/75% | Me; 25/75% | Me; 25/75% | |
СРБ (мг/дл) | 0,675; 0,653/0,734*# | 1,220; 1,150/1,230*# | 1,900; 0,457/4,325*# | 0,351; 0,345/0,426* | 0,370; 0,345/0,426* | 0,353; 0,236/0,431* |
Палочкоядерные нейтрофилы, % | 2; 2/4# | 7; 7/7*#☼ | 4; 2/6*☼ | 1,5; 1/2 | 2; 1/2* | 1,5; 1/2* |
Сегментоядерные нейтрофилы, % | 41; 33/42*# | 42; 39/44*☼ | 54; 48/56*#☼ | 33,5; 33/36* | 33; 32/33* | 33; 32/34* |
Эозинофилы, % | 1; 1/2 | 2; 1/3 | 2; 2/2 | 2; 1/2 | 2; 1/2 | 2; 2/3 |
Лимфоциты, % | 51; 49/60*# | 45; 40/47*# | 37,5; 29/45*# | 60; 55/60* | 59,5; 55/60* | 60; 57/60* |
Моноциты, % | 4; 3/6 | 4,5; 3/8 | 2,5; 2/6 | 4; 3/5 | 5; 4/8 | 4,5; 4/5 |
Примечание: таблица составлена авторами; значками отмечены статистически значимые (р < 0,05) отличия: * — между экспериментальной группой 1 и контрольной группой 2 (критерий Манна — Уитни); # — между показателями на 2-й день травмы и другими сроками выведения (критерий Вилкоксона).; ☼ — между показателями на 5-й день травмы с другими сроками выведения (критерий Вилкоксона). СРБ — С- реактивный белок.
Note. Symbols indicate statistically significant differences (p < 0.05): * — between experimental group #1 and control group #2 (Mann—Whitney test); # — between the parameters on day 2 after injury and other periods (Wilcoxon test); ☼ — between the parameters on day 5 after injury and other periods (Wilcoxon test). СРБ — С-reactive protein.
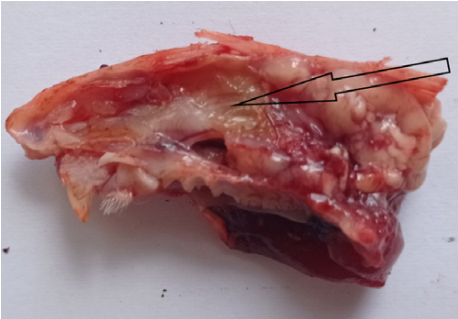
Рис. 6. Носовая перегородка у крысы экспериментальной группы на 5-й день: стрелкой указан слизисто-гнойный секрет.
Примечание: фотография сделана авторами.
Fig. 6. Nasal septum in a rat of the experimental group on day 5: the arrow indicates a mucopurulent secret.
Note: photo taken by the authors.
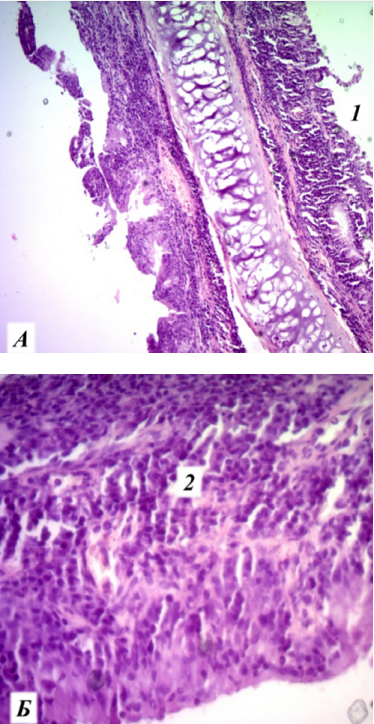
Рис. 7. Микропрепараты носовой перегородки у крысы экспериментальной группы после травмы на 5-й день, окраска гематоксилин-эозином, коронарная проекция: А — увеличение ×100; Б — увеличение ×400: 1 — десквамация реснитчатого эпителия; 2 — инфильтрация клетками субэпителиального слоя.
Примечание: фотографии сделаны авторами.
Fig. 7. Nasal septum microslides from an experimental rat on day 5 after injury, hematoxylin-eosin staining, coronary projection; а (×100); Б (×400): 1 — desquamation of the mucociliary epithelium; 2 — infiltration of the subepithelial layer.
Note: photo taken by the authors.
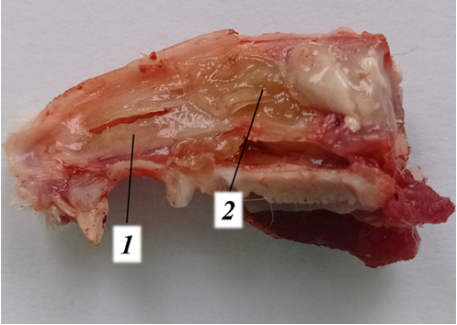
Рис. 8. Носовая перегородка у крысы экспериментальной группы на 10-й день: слизистая оболочка бледная (1), отделяемое слизисто-гнойного характера (2).
Примечание: фотография сделана авторами.
Fig. 8. Nasal septum of an experimental rat on day 10: pale mucous membrane (1), mucopurulent detachments (2).
Note: photo taken by the authors.
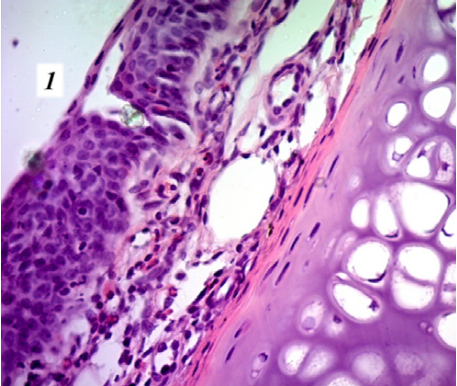
Рис. 9. Микропрепарат носовой перегородки у крысы экспериментальной группы на 10-й день после травмы, окраска гематоксилин-эозином, коронарная проекция (×400): 1 — недифференцированный регенерирующий эпителий.
Примечание: фотография сделана авторами.
Fig. 9. Nasal septum microslides from an experimental rat on day 10 after injury, hematoxylin-eosin staining, coronary projection (×400): 1 — undifferentiated regenerating epithelium.
Note: photo taken by the authors.
ОБСУЖДЕНИЕ
Интерпретация / научная значимость
После травмы у крыс в экспериментальной группе 1 развивается острый ринит, который клинически проявляется выделением из ноздрей слизистого или слизисто-гнойного секрета, чиханием с расчесыванием носа. В крови в сравнении с контрольной группой отмечается повышение уровня СРБ, палочкоядерных и сегментоядерных нейтрофилов, снижение лимфоцитов. На макро- и микропрепаратах СО носовой перегородки на 2-е, 5-е сутки после травмы регистрируется выраженная воспалительная реакция.
Ограничения исследования
Ограничения исследования определены форматом эксперимента (мелкие лабораторные животные, модель посттравматического ринита, сроки выведения из эксперимента), что следует учитывать при воспроизведении аналогичных исследований для разработки методов лечения повреждения СО.
Обобщаемость / экстраполяция
На сегодня актуально изучение характера патоморфологических воспалительных изменений СО после хирургических вмешательств в полости носа, причины нарушения ее регенерации. Полученные нами экспериментальные данные коррелируют с результатами, полученными другими авторами при моделировании экспериментальных ринитов у лабораторных животных: на 2-е сутки отек и инфильтрация нейтрофилами субэпителиального слоя, появление на 5-й день инфильтрации СО моноцитами [19][20]. На 10-е сутки нами установлено появление недифференцированного регенерирующего эпителия, в то время как те же авторы отмечают формирование грануляционной ткани уже с 5-го дня, с 10-го дня начало регенерации бокаловидных и мерцательных клеток. Недостатком моделей воспаления СО после применения химических веществ, по нашему мнению, является ее ожог, приводящий к сильным деструктивным изменениям, что не позволяет адекватно оценивать репаративные функции СО.
Данная разработанная модель экспериментального ринита у лабораторной крысы позволяет получить объективную характеристику последовательности функциональных и структурных нарушений на всех стадиях воспалительного процесса СО полости носа после хирургической травмы.
ЗАКЛЮЧЕНИЕ
Результаты исследования показали, что была получена адекватная экспериментальная модель острого ринита у лабораторных животных. Клинические проявления и изменения в показателях крови характерны для острого воспалительного процесса. У экспериментальных животных после нанесения хирургической травмы в СО перегородки носа развиваются характерные деструктивные и репаративно-пролиферативные процессы.
Микроскопическая характеристика изменений СО носовой перегородки показала, что острая фаза экссудативного воспаления развивается на 2-е сутки: на фоне очагов некроза эпителия наблюдается полнокровие сосудов, отек, нейтрофильная воспалительная инфильтрация подслизистого слоя. К 5-м суткам в воспалительном инфильтрате возрастает доля лимфоцитов и макрофагов, к 10-м наблюдаются начальные признаки восстановления целостности эпителиальной ткани — появление недифференцированного регенерирующего эпителия.
Предложенная нами экспериментальная модель ринита у крыс легко воспроизводима, патоморфологически верифицирована, дает возможность динамического наблюдения за состоянием МЦС после хирургического вмешательства, позволяет оценить эффективность терапевтического воздействия на регенерацию СО носовой полости.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Регистрация протокола
Протокол исследования был составлен до начала исследования, одобрен на заседании кафедры физиологии, а также комиссией по вопросам биоэтики ГУ ЛНР «ЛГМУ им. Святителя Луки».
Доступ к данным
Доступ к данным ограничен авторскими правами.
Список литературы
1. Крюков А.И., Туровский А.Б., Колбанова И.Г., Мусаев К.М., Карасов А.Б. Медикаментозный ринит — предотвратимое заболевание. Медицинский Совет. 2019; (20): 27–30. DOI: 10.21518/2079-701X-2019-20-27-30
2. Свистушкин В.М., Щенникова Е.С., Синьков Э.В., Соболев В.П. Анализ результатов хирургического лечения пациентов с хроническим ринитом. Медицинский Совет. 2020; 6: 127–131. DOI: 10.21518/2079-701X-2020-6-127-131
3. Вязников Д.А. Состояние мукоцилиарной активности слизистой оболочки остиомеатального комплекса в прогнозировании воспалительных заболеваний околоносовых пазух. Российская оториноларингология. 2018; 1: 38–40. DOI: 10.18692/1810-4800-20181-38-40
4. Beule A.G. Physiology and pathophysiology of respiratory mucosa of the nose and the paranasal sinuses. GMS Curr. Top. Otorhinolaryngol. Head. Neck. Surg. 2010; 9: Doc07. DOI: 10.3205/cto000071
5. Носуля Е.В. Медикаментозный ринит. Вестник оториноларингологии. 2017; 82(3): 84–90. DOI: 10.17116/otorino201782384-90
6. Lux C.A., Douglas R.G., Cho Do-Y., Taylor M.W., Biswas K. Animal models for infl ammatory mucosal disease and their potential for studying the microbiome in chronic rhinosinusitis. Rhinology Online. 2019; 2: 69–80. DOI: 10.4193/RHINOL/19.015
7. Girkin J., Maltby S., Singanayagam A., Bartlett N., Mallia P. In vivo experimental models of infection and disease. In: Bartlett N., Wark P., Knight D. Rhinovirus Infections. Rethinking the Impact on Human Health and Disease. 2019; 195–238. DOI: 10.1016/b978-0-12-816417-4.00008-1
8. Al-Sayed A.A., Agu R.U., Massoud E. Models for the study of nasal and sinus physiology in health and disease: A review of the literature. Laryngoscope. Investig. Otolaryngol. 2017; 2(6): 398–409. DOI: 10.1002/lio2.117
9. Остроумова О.Д., Ших Е.В., Реброва Е.В., Рязанова А.Ю. Лекарственно-индуцированный ринит. Вестник оториноларингологии. 2020; 85(3): 75–82. DOI: 10.17116/otorino20208503175
10. Крижна С.І., Київська Ю.О., Козар В.В. Стан імунологічної резистентності в умовах експериментального бактеріального риніту та його фармакологічної корекції. Вестник проблем биологии и медицины. 2018; 2(1(143)): 137–140. DOI: 10.29254/20774214-2018-1-2-143-137-141
11. Day J.H., Ellis A.K., Rafeiro E., Ratz J.D., Briscoe M.P. Experimental models for the evaluation of treatment of allergic rhinitis. Ann. Allergy. Asthma. Immunol. 2006; 96(2): 263–277; quiz 277–278, 315. DOI: 10.1016/S1081-1206(10)61235-5
12. Xu J., Zhang Q., Li Z., Gao Y., Pang Z., Wu Y., Li G., Lu D., Zhang L., Li D. Astragalus Polysaccharides Attenuate Ovalbumin-Induced Allergic Rhinitis in Rats by Inhibiting NLRP3 Infl ammasome Activation and NOD2-Mediated NF-κB Activation. J. Med. Food. 2021; 24(1): 1–9. DOI: 10.1089/jmf.2020.4750
13. Altuntaş E., Yener G., Doğan R., Aksoy F., ŞerifAydın M., Karataş E. Effects of a Thermosensitive In Situ Gel Containing MometasoneFuroate on a Rat Allergic Rhinitis Model. Am. J. Rhinol. Allergy. 2018; 32(3): 132–138. DOI: 10.1177/1945892418764951
14. Chen S., Chen G., Shu S., Xu Y., Ma X. Metabolomics analysis of baicalin on ovalbumin-sensitized allergic rhinitis rats. R. Soc. Open. Sci. 2019; 6(2): 181081. DOI: 10.1098/rsos.181081
15. Köse Ş., TatlıKış T., Diniz G., Akbulut İ., GölSerin B., Yılmaz C., Özyazıcı M., Arıcı M., Yurdasiper A., Yılmaz O. A New Experimental Allergic Rhinitis Model in Mice.İzmir. Dr. Behçet. Uz. Çocuk. Hast. Dergisi. 2021; 11(3): 233–239. DOI: 10.5222/buchd.2021.86658
16. Du Q., Wang R. Effects of Biminkang mixture on AQP5 level in allergic rhinitis rats. IOP Conference Series: Earth and Environmental Science. 2021; 692(3): 032118. DOI: 10.1088/1755-1315/692/3/032118
17. Liu Z., Yang X., Liu X., Mu Y., Wang L., Song X., Zhang H. Analysis of expression of ILC2 cells in nasal mucosa based on animal model of allergic bacterial infection rhinitis. J. Infect. Public. Health. 2021; 14(1): 77–83. DOI: 10.1016/j.jiph.2019.09.010
18. Selvarajah J., Saim A.B., BtHjIdrus R., Lokanathan Y. Current and Alternative Therapies for Nasal Mucosa Injury: A Review. Int. J. Mol. Sci. 2020; 21(2): 480. DOI: 10.3390/ijms21020480
19. Čoma M., Fröhlichová L., Urban L., Zajíček R., Urban T., Szabo P., Novák Š., Fetissov V., Dvořánková B., Smetana K. Jr, Gál P. Molecular Changes Underlying Hypertrophic Scarring Following Burns Involve Specifi c Deregulations at All Wound Healing Stages (Infl ammation, Proliferation and Maturation). Int. J. Mol. Sci. 2021; 22(2): 897. DOI: 10.3390/ijms22020897
20. Khalmuratova R., Jeon S.Y., Kim D.W., Kim J.P., Ahn S.K., Park J.J., Hur D.G. Wound healing of nasal mucosa in a rat. Am. J. Rhinol. Allergy. 2009; 23(6): e33–37. DOI: 10.2500/ajra.2009.23.3390
21. El-Anwar M.W., Abdelmonem S., Abdelsameea A.A., AlShawadfy M., El-Kashishy K. The Effect of Propolis in Healing Injured Nasal Mucosa: An Experimental Study. Int. Arch. Otorhinolaryngol. 2016; 20(3): 222–225. DOI: 10.1055/s-0036-1579664
22. Choi K.Y., Cho S.W., Choi J.J., Zhang Y.L., Kim D.W., Han D.H., Kim H.J., Kim D.Y., Rhee C.S., Won T.B. Healing of the nasal septal mucosa in an experimental rabbit model of mucosal injury.World J. Otorhinolaryngol. Head Neck Surg. 2017; 3(1): 17–23. DOI: 10.1016/j.wjorl.2017.02.004
23. Kavaz E., Kurnaz S.Ç., Güvenç D., Yarım M., Aksoy A. Effects of Oral Propolis on Mucosal Wound Healing after Endoscopic Nasal Surgery in a Rabbit Model. Turk. Arch. Otorhinolaryngol. 2019; 57(2): 68–74. DOI: 10.5152/tao.2019.4164
24. Ceylan S.M., Uysal E., Sokucu M., Sezgin E., Kanmaz M.A., Yurtseven D.G., Bilal N. The Effects of Halofuginone on Wound Healing in the Rat Nasal Mucosa. Am. J. Rhinol. Allergy. 2020; 34(1): 9–15. DOI: 10.1177/1945892419866312
25. Çakan D., Uşaklıoğlu S. The effect of locally administered phenytoin on wound healing in an experimental nasal septal perforation animal model. Eur. Arch. Otorhinolaryngol. 2022; 279(7): 3511–3517. DOI: 10.1007/s00405-022-07276-z
Об авторах
И. Е. БерестБерест Ирина Евгеньевна — кандидат медицинских наук; доцент кафедры оториноларингологии и офтальмологии.
Ул. Былинная, д. 17, г. Луганск, 91045; тел.: +7 959 1799400
Т. П. Тананакина
Тананакина Татьяна Павловна — доктор медицинских наук, профессор; заведующая кафедрой физиологии государственного учреждения.
Ул. Былинная, д. 17, г. Луганск, 91045
О. В. Телешова
Телешова Ольга Васильевна — кандидат медицинских наук, доцент; заведующая кафедрой патологической анатомии и судебной медицины.
Ул. Былинная, д. 17, г. Луганск, 91045
Е. В. Бургело
Бургело Елена Викторовна — ассистент кафедры патологической анатомии и судебной медицины государственного учреждения.
Ул. Былинная, д. 17, г. Луганск, 91045
Р. А. Паринов
Паринов Руслан Андреевич — ассистент кафедры физиологии.
Ул. Былинная, д. 17, г. Луганск, 91045
А. В. Корецкий
Корецкий Анатолий Васильевич— врач-стажер по клинической лабораторной диагностике.
Кв. 50-летия Обороны Луганска, д. 1г, Луганск, 91034
Дополнительные файлы
Рецензия
Для цитирования:
Берест И.Е., Тананакина Т.П., Телешова О.В., Бургело Е.В., Паринов Р.А., Корецкий А.В. Оценка разработанной модели экспериментального ринита у лабораторных крыс: доклиническое экспериментальное рандомизированное исследование. Кубанский научный медицинский вестник. 2023;30(1):78-87. https://doi.org/10.25207/1608-6228-2023-30-1-78-87
For citation:
Berest I.Ye., Tananakina T.P., Teleshova O.V., Burgelo E.V., Parinov R.A., Koretsky A.V. Evaluating the Developed Model of Experimental Rhinitis in Laboratory Rats: Pre-Clinical Experimental Randomized Study. Kuban Scientific Medical Bulletin. 2023;30(1):78-87. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-1-78-87








































