Перейти к:
Клинико-морфологический анализ эффективности внутрибрюшинного применения озона при экспериментальном колите: доклиническое рандомизированное исследование
https://doi.org/10.25207/1608-6228-2023-30-1-98-108
Аннотация
Введение. Воспалительные заболевания кишечника — болезнь Крона и язвенный колит — хронические заболевания пищеварительного тракта, поражающие молодое трудоспособное население. Альтернативой применения базисной терапии (5-аминосалициловая кислота) при воспалительных заболеваниях кишечника является применение озона, который обладает противовоспалительными, иммуномодулирующими, антибактериальными свойствами, в терапевтических концентрациях он лишен побочных эффектов.
Цель исследования: провести клинико-морфологический анализ эффективности применения озона при экспериментальном колите.
Методы. Исследование выполнено на 73 самцах крыс массой 200–250 г линии Wistar. Методом простой рандомизации животных делили на четыре группы. Исследования проводили на вторые, четвертые и шестые сутки. Оксазолон-индуцированный колит моделировали в два этапа с помощью 3% спиртового раствора оксазолона. Озонокислородную смесь получали на установке «УОТА-60–01» («Медозон», Россия). Ректальные суппозитории с 5-аминосалициловой кислотой готовили на основе ректальных суппозиториев «Салофальк». Клинический статус оценивали ежедневно в соответствии со шкалой индекса активности болезни (disease activity index, DAI). Морфологическую оценку фрагментов тканей очага повреждения толстой кишки проводили на микроскопе PrimoStar (CarlZeiss, Германия). Повреждение тканей толстой кишки оценивали с помощью индекса повреждения тканей (tissue damage index, TDI). Статистическую обработку результатов проводили с использованием SPSS Statistics 19 (IBM, США).
Результаты. Клинико-морфологическая картина поражения толстой кишки при оксазолон-индуцированном колите на вторые, четвертые и шестые сутки соответствует изменениям при воспалительных заболеваниях кишечника у человека. Ежедневные внутрибрюшинные инсуффляции озона в дозе 0,05 мг/кг при оксазолон-индуцированном колите приводят к частичному восстановлению индекса DAI, снижению в очаге повреждения количества нейтрофилов, эозинофилов, гистиоцитов, фибробластов, уменьшению диаметра язвенного дефекта и индекса TDI. Эффекты при оксазолон-индуцированном колите внутрибрюшинных инсуффляций озона по сравнению с эффектами применения каждые 12 ч ректальных суппозиториев с 50 мг 5-аминосалициловой кислоты менее выражены в отношении индекса DAI на четвертые сутки; в отношении количества эозинофилов, плазмоцитов, гистиоцитов — на вторые, четвертые и шестые; в отношении лимфоцитов — на шестые сутки.
Заключение. Клинико-морфологическая картина поражения толстой кишки при озон-индуцированном колите соответствует изменениям при воспалительных заболеваниях кишечника у человека. Положительный эффект озона при озон-индуцированном колите обусловлен его противовоспалительными свойствами за счет активации Nrf2, антиоксидантными свойствами за счет ингибирования Keap1.
Ключевые слова
Для цитирования:
Осиков М.В., Кайгородцева Н.В., Бойко М.С., Астахова Л.В. Клинико-морфологический анализ эффективности внутрибрюшинного применения озона при экспериментальном колите: доклиническое рандомизированное исследование. Кубанский научный медицинский вестник. 2023;30(1):98-108. https://doi.org/10.25207/1608-6228-2023-30-1-98-108
For citation:
Osikov M.V., Kaygorodtceva N.V., Boyko M.S., Astachova L.V. Clinical and Morphological Analysis of Efficacy of Intraperitoneal Ozone Application in Experimental Colitis: Preclinical Randomized Experimental Study. Kuban Scientific Medical Bulletin. 2023;30(1):98-108. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-1-98-108
ВВЕДЕНИЕ
Воспалительные заболевания кишечника (ВЗК) — болезнь Крона (БК) и язвенный колит (ЯК) — хронические заболевания пищеварительного тракта, поражающие молодое трудоспособное население [1]. За последние 40 лет произошло увеличение заболеваемости ВЗК в 6 раз [2]. ВЗК возникает при воздействии неблагоприятных факторов внешней среды (антибактериальная терапия, нерациональное питание, курение и др.) на генетически предрасположенный организм [3–5]. В результате сложного взаимодействия факторов окружающей среды и генетических факторов возникает дизрегуляция иммунного ответа в мукозоассоциированной лимфоидной ткани слизистой оболочки на измененную микробиоту кишечника и аутоантигены кишечной стенки при нарушении защитных механизмов интестинального барьера [6][7]. ЯК и БК характеризуются воспалением в стенке кишечника различной глубины: трансмуральным при БК и на уровне слизистой оболочки при ЯК [8]. В настоящее время терапия базисными препаратами (5-аминосалициловая кислота, глюкокортикостероиды, иммуносупрессоры) примерно в 30% случаев сопровождается непереносимостью, что является предпосылкой для поиска новых подходов в терапии ВЗК [9, 10]. Альтернативой является применение озона, который обладает противовоспалительными, иммуномодулирующими, антибактериальными свойствами, в терапевтических концентрациях он лишен побочных эффектов [11].
Цель исследования — провести клинико-морфологический анализ эффективности применения озона при экспериментальном колите.
МЕТОДЫ
Экспериментальные животные
Исследование выполнено на половозрелых самцах крыс массой 240–250 г линии Wistar, полученных из федерального государственного бюджетного учреждения «Питомник лабораторных животных “Рапполово”» Национального исследовательского центра «Курчатовский институт» (НИЦ «Курчатовский институ» — ПЛЖ «Рапполово»).
Размещение и содержание
Животные находились под наблюдением в экспериментально-биологической клинике федерального государственного бюджетного образовательного учреждения высшего образования «Южно-Уральский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО ЮУГМУ Минздрава России) при соблюдении правил надлежащей лабораторной практики (приказ МЗ РФ № 199 н от 01.04.2016 г.), Директивы 2010/63/EU Европейского парламента и Совета ЕС по охране животных, используемых в научных целях, со свободным доступом к пище и воде, на стандартном пищевом рационе.
Дизайн исследования
Проведено рандомизированное исследование. Моделью исследования послужили животные с оксазолон-индуцированным колитом (ОИК). Исследование длилось 14 дней, на 7-е сутки проводилось лечение озоном и 5-АСК в соответствующих группах, клинические и морфологические исследования проводились на 2-е, 4-е и 6-е сутки от развития ОИК. Блок-схема дизайна исследования представлена на рисунке 1.
Объем выборки
Методом простой рандомизации 73 животных делили на группы: I-я (n = 10) — интактный контроль, II-я (n = 21) — животные с оксазолон-индуцированным колитом (ОИК), III-я (n = 21) — животные с ОИК на фоне внутрибрюшинной инсуффляции О3, IV-я (n = 21) — животные с ОИК, получающие ректальные суппозитории с 5-аминосалициловой кислотой (5-АСК).
Критерии соответствия
Критерии включения
В исследование включены самцы крыс без видимых признаков заболеваний массой 240–250 г.
Критерии невключения
В эксперимент не включались особи, вес которых отличался более чем на 10 г, и особи женского пола.
Рандомизация
В рамках эксперимента крысам присваивался уникальный номер и с помощью генератора случайных чисел «Рандомайзер», расположенного по ссылке https://randomus.ru, их разделили на 4 группы.
Обеспечение анонимности данных
Данными во время распределения животных на группы, проведения эксперимента, оценки результатов и анализа данных владели ассистенты кафедры Кайгородцева Н. В., Бойко М. С.
Итоговые показатели (исходы исследования)
Итоговые показатели позволили выявить эффективность ректального применения озона в отличие от стандартной терапии в отношении клинико-морфологической картины.
Экспериментальные процедуры
ОИК моделировали в два этапа с помощью 3%-го спиртового раствора оксазолона (4-этоксиметилен-2-фенил-2-оксазолин-5-он). Первый этап заключался в накожной сенсибилизации нанесением 675 мкл/кг на межлопаточную область, второй — в ректальном введении 675 мкл/кг в толстую кишку на глубину 7 см [12][13].
Клинический статус оценивали ежедневно в соответствии со шкалой индекса активности болезни (disease activity index, DAI), адаптированной для оценки исследуемой патологии у крыс1 [14]. Каждый параметр (потеря веса, консистенция стула и ректальное кровотечение) оценивали для каждой крысы по 5-балльной шкале от 0 до 4, баллы для каждого показателя суммировали, минимальное значение индекса равно 0, максимальное значение индекса равно 12. Наличие скрытой крови в каловых массах определяли с помощью бензидиновой реакции2 [15].
ОКС вводили внутрибрюшинно 1 раз в сутки в течение 6 суток в дозе 0,05 мг/кг. Ректальные суппозитории массой 0,3 г, содержащие 50 мг 5-АСК, готовили на основе ректальных суппозиториев «Салофальк» (МНН: Месалазин, Doctor Falk Pharma GmbH, Германия) и применяли каждые 12 ч в течение 6 суток в соответствии с данными о периоде полувыведения 5-АСК из тканей кишки. Исследования проводили на 2-е, 4-е и 6-е сутки.
Для морфометрических исследований материал забирали в соответствующие сроки исследования, маркировали и фиксировали в 10% нейтральном растворе формалина, обезвоживали, обезжиривали и заливали в парафин. С парафиновых блоков готовились гистологические срезы толщиной 5–7 мкм, которые окрашивали гематоксилином и эозином. Микроскопические исследования проводили на микроскопе DMRXA фирмы Leika (Германия) с помощью компьютерной программы анализа изображений «ДиаМорф Cito-W» (Москва, Россия), совмещенной с микроскопом, при увеличении микроскопа ×50, ×100, ×200 и ×400 в 10 случайно отобранных полях зрения в пересчете на 1 мм 2. Оценивали глубину повреждения кишечника, реакцию сосудистого русла, наличие и состав клеточного инфильтрата, сроки появления в ране грануляционной ткани. Кроме описательных использовали следующие морфометрические признаки: количество эозинофилов на мм 2; количество нейтрофилов на мм 2; количество гистиоцитов на мм 2; количество лимфоцитов на мм 2; количество плазматических клеток на мм 2; количество фибробластов на мм 2; диаметр язвенного дефекта, мкм, площадь распределения сосудов, мкм 2. Морфометрические исследования проводили с помощью компьютерной программы анализа изображений ImageScope M (Россия). Повреждение тканей толстой кишки оценивали с помощью индекса повреждения тканей (tissue damage index, TDI) по шкале от 0 до 6, включая площадь повреждения, утолщение стенки кишки, сосудистый компонент, потерю клеточной специфичности (потерю бокаловидных клеток, интенсивность лейкоцитарной инфильтрации).
Уход за животными и мониторинг
Ежедневная смена подстилки (березовые опилки), кормление комбикормом, смена питьевой воды. Вывод животных из эксперимента производился согласно рекомендациям под действием анестезии «Золетил 100» (МНН: тилетамина гидрохлорид) (Virbac Sante Animale; Фpaнция) в дозе 20 мг/кг.
Статистические методы
Принципы расчета размера выборки
Предварительный расчет выборки не производился.
Методы статистического анализа данных
Статистическую обработку результатов проводили с использованием программы IBM SPSS Statistics 19. Характеристика выборок представлена в формате «Me (Q1; Q3)», где Мe — медиана, Q1 и Q3 — значение нижнего и верхнего квартиля соответственно. Значимость различий между группами оценивали при помощи критериев Краскела — Уоллиса, Манна — Уитни.
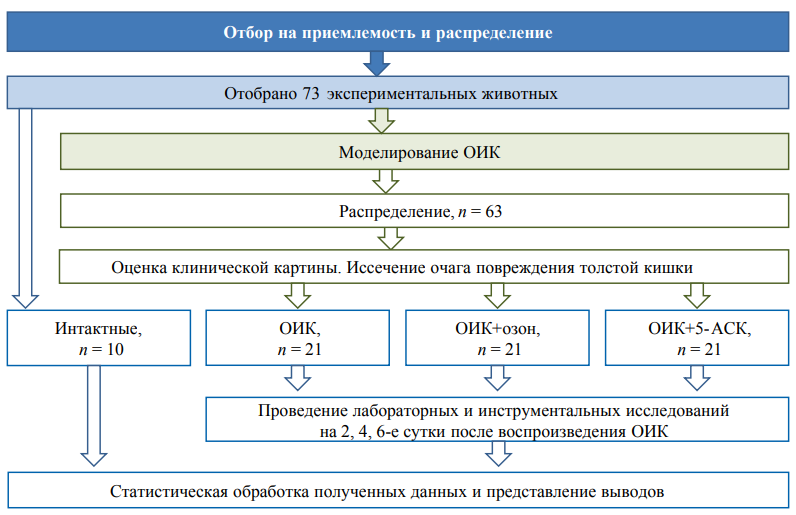
Рис. 1. Блок-схема дизайна исследования.
Примечание: блок-схема согласно рекомендациям ARRIVE заполнена авторами; ОИК — оксазолон-индуцированный колит; 5-АСК — 5-аминосалициловая кислота.
Fig. 1. Schematic diagram of the research design.
Note: the flow-chart according to the recommendations of ARRIVE; ОИК — oxazolone-induced colitis; 5-AСК — 5-aminosalicylic acid.
РЕЗУЛЬТАТЫ
При ОИК у животных со 2-х по 6-е сутки наблюдения отмечались увеличение частоты дефекаций, жидкая консистенция кала с примесью крови (табл. 1).
На 4-е и 6-е сутки наблюдения снижалась масса тела (7–10% от начального веса), обусловленная преимущественно диареей, у крыс снизилась двигательная активность. Клиническая картина нашла отражение в значимом увеличении индекса DAI на 2-е, 4-е и 6-е сутки наблюдения. В динамике ОИК значение DAI на 6-е сутки выше (р < 0,01) значений на 2-е и 4-е сутки, что отражает максимальное развертывание воспалительных изменений в толстой кишке.
Клиническая картина при ОИК является отражением морфологических изменений в толстой кишке: на 2-е сутки в очаге повреждения зафиксированы язвенные дефекты, дно которых располагается в слизистой оболочке, собственная пластинка слизистой оболочки разрыхлена, ее непрерывность в проекции язвенных дефектов нарушена, утолщена за счет клеточной инфильтрации, которая состояла преимущественно из лимфоцитов и нейтрофилов с примесью эозинофилов, подслизистый слой разрыхлен, резко утолщен за счет выраженного отека, увеличена плотность сосудистой сети (рис 1 А). Эпителий желез с лимфогранулоцитарной инфильтрацией, лейкодиапедезом и формированием крипт-абсцессов (рис. 1 А). На 4-е сутки в толстой кишке в подслизистом слое зафиксированы очаги некроза с выраженными кровоизлияниями, наложениями фибрина, паретично расширенными сосудами с утолщенной стенкой. Отмечалась тотальная полиморфноклеточная инфильтрация тканей с большим количеством эозинофилов и нейтрофилов, белковая дистрофия крипт (рис. 1 Б). На 6-е сутки в толстой кишке ниша язвенных дефектов покрыта бесструктурным некротизированным детритом, ткани отечны, полнокровны, отмечаются единичные участки фибробластогенеза (рис. 1 В).
Оценка морфометрических показателей в очаге повреждения толстой кишки при ОИК на 2-е сутки выявила увеличение количества нейтрофилов, эозинофилов, плазмоцитов и фибробластов, на 4-е сутки — количества лимфоцитов, нейтрофилов, эозинофилов, гистиоцитов, плазмоцитов и фибробластов, на 6-е сутки — количества нейтрофилов, эозинофилов, гистиоцитов, плазмоцитов (табл. 2).
Площадь распределения сосудов и диаметр язвенного дефекта увеличиваются на 2-е, 4-е и 6-е сутки. Морфометрические показатели отразились в увеличении индекса TDI на 2-е, 4-е и 6-е сутки.
В динамике ОИК в очаге повреждения толстой кишки количество лимфоцитов на 6-е сутки выше (р < 0,01), чем на 4-е сутки; количество нейтрофилов и эозинофилов на 6-е и 4-е сутки выше (р < 0,01), чем на 2-е сутки; количество гистиоцитов, плазмоцитов и фибробластов на 4-е сутки выше (р < 0,01), чем на 2-е сутки, на 6-е сутки выше (р < 0,01), чем на 4-е и 2-е сутки; площадь распределения сосудов на 4-е сутки ниже (р < 0,01), чем на 2-е и 6-е сутки, на 6-е сутки ниже (р < 0,01), чем на 2-е сутки; диаметр язвенного дефекта без динамических изменений на 2-е, 4-е и 6-е сутки; индекс TDI на 4-е и 6-е сутки выше (р < 0,01), чем на 2-е сутки наблюдения (табл. 2).
Таким образом, при ОИК на 2-е, 4-е и 6-е сутки увеличивается индекс активности болезни DAI, в очаге повреждения толстой кишки фиксируются морфологические признаки поражения толстой кишки по показателю TDI с максимальными проявлениями на 6-е сутки эксперимента.
В условиях внутрибрюшинного применения ОКС при ОИК на 4-е и 6-е сутки зафиксировано снижение индекса DAI: консистенция стула становилась более оформленной, масса тела не снижалась, кровь в кале определялась только с помощью бензидиновой пробы. В динамике ОИК индекс DAI на 6-е сутки ниже (р < 0,01), чем на 4-е и 2-е сутки.
При оценке морфологической картины ОИК при внутрибрюшинной инсуффляции ОКС на 2-е сутки наблюдалось изменение микроархитектоники поврежденных тканей: разрыхление стромы, частичное разрушение желез, полнокровие сосудов с утолщением стенки, диффузная лимфоцитарная инфильтрация (рис. 2 А). 4-е сутки характеризовались диффузной гранулоцитарно-лимфоцитарной инфильтрацией стромы, тесным расположением железистых крипт, снижением количества бокаловидных клеток, на дне язвенного дефекта отмечалось разрастание грануляционной ткани с фибрином на верхушке дефекта (рис. 2 Б). На 6-е сутки определялись признаки эпителизации язвенного дефекта с наличием полей фибриллогенеза, пролиферации фибробластов в грануляционной ткани подслизистого слоя (рис. 2 В).
Оценка морфометрических показателей очага повреждения толстой кишки при ОИК в условиях внутрибрюшинного применения ОКС на 2-е сутки выявила увеличение количества нейтрофилов, гистиоцитов и уменьшение диаметра язвенного дефекта; на 4-е сутки снижение количества нейтрофилов, увеличение количества гистиоцитов, плазмоцитов и фибробластов, увеличение площади распределения сосудов, уменьшение диаметра язвенного дефекта; на 6-е сутки снижение количества нейтрофилов, эозинофилов, увеличение количества гистиоцитов и фибробластов, уменьшение диаметра язвенного дефекта (табл. 2). Морфометрические показатели отражаются в индексе TDI, который уменьшается на 4-е и 6-е сутки.
В динамике ОИК в условиях внутрибрюшинного применения ОКС количество лимфоцитов на 4-е и 6-е сутки ниже (р < 0,01), чем на 2-е сутки; количество нейтрофилов на 4-е сутки ниже (р < 0,01), чем на 2-е сутки, на 6-е сутки ниже (р < 0,01), чем на 4-е и 2-е сутки; количество эозинофилов на 4-е сутки выше (р < 0,01), чем на 2-е сутки, на 6-е сутки выше (р < 0,01), чем на 2-е сутки, но ниже (р < 0,01), чем на 4-е сутки; количество гистиоцитов и фибробластов на 4-е сутки выше (р < 0,01), чем на 2-е сутки, на 6-е сутки выше (р < 0,01), чем на 2-е и 4-е сутки; количество плазмоцитов на 4-е сутки выше (р < 0,01), чем на 2-е сутки, на 6-е сутки выше (р < 0,01), чем на 2-е сутки, но ниже (р < 0,01), чем на 4-е сутки; площадь распределения сосудов на 6-е сутки ниже (р < 0,01), чем на 4-е и 2-е сутки; диаметр язвенного дефекта и индекс TDI на 4-е и 6-е сутки ниже (р < 0,01), чем на 2-е сутки наблюдения (табл. 2).
Итак, при экспериментальном ОИК в условиях внутрибрюшинного применения озона уменьшаются клинические признаки по показателю DAI с максимальной выраженностью на 4-е и 6-е сутки; снижаются морфологические признаки повреждения толстой кишки по показателю TDI с максимальной выраженностью на 2-е и 6-е сутки наблюдения.
На фоне применения 5-АСК при ОИК зафиксированы его известные свойства. На 4-е и 6-е сутки снижается показатель DAI: масса тела не снижается, животные становятся более активными, диарея сменяется оформленным калом, а кровь в кале определяется только в бензидиновой пробе. Морфометрическая оценка очага повреждения толстой кишки при ОИК в условиях применения 5-АСК выявила на 2-е сутки снижение количества эозинофилов, увеличение количества плазмоцитов и фибробластов, уменьшение диаметра язвенного дефекта; на 4-е сутки уменьшение количества нейтрофилов, эозинофилов, увеличение количества фибробластов, площади распределения сосудов, уменьшение диаметра язвенного дефекта и индекса TDI; на 6-е сутки снижение содержания лимфоцитов, нейтрофилов, эозинофилов, плазмоцитов, диаметра язвенного дефекта и индекса TDI, увеличение содержания гистиоцитов и фибробластов (табл. 2). Максимальная выраженность эффектов 5-АСК достигнута к 6-м суткам эксперимента (рис. 3 А–В).
Представляет интерес сравнительный анализ эффектов внутрибрюшинного применения озона и 5-АСК при ОИК. При ОИК в условиях внутрибрюшинного применения озона в отличие от ректального применения 5-АСК зафиксирован более высокий индекс активности болезни DAI на 4-е сутки наблюдения; на 2-е сутки в очаге повреждения толстой кишки зафиксировано больше эозинофилов и гистиоцитов, меньше плазмоцитов и фибробластов; на 4-е сутки — больше эозинофилов, гистиоцитов и плазмоцитов, меньше фибробластов и диаметр язвенного дефекта; на 6-е сутки — больше лимфоцитов, эозинофилов, гистиоцитов, и плазмоцитов, меньше фибробластов. Площадь распределения сосудов и индекс TDI не имели значимых различий.
Таким образом, при ОИК внутрибрюшинная инсуффляции озона по сравнению с применением ректальных суппозиториев с 5-АСК оказывает менее выраженный эффект на снижение клинических проявлений и морфологических признаков повреждения толстой кишки.
Таблица 1. Клиническая картина при ОИК, Ме (Q1; Q3)
Table 1. Clinical picture in oxazolone-induced colitis, Me (Q1; Q3)
Показатели | Группа 1 Интактные (n = 10) | Группа 2 ОИК | Группа 3 ОИК + озон | Группа 4 ОИК + 5-АСК | ||||||
2 сутки (n = 7) | 4 сутки (n = 7) | 6 сутки (n = 7) | 2 сутки (n = 7) | 4 сутки (n = 7) | 6 сутки (n = 7) | 2 сутки (n = 7) | 4 сутки (n = 7) | 6 сутки (n = 7) | ||
Индекс DAI, баллы | 0 | 7,00 (5,00; 7,00) * | 8,00 (6,00; 10,00) * | 11,00 (11,00; 11,00) * | 5,00 (4,00; 5,00) * | 5,00 (4,00; 5,00) * # | 4,00 (2,00; 4,00) * # | 5,00 (4,00; 5,00) * | 4,00 (3,00; 5,00) * # $ | 3,00 (3,00; 4,00) * # |
Примечание: таблица составлена авторами; * — статистически значимые (p < 0,01) различия с группой интактных животных; # — с группой 2; $ — с группой 3. ОИК — оксазолон-индуцированный колит. 5-АСК — 5-аминосалициловая кислота; DAI — disease activity index.
Note: compiled by the authors; * — statistically significant (p<0.01) differences with the group of intact animals; # — with group 2; $ — with group 3. ОИК — oxazolone-induced colitis. 5-АСК — 5-aminosalicylic acid; DAI — disease activity index.
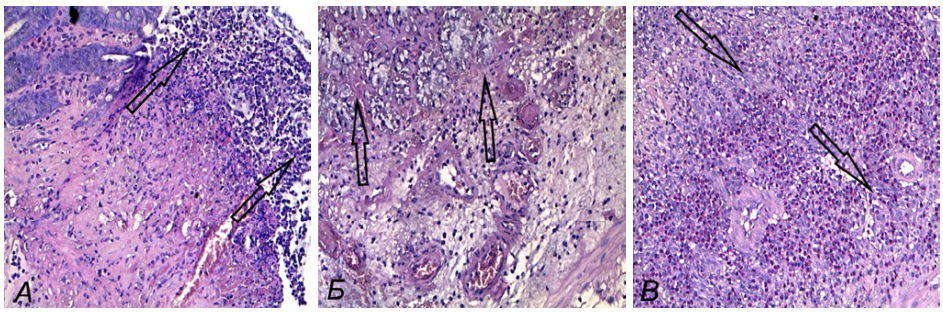
Рис. 1. Морфологические изменения в стенке толстой кишки при оксазолон-индуцированном колите, окраска гематоксилин-эозином, ув. ×200: А) Вторые сутки — поверхностный эпителий разрушен, поверхность покрыта фибрином с выраженной гранулоцитарно-лимфоцитарной инфильтрацией (обозначены стрелками). Б) Четвертые сутки — очаг некроза слизистой оболочки (обозначены стрелками), поверхностный эпителий разрушен, желез мало, бокаловидные клетки отсутствуют. В) Шестые стуки — венозное и капиллярное полнокровие подслизистого слоя, плотная диффузная воспалительная клеточная инфильтрация, на фоне которой видны небольшие тяжи пролиферирующих фибробластов (обозначены стрелками).
Примечание: фотографии сделаны авторами.
Fig. 1. Morphological changes in colon wall in oxazolone-induced colitis, stained with hematoxylin-eosin, ×200: A) Day 2 — superficial epithelium destroyed, surface covered with fibrin with pronounced granulocytic-lymphocytic infiltration (arrows). Б) Day 4 — focus of mucosal necrosis (arrows), superficial epithelium destroyed, few glands, goblet cells absent. В) Day 6 — venous and capillary congestion of submucosa, dense diffuse inflammatory cellular infiltration, against which small cords of proliferating fibroblasts are visible (arrows).
Note: photos taken by the authors.
Таблица 2. Морфометрические показатели в очаге повреждения толстого кишечника при ОИК, Ме (Q1; Q3)
Тable 2. Morphometric indicators in large intestine lesion in oxazolone-induced colitis, Me (Q1; Q3)
Показатели | Группа 1 Интактные (n = 10) | Группа 2 ОИК | Группа 3 ОИК + озон | Группа 4 ОИК + 5-АСК | ||||||
2 сутки (n = 7) | 4 сутки (n = 7) | 6 сутки (n = 7) | 2 сутки (n = 7) | 4 сутки (n = 7) | 6 сутки (n = 7) | 2 сутки (n = 7) | 4 сутки (n = 7) | 6 сутки (n = 7) | ||
Лимфоциты, ед./мм 2 | 563,07 (480,35; 663,72) | 400,00 (288,46; 545,45) | 366,97 (270,27; 495,86) * | 535,46 (427,35; 661,15) | 344,82 (258,62; 476,19)* | 359,46 (256,41; 434,78)* | 1226,41 (423,72; 1442,31) | 287,76 (195,31; 398,01)* | 295,56 (215,05; 304,56)* | 253,31 (202,02; 346,32)* # $ |
Нейтрофилы, ед./мм 2 | 94,37 (56,18; 131,00) | 1315,78 (1025,64; 1759,25)* | 2960,56 (1284,41; 4793,38)* | 3363,64 (2258,06; 4326,92)* | 2105,64 (1711,71; 2268,91)* # | 1043,47 (727,27; 1452,99)* # | 564,55 (769,23; 940,17)* # | 1727,14 (1015,22; 2413,79)* | 1038,96 (757,57; 1188,81)* # | 761,42 (408,16; 1060,61)* # |
Эозинофилы, ед./мм 2 | 56,18 (51,02; 87,34) | 466,60 (272,73; 516,13)* | 1241,64 (1442,47; 2051,28)* | 1977,28 (1648,14; 2767,85)* | 673,88 (360,36; 952,38)* | 1545,45 (1196,58; 2000,00)* | 1100,14 (1088,67; 1279,66)* # | 177,55 (180,78; 291,78)* # $ | 151,37 (110,11; 169,59)* # $ | 213,52 (156,25; 244,75)* # $ |
Гистиоциты, ед./мм 2 | 88,50 (51,02; 181,00) | 181,82 (96,15; 322,58) | 378,78 (330,57; 512,82)* | 803,57 (740,74; 854,71)* | 450,45 (263,15; 517,24)* # | 1176,47 (1081,08; 1272,72)* # | 1558,92 (1415,09; 1769,91) * # | 159,22 (139,86; 173,16)$ | 503,37 (406,09; 591,13)* $ | 1069,51 (957,85; 1212,12)* # $ |
Плазмоциты, ед./мм 2 | 51,02 (43,67; 54,41) | 186,92 (80,00; 272,73)* | 292,45 (176,99; 366,97)* | 550,51 (370,37; 701,75)* | 285,71 (175,43; 344,82)* | 477,31 (434,78; 545,45)* # | 423,72 (353,98; 471,69)* | 404,04 (355,33; 476,19)* # $ | 270,23 (252,52; 285,71)* $ | 113,63 (99,51; 117,18)* # $ |
Фибробласты, ед./мм 2 | 1123,72 (960,70; 1236,56) | 489,50 (288,46; 654,21)* | 744,11 (521,73; 1025,64)* | 1388,88 (991,73; 1491,22) | 517,24 (350,87; 588,23)* | 1304,34 (1217,39; 1367,52)* # | 1743,11 (1538,46; 1886,79)* # | 1156,25 (1129,87; 1248,75)# $ | 1857,14 (1645,16; 1936,96)* # $ | 2218,27 (2176,47; 2471,86)* # $ |
Площадь распределения сосудов, мкм 2 | 12250,00 (10300,00; 14400,00) | 29700,00 (24800,00; 32300,00)* | 15650,00 (14500,00; 17800,00)* | 17600,00 (17400,00; 19500,00)* | 25450,00 (19600,00; | 24450,00 (22200,00; 28800,00)* # | 18450,00 (15500,00; 23400,00)* | 28950,00 (28500,00; 30100,00)* | 26200,00 (23700,00; 28300,00)* # | 28800,00 (19200,00; 30800,00)* # |
Диаметр язвенного дефекта, мкм | 0 | 629,97 (397,97; 726,95)* | 795,98 (691,97; 864,89)* | 792,97 (439,97; 876,78)* | 323,32 (274,97; 349,97)* # | 200,97 (187,97; 207,97)* # | 197,79 (190,97; 243,97)* # | 338,89 (184,33; 463,61)* # | 439,97 (381,25; 495,95)* # $ | 184,21 (149,35; 194,97)* # |
TDI, у. е. | 0 | 3,00 (2,00; 3,00)* | 4,00 (3,00; 4,00)* | 4,00 (4,00; 5,00)* | 3,00 (3,00; 4,00)* | 2,00 (2,00; 3,00)* # | 2,00 (2,00; 3,00)* # | 2,00 (2,00; 3,00)* | 3,00 (2,00; 3,00)* # | 1,00 (1,00; 2,00)* # |
Примечание: таблица составлена авторами; * — статистически значимые (p < 0,01) различия с группой интактных животных; # — с группой 2; $ — с группой 3. ОИК — оксазолон-индуцированный колит. 5-АСК — 5-аминосалициловая кислота, TDI — индекс повреждения ткани (tissue damage index).
Note: compiled by the authors; * — statistically significant (p<0.01) differences with the group of intact animals; # — with group 2; $ — with group 3. ОИК — oxazolone-induced colitis. 5-АСК — 5-aminosalicylic acid, TDI — tissue damage index.
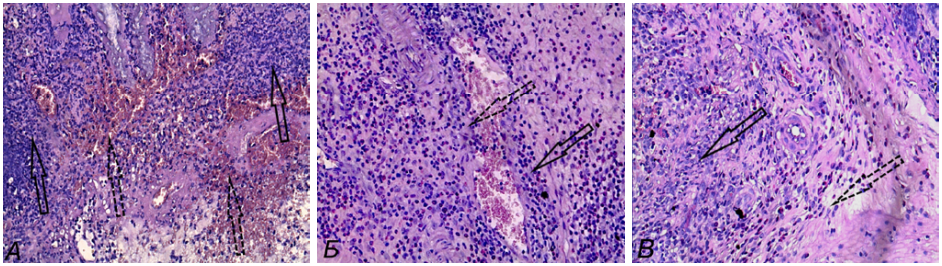
Рис. 2. Морфологические изменения в стенке толстой кишки при оксазолон-индуцированном колите в условиях внутрибрюшинного введения озонокислородной смеси, окраска гематоксилин-эозином, ув. ×200: А) 2-е сутки — густая нейтрофильно-лимфоцитарная инфильтрация (обозначено стрелками) и очаговые диапедезные кровоизлияния (обозначено пунктирными стрелками) в подслизистом слое на границе с некротизированной слизистой оболочкой. Б) 4-е сутки — в подслизистом слое на фоне венозного полнокровия (обозначено стрелкой) видна плотная нейтрофильно-лимфоцитарная инфильтрация (обозначено пунктирной стрелкой). В) 6-е стуки — нейтрофильно-лимфоцитарный инфильтрат (обозначено стрелкой) в подслизистом слое и небольшие тяжи пролиферирующих фибробластов (обозначено пунктирной стрелкой).
Примечание: фотографии сделаны авторами.
Fig. 2. Morphological changes in colon wall in oxazolone-induced colitis under conditions of intraperitoneal injection of ozone-oxygen mixture, stained with hematoxylin-eosin, ×200: A) Day 2 — dense neutrophilic-lymphocytic infiltration (arrows) and focal diapedetic hemorrhages (dotted arrows) in submucosa at the border of necrotized mucosa. Б) Day 4 — dense neutrophilic-lymphocytic infiltration (dotted arrow) in submucosa on the background of venous congestion (arrow). В) Day 6 — neutrophilic-lymphocytic infiltrate (arrow) in submucosa and small cords of proliferating fibroblasts (dotted arrow)
Note: photos taken by the authors.
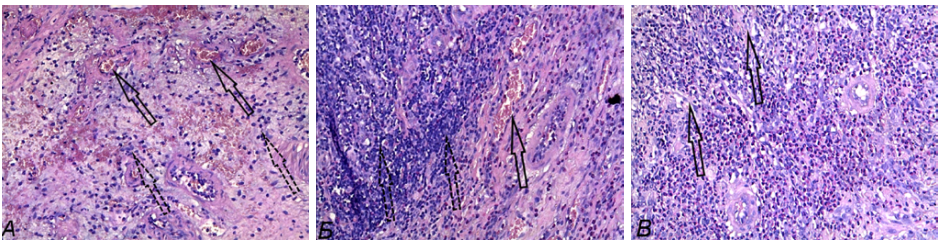
Рис. 3. Морфологические изменения в стенке толстой кишки при ОИК в условиях применения 5-АСК, окраска гематоксилин-эозином, ув. ×200: А) 2-е сутки — рыхлое диапедезное кровоизлияние (обозначено стрелками), резкий отек и разволокнение межуточной ткани с нейтрофильно-лимфоцитарной инфильтрацией (обозначено пунктирными стрелками). Б) 4-е сутки — в подслизистом слое на фоне венозного полнокровия и диапедезных кровоизлияний (обозначено стрелкой) — выраженный отек межуточной ткани и плотная воспалительная инфильтрация (обозначено пунктирными стрелками). В) 6-е стуки — венозное и капиллярное полнокровие подслизистого слоя, плотная диффузная воспалительная клеточная инфильтрация, на фоне которой видны небольшие тяжи пролиферирующих фибробластов (обозначено стрелками).
Примечание: фотографии сделаны авторами.
Fig. 3. Morphological changes in colon wall in oxazolone-induced colitis under conditions of injection of 5-aminosalicylic acid, stained with hematoxylin-eosin, ×200: A) Day 2 — ‘loose’ diapedetic hemorrhage (arrows), acute edema and dissociation of interstitial tissue with neutrophilic-lymphocytic infiltration (dotted arrows). Б) Day 4 — pronounced edema of interstitial tissue and dense inflammatory infiltration (dotted arrows) in submucosa on the background of venous plethora and diapedetic hemorrhages (arrow). В) Day 6 — venous and capillary congestion of submucosa, dense diffuse inflammatory cellular infiltration, against which small cords of proliferating fibroblasts are visible (arrows).
Note: photos taken by the authors.
ОБСУЖДЕНИЕ
Интерпретация / научная значимость
Клинико-морфологическая картина поражения толстой кишки при ОИК соответствует изменениям при ВЗК у человека и позволяет применять оксазолоновую модель колита для изучения патогенеза и апробации эффективности применения новых терапевтических подходов при ВЗК [16][17].
Положительный эффект озона при ОИК может быть обусловлен мультимодальными свойствами его молекулы. Озон обладает противовоспалительным эффектом, который достигается путем активации транскрипционного фактора Nrf2, что приводит к ингибированию экспрессии NF-kB и уменьшению экспрессии воспалительных цитокинов, связанных с активностью NF-kB [18], вследствие чего снижается экспрессия GPC6 и сигнального пути WNT5A, а также синтез провоспалительных цитокинов IL-1, IL-6, IL-8, TNF-α и IFN-γ, что приводит к развитию обширной воспалительной реакции с последующим вовлечением нейтрофилов, лимфоцитов и макрофагов [19]. Антиоксидантные свойства озона связаны с его способностью активировать транскрипционный ядерный фактор Nrf2, в норме связанный с его специфическим ингибитором Keap1. Несмотря на то что рассматриваемый механизм нуждается в пояснении, известно, что производные озона диссоциируют комплекс Nrf2-Keap1 за счет окисления двух групп -SH, входящих в состав Keap1, с последующим высвобождением Nrf2, который накапливается в ядре и вступает в реакцию с фактором транскрипции MAF, образуя гетеродимер, который связывается с областями ДНК, содержащими элементы антиоксидантного ответа (ARE). Это связывание вызывает активацию транскрипции более чем 200 генов антиоксидантов, таких как супероксиддисмутаза, каталаза, глутатионпероксидаза, глутатионредуктаза, глутатион-S-трансфераза, НАДФН-хиноноксидоредуктаза 1, гемеоксигеназа и система тиоредоксин (Trx)/тиоредоксинредуктаза (TrxR), действие которых препятствует образованию прооксидантных ферментов, таких как НАДФН-оксидаза, NOS, ксантиноксидаза, липоксигеназа, ЦОГ и миелопероксидаза (МПО) [20][21].
Ограничения исследования
Ограничений не было.
Обобщаемость/экстраполяция
В этом отношении интересно использование озонотерапии, эффективность применения которой подтверждена в ряде клинических исследований при различных воспалительных заболеваниях [22–25].
ЗАКЛЮЧЕНИЕ
При оксазолон-индуцированном колите на 2-е, 4-е и 6-е сутки эксперимента у животных наблюдаются клинические и морфологические признаки, прогрессирующие от 2-х к 6-м суткам наблюдения: увеличение DAI, повышение количества нейтрофилов, лимфоцитов, гистиоцитов, плазмоцитов и фибробластов, индекса повреждения тканей TDI, что позволяет использовать данную модель для изучения ВЗК. Внутрибрюшинные инсуффляции озона в дозе 0,05 мг/кг ежедневно при оксазолон-индуцированном колите приводят к снижению и частичному восстановлению индекса DAI, в очаге повреждения толстой кишки к снижению количества нейтрофилов, эозинофилов, гистиоцитов, фибробластов, уменьшению диаметра язвенного дефекта и индекса TDI с максимальной выраженностью эффекта на 4-е и 6-е сутки наблюдения. Эффекты при оксазолон-индуцированном колите внутрибрюшинных инсуффляций озона по сравнению с эффектами применения каждые 12 ч ректальных суппозиториев с 50 мг 5-АСК менее выражены в отношении индекса DAI на 4-е сутки; в отношении количества эозинофилов, плазмоцитов, гистиоцитов — на 2-е, 4-е и 6-е сутки; в отношении лимфоцитов — на 6-е сутки.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Регистрация протокола
Выписка из протокола от 20.03.2020 № 14 заседания кафедры патологической физиологии ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Челябинска о рассмотрении и утверждении индивидуального плана подготовки диссертации на соискание ученой степени кандидата медицинских наук Кайгородцевой Н. В.
Доступ к данным
Данные о проведенных исследованиях относятся к свободно доступным для машиночитаемого использования и дальнейшей републикации с учетом авторских прав.
1 Best W. R., Becktel J. M., Singleton J. W., Kern F. Jr. Development of a Crohn’s disease activity index. National Cooperative Crohn’s Disease Study. Gastroenterology. 1976; 70 (3): 439–444
2 Hughes A. A simplified benzidine test with an evaluation of some faecal occult blood tests. Br. Med. J. 1952; 2 (4791): 970–975. DOI: 10.1136/bmj.2.4791.970
Список литературы
1. Игнатьева В.И., Авксентьева М.В., Омельяновский В.В., Деркач Е.В. Социально-экономическое бремя воспалительных заболеваний кишечника в Российской Федерации. Профилактическая медицина. 2020; 23(2): 19–25. DOI: 10.17116/profmed20202302119
2. Биннатли Ш.А., Алешин Д.В., Куликов А.Э., Романов Р.И. Качество жизни пациентов, оперированных по поводу язвенного колита (обзор литературы). Колопроктология. 2019; 18(1(67)): 89–100. DOI: 10.33878/2073-7556-2019-18-1-89-100
3. Omenetti S., Pizarro T.T. The Treg/Th17 Axis: A Dynamic Balance Regulated by the Gut Microbiome. Front. Immunol. 2015; 6: 639. DOI: 10.3389/fimmu.2015.00639
4. Ситкин СИ, Вахитов ТЯ, Демьянова ЕВ. Микробиом, дисбиоз толстой кишки и воспалительные заболевания кишечника: когда функция важнее таксономии. Альманах клинической медицины. 2018; 46(5): 396–425. DOI: 10.18786/20720505-2018-46-5-396-425.
5. GBD 2017 Infl ammatory Bowel Disease Collaborators. The global, regional, and national burden of infl ammatory bowel disease in 195 countries and territories, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. Gastroenterol. Hepatol. 2020; 5(1): 17–30. DOI: 10.1016/S2468-1253(19)30333-4
6. Ryan F.J., Ahern A.M., Fitzgerald R.S., Laserna-Mendieta E.J., Power E.M., Clooney A.G., O’Donoghue K.W., McMurdie P.J., Iwai S., Crits-Christoph A., Sheehan D., Moran C., Flemer B., Zomer A.L., Fanning A., O’Callaghan J., Walton J., Temko A., Stack W., Jackson L., Joyce S.A., Melgar S., DeSantis T.Z., Bell J.T., Shanahan F., Claesson M.J. Colonic microbiota is associated with infl ammation and host epigenomic alterations in infl ammatory bowel disease. Nat. Commun. 2020; 11(1): 1512. DOI: 10.1038/s41467-020-15342-5
7. Schirmer M., Garner A., Vlamakis H., Xavier R.J. Microbial genes and pathways in infl ammatory bowel disease. Nat. Rev. Microbiol. 2019; 17(8): 497–511. DOI: 10.1038/s41579-019-0213-6
8. He C., Wang H., Liao W.D., Peng C., Shu X., Zhu X., Zhu Z.H. Characteristics of mucosa-associated gut microbiota during treatment in Crohn’s disease. World J. Gastroenterol. 2019; 25(18): 2204–2216. DOI: 10.3748/wjg.v25.i18.2204
9. Weisshof R., El Jurdi K., Zmeter N., Rubin D.T. Emerging Therapies for Infl ammatory Bowel Disease. Adv. Ther. 2018; 35(11): 1746–1762. DOI: 10.1007/s12325-018-0795-9
10. Маев И.В., Андреев Д.Н. Таргетная терапия воспалительных заболеваний кишечника: реалии и перспективы. Медицинский Совет. 2018; 6: 114–118. DOI: 10.21518/2079-701X2018-6-114-118
11. Ner J., Lomba E., Karam A.M., De Almeda Reis S.R., Teixeira Marchionni A., Pexoto Meidrado A. Ozone therapy infl uence in the tissue repair process: a literature review. JORDI — Journal of Oral Diagnosis. 2017; 2: 1–6. DOI: 10.5935/2525-5711.20170032
12. Kiesler P., Fuss I.J., Strober W. Experimental Models of Infl ammatory Bowel Diseases. Cell Mol. Gastroenterol. Hepatol. 2015; 1(2): 154–170. DOI: 10.1016/j.jcmgh.2015.01.006
13. Hoving J.C., Keeton R., Höft M.A., Ozturk M., Otieno-Odhiambo P., Brombacher F. IL-4 Receptor-Alpha Signalling of Intestinal Epithelial Cells, Smooth Muscle Cells, and Macrophages Plays a Redundant Role in Oxazolone Colitis. Mediators. Infl amm. 2020; 2020: 4361043. DOI: 10.1155/2020/4361043
14. Varma A., Weinstein J., Seabury J., Rosero S., Wagner E., Zizzi C., Luebbe E., Dilek N., McDermott M., Heatwole J., Saubermann L., Temple L., Rogoff S., Heatwole C. Patient-Reported Impact of Symptoms in Crohn’s Disease. Am. J. Gastroenterol. 2022; 117(12): 2033–2045. DOI: 10.14309/ajg.0000000000001954
15. Vart G., Banzi R., Minozzi S. Comparing participation rates between immunochemical and guaiac faecal occult blood tests: a systematic review and meta-analysis. Prev. Med. 2012; 55(2): 87–92. DOI: 10.1016/j.ypmed.2012.05.006
16. Osikov M., Boyko M., Fedosov A., Ilyinykh M. Effectiveness of Experimental Colitis Therapy with Original Vitamin D3 Rectal Suppositories. International Journal of Biomedicine. 2022; 12(1): 124–133. DOI: 10.21103/article12(1)_oa13
17. Осиков М.В., Давыдова Е.В., Бойко М.С., Бакеева А.Е., Кайгородцева Н.В., Галеева И.Р., Федосов А.А., Ильиных М.А., Воргова Л.В. Особенности свободнорадикального окисления в толстом кишечнике при язвенном колите и болезни Крона. Вестник РГМУ. 2020; 3: 63–70. DOI: 10.24075/vrgmu.2020.027
18. Galiè M., Covi V., Tabaracci G., Malatesta M. The Role of Nrf2 in the Antioxidant Cellular Response to Medical Ozone Exposure. Int. J. Mol. Sci. 2019; 20(16): 4009. DOI: 10.3390/ijms20164009
19. Cenci A., Macchia I., La Sorsa V., Sbarigia C., Di Donna V., Pietraforte D. Mechanisms of Action of Ozone Therapy in Emerging Viral Diseases: Immunomodulatory Effects and Therapeutic Advantages With Reference to SARS-CoV-2. Front. Microbiol. 2022; 13: 871645. DOI: 10.3389/fmicb.2022.871645
20. Burke R., Chu C., Zhou G.D., Putluri V., Putluri N., Stading R.E., Couroucli X., Lingappan K., Moorthy B. Role of Human NADPH Quinone Oxidoreductase (NQO1) in Oxygen-Mediated Cellular Injury and Oxidative DNA Damage in Human Pulmonary Cells. Oxid. Med. Cell Longev. 2021; 2021: 5544600. DOI: 10.1155/2021/5544600
21. Зинчук В.В., Билецкая Е.С. Кислородзависимые механизмы физиологического действия озона (обзор). Журнал медико-биологических исследований. 2019; 7(2): 216–227. DOI: 10.17238/issn2542-1298.2019.7.2.216
22. Clavo B., Santana-Rodríguez N., Llontop P., Gutiérrez D., Suárez G, López L., Rovira G., Martínez-Sánchez G., González E., Jorge I.J., Perera C., Blanco J., Rodríguez-Esparragón F. Ozone Therapy as Adjuvant for Cancer Treatment: Is Further Research Warranted? Evid. Based. Complement. Alternat. Med. 2018; 2018: 7931849. DOI: 10.1155/2018/7931849
23. Martínez-Sánchez G., Schwartz A., Donna V.D. Potential Cytoprotective Activity of Ozone Therapy in SARS-CoV-2/COVID-19. Antioxidants (Basel). 2020; 9(5): 389. DOI: 10.3390/antiox9050389
24. Manoto S.L., Maepa M.J., Motaung S.K. Medical ozone therapy as a potential treatment modality for regeneration of damaged articular cartilage in osteoarthritis. Saudi. J. Biol. Sci. 2018; 25(4): 672–679. DOI: 10.1016/j.sjbs.2016.02.002
25. Sauaia A., Moore F.A., Moore E.E. Postinjury Infl ammation and Organ Dysfunction. Crit. Care. Clin. 2017; 33(1): 167–191. DOI: 10.1016/j.ccc.2016.08.006
Об авторах
М. В. ОсиковРоссия
Осиков Михаил Владимирович — доктор медицинских наук, профессор; заведующий кафедрой патологической физиологии Южно-Уральский ГМУ; руководитель научного отдела Челябинская ОКБ.
Ул. Воровского, д. 64, Челябинск, 454048; Ул. Воровского, д. 70, г. Челябинск, 454048
Н. В. Кайгородцева
Россия
Кайгородцева Наталья Васильевна — ассистент кафедры патологической физиологии Южно-Уральский ГМУ; врач—анестезиолог-реаниматолог отделения реанимации и интенсивной терапии № 3 Челябинская ОКБ.
Ул. Воровского, д. 64, Челябинск, 454048; Ул. Воровского, д. 70, г. Челябинск, 454048
М. С. Бойко
Россия
Бойко Маргарита Сергеевна — ассистент кафедры патологической физиологии.
Ул. Воровского, д. 64, Челябинск, 454048
Л. В. Астахова
Россия
Астахова Людмила Витальевна — руководитель отдела поисковых исследований.
Пр-кт Победы, д. 287, г. Челябинск, 454136
Дополнительные файлы
Рецензия
Для цитирования:
Осиков М.В., Кайгородцева Н.В., Бойко М.С., Астахова Л.В. Клинико-морфологический анализ эффективности внутрибрюшинного применения озона при экспериментальном колите: доклиническое рандомизированное исследование. Кубанский научный медицинский вестник. 2023;30(1):98-108. https://doi.org/10.25207/1608-6228-2023-30-1-98-108
For citation:
Osikov M.V., Kaygorodtceva N.V., Boyko M.S., Astachova L.V. Clinical and Morphological Analysis of Efficacy of Intraperitoneal Ozone Application in Experimental Colitis: Preclinical Randomized Experimental Study. Kuban Scientific Medical Bulletin. 2023;30(1):98-108. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-1-98-108







































