Перейти к:
Сравнительная оценка влияния гепатопротекторов на состояние окислительного гомеостаза в крови больных алкогольным гепатитом: рандомизированное экспериментальное исследование
https://doi.org/10.25207/1608-6228-2023-30-1-88-97
Аннотация
Введение. Анализ химической структуры, фармакодинамики и фармакокинетики, а также взаимосвязи структуры и свойств, опыта экспериментальных разработок и практического использования в клинике не позволяет сформировать целостную картину фармакологии гепатопротекторов. Еще более сложным вопросом является определение показаний к применению гепатопротекторов, выбор конкретного препарата, схемы и продолжительности лечения. Неясной остается связь между антиоксидантной активностью и эффективностью снижения цитолиза гепатоцитов.
Цель — определение особенностей влияния гепатопротекторных средств с разным механизмом действия на показатели окислительного метаболизма в крови больных алкогольным гепатитом.
Методы. Для проведения исследования были сформированы 4 группы испытуемых лиц. 1-ю группу составили относительно здоровые лица мужского пола (n = 15). Остальные группы (по 10 мужчин) были представлены больными алкогольным гепатитом средней степени тяжести. Больные 2-й группы получали ремаксол, больные 3-й группы получали адеметионин, больные 4-й группы получали урсодезоксихолевую кислоту. До и после лечения в крови определяли маркеры цитолиза и прооксидантно-антиоксидантного статуса. Статистическую обработку данных проводили на базе программы StatPlus версия 7 (AnalystSoft Inc.).
Результаты. По данным изменений ферментов — маркеров цитолитического синдрома все три используемых гепатопротектора обладают сопоставимой эффективностью. После лечения по какой-либо из схем активность АЛТ и АСТ в плазме крови снижалась на 56–68 и 75–81 % относительно исходных значений соответствующих показателей. Общая антиоксидантная активность плазмы крови на этапе поступления больных в стационар была снижена на 20–27 %, содержание ТБК-реактивных продуктов в эритроцитарной взвеси было увеличено на 61–87 % по сравнению с показателями контрольной группы. На фоне терапии с использованием ремаксола, адеметионина или урсодезоксихолевой кислоты отмечалась частичная нормализация данных показателей без существенных различий между группами больных с разными схемами коррекции. После терапии концентрация глутатиона в эритроцитарной взвеси и содержание тиоловых групп в плазме увеличивались на 12–15 %, но также не было выявлено преимущественное влияние какого-либо одного из изученных гепатопротекторов.
Заключение. В результате сравнительного исследования были получены данные, свидетельствующие об отсутствии какого-то специфического антиоксидантного эффекта среди фармакологических механизмов действия ремаксола, адеметионина и урсодезоксихолевой кислоты. В этой связи интерес представляет дальнейшая оценка влияния гепатопротекторных препаратов на патобиохимические изменения и анализ возможной связи между антиоксидантным действием и эффективностью снижения уровня цитолиза гепатоцитов.
Ключевые слова
Для цитирования:
Быков И.М., Ермакова Г.А., Попов К.А., Цымбалюк И.Ю., Быков М.И., Денисова Я.Е., Тутаришева С.М. Сравнительная оценка влияния гепатопротекторов на состояние окислительного гомеостаза в крови больных алкогольным гепатитом: рандомизированное экспериментальное исследование. Кубанский научный медицинский вестник. 2023;30(1):88-97. https://doi.org/10.25207/1608-6228-2023-30-1-88-97
For citation:
Bykov I.M., Ermakova G.A., Popov K.A., Tsymbalyuk I.Yu., Bykov M.I., Denisova Ya.E., Tutarisheva S.M. Comparative Evaluation of the Effect of Hepatoprotectors on Oxidative Homeostasis in the Blood of Patients with Alcoholic Hepatitis: A Randomized Experimental Study. Kuban Scientific Medical Bulletin. 2023;30(1):88-97. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-1-88-97
ВВЕДЕНИЕ
Злоупотребление спиртосодержащей продукцией является проблемой мирового масштаба с тяжелыми последствиями для экономики, общества и здоровья населения. Так, ежегодно вследствие причин, связанных с чрезмерным употреблением алкоголя, происходит более 3,3 миллиона смертей (World Health Organization, 2018)1. Средний уровень потребления алкоголя в мире в 2019 году составил 5,8 литра чистого спирта на душу населения, что незначительно ниже показателя 2010 года [1]. Чрезмерное употребление алкоголя в течение десятилетий повреждает почти все органы и системы организма человека. Однако наиболее чувствительной к действию алкоголя является печень, которая также является основным местом метаболизма этанола, других эндогенных токсинов и ксенобиотиков. Печень поражается в первую очередь, и степень ее повреждения наиболее выражена в сравнении с другими органами и тканями [2]. Этиловый спирт в составе различных напитков метаболизируется в основном в паренхиматозных клетках печени — в гепатоцитах, которые составляют около 70 % массы печени. Эти клетки экспрессируют самые высокие уровни основных ферментов, окисляющих этанол: алкогольдегидрогеназы, которая локализована в цитозоле, и цитохрома P450 2E1 (CYP2E1), который локализован в гладком эндоплазматическом ретикулуме [3].
Результаты современных клинических исследований гепатопротекторных препаратов, отвечающих требованиям доказательной медицины, в настоящее время не позволяют сделать выводы об их эффективности, безопасности и показаниях к применению. Анализ химической структуры, фармакодинамики и фармакокинетики, а также взаимосвязи структуры и свойств, опыта экспериментальных разработок и практического использования в клинике также не позволяет сформировать целостную картину фармакологии этой группы лекарственных препаратов.
Еще более сложным вопросом является определение показаний к применению гепатопротекторов, выбор конкретного препарата, схемы и продолжительности лечения [4][5]. На фармацевтическом рынке представлено большое количество гепатопротекторов с разными составом, тропностью к печени и механизмами действия. Широко в практической медицине используются лекарственные препараты, представляющие собой: источник активной формы метионина, участвующего в обезвреживании ксенобиотиков в печени; эссенциальные жирные кислоты; инфузионные метаболические препараты, содержащие янтарную кислоту и витамины; желчные кислоты; антиоксиданты и другие соединения растительного происхождения [6–8]. Разрабатываются новые подходы к комбинированному использованию нескольких гепатопротекторов с разными механизмами действия [9][10]. Часто эффекты лекарственных препаратов группы гепатопротекторных средств связывают с их антиоксидантным действием, хотя немногие из вышеперечисленных средств способны непосредственно связывать и нейтрализовать активные формы кислорода, азота, хлора и другие сильные прооксиданты [11]. В связи с этим интерес представляет анализ возможной связи между антиоксидантной активностью, прямой или косвенной, и эффективностью снижения уровня цитолиза гепатоцитов при использовании разных гепатопротекторов.
Цель исследования — определение особенностей влияния гепатопротекторных средств с разным механизмом действия на показатели окислительного метаболизма в крови больных алкогольным гепатитом.
МЕТОДЫ
Дизайн исследования
Работа выполнена по дизайну рандомизированного экспериментального клинического исследования.
Критерии соответствия
Критерии включения
Критерии включения в исследование для группы контроля: возраст 18–45 лет; мужской пол, отсутствие соматических патологий, состояние психического здоровья на момент обследования, наличие добровольного информируемого согласия.
Критерии включения в исследование для основных групп: возраст 18–45 лет; мужской пол; верифицированный диагноз: «алкогольная болезнь печени», клиническая форма «алкогольный гепатит» средней степени тяжести, наличие добровольного информируемого согласия.
Критерии невключения
Возраст старше 45 или моложе 18 лет; женский пол; наличие онкологических заболеваний; наличие острых или хронических болезней в фазе обострения, не относящихся к исследуемым нозологическим формам (например, декомпенсированная патология сердечно-сосудистой системы, органов дыхания, почек, ВИЧ-инфекция и прочее); неврологические и психические расстройства; неконтролируемый прием лекарственных препаратов, прием биологически активных добавок, лекарственных трав, отягощенный аллергологический анамнез, отказ от включения в исследование.
Условия проведения исследования
Больные находились на стационарном лечении в государственном бюджетном учреждении здравоохранения «Наркологический диспансер» Министерства здравоохранения Краснодарского края (ГБУЗ НД). Относительно здоровые испытуемые лица контрольной группы наблюдались на базе Клиники федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО КубГМУ Минздрава России) в рамках ежегодных профилактических медосмотров. Лабораторные исследования проведены на базе клинико-диагностической лаборатории ГБУЗ НД и лаборатории кафедры фундаментальной и клинической биохимии ФГБОУ ВО КубГМУ Минздрава России.
Продолжительность исследования
Период проведения исследования: с января по август 2022 года.
Рандомизация
Для проведения исследования была сформирована контрольная группа (n = 15) и три опытные (n = 30), представленные больными алкогольным гепатитом. Распределение испытуемых лиц по группам было основано на методе простой рандомизации с использованием таблиц случайных чисел.
Медицинские вмешательства
Больные с диагнозом «алкогольный гепатит» были разделены на три группы в зависимости от типа гепатопротектора, используемого в составе комплексной терапии. Кроме используемых гепатопротекторных средств больные опытных групп получали всю необходимую помощь, предусмотренную стандартами оказания медицинской помощи больным с синдромом алкогольной зависимости, алкогольной болезнью печени в исследуемой клинической форме «алкогольный гепатит» средней степени тяжести. Больные 2-й группы (n = 10) получали ремаксол (400 мл в/в ежесуточно, «Ремаксол», ООО «НТФФ Полисан», Россия), больные 3-й группы (n = 10) получали адеметионин (S-аденозилметионин, SAM, 400 мг в/в ежесуточно в составе лекарственного препарата «Гепцифол», АО «Фармсинтез», Россия), больные 4-й группы (n = 10) получали урсодезоксихолевую кислоту (10 мг/кг/сутки внутрь в составе препарата «Протехолин», ЗАО «ОХФК», Россия). Больные находились на стационарном лечении в ГБУЗ НД в течение 15–18 суток. На момент поступления больных в стационар и перед выпиской осуществляли забор крови для лабораторных исследований прооксидантно-антиоксидантного статуса.
Исходы исследования
Основной исход исследования
Основным исходом сравнительного анализа влияния гепатопротекторных средств (ремаксол, SAM, УДХК) на течение хронического алкогольного гепатита считали выявление статистически значимого снижения уровня маркеров цитолиза гепатоцитов, увеличения антиоксидантной активности или содержания метаболитов антиоксидантной системы, а также снижение концентрации продуктов окислительных модификаций биомолекул.
Дополнительные исходы исследования
Исследованием не предусмотрено.
Методы регистрации исходов
Для оценки эффективности гепатопротекторного действия лекарственных препаратов определяли активность ферментов-маркеров цитолитического синдрома — аспартатаминотрансфераза (АСТ), аланинаминотрансфераза (АЛТ) и лактатдегидрогеназа (ЛДГ). Для определения данных показателей использовали наборы реагентов Randox (Великобритания) и биохимический автоматический многоканальный анализатор Super Z (Китай).
Для определения прооксидантно-антиоксидантного статуса определяли общую антиоксидантную активность (ОАОА) и способность радикальной сорбции плазмы крови, содержание восстановленной формы глутатиона в отмытой эритроцитарной массе, общее содержание сульфгидрильных (тиоловых, SH-) групп белков плазмы крови, содержание ТБК-реактивных продуктов (малонового диальдегида) в эритроцитарной взвеси. Определение ОАОА выполняли железовосстанавливающим способом, предполагающим преинкубацию биожидкости с раствором ионов трехвалентного железа с последующим внесением раствора 2,2’-дипиридила, образующего окрашенный комплекс с ионами восстановленного железа Fe+2. Для определения способности радикальной сорбции использовали зеленый катионный радикал ABTS. Определение концентрации глутатиона или содержания тиоловых групп было основано на их способности реагировать с реактивом Эллмана с высвобождением окрашенного тионитрофенильного аниона. Определение продуктов окислительных модификаций карбонильной химической природы было основано на способности их реагировать с тиобарбитуровой кислотой с образованием окрашенного кирпично-красного аддукта [12].
Для выполнения лабораторных исследований использовали реактивы: восстановленный глутатион, окисленный глутатион, сульфосалициловая кислота (Sigma, USA), трис(оксиметил)аминометан, раствор пероксида водорода 30 %, раствор трет-бутилгидропероксида 70 %, NaN3 («Вектон», Россия), трихлоруксусная кислота, гидроортофосфат калия, соляная кислота, хлористый натрий, гидроксид натрия («Реактив», Россия), реактив Эллмана, никотинамидадениндинуклеотидфосфат восстановленный (AppliChem, США).
Статистические процедуры
Принципы расчета размера выборки
Размер выборки предварительно не рассчитывался.
Методы статистического анализа данных
Статистическая обработка данных была проведена с помощью программы StatPlus версия 7 (AnalystSoft Inc.). Для проверки нормальности распределения показателей использовали критерий Шапиро — Уилка, описательная статистика была основана на представлении данных в виде медианы (Ме) и квартилей (Q1 и Q3). Сравнение показателей групп выполняли с помощью непараметрических критериев Краскела — Уоллиса и Манна — Уитни. Для сравнения показателей внутри группы до и после курса лечения использовали критерий Уилкоксона. Различия считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
Формирование групп исследования
Для проведения исследования была сформирована контрольная группа (n = 15) и 3 опытных (n = 30) (рис. 1). 1-ю группу составили относительно здоровые добровольцы мужского пола. Остальные группы были представлены больными с диагнозом «алкогольная болезнь печени», установленной в соответствии с диагностическими критериями Клинических рекомендаций (2019), клиническая форма «Алкогольный гепатит» средней степени тяжести [13, 14].
Характеристика групп исследования
Испытуемые лица, включенные в контрольную и опытные группы, были сопоставимы по полу (все мужчины) и возрасту. Возраст мужчин 1-й группы составлял 32 (28/35) года, 2-й группы — 35 (30/38) лет, 3-й группы — 35 (31/38) лет, 4-й группы — 34 (28/38) года. Исходные значения анализируемых лабораторных показателей больных опытных групп были сопоставимы, что наглядно представлено в таблицах 1–3 и подчеркивает однородность сформированных групп.
Основные результаты исследования
В результате проведенных исследований было установлено, что все 3 используемых гепатопротектора обладают сопоставимой эффективностью по данным изменений ферментов — маркеров цитолитического синдрома. Так, на этапе поступления больных в стационар активность АЛТ в плазме крови была увеличена в 7,8–9,0 раза относительно контрольных цифр, активность АСТ в тех же условиях превышала соответствующие значения показателя 1-й группы в 7,9–8,9 раза (табл. 1). При этом после лечения по любой из предложенных схем отмечалось статистически значимое снижение активности АЛТ или АСТ. Так, на фоне комплексной терапии с ремаксолом активность данных ферментов снижалась на 56 и 75 % соответственно. После лечения с использованием адеметионина активность изученных ферментов была на 60 и 81 % ниже исходных значений соответствующих показателей. Введение урсодезоксихолевой кислоты в качестве гепатопротектора способствовало снижению активности АЛТ на 68 % и АСТ — на 79 %.
Таким образом, все три используемых лекарственных препарата показали высокую эффективность, но тем не менее уровень выраженности цитолитического синдрома оставался существенно выше контроля. Так, после курса лечения активность АЛТ оставалась в 2,9–3,5 раза выше значения показателя испытуемых лиц 1-й группы, а активность АСТ — в 1,6–2,0 раза (табл. 1). Это может быть обусловлено как недостаточной длительностью терапии и наблюдения за больными, так и недостаточно высокой эффективностью препаратов. В настоящее время остается актуальным не только обоснование использования существующих, но и поиск новых гепатопротекторов, а также схем комбинированного их использования.
Определение общей антиоксидантной активности плазмы крови показало отсутствие какого-то особенного действия одного из изученных гепатопротекторных средств. Каждый из используемых в исследовании лекарственных препаратов способствовал статистически значимому увеличению антиоксидантной активности и снижению содержания продуктов свободнорадикальных повреждений биомолекул в крови (табл. 2). На этапе поступления в стационар в крови больных были определены классические лабораторные признаки окислительного стресса. Железовосстанавливающая способность плазмы крови была снижена относительно контроля на 20–25 %, способность радикальной сорбции ABTS — на 20–27 %. В то же время содержание ТБК-реактивных продуктов в эритроцитарной взвеси было увеличено на 61–87 %. На фоне терапии с использованием ремаксола, адеметионина или урсодезоксихолевой кислоты отмечалось увеличение общей антиоксидантной активности, определенной путем оценки степени нейтрализации радикала ABTS, до уровня значения, характерного для испытуемых лиц 1-й группы. Однако рост другого показателя — железовосстанавливающей способности плазмы крови — был существенно ограничен в процессе терапии и в большей степени наблюдался у больных 4-й группы — на 11 % относительно исходного значения показателя. Также следует отметить, что данный параметр, как и уровень ТБК-реактивных продуктов, хоть и стремился к нормализации после лечения, но оставался выше уровня контрольных цифр.
Дополнительное исследование некоторых показателей состояния гомеостаза тиолсодержащих соединений подтвердило предположение об отсутствии специфического антиоксидантного действия одного из используемых препаратов. На фоне острой фазы алкогольного гепатита уровень концентрации восстановленного глутатиона в эритроцитарной взвеси и содержания сульфгидрильных групп в плазме крови больных был снижен относительно контрольной группы на 16 и 26 % соответственно (табл. 3). После терапии оба изученных показателя стремились к увеличению, но не достигали контрольного уровня. Наиболее заметный рост концентрации глутатиона был определен в крови больных 3-й группы — на 12 %, а тиоловых групп — на 15 % в крови больных 4-й группы относительно исходного значения.
Дополнительные результаты исследования
Дополнительные результаты в ходе исследования не получены.
Нежелательные явления
Нежелательных явлений зарегистрировано не было.
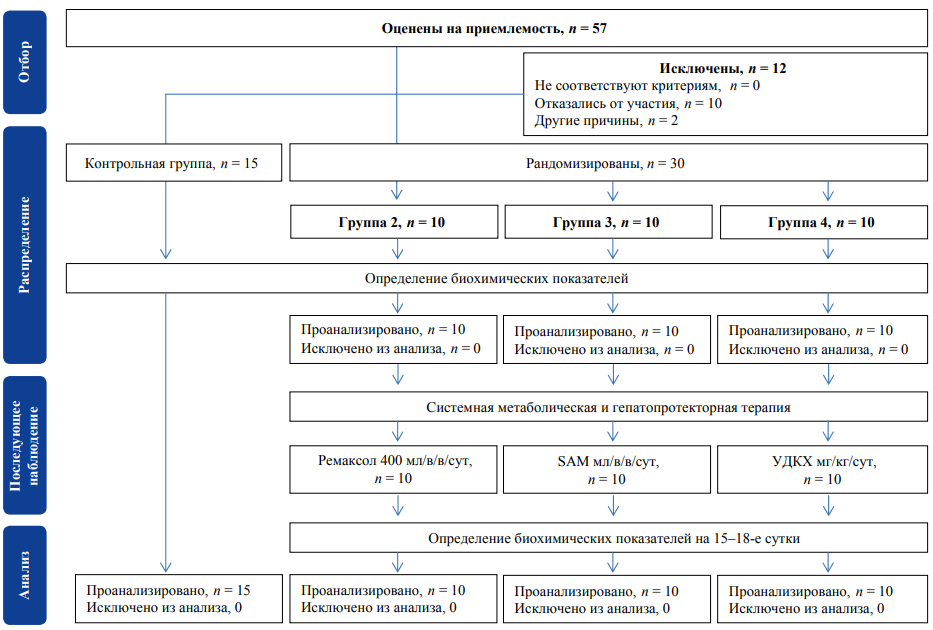
Рис. Блок-схема проведенного исследования.
Примечание: Блок-схема согласно рекомендациям CONSORT заполнена авторами; SAM — S-аденозилметионин; УДКХ — урсодезоксихолевая кислота; в/в — внутривенно; сут — сутки.
Fig. Block diagram of the conducted study.
Note: Block diagram according to CONSORT recommendations completed by the authors; SAM — S-adenosylmethionine; УДКХ — ursodeoxycholic acid; в/в — intravenous; cут — days.
Таблица 1. Изменения показателей цитолиза гепатоцитов в крови больных алкогольным гепатитом на фоне терапии с использованием гепатопротекторов (Ме (Q1/Q3))
Table 1. Changes in the parameters of hepatocyte cytolysis in the blood of patients with alcoholic hepatitis during hepatoprotective therapy (Ме (Q1;Q3))
Исследуемые показатели | Исследуемые группы | ||
Этап наблюдения | АЛТ, ед/л | АСТ, ед/л | |
1 (контрольная группа, n = 15) | 22,3 (17,3/25,2) | 24,5 (18,0/28,7) | |
2 (ремаксол) n = 10 | до лечения | 172,4* (158,3/185,1) | 193,3* (174,5/202,0) |
после лечения | 76,0*^ (65,0/84,9) | 48,8*^ (43,2/56,0) | |
3 (SAM) n = 10 | до лечения | 178,2* (160,8/188,2) | 213,7* (182,1/228,5) |
после лечения | 71,0*^ (61,3/77,4) | 40,2*^ (35,7/45,1) | |
4 (УДХК) n = 10 | до лечения | 197,6* (176,8/208,5) | 217,1* (187,4/228,5) |
после лечения | 63,5*^ (58,6/72,5) | 46,6*^ (38,7/50,2) | |
Примечание: таблица составлена авторами; * — статистически значимые отличия от показателя 1-й группы; ^ — статистически значимые отличия между показателями больных одной группы до и после лечения; АСТ — аспартатаминотрансфераза; АЛТ — аланинаминотрансфераза; SAM — S-аденозилметионин; УДКХ — урсодезоксихолевая кислота.
Note: The table was compiled by the authors; * — statistically significant differences in comparison with the indicator of the 1st group; ^ — statistically significant differences between the parameters of patients of the same group before and after treatment; АСТ — aspartate aminotransferase; АЛТ — alanine aminotransferase; SAM — S-adenosylmethionine; УДКХ — ursodeoxycholic acid.
Таблица 2. Изменения показателей окислительного гомеостаза в крови больных алкогольным гепатитом на фоне терапии с использованием гепатопротекторов (Ме (Q1/Q3))
Table 2. Changes in the parameters of oxidative homeostasis in the blood of patients with alcoholic hepatitis during hepatoprotective therapy (Ме (Q1;Q3))
Исследуемые показатели | Исследуемые группы | |||
Этап наблюдения | ОАОА (FRAP), мМ витамина С | ОАОА (ABTS), мМ витамина С | ТБК-реактивные продукты, усл. ед. | |
1 (контрольная группа, n = 15) | 0,55 (0,52/0,60) | 0,60 (0,55/0,64) | 0,38 (0,33/0,42) | |
2 (ремаксол) n = 10 | до лечения | 0,41* (0,34/0,45) | 0,46* (0,42/0,49) | 0,61* (0,56/0,68) |
после лечения | 0,43* (0,35/0,46) | 0,61^ (0,55/0,64) | 0,45*^ (0,42/0,53) | |
3 (SAM) n = 10 | до лечения | 0,41* (0,35/0,45) | 0,48* (0,43/0,51) | 0,71* (0,63/0,80) |
после лечения | 0,46* (0,37/0,49) | 0,58^ (0,54/0,63) | 0,56*^ (0,50/0,64) | |
4 (УДХК) n = 10 | до лечения | 0,44* (0,38/0,47) | 0,44* (0,40/0,48) | 0,65* (0,58/0,74) |
после лечения | 0,51* (0,40/0,53) | 0,55^ (0,52/0,60) | 0,48*^ (0,45/0,55) | |
Примечание: таблица составлена авторами; статистически значимые отличия от показателя 1-й группы; ^ — статистически значимые отличия между показателями больных одной группы до и после лечения; ОАОА — общая антиоксидантная активность; FRAP — железовосстанавливающая способность; ABTS — способность радикальной сорбции; ТБК-реактивные продукты — малонового диальдегид; SAM — S-аденозилметионин; УДКХ — урсодезоксихолевая кислота.
Note: The table was compiled by the authors; * — statistically significant differences in comparison with the indicator of the 1st group; ^ — statistically significant differences between the parameters of patients of the same group before and after treatment; OAOA — total antioxidant activity; FRAP — iron reducing capacity; ABTS — radical sorption capacity; TБK-reactive products — malondialdehyde; SAM — S-adenosylmethionine; УДКХ — ursodeoxycholic acid.
Таблица 3. Изменения показателей тиолового метаболизма в крови больных алкогольным гепатитом на фоне терапии с использованием гепатопротекторов (Ме (Q1/Q3))
Table 3. Changes in the parameters of thiol metabolism in the blood of patients with alcoholic hepatitis during hepatoprotective therapy (Ме (Q1/Q3))
Исследуемые показатели | Исследуемые группы | ||
Этап наблюдения | Глутатион, мкмоль/л | SH-группы, 100*е. о.п./г белка | |
1 (контрольная группа, n = 15) | 2,56 (2,43/2,70) | 0,57 (0,54/0,61) | |
2 (ремаксол) n = 10 | до лечения | 2,16 (1,97/2,28)* | 0,43 (0,41/0,45)* |
после лечения | 2,27 (2,18/2,38)*^ | 0,48 (0,45/0,51)*^ | |
3 (SAM) n = 10 | до лечения | 2,12 (1,95/2,20)* | 0,44 (0,41/0,46)* |
после лечения | 2,38 (2,21/2,47)*^ | 0,47 (0,44/0,50)* | |
4 (УДХК) n = 10 | до лечения | 2,14 (1,95/2,23)* | 0,39 (0,37/0,43)* |
после лечения | 2,33 (2,24/2,48)*^ | 0,45 (0,42/0,47)*^ | |
Примечание: статистически значимые отличия от показателя 1-й группы; ^ — статистически значимые отличия между показателями больных одной группы до и после лечения; SAM — S-аденозилметионин; УДКХ — урсодезоксихолевая кислота.
Note: * — statistically significant differences in comparison with the indicator of the 1st group; ^ — statistically significant differences between the parameters of patients of the same group before and after treatment; SAM — S-adenosylmethionine; УДКХ — ursodeoxycholic acid.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Сравнительный анализ влияния лекарственных средств (ремаксол, SAM, УДХК) на показатели цитолиза гепатоцитов и маркеры окислительного стресса в крови больных алкогольным гепатитом показал отсутствие специфического антиоксидантного действия какого-либо из используемых средств. Терапия с использованием одного из гепатопротекторов характеризовалась сравнительно небольшим ростом антиоксидантной активности и снижением содержания ТБК-реактивных продуктов. После лечения сохранялся дисбаланс прооксидантно-антиоксидантной системы.
Ограничения исследования
Результаты настоящего исследования были получены на небольших выборках пациентов. Для дальнейшего развития выполненной работы необходимо проведение более крупного рандомизированного плацебо-контролируемого исследования с бóльшим объемом выборки, большей продолжительностью. Метаболическая коррекция хронических повреждений печени обычно требует более длительного времени, что подтверждается данными настоящего исследования о сохранении увеличенных значений активности аминотрансфераз в плазме крови после стандартного 15–18-дневного курса терапии. Другим направлением развития исследования может быть параллельное формирование дополнительной группы больных, которые будут получать гепатопротектор, обладающий прямой антиоксидантной активностью.
Обсуждение основного результата исследования
Исследуемые в работе гепатопротекторы имеют разные механизмы действия, тем не менее часто среди их эффектов выделяют антиоксидантное действие [15][16]. Также изменения окислительного метаболизма могут служить показателем активности патологического процесса ввиду тесной связи воспаления и окислительного стресса и неспецифическим характером их развития, сопровождающего течение многих заболеваний [17][18]. В частности, ремаксол относят к группе антиоксидантов и антигипоксантов, хотя такие эффекты реализуются косвенными механизмами, связанными с нормализацией энергетического обмена, особенно в условиях ишемии за счет янтарной кислоты, никотинамида и инозина [19–21]. Определение интегральной характеристики состояния окислительного гомеостаза — антиоксидантной активности плазмы крови показало отсутствие какого-то особенного действия одного из изученных гепатопротекторных средств. Каждый из используемых в исследовании лекарственных препаратов способствовал статистически значимому увеличению антиоксидантной активности и снижению содержания продуктов свободнорадикальных повреждений биомолекул в крови.
С учетом очевидно разного механизма гепатопротективного действия изученных средств [22–24], но отсутствия существенных различий в изменениях маркеров окислительного стресса можно предположить отсутствие также какого-то явного антиоксидантного действия одного из лекарственных препаратов, в том числе ремаксола. Таким образом, особый интерес представляет сравнительное исследование влияния на метаболические показатели нескольких лекарственных препаратов с разными механизмами действия. Если в отдельной работе, посвященной анализу влияния одного из препаратов, можно было бы сделать вывод о нормализации окислительного метаболизма на фоне терапии, а цитопротективное действие связать в том числе с антиоксидантными эффектами, то сравнительный анализ показал, что такой эффект скорее сопутствующий и связан с разрешением патологического процесса в целом.
При этом однозначно отрицать какое-то небольшое косвенное антиоксидантное действие всех трех изученных гепатопротективных средств также нельзя. Так, в работе [25] обсуждаются возможные механизмы, с помощью которых S-аденозил-L-метионин снижает экспрессию вируса гепатита С. В экспериментальных условиях исследовательским коллективом получены данные, свидетельствующие о наличии аддитивного эффекта между модуляцией систем антиоксидантных ферментов, соотношением восстановленной и окисленной формы глутатиона и переключением изоформ фермента метионин-аденозилтрансферазы (MAT2A и MAT1A). S-аденозил-L-метионин является основным предшественником эндогенного синтеза глутатиона, поставляя для него цистеин. Глутатион, в свою очередь, является ключевым регулятором клеточного редокс-гомеостаза. Поэтому многие исследователи среди возможных механизмов гепатопротекторного действия адеметионина называют косвенные антиоксидантные эффекты.
Широко обсуждаются антиоксидантные эффекты метаболического препарата «ремаксол», представляющего собой многокомпонентный инфузионный гепатопротектор, обладающий также антигипоксантными и мембраностабилизирующими свойствами. Данный препарат можно также отнести к митохондриальным цитопротекторам, эффект которых обеспечивается янтарной кислотой, поддерживающей высокий уровень активности сукцинатоксидазного звена окисления, ключевого в гипоксических условиях, а также оказывающей непрямое антиоксидантное действие, проявляющееся, в частности, сохранением пула восстановленного глутатиона [26]. Косвенное антиоксидантное действие можно описать и для урсодезоксихолевой кислоты, однако у ремаксола это один из основных эффектов. Тем не менее результаты нашей работы свидетельствуют больше в пользу того, что нормализация окислительного гомеостаза может быть не причиной гепатопротекторного эффекта, а его следствием.
Таким образом, видимые эффекты увеличения общей антиоксидантной активности плазмы крови, концентрации глутатиона и тиоловых групп, снижения уровня продуктов окислительных модификаций биомолекул могут оказаться результатом восстановления метаболической активности гепатоцитов, дезинтоксикации, стихания патологического процесса. Тем не менее общий вопрос о связи гепатопротекторного действия и антиоксидантной активности остается неразрешенным. Имеются экспериментальные данные, показывающие возможность снижения выраженности повреждения печеночной паренхимы при использовании таких антиоксидантов, как кверцетин, липоевая кислота, куркумин и другие [15][17]. Интерес также представляет возможность усиления эффективности гепатопротекторов за счет комбинаций, в том числе с вышеперечисленными и другими перспективными антиоксидантами.
ЗАКЛЮЧЕНИЕ
В результате сравнительного исследования были получены данные, указывающие на сопоставимую эффективность трех гепатопротекторов — ремаксол, адеметионин и урсодезоксихолевая кислота — в условиях обострения алкогольного гепатита средней тяжести. При этом терапия с использованием любого из вышеперечисленных средств сопровождалась частичной нормализацией показателей окислительного гомеостаза. Это можно рассматривать как доказательство отсутствия какого-то специфического антиоксидантного действия среди фармакологических механизмов действия одного из используемых лекарственных препаратов. В этой связи интерес представляет дальнейшая оценка влияния гепатопротекторных препаратов на патобиохимические изменения и анализ возможной связи между антиоксидантным действием и эффективностью снижения уровня цитолиза гепатоцитов.
1 WHO global information system on alcohol and health (GISAH) [online database]. Global Health Observatory. Geneva: World Health Organization; 2018. Available: https://www.who.int/publications/i/item/9789241565639
Список литературы
1. Ilhan M.N., Yapar D. Alcohol consumption and alcohol policy. Turk. J. Med. Sci. 2020; 50(5): 1197–1202. DOI: 10.3906/sag-2002-237
2. Kourkoumpetis T., Sood G. Pathogenesis of Alcoholic Liver Disease: An Update. Clin. Liver. Dis. 2019; 23(1): 71–80. DOI: 10.1016/j.cld.2018.09.006
3. Kong L.Z., Chandimali N., Han Y.H., Lee D.H., Kim J.S., Kim S.U., Kim T.D., Jeong D.K., Sun H.N., Lee D.S., Kwon T. Pathogenesis, Early Diagnosis, and Therapeutic Management of Alcoholic Liver Disease. Int. J. Mol. Sci. 2019; 20(11): 2712. DOI: 10.3390/ijms20112712
4. Singal A.K., Bataller R., Ahn J., Kamath P.S., Shah V.H. ACG Clinical Guideline: Alcoholic Liver Disease. Am. J. Gastroenterol. 2018; 113(2): 175–194. DOI: 10.1038/ajg.2017.469
5. Thakral N., Deutsch-Link S., Singal A.K. Therapeutic Pipeline in Alcohol-Associated Liver Disease. Semin. Liver. Dis. 2022. DOI: 10.1055/s0042-1759614
6. Долгарева С.А., Сорокин А.В., Конопля Н.А., Бушмина О.Н., Быстрова Н.А., Овод А.И. Использование иммуномодуляторов, антиоксидантов и гепатопротекторов для коррекции нарушений в печени, эритроцитах и иммунной системе при хронической интоксикации этанолом. Биомедицинская химия. 2018; 64(4): 360–367. DOI: 10.18097/PBMC20186404360
7. Daoudi N.E., Bnouham M. Hepatoprotective Essential Oils: A Review. J. Pharmacopuncture. 2020; 23(3): 124–141. DOI: 10.3831/KPI.2020.23.3.124
8. Babinets L.S., Halabitska I.M., Borovyk I.O., Redkva O.V. Effectiveness of hepatoprotector in the complex correction of clinical manifestations of chronic pancreatitis and type 2 diabetes mellitus comorbidity. Wiad. Lek. 2022; 75(4 pt 2): 970–973. DOI: 10.36740/WLek202204209
9. Оковитый С.В. Комбинированное применение гепатопротекторов. Лечащий Врач. 2020; 8: 38–43. DOI: 10.26295/OS.2020.65.19.005
10. Shasthry S.M., Sarin S.K. New treatment options for alcoholic hepatitis. World J. Gastroenterol. 2016; 22(15): 3892–3906. DOI: 10.3748/wjg.v22.i15.3892
11. de la Riva G.A., López Mendoza F.J., Agüero-Chapin G. Known Hepatoprotectors Act as Antioxidants and Immune Stimulators in Stressed Mice: Perspectives in Animal Health Care. Curr. Pharm. Des. 2018; 24(40): 4825–4837. DOI: 10.2174/1381612825666190116151628
12. Moreira P.I., Sayre L.M., Zhu X., Nunomura A., Smith M.A., Perry G. Detection and localization of markers of oxidative stress by in situ methods: application in the study of Alzheimer disease. Methods. Mol. Biol. 2010; 610: 419–434. DOI: 10.1007/978-1-60327-029-8_25
13. Лазебник Л.Б., Голованова Е.В., Тарасова Л.В., Кривошеев А.Б., Сас Е.И., Еремина Е.Ю., Трухан Д.И., Хлынова О.В., Цыганова Ю.В. Алкогольная болезнь печени (АБП) у взрослых. Экспериментальная и клиническая гастроэнтерология. 2020; 174(2): 4–28. DOI: 10.31146/1682-8658ecg-174-2-4-28
14. Bataller R., Arab J.P., Shah V.H. Alcohol-Associated Hepatitis. N. Engl. J. Med. 2022; 387(26): 2436–2448. DOI: 10.1056/NEJMra2207599
15. Быков И.М., Бербериди Х.П., Попов К.А., Ермакова Г.А., Цымбалюк И.Ю., Есауленко Е.Е., Денисова Я.Е., Азимов Э.А. Сравнение эффективности различных серосодержащих гепатопротекторов в коррекции хронической алкогольной интоксикации в эксперименте. Медицинский вестник Северного Кавказа. 2019; 14(3): 523–527. DOI: 10.14300/mnnc.2019.14129
16. Kapelle I.B.D., Manalu W., Souhoka F.A. Effect of curcumin analogue synthetic product from cullilawan oil for the liver damage treatment in male mice (Mus musculus L.). J. Basic. Clin. Physiol. Pharmacol. 2020; 30(6): /j/jbcpp.2019.30.issue-6/jbcpp-2019-0241/jbcpp-2019-0241.xml. DOI: 10.1515/jbcpp-2019-0241
17. Miltonprabu S., Tomczyk M., Skalicka-Woźniak K., Rastrelli L., Daglia M., Nabavi S.F., Alavian S.M., Nabavi S.M. Hepatoprotective effect of quercetin: From chemistry to medicine. Food. Chem. Toxicol. 2017; 108(Pt B): 365–374. DOI: 10.1016/j.fct.2016.08.034
18. Попов К.А., Быков И.М., Цымбалюк И.Ю., Быков М.И., Сидоренко А.Н., Сторожук П.Г., Овсянников В.Г., Павлюченко И.И. Изменения состояния тиолового звена антиоксидантной системы в ишемический и ранний реперфузионный периоды при васкулярной эксклюзии печени крыс. Медицинский вестник Северного Кавказа. 2018; 13(3): 525–529. DOI: 10.14300/mnnc.2018.13096
19. Гофман А.Г., Понизовский П.А. Применение метаболического гепатотропного инфузионного препарата ремаксол при лечении больных алкогольной зависимостью. Психиатрия. 2018; 3(79): 95– 99. DOI: 10.30629/2613-6667-2013-79-95-99
20. Куркина И.А., Маевская М.В., Тихонов И.Н., Зозуля В.Н., Лещенко В.И. Инфузионная терапия при хронических заболеваниях печени. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2018; 28(3): 81–87. DOI: 10.22416/13824376-2018-28-3-81-87
21. Попова Т.С., Тропская Н.С., Шестопалов А.Е., Кислякова Е.А., Кислицына О.С., Ботин А.С., Петрова М.В., Гурман Ю.В. Сукцинатсодержащие гепатопротекторы в эффективном метаболическом лечении заболеваний и поражений печени различного генеза. Вопросы диетологии. 2020; 10(4): 58–65. DOI: 10.20953/2224-5448-2020-4-58-65
22. Загоскин, П.П., Ерлыкина Е.И. Желчные кислоты — новый тип стероидных гормонов, регулирующих неспецифические энерготраты организма (обзор). Современные технологии в медицине. 2020; 12(5): 114–128. DOI: 10.17691/stm2020.12.5.13
23. Минушкин О.Н., Масловский Л.В., Буланова М.И., Шапошникова О.Ф. Оценка эффективности адеметионина у пациентов с холестазом при хронической алкогольной болезни печени. Медицинский Совет. 2019; (14): 52–57. DOI: 10.21518/2079701X-2019-14-52-57
24. Mora S.I., García-Román J., Gómez-Ñañez I., García-Román R. Chronic liver diseases and the potential use of S-adenosyl-L-methionine as a hepatoprotector. Eur. J. Gastroenterol. Hepatol. 2018; 30(8): 893–900. DOI: 10.1097/MEG.0000000000001141
25. Lozano-Sepulveda S.A., Bautista-Osorio E., Merino-Mascorro J.A., Varela-Rey M., Muñoz-Espinosa L.E., Cordero-Perez P., Martinez-Chantar M.L., Rivas-Estilla AM. S-adenosyl-L-methionine modifi es antioxidant-enzymes, glutathione-biosynthesis and methionine adenosyltransferases-1/2 in hepatitis C virus-expressing cells. World J. Gastroenterol. 2016; 22(14): 3746–3757. DOI: 10.3748/wjg.v22.i14.3746
26. Джимак С.С., Басов А.А., Волченко Н.Н., Самков А.А., Федулова Л.В., Барышев М.Г. Изменение функциональной активности митохондрий, выделенных из клеток печени крыс, прошедших предадаптацию к сверхнизким концентрациям дейтерия. Доклады Академии наук. 2017; 476(5): 584–587. DOI: 10.7868/S0869565217290230 DOI: 10.1134/S1607672917050088
Об авторах
И. М. БыковРоссия
Быков Илья Михайлович — доктор медицинских наук, профессор; заведующий кафедрой фундаментальной и клинической биохимии.
Ул. им. Митрофана Седина, д. 4, Краснодар, 350086
Г. А. Ермакова
Россия
Ермакова Галина Алексеевна — кандидат медицинских наук, соискатель кафедры фундаментальной и клинической биохимии.
Ул. им. Митрофана Седина, д. 4, Краснодар, 350086
К. А. Попов
Россия
Попов Константин Андреевич — кандидат медицинских наук, доцент кафедры фундаментальной и клинической биохимии.
Ул. им. Митрофана Седина, д. 4, Краснодар, 350086
И. Ю. Цымбалюк
Россия
Цымбалюк Игорь Юрьевич — кандидат медицинских наук; ассистент кафедры фундаментальной и клинической биохимии.
Ул. им. Митрофана Седина, д. 4, Краснодар, 350086
М. И. Быков
Россия
Быков Михаил Ильич — доктор медицинских наук, профессор, профессор кафедры хирургии № 1 ФПК и ППС.
Тел.: +7(918)212-55-30; ул. им. Митрофана Седина, д. 4, Краснодар, 350086
Я. Е. Денисова
Россия
Денисова Яна Евгеньевна — ассистент кафедры фундаментальной и клинической биохимии.
Ул. им. Митрофана Седина, д. 4, Краснодар, 350086
С. М. Тутаришева
Россия
Тутаришева Саида Муратовна — аспирант кафедры фундаментальной и клинической биохимии.
Ул. им. Митрофана Седина, д. 4, Краснодар, 350086
Рецензия
Для цитирования:
Быков И.М., Ермакова Г.А., Попов К.А., Цымбалюк И.Ю., Быков М.И., Денисова Я.Е., Тутаришева С.М. Сравнительная оценка влияния гепатопротекторов на состояние окислительного гомеостаза в крови больных алкогольным гепатитом: рандомизированное экспериментальное исследование. Кубанский научный медицинский вестник. 2023;30(1):88-97. https://doi.org/10.25207/1608-6228-2023-30-1-88-97
For citation:
Bykov I.M., Ermakova G.A., Popov K.A., Tsymbalyuk I.Yu., Bykov M.I., Denisova Ya.E., Tutarisheva S.M. Comparative Evaluation of the Effect of Hepatoprotectors on Oxidative Homeostasis in the Blood of Patients with Alcoholic Hepatitis: A Randomized Experimental Study. Kuban Scientific Medical Bulletin. 2023;30(1):88-97. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-1-88-97
JATS XML








































