Перейти к:
Острый коронарный синдром как современная проблема детской кардиологии. Исходы и прогноз: клинический случай
https://doi.org/10.25207/1608-6228-2023-30-5-113-123
Аннотация
Введение. Проблема острого коронарного синдрома широко распространена во взрослой популяции и имеет четкие диагностические критерии. В педиатрической практике данная патология встречается редко и часто сопровождается трудностями в диагностике. Описание клинического случая. У юноши 16 лет с отягощенной наследственностью по отцовской линии, гиперхолестеринемией, дислипидемией, избыточной массой тела инфаркт миокарда развился на фоне острого тонзиллита. В дебюте заболевания у подростка были выявлены клинические признаки острой респираторной инфекции и коронароспазма. На электрокардиограмме диагностированы подъем сегмента ST выше изолинии в I, II, III, aVF, V4–V6 отведениях и биохимические маркеры некроза миокарда. При эхокардиографии выявлены признаки очагового гипокинеза левого желудочка, наличие вновь выявленной митральной регургитации II степени. По данным чрескожной коронарной ангиографии у подростка не получены признаки стенозирования коронарных артерий. Наряду с общепринятой медикаментозной тактикой лечения острого инфаркта миокарда юноша получал и антибактериальную терапию. Выписан в удовлетворительном состоянии. Спустя 1 год наблюдения после перенесенного инфаркта миокарда у подростка не выявлено патологических изменений как при стресс-эхокардиграфии, так и на электрокардиограмме. Трехлетний катамнез благоприятный. Заключение. Представленный клинический случай демонстрирует, насколько индивидуален механизм развития острого коронарного синдрома у детей. Врачам-педиатрам необходимо помнить о возможности развития острого коронарного синдрома на фоне инфекционной патологии.
Ключевые слова
Для цитирования:
Томчик Н.В., Лашковская Т.А., Кизелевич А.И., Матвейчик А.И. Острый коронарный синдром как современная проблема детской кардиологии. Исходы и прогноз: клинический случай. Кубанский научный медицинский вестник. 2023;30(5):113-123. https://doi.org/10.25207/1608-6228-2023-30-5-113-123
For citation:
Tomchik N.V., Lashkovskaya T.A., Kizilevich A.I., Matveichyk A.I. Acute coronary syndrome as a current issue of pediatric cardiology. Outcomes and prognosis: Clinical case. Kuban Scientific Medical Bulletin. 2023;30(5):113-123. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-5-113-123
ВВЕДЕНИЕ
Острый коронарный синдром (ОКС) представляет собой группу клинических признаков, связанных с острой коронарной ишемией, обусловленной внезапным снижением или прекращением кровотока в коронарных сосудах, питающих сердце, по разным причинам [1][2]. Ежегодно во всем мире ОКС диагностируется более чем у 7 миллионов человек [2][3]. Спазм коронарных артерий (КА) и ишемия миокарда наблюдаются на ранней стадии окклюзии. Если соответствующая КА не может быть реваскуляризирована, то развивается инфаркт миокарда (ИМ).
К сожалению, эта проблема «молодеет» с каждым годом. По данным литературы распространенность ишемии миокарда в популяции детей четко не установлена, существует мнение, что ее частота составляет 4,48 % [2][4]. Нередко диагноз устанавливают при аутопсии [2]. Понятие ОКС чаще встречается у взрослых пациентов [4], и ассоциировано с ишемической болезнью сердца. Распространенность этой патологии среди лиц молодого возраста увеличивается [4][5], однако фенотипические характеристики, причины и клинические исходы в этой группе малочисленны. Развитие ОКС у детей до недавнего времени считали казуистическими случаями [4][6][7].
ОКС клинически проявляется ИМ с подъемом сегмента ST, ИМ без подъема сегмента ST, развитием нестабильной стенокардии или внезапной сердечной смертью [1].
Если у взрослых основной причиной ОКС является атеросклеротическое поражение КА, то у детей этот этиологический фактор по частоте занимает последнюю позицию. Первое место в структуре причин ОКС в педиатрической практике занимают заболевания КА — аномалии их развития и коронариты [2], около 13 % — это воспалительные заболевания миокарда [2][4].
Острые коронариты могут встречаться при различных инфекционных заболеваниях (грипп, стептококковый тонзиллофарингит, тифы и др.). В исследованиях J. C. Kwong с соавторами (2018) продемонстрирована связь между острым ИМ и некоторыми респираторными инфекциями (грипп, РС-вирус и др.) [1]. Независимо от этиологии клинические проявления коронарита характеризуются острой коронарной недостаточностью вплоть до развития ИМ. Миокардиты у детей, имитирующие картину ОКС, — достаточно редкая патология в педиатрической практике. Однако пандемия новой коронавирусной инфекции внесла свои коррективы. Доказано, что изменения, обусловленные вирусом SARS-CoV-2 (альтерация эндотелия, нарушения свертывающей системы, гемодинамические изменения сосуда), предрасполагают к ОКС. По мнению E. Cinteză и соавт. (2022), наибольший риск ОКС у детей связан с гигантскими аневризмами (более 8 мм в диаметре), распространенность которых составляет 0,16 % [5]. Ретроспективным наблюдением в Ухане (Хубэй, Китай, 2020) на электрокардиограмме 7 % пациентов из 138 лиц с коронавирусной инфекцией установлены подъем сегмента ST или инверсия зубца T. Другой метаанализ с участием 1527 пациентов с COVID-19 показал, что у 8 % пациентов было диагностировано острое повреждение миокарда [8]. Риск ОКС у детей составляет 2,6 % в первые 30 дней от начала вирусной инфекции, вызванной SARS-CoV-2 [5]. Таким образом, описанные случаи доказывают связь инфекции COVID-19 с повреждением сердца и ОКС.
К аномалиям КА относят широкий круг врожденных нарушений отхождения, расположения и их структуры. Данные аномалии чаще всего являются находкой при проведении коронарной ангиографии (КАГ) (0,5–4,5 %) или аутопсии (15–85 %). Частота различных типов аномалий КА составляет 1,1 на 1000 случаев врожденных пороков сердца. Эта патология может быть причиной коронарной недостаточности, вплоть до летального исхода, на аутопсии проявляться распространенными некротическими и рубцовыми изменениями миокарда [4][8]. Наиболее частой врожденной патологией коронарных сосудов является аномальное отхождение левой КА от легочной артерии (синдром Bland—White—Garland).
Ранее нами был описан случай ОКС [8] с летальным исходом, который имел неспецифические клинические проявления, протекавшие под маской патологии пищеварительной системы, у недоношенной девочки, родившейся с экстремально низкой массой тела и имевшей аномалии КА. Диагностические трудности, испытываемые неонатологами и детскими кардиологами, носили объективный характер и были обусловлены особенностями физического развития ребенка, недоношенностью, неспецифичностью клинических проявлений. Особенности строения коронарных сосудов у младенца были заподозрены при жизни, однако диагностированы только патолого-анатомически. В данном клиническом случае прогноз зависел от развития коллатералей, анатомического типа кровоснабжения сердца новорожденного и своевременной хирургической коррекции.
По литературным данным, у значительной части пациентов при аномальном отхождении КА заболевание манифестирует на 2–3-м месяце жизни и может проявляться одышкой, тахикардией, вялостью, бледностью, повышенной потливостью и срыгиванием [6]. В большинстве случаев сложно распознать начальные признаки болезни, т. к. порой ангинозный приступ у детей грудного возраста ошибочно принимается за кишечную колику [2][4][8].
В настоящее время существует еще несколько проблем диагностики ОКС у детей. Во-первых, в процессе роста и развития ребенка в детском сердце происходят анатомо-физиологические перестройки, что находит отражение на электрокардиограмме (ЭКГ) в виде ST-T изменений, а значит затрудняет диагностику ишемии. Во-вторых, большинство детских стационаров по разным причинам не имеют возможности выполнять КАГ, что, в свою очередь, порождает затягивание сроков постановки диагноза и тем самым позднюю терапию. В-третьих, сегодня педиатры не готовы диагностировать в своей практике патологию, прерогативную для взрослого населения.
В большинстве случаев у старших детей клинические признаки ИМ проявляются типичным ангинозным приступом, редко течение болезни протекает без болевого синдрома. В отдельных случаях в клинической картине у детей возможно развитие кардиогенного шока. При осмотре, как правило, отмечаются бледность кожных покровов, цианоз, похолодание конечностей, потливость, тахипноэ или диспноэ, артериальная гипотензия. У некоторых детей могут выявляться признаки дисфункции желудочно-кишечного тракта, имеющие рефлекторное происхождение. Основными критериями диагностики острого ИМ как у взрослых, так и у детей являются типичные ЭКГ-паттерны [4][8], биохимические маркеры некроза миокарда [8][9], изменения, установленные с помощью методов визуализации (эхокардиографии (эхоКГ) и др.) [10] и патолого-анатомически. Течение ИМ может осложняться возникновением различного спектра аритмий, тромбоэмболиями, развитием острой и формированием хронической аневризмы сердца.
Нами проанализирован клинический случай острого ИМ, манифестировавший у юноши 16 лет на фоне острого тонзиллита, с благоприятным исходом.
КЛИНИЧЕСКИЙ ПРИМЕР
Информация о пациенте
Юноша С., 16 лет, доставлен в учреждение здравоохранения «Гродненская областная детская клиническая больница» 13.07.2020 г. бригадой скорой помощи в тяжелом состоянии, в ясном сознании с жалобами на интенсивную сжимающую боль в области сердца с иррадиацией в левую руку, область шеи слева, появившуюся спустя 2 дня от начала болезни на фоне лихорадки, болей в горле при глотании.
Анамнез заболевания: юноша заболел накануне остро, с повышения температуры тела до 40,5 °C, с появления боли в горле, болезненности при глотании. Назначения врача-педиатра не выполнял.
Анамнез жизни: ребенок от I беременности, I срочных родов с массой тела 3200 г, длинной 52 см. От сверстников в физическом и нервно-психическом развитии не отставал. Со слов матери установлено, что юноша привит по возрасту, редко болел респираторными инфекциями.
Аллергологический анамнез: мама отмечала появление сыпи на прием антибиотиков группы пенициллинов.
Наследственный анамнез: со слов матери подросток имел отягощенную наследственность по отцовской линии: у папы и бабушки — артериальная гипертензия.
Физикальная диагностика
Ребенок гиперстенического телосложения, ИМТ 26 (масса тела — 90 кг, рост — 186 см), Z-score 1,50 (программа «Anthro plus»).
Подросток в сознании, ориентирован и контактен. Лихорадит. Кожные покровы чистые, влажные. Дыхание через нос свободное. Зев: яркая гиперемия небных дужек, на миндалинах — гнойный налет, легко снимаемый шпателем. Язык чистый, влажный. Менингеальных симптомов нет. В легких дыхание везикулярное, хрипов нет, частота дыхания 18 в минуту. Границы сердца перкуторно не расширены, тоны сердца громкие, ритмичные, шумы не выслушивались, частота сердечных сокращений (ЧСС) 84 в минуту. Артериальное давление (АД) 118/75 мм рт. ст. Живот мягкий, не вздут, при пальпации безболезненный. Печень и селезенка не пальпировались. Периферических отеков нет. Физиологические отправления в норме.
Предварительный диагноз
Предварительный диагноз: Острый тонзиллит. Острый коронарный синдром. Сердечная недостаточность I степени.
Временная шкала
Хронология развития болезни у юноши С. представлена на рисунке 1.
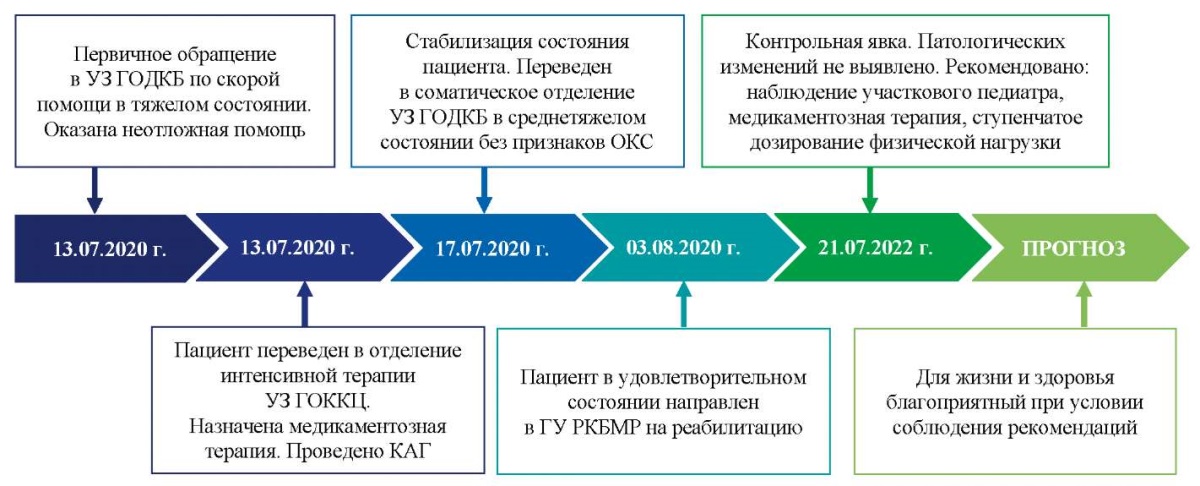
Рис. 1. Хронология развития болезни у подростка С.:
ключевые события и прогноз
Примечание: блок-схема временной шкалы выполнена авторами
(согласно рекомендациям CARE).
Сокращения: ГУ РКБМР — Государственное учреждение «Республиканская клиническая больница медицинской реабилитации»; ОКС — острый коронарный синдром; УЗ ГОДКБ — Учреждение здравоохранения «Гродненская областная детская клиническая больница»; УЗ ГОККЦ — Учреждение здравоохранения «Гродненский областной клинический кардиологический центр»; КАГ — чрескожная коронарография.
Fig. 1. Patient S.: course of disease, key events and prognosis
Note: the schematic diagram was performed by the authors
(according to SCARE recommendations).
Abbreviations: ГУ РКБМР — Republican Clinical Hospital of Medical Rehabilitation; ОКС — acute coronary syndrome; УЗ ГОДКБ — Grodno Regional Children’s Clinical Hospital; УЗ ГОККЦ — Grodno Regional Clinical Cardiology Center; КАГ — percutaneous coronary angiography.
Диагностические процедуры (выполнены в учреждения здравоохранения «Гродненская областная детская клиническая больница» в условиях приемного отделения)
Лабораторные исследования (референсные значения указаны в скобках)
Общий анализ крови: выявлен лейкоцитоз 14,4×10 9/л ((4–9)×109/л) со сдвигом влево, повышенная скорость оседания эритроцитов (СОЭ) 35 мм/час (1–10 мм/час).
Общий анализ мочи: Моча светло-желтого цвета. Все показатели в пределах нормальных значений.
Биохимический анализ крови: зарегистрировано повышение креатинфосфокиназы (КФК) — 2154 ед/л (38–174 ед/л); креатинфосфокиназа MB (КФК-МВ) — 262 ед/л (0–25 ед/л); лактатдегидрогеназы — 1048 ед/л (207–414 ед/л); аспартатаминотрансферазы — 173 ед/л (0–40 ед/л); аланинаминотрансферазы — 56 ед/л (0–41 ед/л); тропонина I (TNIhs) — 37583 нг/л (0–20 нг/л); С-реактивный белок (СРБ) — 117,7 мг/л (0–5,0 мг/л).
Липидограмма: выявлены гиперхолестеринемия (холестерин — 5,61 ммоль/л (3,1–5,2 ммоль/л)); дислипидемия (липопротеины высокой плотности (ЛПВП) — 0,72 ммоль/л (≥1,56 ммоль/л); липопротеины низкой плотности (ЛПНП) — 3,99 ммоль/л (≤2,59 ммоль/л); коэффициент атерогенности — 6,79 усл. ед. (2–3 усл. ед.); триглицериды — 1,80 ммоль/л (0,2–1,7 ммоль/л); липопротеины очень низкой плотности (ЛПОНП) — 0,82 ммоль/л (≥1,56 ммоль/л)).
Гемостазиограмма: отмечалось укорочение активированного частичного тромбопластинового времени — 23,1 с (26,8–36,3 с); повышение уровня D-димера 1085 нг/мл (0–500 нг/мл); фибриногена 6,5 г/л (1,5–3,5 г/л).
Иммуноферментный анализ: антитела к SARS-CoV-2 не выявлены.
Инструментальные исследования
Электрокардиограмма
В приемном отделении по cito зарегистрировали электрокардиограмму (ЭКГ), на которой в отведениях II, III, aVF, V4–V6 имели место умеренно выраженная элевация сегмента ST (рис. 2 А–Г), снижение вольтажа комплекса QRS в стандартных отведениях (рис. 2 А), признаки неполной блокады правой ножки пучка Гиса (рис. 2 Б, В).

Рис. 2. Электрокардиограмма пациента С.
в первые 4 часа ангинозного приступа:
А — стандартные I, II, III отведения (обозначено фигурой);
Б — усиленные от конечностей aVR, aVL, aVF отведения
(обозначено фигурой);
В — грудные V1–V3 отведения (обозначено фигурой);
Г — грудные V4–V6 отведения (обозначено фигурами)
Примечание: фотографии выполнены авторами.
Fig. 2. Patient S.: electrocardiogram in the first 4 hours of angina attack:
A — standard leads I, II, III (indicated by the rectangle);
Б — augment limb leads aVR, aVL, aVF (indicated by the rectangle);
В — precordial leads V1-V3 (indicated by the rectangle);
Г — precordial leads V4–V6 (indicated by the rectangles)
Note: photos taken by the authors.
Трансторакальная эхокардиография (эхоКГ)
При проведении трансторакальной ЭхоКГ не установлено увеличения размеров камер сердца, верифицирована регургитация на митральном клапане (МК) II степени и трикуспидальном клапане (ТК) II степени. Фракция выброса (ФВ) составила 41,8 %.
Клинический диагноз
С учетом полученных клинических, лабораторных и инструментальных данных выставлен диагноз: острый инфаркт миокарда заднебоковой стенки левого желудочка (ЛЖ) 2-го типа. Недостаточность митрального клапана I степени, недостаточность трикуспидального клапана II степени. Сердечная недостаточность I степени, функциональный класс II. Острый тонзиллит.
Дифференциальная диагностика
В круг дифференциального диагноза были включены острый миокардит и медиастенит. В клинической картине этих заболеваний доминируют выраженный болевой синдром в области грудной клетки и признаки интоксикации. Однако при медиастените у ребенка может наблюдаться не только боль в груди, но и дискомфорт при акте глотания, осиплость голоса, в анамнезе — иметься указания на травмы грудной клетки, хирургические или эндоскопические вмешательства на органах средостения, инородное тело пищевода. При осмотре таких детей можно увидеть отек верхней половины туловища, шеи и лица с расширением и напряжением поверхностных вен, цианозом кожи. Выраженный интоксикационный синдром при остром медиастените может сопровождаться тяжелыми гемодинамическими нарушениями.
При миокардите дети жалуются не только на кардиалгии, но и на миалгии, артралгии. Эти симптомы могут сопровождаться также лихорадкой, слабостью, утомляемостью различной интенсивности. При осмотре иногда есть признаки сердечной недостаточности, аритмии.
При лабораторном обследовании как для миокардита, так и медиастенита характерны признаки воспаления, повышения уровня острофазовых белков, однако гиперхолестеринемия, дислипидемия не патогномоничны для этих заболеваний. Ключевую роль в диагностическом поиске играют инструментальные методы. Так, при рентгенографии органов грудной клетки при остром медиастените наблюдается расширение органов средостения, при компьютерной томографии — признаки повреждения пищевода или трахеи, несостоятельность швов после оперативных вмешательств и т. д. При миокардите, как и при ОКС, на электрокардиограмме могут быть различные аритмии, нарушения процесса реполяризации. При ультразвуковом и магнитно-резонансном исследованиях сердца — признаки очагового или диффузного поражения миокарда. Безусловно, наличие признаков интоксикации (лихорадка, слабость), боли в горле наряду с выраженной кардиалгией затрудняли в нашем случае диагностический поиск. Важное значение для постановки диагноза имела чрескожная коронарография.
Медицинские вмешательства
В качестве неотложных мероприятий в приемном отделении введены 1,0 мл 1 % морфина, цефотаксим 1,0 г, налажена инфузионная терапия глюкозо-солевыми растворами в объеме 500 мл в соотношении 1:1.
Динамика и исходы
Ввиду тяжелого состояния пациента юноша был госпитализирован в отделение интенсивной терапии учреждения здравоохранения «Гродненский областной клинический кардиологический центр». Для уточнения диагноза выполненена чрескожная коронарография (КАГ). По данным чрескожной КАГ не получены признаки окклюзионной патологии и гемодинамических стенозов в коронарных артериях; тип кровоснабжения — правый.
С первых суток юноша получал медикаментозное лечение: антиагреганты (ацетилсалициловая кислота 75 мг в сутки, клопидогрел 75 мг в сутки), антикоагулянты (эноксапарин натрия 0,4 мл подкожно 2 раза в сутки), гастропротекторы (лансопразол), β-блокаторы (карведилол 3,125 мг в сутки), ингибиотры-АПФ (рамиприл 1,25 мг в сутки), антибиотикотерапию (цефотаксим 1,0 г внутривенно 3 раза в сутки 10 дней), спиронолактон, местное орошение задней стенки глотки 0,05 % раствором хлоргексидина биглюконата, инфузионную терапию. Учитывая повышение референсных значений таких показателей, как аспартатаминотрансфераза — 173 ед/л (0–40) и аланинаминотрансфераза 56 ед/л (0–41), консилиумом решено было воздержаться от назначения подростку статинов.
В связи со стабилизацией состояния пациента и его гемодинамических параметров на 5-е сутки болезни в среднетяжелом состоянии без признаков острого коронарного синдрома подросток переведен в соматическое отделение учреждения здравоохранения «Гродненская областная детская клиническая больница», где была продолжена вышеперечисленная медикаментозная терапия. Учитывая, что на 7-е сутки болезни у юноши наблюдались улучшение общего самочувствия и аппетита, нормализация температуры тела, прекращено внутривенно капельное введение глюкозо-солевых растворов. На 8 сутки в связи с положительной динамикой воспалительных изменений в миндалинах по рекомендации врача оториноларинголога было отменено местное орошение задней стенки глотки 0,05 % раствором хлоргексидина биглюконата. Учитывая нормализацию параметров в периферической крови, купирование симптоматики острого тонзиллита на 10 сутки закончена антибактериальная терапия цефатоксимом.
За время нахождения в стационаре юноше проводился ежедневный контроль ЭКГ, где было установлено, что водителем ритма являлся синусовый узел, нормосистолия, выявлены динамические изменения, характерные для острого инфаркта миокарда заднебоковой области левого желудочка.
Установлено, что на 4-е сутки болезни сохранялись элевация сегмента ST во II, III, aVF отведениях вместе со снижением вольтажа комплекса QRS (рис. 3 А–В). В III отведении желудочковый комплекс имел вид rS с расширением зубца S свыше 40 мс, в отведении aVR регистрировались глубокие зубцы Q и T.
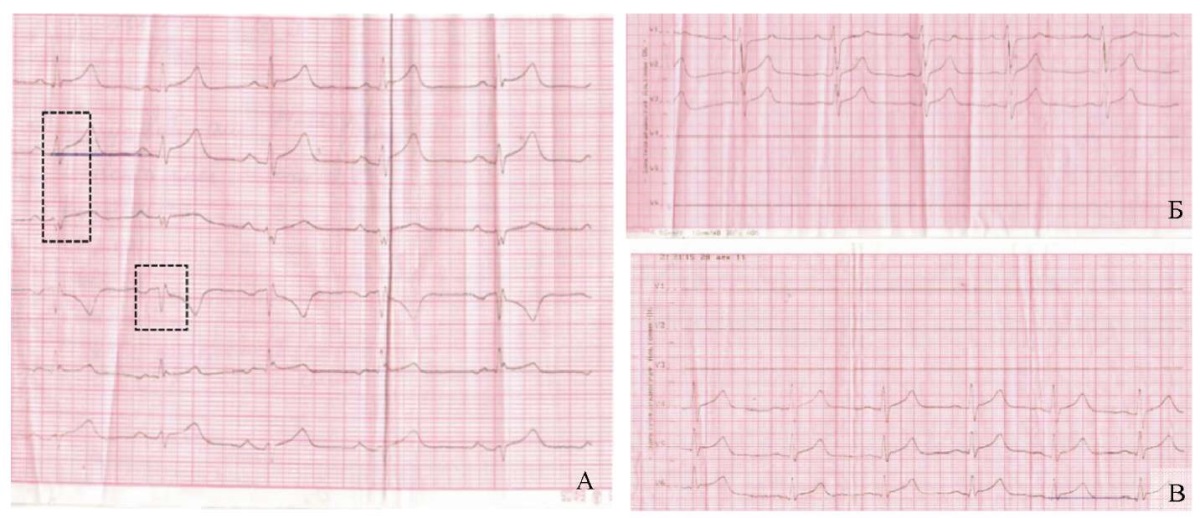
Рис. 3. Динамический мониторинг параметров
электрокардиографии пациента С., 4-е сутки болезни
(контрольный милливольт 10 мм, скорость 50 мм/с)
(изменения обозначены фигурами):
А — стандартные и усиленные отведения от конечностей;
Б — правые грудные отведения;
В — левые грудные отведения
Примечание: фотографии выполнены авторами.
Fig. 3. Patient S.: dynamic monitoring
of electrocardiography parameters, day 4 of disease
(control millivolt 10 mm, velocity 50 mm/s),
changes are indicated by the rectangles:
A — standard and augment limb leads;
Б — right precordial leads;
В — left precordial leads
Note: photos taken by the authors.
К 7-м суткам болезни отмечались депрессия ST и появление отрицательного зубца Т в I, II, III, aVF, V4–V6 отведениях на фоне снижения вольтажа желудочкового комплекса. В отведении aVR желудочковый комплекс имел форму qR, наблюдалась положительная динамика в отношении глубины зубца Q в этом отведении по сравнению с предыдущей ЭКГ (рис. 4 А, Б).
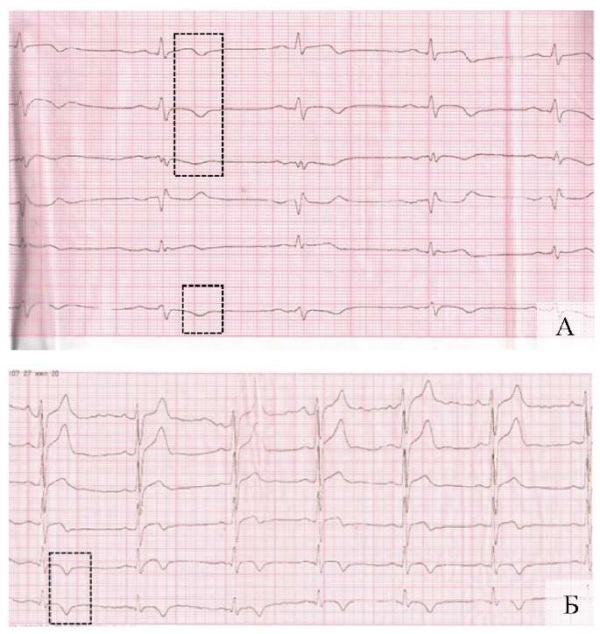
Рис. 4. Динамический мониторинг параметров
электрокардиографии пациента С., 7-е сутки болезни
(контрольный милливольт 10 мм, скорость 50 мм/с)
(изменения обозначены фигурами):
А — стандартные и усиленные отведения от конечностей;
Б — грудные отведения
Примечание: фотографии выполнены авторами.
Fig. 4. Patient S.: dynamic monitoring
of electrocardiography parameters, day 7 of disease
(control millivolt 10 mm, velocity 50 mm/s),
changes are indicated by the rectangles:
A — standard and augment limb leads;
Б — precordial leads
Note: photos taken by the authors.
К 16-м суткам от начала ангинозного приступа вместе со снижением вольтажа комплекса QRS регистрировались признаки нарушения процессов реполяризации, характерные для динамики ИМ: уплощение зубца T в стандартных и усиленных отведениях от конечностей и появление двухфазных T в отведениях V5–V6 (рис. 5 А, Б).
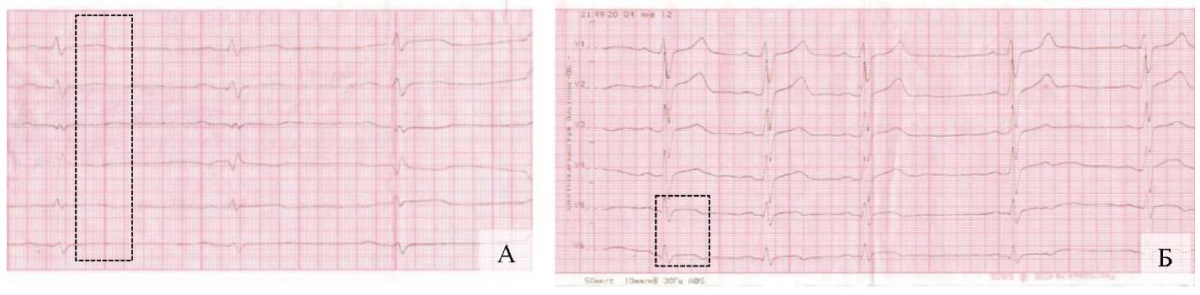
Рис. 5. Динамический мониторинг параметров
электрокардиографии пациента С., 16-е сутки болезни
(контрольный милливольт 10 мм, скорость 50 мм/с)
(изменения обозначены фигурами):
А — стандартные и усиленные отведения от конечностей;
Б — грудные отведения.
Примечание: фотографии выполнены авторами.
Fig. 5. Patient S.: dynamic monitoring
of electrocardiography parameters, day 16 of disease
(control millivolt 10 mm, velocity 50 mm/s),
changes are indicated by the rectangles:
A — standard and augment limb leads;
Б — precordial leads
Note: photos taken by the authors.
Осуществлялся динамический мониторинг основных параметров эхоКГ (табл. 1).
Таблица 1. Мониторинг основных параметров трансторакальной эхоКГ
в течение 20 суток от начала ангинозного приступа
Table 1. Monitoring of the main parameters of transthoracic echocardiography
within 20 days from the angina attack onset
|
Параметры |
2-е сутки |
3-сутки |
4-е сутки |
20-е сутки |
|
ФВ, % |
47 |
51 |
51 |
67 |
|
КДОЛЖ, М-режим, мл |
93 |
64 |
63 |
40 |
|
КДОЛЖ, В-режим, мл |
93 |
49 |
51 |
32 |
|
КСОЛЖ, М-режим, мл |
84 |
66 |
63 |
49 |
|
КСОЛЖ, В-режим, мл |
72 |
47 |
53 |
40 |
|
ТЗСЛЖ систола, мм |
14 |
17 |
13 |
11 |
|
ТЗСЛЖ диастола, мм |
11 |
13 |
12 |
10 |
|
Состояние клапанного аппарата |
МР II ст., ТР I–II ст. |
МР II ст., ТР II ст. |
МР I ст., ТР I ст. |
Без патологии |
|
ЭхоКГ-заключение |
Расширение полости ЛЖ. Очаговый гипокинез миокарда ЛЖ. Снижение систолической функции |
Гипертрофия Очаговый гипокинез миокарда ЛЖ. Снижение систолической функции |
Гипертрофия |
Камеры сердца не расширены. |
Примечание: таблица выполнена авторами.
Сокращения: КДОЛЖ — конечно-диастолический объем левого желудочка; КСОЛЖ — конечно-систолический объем левого желудочка; ЛЖ — левый желудочек; МР — митральная регургитация; ТЗСЛЖ — толщина задней стенки левого желудочка; ТР — трикуспидальная регургитация; ФВ — фракция выброса; ЭхоКГ — эхокардиография.
Notes: table compiled by the authors.
Abbreviations: КДОЛЖ — left ventricular end diastolic volume; КСОЛЖ — left ventricular end-systolic volume; ЛЖ — left ventricle; МР — mitral regurgitation; ТЗСЛЖ — left ventricular posterior wall thickness; ТР — tricuspid regurgitation; ФВ — ejection fraction; эхоКГ — echocardiography
Исследование проводили трансторакально в М- и В-режимах; в условиях импульсно-волнового и непрерывно-волнового допплера, стандартного цветового допплеровского картирования.
Среднесуточные колебания АД соответствовали нормальному распределению для данного пола, возраста и роста, суточный индекс систолического АД был равен 14,1 %; диастолического 12,9 %; индекс времени день/ночь для систолического АД составил 0,3/0 %; для диастолического АД 0,1/0 %.
Юноше регулярно проводился лабораторный мониторинг уровня тропонина I (TNIhs), BNP в 1–13-е сутки болезни (табл. 2).
Таблица 2. Динамика уровня тропонина I (TNIhs), BNP в 1–13-е сутки болезни
Table 2. Dynamics of troponin I (TNIhs), BNP, days 1–13 of the disease
|
Показатель |
Нормативные значения |
1-е сутки |
2-е сутки |
4-е сутки |
13-е сутки |
|
|
Первые 5 часов ангинозного приступа |
Первые 8 часов ангинозного приступа |
|||||
|
Тропонин I (TNIhs), нг/л |
0–19 |
40 000 |
37 583 |
40 000 |
18 972 |
26 |
|
BNP, пг/мл |
0–125 |
1014 |
- |
938 |
- |
84 |
Примечание: таблица выполнена авторами.
Сокращение: BNP — мозговой натрийуретический пептид.
Notes: table compiled by the authors.
Abbreviation: BNP — brain natriuretic peptide
За все время наблюдения за ребенком установлено, что высокий уровень кардиоспецифических ферментов, острофазовых белков сохранялся до 10 дня болезни, и только к 14-м суткам эти показатели соответствовали референсным значениям. Показатели гемостазиограммы нормализовались к 9-м суткам заболевания.
С целью физической и психосоциальной реабилитации на 21-е сутки лечения юноша в удовлетворительном состоянии был направлен в государственное учреждение «Республиканская клиническая больница медицинской реабилитации» (Минский район, д. Аксаковщина).
На фоне проводимой терапии отмечена стойкая положительная динамика, улучшение общего состояния. Подросток был выписан под наблюдение участкового педиатра, кардиолога по месту жительства с рекомендациями: продолжить медикаментозное лечение (клопидогрел 75 мг, метопролол 25 мг в сутки, рамиприл 1,25 мг в сутки, омега 1000 МЕ в сутки), ступенчато и дозированно повышать физическую нагрузку.
Через 1 год (21.07.22) после перенесенного острого ИМ юноше выполнена стресс-эхоКГ, на которой не установлено патологических изменений. Спустя 3 года после острого коронарного события амплитудные характеристики ЭКГ соответствовали референсным значениям, не выявлены нарушения процессов реполяризации (рис. 6).
В настоящее время (3 года наблюдения) юноша чувствует себя хорошо, удовлетворительно переносит физические нагрузки. Наблюдается кардиологом по месту жительства.
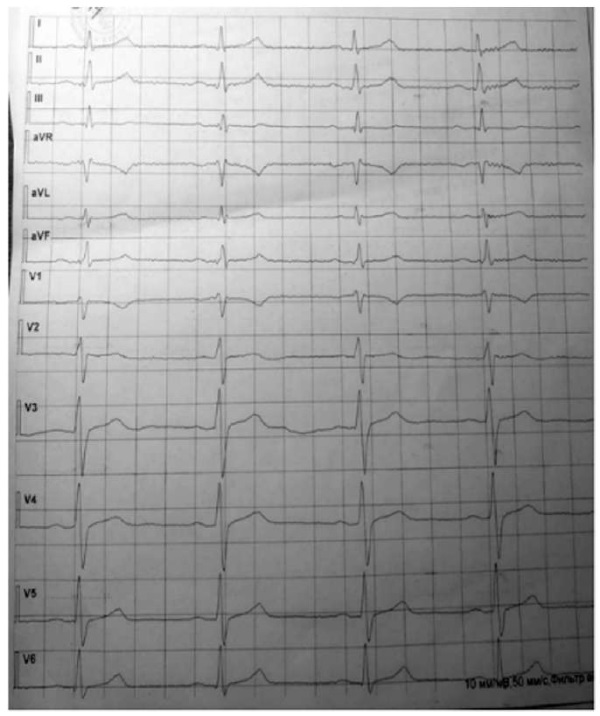
Рис. 6. Электрокардиограмма пациента С. через 3 года (02.03.2023)
после перенесенного острого инфаркта миокарда,
не установлено патологических изменений
Примечание: фотография выполнена авторами.
Fig. 6. Patient S.: electrocardiogram,
02.03.2023, 3 years after acute myocardial infarction
Note: photo taken by the authors.
Прогноз
Прогноз для жизни благоприятный. Подростку необходимо соблюдать принципы здорового образа жизни, диспансерно наблюдаться у кардиолога по месту жительства, проводить контроль лабораторных, электро- и эхокардиографических показателей, получать поддерживающую терапию.
ОБСУЖДЕНИЕ
Продемонстрированный клинический случай показывает манифестацию острого ИМ у юноши на фоне острого тонзиллита, который, возможно, стал причиной острого коронарита и, как следствие, развития ОКС. По-видимому, определенный вклад в развитие патологии у подростка внесли такие факторы риска, как гиперхолестеринемия, дислипидемия, избыточная масса тела, отягощенная наследственность. По мнению Е. В. Константиновой (2017), среди лиц молодого возраста, перенесших ИМ, чаще преобладают мужчины, страдающие ожирением и/или имеющие ту или иную форму дислипидемии, что, по мнению автора, является факторами риска раннего развития и прогрессирования атеросклероза КА [11].
По данным литературы, клиническое течение острого ИМ у детей не отличается от взрослых, что и продемонстрировано в клиническом примере. Диагноз подтверждается с помощью инструментальных и лабораторных методов исследования [6][12][13]. В представленном клиническом примере использованы все современные лабораторные и инструментальные ресурсы для верификации диагноза.
Важность мониторинга показателей эхоКГ для прогноза и терапевтической тактики острого ИМ активно дискутируется кардиологами. Описано, что у пациентов с острым ИМ острая митральная регургитация развивается нередко, может протекать бессимптомно и является независимым предиктором поздней сердечно-сосудистой и общей смертности. В работах K. G. Lehmann et al. [10] показана распространенность митральной регургитации у 13 % пациентов; в исследовании SAVE (Survival And Ventricular Enlargement), G. A. Lamas et al. [10] — у 19 %. Авторы считают, что наличие митральной регургитации связано с риском возникновения сердечно-сосудистых событий в течение последующих 3,5 года наблюдения. Пациенты с митральной регургитацией на фоне острого ИМ имели выше уровень сердечно-сосудистой смертности (29 % против 12 %, p = 0,002) и частоты тяжелой сердечной недостаточности (24 % против 16 %, p = 0,001).
Таким образом, важным диагностическим и прогностическим критерием при ОКС является выявление даже небольшой степени митральной регургитации. Используя стандартное цветовое допплеровское картирование, у этих пациентов необходимо измерять эффективную площадь регургитационного отверстия и объем регургитации. Динамику митральной регургитации на фоне медикаментозной терапии у наблюдаемого юноши можно проследить в таблице 1.
КАГ является одним из инструментальных диагностических методов ОКС [1–6][11][13]. Методика дает не только информацию о наличии аномальных или стенозирующих изменений КА и их тяжести, но и является методом интервенционной реваскуляризации, позволяющим не только влиять на качество жизни, но и существенно улучшить прогноз у данной группы пациентов. Отсутствие признаков стенозирования КА при наличии выраженного болевого синдрома у пациента ухудшает качество жизни и требует дообследования. По данным литературы, нормальные или почти нормальные КА на КАГ присутствуют примерно у 5–25 % пациентов с ОКС [1][13], что, в свою очередь, требует дополнительной интракоронарной визуализации для подтверждения необструктивных КА. Стоит подчеркнуть, что в описанных в литературе клинических случаях ИМ у детей часто отсутствует повреждения КА при КАГ [2][6]. У наблюдаемого нами юноши с острым ИМ при проведении чрескожной КАГ также не выявлено признаков стенозирования КА.
В настоящее время известно немало биохимических индикаторов некроза миокарда [14][15]. Специфичны при повреждении кардиомиоцитов изоформы тропонина cTnI и cTnT. Концентрация этих белков повышается через 4–6 часов после начала ангинозного приступа и достигает пика в течение 12–42 часов. Концентрации тропонина может увеличиваться в 1000 раз и более, диагностическое окно составляет 3–14 суток [13]. В продемонстрированном клиническом случае в первые сутки болезни повышение концентрации тропонина I составляло до 40 000 нг/л наряду с подъемом сегмента ST на ЭКГ. Снижение уровня этого белка наблюдалось к 4-м суткам от начала ангинозного приступа (табл. 2).
ЗАКЛЮЧЕНИЕ
Острый коронарный синдром в детском возрасте — это редкая и сложная патология, поскольку требует от специалистов не только знаний по этой проблеме, но и возможностей лабораторной и инструментальной диагностики. Независимо от того, насколько универсален патофизиологический механизм развития острой ишемии и некроза миокарда, в детском возрасте этот процесс всегда индивидуален. Особенности течения инфаркта миокарда в педиатрической практике определяются множеством факторов, в том числе инфекционными. Своевременная диагностика ОКС улучшает прогноз, повышает качество жизни, снижает риск летального исхода и раннего выхода на инвалидность.
Список литературы
1. Kwong JC, Schwartz KL, Campitelli MA, Chung H, Crowcroft NS, Karnauchow T, Katz K, Ko DT, McGeer AJ, McNally D, Richardson DC, Rosella LC, Simor A, Smieja M, Zahariadis G, Gubbay JB. Acute Myocardial Infarction after Laboratory-Confirmed Influenza Infection. N Engl J Med. 2018;378(4):345–353. https://doi.org/10.1056/NEJMoa1702090
2. Jeong JH, Seo YH, Ahn JY, Kim KH, Seo JY, Chun KY, Lim YS, Park PW. Performance of Copeptin for Early Diagnosis of Acute Myocardial Infarction in an Emergency Department Setting. Ann Lab Med. 2020;40(1):7–14. https://doi.org/10.3343/alm.2020.40.1.7
3. Nabovati E, Farzandipour M, Sadeghi M, Sarrafzadegan N, Noohi F, Sadeqi Jabali M. A global overview of acute coronary syndrome registries: a systematic review. Curr Probl Cardiol. 2023;48(4):101049. https://doi.org/10.1016/j.cpcardiol.2021.101049
4. Suryawanshi SP, Das B, Patnaik AN. Myocardial infarction in children: Two interesting cases. Ann Pediatr Cardiol. 2011;4(1):81–83. http://dx.doi.org/10.4103/0974-2069.79633
5. Cinteză E, Voicu C, Filip C, Ioniță M, Popescu M, Bălgrădean M, Nicolescu A, Mahmoud H. Myocardial Infarction in Children after COVID-19 and Risk Factors for Thrombosis. Diagnostics (Basel). 2022;12(4):884. http://dx.doi.org/10.3390/diagnostics12040884
6. Chamling B, Vehof V, Drakos S, Weil M, Stalling P, Vahlhaus C, Mueller P, Bietenbeck M, Reinecke H, Meier C, Yilmaz A. Occurrence of acute infarct-like myocarditis following COVID-19 vaccination: just an accidental co-incidence or rather vaccination-associated autoimmune myocarditis? Clin Res Cardiol. 2021;110(11):1850–1854. http://dx.doi.org/10.1007/s00392-021-01916-w
7. Krendel S, Pollack P, Hanly J. Tissue plasminogen activator in pediatric myocardial infarction. Ann Emerg Med. 2000;35(5):502–505. https://doi.org/10.1067/mem.2000.105592
8. Feng J, Zhao J, Li J, Sun Z, Li Q. Classification, diagnosis and clinical strategy of congenital coronary artery disease in children. Front Pediatr. 2023;11:1132522. https://doi.org/10.3389/fped.2023.1132522
9. Чаулин А.М., Дупляков Д.В. Биомаркеры острого инфаркта миокарда: диагностическая и прогностическая ценность. Часть 1. Клиническая практика. 2020;11(3):75–84. http://dx.doi.org/10.17816/clinpract34284
10. Крикунов П.В., Васюк Ю.А., Крикунова О.В. Прогностическая значимость эхокардиографии после острого инфаркта миокарда. Часть 1. Российский кардиологический журнал. 2017;(12):120–128. https://doi.org/10.15829/1560-4071-2017-12-120-128
11. Константинова Е.В., Балаян Н.М., Шостак Н.А. Инфаркт миокарда у молодых: причины и прогноз заболевания. Клиницист. 2017;11(1):10–15. https://doi.org/10.17650/1818-8338-2016-10-4-10-15
12. Рагрина Н.С., Мочихин Д.С., Хаит О.В., Малинина Е.И., Рычкова О.А., Мазалова М.В. Элевация сегмента ST в педиатрической практике. Российский вестник перинатологии и педиатрии. 2020;65(5):112–115. https://doi.org/10.21508/1027-4065-2020-65-5-112115
13. Humphries KH, Pu A, Gao M, Carere RG, Pilote L. Angina with “normal” coronary arteries: sex differences in outcomes. Am Heart J. 2008;155(2):375–381. https://doi.org/10.1016/j.ahj.2007.10.019
14. Kim KS, Suh GJ, Song SH, Jung YS, Kim T, Shin SM, Kang MW, Lee MS. Copeptin with high-sensitivity troponin at presentation is not inferior to serial troponin measurements for ruling out acute myocardial infarction. Clin Exp Emerg Med. 2020;7(1):35-42. https://doi.org/10.15441/ceem.19.013
15. Budnik M, Białek S, Peller M, Kiszkurno A, Kochanowski J, Kucharz J, Sitkiewicz D, Opolski G. Serum copeptin and copeptin/NT-proBNP ratio — new tools to differentiate takotsubo syndrome from acute myocardial infarction. Folia Med Cracov. 2020;60(1):5–14. https://doi.org/10.24425/fmc.2020.133481
Об авторах
Н. В. ТомчикБеларусь
Томчик Наталья Валентиновна — кандидат медицинских наук, доцент; заведующая кафедрой поликлинической педиатрии
ул. Горького, д. 80, г. Гродно, 230009
Т. А. Лашковская
Беларусь
Лашковская Татьяна Алексеевна — кандидат медицинских наук; доцент кафедры поликлинической педиатрии
ул. Горького, д. 80, г. Гродно, 230009
А. И. Кизелевич
Беларусь
Кизилевич Алиция Ипполитовна — заведующая 5-м педиатрическим отделением
ул. Островского, д. 22, г. Гродно, 230029
А. И. Матвейчик
Беларусь
Матвейчик Александр Игоревич — врач-реаниматолог-анестезиолог отделения интенсивной терапии
ул. Болдина, д. 9, г. Гродно, 230030
Дополнительные файлы
Рецензия
Для цитирования:
Томчик Н.В., Лашковская Т.А., Кизелевич А.И., Матвейчик А.И. Острый коронарный синдром как современная проблема детской кардиологии. Исходы и прогноз: клинический случай. Кубанский научный медицинский вестник. 2023;30(5):113-123. https://doi.org/10.25207/1608-6228-2023-30-5-113-123
For citation:
Tomchik N.V., Lashkovskaya T.A., Kizilevich A.I., Matveichyk A.I. Acute coronary syndrome as a current issue of pediatric cardiology. Outcomes and prognosis: Clinical case. Kuban Scientific Medical Bulletin. 2023;30(5):113-123. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-5-113-123







































