Перейти к:
Оценка функционального состояния почек при ренальных осложнениях у детей в период пандемии COVID-19: обсервационное когортное ретроспективное клиническое исследование
https://doi.org/10.25207/1608-6228-2023-30-3-25-33
Аннотация
Введение. В настоящее время нефрология борется с проблемой увеличения числа детей с острыми ренальными нарушениями, резвившимися на фоне инфекционных заболеваний, в том числе после острой инфекции COVID-19, в структуре которых по частоте одно из первых мест занимает пиелонефрит. Недостаточность специфических признаков и явных клинических симптомов, их правильная интерпретация становятся причиной того, что острая ренальная патология на фоне COVID-19 впервые определяется в период стабильного ухудшения функционального состояния почек. Определение механизмов развития осложнений может оказаться сложной задачей из-за отсутствия в настоящее время точного неинвазивного диагностического теста и способствовать формированию необратимого повреждения функционального состояния почек.
Цель исследования — определить и оценить особенности функционального состояния почек у детей с острым пиелонефритом, развившимся на фоне COVID-19.
Методы. Проведено обсервационное когортное ретроспективное клиническое исследование 65 детей с острым пиелонефритом. Также в исследование в качестве группы контроля были включены 20 здоровых детей, которые наблюдались в рамках профмедосмотров. Больные наблюдались на базе государственного бюджетного учреждения здравоохранения «Самаркандский областной детский многопрофильный медицинский центр» Министерства здравоохранения Республики Узбекистан, в отделении нефрологии. Лабораторный этап исследования выполнен на базе клинико-диагностической лаборатории государственного бюджетного учреждения здравоохранения «Самаркандский областной детский многопрофильный медицинский центр» Министерства здравоохранения Республики Узбекистан и лаборатории клиники «Иннова» Министерства здравоохранения Республики Узбекистан. Период проведения исследования: с января 2021 по декабрь 2022 года. Подбор участников в группы был осуществлен до начала лечения на основании наличия COVID-19 в анамнезе. Таким образом, были сформированы две группы: в 1-ю группу вошли 30 детей с острым пиелонефритом без наличия в анамнезе COVID-19, а во 2-ю группу — 35 больных с острым пиелонефритом на фоне COVID-19. Исследовано функциональное состояние почек на основании изучения функционирования гломерул, проксимальных и дистальных канальцев. Исследованы показатели «мочевого синдрома», определяли лейкоцитурию нейтрофильного генеза, микрогематурию, протеинурию, бактериурию. Полученные данные лабораторных исследований обработаны методом вариационной статистики и приведены в международной системе единиц СИ. Проведение расчетов осуществляли с помощью программ StatPlus версия 7 (AnalystSoft Inc., США).
Результаты. Ренальные функции снижаются в остром периоде за счет снижения концентрационной функции и функции дистального канальца, более значимое поражение которых установлено у пациентов 2-й группы. В основе выявленных нарушений лежат воспалительные изменения ренальной ткани из-за токсического действия коронавирусной инфекции. Срок заболевания COVID-19 в анамнезе от даты поступления составил от 3 недель до 2 месяцев. Нарушения функции почек у детей, перенесших COVID-19, проявлялись вне зависимости от их клинического полиморфизма, из-за нарушения тубулярных структур (обратного всасывания, ацидо-аммониогенеза, осмотического концентрирования), а также из-за поражения клубочковой фильтрации. Для больных острым пиелонефритом на фоне COVID-19 было характерно статистически достоверное уменьшение ацидогенеза (р = 0,001).
Заключение. Требуется применение мониторинга ренальных функций у детей с респираторными симптомами COVID-19 для ранней диагностики и лечения в случае поражения почек. Для определения скрытой почечной патологии больным с изолированным мочевым синдромом в острый период необходим длительный контроль.
Для цитирования:
Ахмеджанова Н.И., Ахмеджанов И.А., Исмаилова З.А., Гаппарова Г.Н. Оценка функционального состояния почек при ренальных осложнениях у детей в период пандемии COVID-19: обсервационное когортное ретроспективное клиническое исследование. Кубанский научный медицинский вестник. 2023;30(3):25-33. https://doi.org/10.25207/1608-6228-2023-30-3-25-33
For citation:
Axmedjanova N.I., Axmedjanov I.A., Ismailova Z.A., Gapparova G.N. Evaluation of Kidney Functioning in Children with Renal Complications During COVID-19 Pandemic: A Retrospective Observational Cohort Clinical Study. Kuban Scientific Medical Bulletin. 2023;30(3):25-33. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-3-25-33
ВВЕДЕНИЕ
В настоящее время нефрология борется с проблемой увеличения числа детей с острыми ренальными нарушениями, развившимися на фоне инфекционных заболеваний [1–5]. В структуре почечной патологии у детей по частоте первое место занимает пиелонефрит [6].
Некоторые сообщения об инфекции COVID-19 у детей уже имеются в связи с эпидемией в Китае в 2019 г. Недавний обзор 45 научных работ показал, что дети до настоящего времени составляли 1–5% диагностированных случаев COVID-19, причем большинство из них протекает бессимптомно, а 10% обычно имеют более легкую форму заболевания, чем у взрослых, а летальные исходы редки [7–14].
Недостаточность специфических признаков, явных клинических симптомов и не всегда правильная интерпретация мочевого синдрома и биохимических параметров крови становятся причиной того, что острая ренальная патология на фоне COVID-19 впервые определяется в период стабильного ухудшения функционального состояния почек, к сожалению, уже необратимого [9][10][15].
Предпринимается все больше усилий для выяснения конкретных механизмов внутренней почечной патофизиологии после острой инфекции COVID-19 [12]. Определение этих механизмов может оказаться сложной задачей из-за этических ограничений, связанных с проведением рутинной биопсии почки у детей, а также из-за отсутствия в настоящее время точного неинвазивного диагностического теста [4][5].
Некоторые данные подчеркивают важность наблюдения за функцией почек у всех госпитализированных детей с COVID-19, одновременно избегая факторов, усугубляющих повреждение почек, таких как гиповолемия и использование нефротоксичных препаратов [13].
В Великобритании примерно половина госпитализированных детей с COVID-19 имеют признаки почечной дисфункции и более четверти соответствуют диагностическим критериям острого пиелонефрита (ОП). Из пациентов с острым повреждением почек 40% относились к наиболее тяжелой категории (т. е. уровень креатинина в сыворотке в 3 раза превышал норму) [7]. Диагностика, клиническое течение и лечение этих пациентов были схожи с таковыми у взрослых, хотя только 0,6% детей имели критическое состояние. Высокая распространенность тяжелой формы заболевания (около 50%) наблюдалась у младенцев.
Принимая во внимание имеющиеся на сегодня данные, можно предположить, что снижение резистентности к данной патологии у детей объясняется меньшей иммунной дисфункцией и незрелостью рецепторов ангиотензин-превращающего фермента 2 (АПФ2), которые являются местами связывания с вирусом SARS-CoV-2 [8].
Цель исследования — определить и оценить особенности функционального состояния почек у детей с острым пиелонефритом, развившимся на фоне COVID-19.
МЕТОДЫ
Дизайн исследования
Проведено обсервационное когортное ретроспективное клиническое исследование 65 детей с острым пиелонефритом. Также в исследование в качестве группы контроля были включены 20 здоровых детей, которые наблюдались в рамках профмедосмотров.
Условия проведения исследования
Больные наблюдались на базе государственного бюджетного учреждения здравоохранения «Самаркандский областной детский многопрофильный медицинский центр» (СОДММЦ) Министерства здравоохранения Республики Узбекистан (МЗРУз), в отделении нефрологии. Лабораторный этап исследования выполнен на базе клинико-диагностической лаборатории СОДММЦ и лаборатории клиники «Иннова» Министерства здравоохранения Республики Узбекистан. Период проведения исследования: с января 2021 по декабрь 2022 года.
Критерии соответствия
Критерии включения
Критерии включения в исследование для здоровых детей: добровольное информируемое согласие родителей больного, возраст исследуемых детей от 4 до 18 лет, отсутствие соматических патологий в течение последних трех месяцев, состояние психического здоровья на момент обследования.
Критерии включения в исследование для основных групп: возраст исследуемых детей от 4 до 18 лет, верифицированный диагноз «острый пиелонефрит», наличие добровольного информируемого согласия в письменном виде.
Критерии невключения
Возраст старше 18 или младше 4 лет; наличие острых или хронических болезней в фазе обострения, не относящихся к исследуемым нозологическим формам (например, декомпенсированная патология сердечно-сосудистой системы, органов дыхания, почек, ВИЧ-инфекция и прочее); неврологические и психические расстройства; неконтролируемый прием лекарственных препаратов, отказ родителей больного от включения в исследование.
Критерии исключения
Отказ родителей от дальнейшего наблюдения, отказ от прохождения реабилитационно-противорецидивного этапа лечения, за 30 дней до начала лечения использование иммуноактивных средств, отсутствие основного диагноза (ОП).
Описание критериев соответствия (диагностические критерии)
Отбор испытуемых лиц включал установление диагноза «острый пиелонефрит» на основании клинико-лабораторной диагностики в соответствии с клиническими рекомендациями1. Клиническую основу ОП у детей в изучаемой группе составила лихорадка фебрильного характера (в сочетании с симптомами интоксикации). Эти проявления сочетались с нарушением ритма мочеиспускания (императивные позывы, паллакиурия, редкие микции), эквивалентами болезненного мочеиспускания.
Подбор участников в группы
Подбор участников в группы осуществился до начала лечения на основании определения наличия COVID-19 в анамнезе. Таким образом были сформированы две группы: в 1-ю группу вошли 30 детей с ОП без наличия в анамнезе COVID-19, а во 2-ю группу — 35 больных с ОП на фоне COVID-19. Параллельно была набрана контрольная группа (n = 20) здоровых детей, которые наблюдались в рамках профмедосмотров.
Целевые показатели исследования
Основной показатель исследования
Исследовано функциональное состояние почек на основании изучения функционирования гломерул, проксимальных и дистальных канальцев. В плазме крови определяли содержание креатинина, на основании которого вычисляли скорость клубочковой фильтрации. Состояние проксимальных канальцев определяли по уровню суточной протеинурии и осмотического концентрирования мочи. Функциональное состояние дистальных канальцев оценивалось по уровню экскреции титрационных кислот и аммиака в моче, которые, исходя из анализа литературных данных, нам представлялись наиболее перспективными маркерами для лабораторной оценки состояния ренальных функций у больных с ОП.
Исследованы показатели «мочевого синдрома», определяли лейкоцитурию нейтрофильного генеза, микрогематурию, протеинурию, бактериурию.
Дополнительные показатели исследования
Определение чувствительности микроорганизмов к различным химиопрепаратам проводили согласно методическим указаниям «Определение чувствительности микроорганизмов к антибиотикам методом диффузии в агар с использованием дисков» (утверждены Инструктивно-методическими указаниями № 3).
Методы измерения целевых показателей
Общеклинические: анамнез, осмотр, анализы крови и мочи, инструментальные: экскреторная урография, УЗИ почек, нефросцинтиграфия, измерение артериального давления, биохимические: креатинин крови и мочи, ПЦР, бактериологические: посев мочи на микрофлору и чувствительность к антибиотикам.
Переменные (предикторы, конфаундеры, модификаторы эффекта)
Искажающими факторами, способными самостоятельно влиять на уровень определяемых показателей в сыворотке или плазме крови, прежде всего являются заболевания соматического профиля (ревматическая лихорадка), органические поражения соединительной ткани. Данные факторы были нивелированы на этапе формирования выборок за счет внесения их в состав критериев невключения. Также косвенным свидетельством отсутствия заметного влияния органических поражений соединительнотканной системы может быть низкий уровень классических периферических маркеров поражения соединительной ткани (показатели ревмапробы).
Статистические процедуры
Принципы расчета размера выборки
Размер выборки предварительно не рассчитывался.
Статистические методы
Полученные данные лабораторных исследований обработаны методом вариационной статистики и приведены в международной системе единиц СИ (Г. Липперт, 1980). Статистическую значимость полученных результатов оценивали параметрическими критериями Стьюдента — Фишера с вычислением средних показателей (М), среднеквадратического отклонения (SD), ошибки средней арифметической величины (m). Соответствие нормальному закону в выборках устанавливали с помощью критерия Шапиро — Уилка. По таблице критерия Стьюдента определялась вероятность (р) возможной ошибки. При этом результат считался статистически достоверным при р < 0,05. Проведение расчетов осуществляли с помощью программ StatPlus версия 7 (AnalystSoft Inc., США).
РЕЗУЛЬТАТЫ
Формирование и характеристики выборки (групп) исследования
Для проведения исследования были сформированы две группы. В основную группу (2-я группа) были включены 35 пациентов с ОП с наличием в анамнезе COVID-19, все больные были доведены до конца наблюдения. Срок заболевания COVID-19 в анамнезе от даты поступления составил от 3 недель до 2 месяцев. Параллельно была набрана группа сравнения (1-я группа, n = 30), которую составили пациенты, не имевшие в анамнезе COVID-19. Контрольную группу (n = 20) составили здоровые дети. Исследуемые дети, включенные в сравнительную, основную и контрольную группы, были сопоставимы по возрасту: в 1-й группе средний возраст (М ± SD) был равен 12,13 ± 4,33 года; во 2-й группе — 11,35 ± 4,25 года; в группе контроля — 11,65 ± 4,33 года.
Однофакторный дисперсионный анализ не выявил статистически значимого различия средних значений возраста среди пациентов трех сравниваемых групп (р = 0,776).
Блок-схема дизайна исследования представлена на рисунке 1.
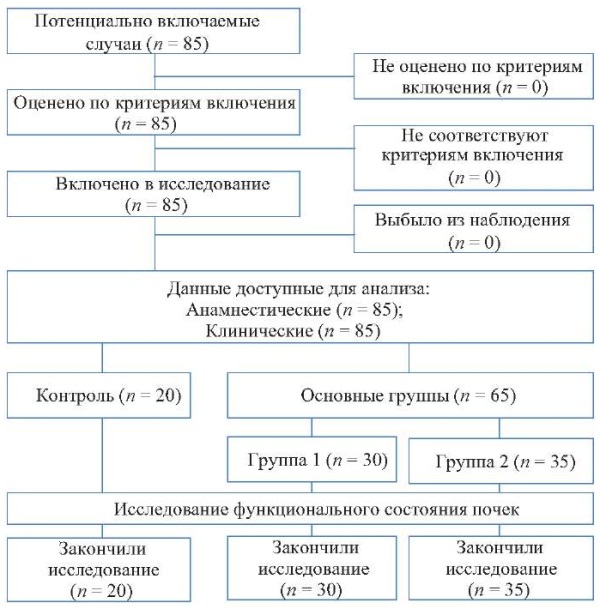
Рисунок 1. Блок-схема дизайна проведенного исследования.
Примечание: блок-схема выполнена авторами (согласно рекомендациям STROBE).
Fig. 1. Schematic diagram of the research design.
Note: performed by the authors (according to STROBE recommendations).
Основные результаты исследования
Исследование ренальных функций показало, что в остром периоде за счет снижения концентрационной функции снижаются и функции дистального канальца, более значимое поражение которых установлено у пациентов 2 группы. В основе выявленных нарушений лежат воспалительные изменения ренальной ткани из-за токсического действия коронавирусной инфекции (табл. 1).
Таблица 1. Средние значения (М ± SD) показателей гломерулярной фильтрации больных ОП в группах сравнения.
Table 1. Mean values (M ± SD) of glomerular filtration in acute pyelonephritis (AP) patients in comparison groups
|
Показатель |
Группы сравнения |
||
|
Контроль (n = 20) |
Группа 1 (n = 30) |
Группа 2 (n = 35) |
|
|
СКФ, мл/мин/1,73 м2 |
98,40 ± 17,85 |
88,66 ± 21,19 Рконтроль = 0,097 |
54,90 ± 11,51 Рконтроль < 0,001* Ргруппа 1 < 0,001* Рдисперсионный < 0,001* |
|
Креатинин сыворотки, мг/л |
0,88 ± 0,36 |
0,90 ± 0,42 Рконтроль = 0,860 |
1,53 ± 0,31 Рконтроль < 0,001* Ргруппа 1 < 0,001* Рдисперсионный < 0,001* |
Примечания: таблица составлена авторами; Рконтроль — уровень значимости различий средних для группы от средних для контрольной группы, Ргруппа 1 — уровень значимости различий средних для группы от средних для группы 1, Рдисперсионный — уровень значимости различий средних для всех групп, * — статистически значимые различия.
Notes: compiled by the authors; Pконтроль — significance of differences between group mean and control group mean, Pгруппа 1 — significance of differences between group mean and group 1 mean, Pдисперсионный — significance of differences between group mean and all groups mean, * — statistically significant differences.
Гломерулярная фильтрация в активной стадии болезни у детей с ОП без наличия COVID-19 оставалась сохранной, тогда как у детей с ОП на фоне COVID-19 отмечено снижение СКФ, что мы связываем с патогенетическим воздействием токсинов вирусной инфекции.
Показатели протеинурии в группе 2 с больными ОП, перенесшими COVID-19, превышали как показатели в контрольной группе, так и в группе больных ОП без COVID-19 (табл. 2).
Таблица 2. Средние значения (М ± SD) показателя функционального состояния проксимальных канальцев больных ОП в группах сравнения
Table 2. Mean values of (M ± SD) of proximal tubule function of AP patients in comparison groups
|
Показатель |
Группы сравнения |
||
|
Контроль (n = 20) |
Группа 1 (n = 30) |
Группа 2 (n = 35) |
|
|
Протеинурия, мг/л |
50,56 ± 5,16 |
387,14 ± 38,49 Рконтроль < 0,001* |
779,14 ± 46,95 Рконтроль < 0,001* Ргруппа 1 < 0,001* Рдисперсионный < 0,001* |
Примечания: таблица составлена авторами; Рконтроль — уровень значимости различий средних для группы от средних для контрольной группы, Ргруппа 1 — уровень значимости различий средних для группы от средних для группы 1, Рдисперсионный — уровень значимости различий средних для всех групп, * — статистически значимые различия.
Notes: compiled by the authors; Pконтроль — significance of differences between group mean and control group mean, Pгруппа 1 — significance of differences between group mean and group 1 mean, Pдисперсионный — significance of differences between group mean and all groups mean, * — statistically significant differences.
Выявили нарушение функции осмотического концентрирования мочи (по пробе Зимницкого и в одноразовых порциях) на высоте воспаления дистальных канальцев больных ОП, которое указывало на нарушение ацидогенетической функции (табл. 3).
Таблица 3. Средние значения (М ± SD) — показателей функционального состояния дистальных канальцев больных ОП в группах сравнения
Table 3. Mean values of (M ± SD) of distal tubule function of AP patients in comparison groups
|
Показатель |
Группы сравнения |
||
|
Контроль (n = 20) |
Группа 1 (n = 30) |
Группа 2 (n = 35) |
|
|
Относительный удельный вес мочи (разовая порция), г/л |
1020,3 ± 13,5 |
1011,2 ± 12,8 Рконтроль = 0,020* |
1003,4 ± 11,7 Рконтроль < 0,001* Ргруппа 1 = 0,012* Рдисперсионный < 0,001* |
|
Относительный удельный вес мочи (пр. Зимницкого) Min, г/л Mах, г/л |
1017,9 ± 10,3 1023,4 ± 9,4 |
1010,3 ± 16,4 Рконтроль = 0,049* 1016,7 ± 13,1 Рконтроль = 0,047* |
1002,6 ± 17,7 Рконтроль = 0,009* Ргруппа 1 = 0,023* 1010,7 ± 14,2 Рконтроль = 0,009* Ргруппа 1 = 0,048* |
|
pH мочи |
5,76 ± 0,94 |
6,12 ± 1,13 Рконтроль = 0,247 |
6,18 ± 0,75 Рконтроль = 0,074 Ргруппа 1 = 0,792 Рдисперсионный = 0,264 |
|
Экскреция титруемых |
51,33 ± 5,95 |
17,89 ± 6,95 Рконтроль < 0,001* |
15,31 ± 1,91 Рконтроль < 0,001* Ргруппа 1 = 0,039* Рдисперсионный < 0,001* |
|
Экскреция аммиака (ммоль/24) |
46,8 ± 1,2 |
25,23 ± 10,95 Рконтроль < 0,001* |
20,20 ± 7,09 Рконтроль < 0,001* Ргруппа 1 = 0,048* Рдисперсионный < 0,001* |
Примечания: таблица составлена авторами; Рконтроль — уровень значимости различий средних для группы от средних для контрольной группы, Ргруппа 1 — уровень значимости различий средних для группы от средних для группы 1, Рдисперсионный — уровень значимости различий средних для всех групп, * — статистически значимые различия.
Notes: compiled by the authors; Pконтроль — significance of differences between group mean and control group mean, Pгруппа 1 — significance of differences between group mean and group 1 mean, Pдисперсионный — significance of differences between group mean and all groups mean, * — statistically significant differences.
У больных 2 группы наблюдалось нарушение суммарной функции почек больных ОП, тогда как у детей 1 группы данная функция отличалась отсутствием нарушений (рис. 2).
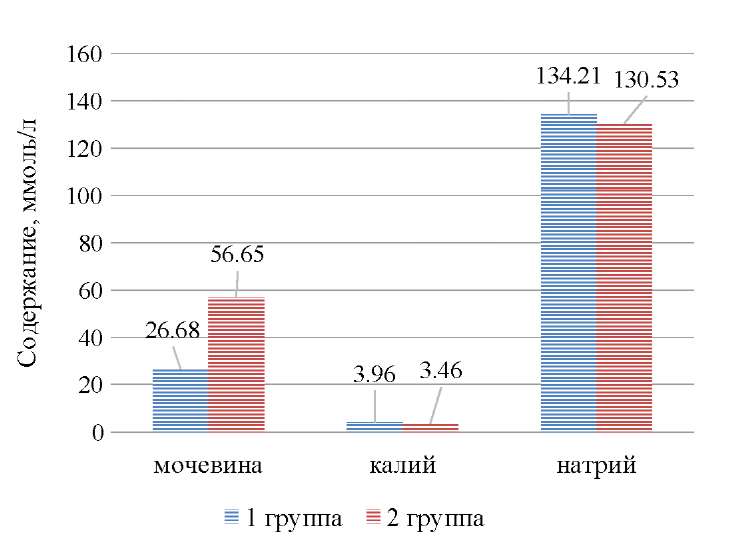
Рис 2. Значения показателей суммарной функции почек больных ОП в сравниваемых группах.
Примечание: рисунок выполнен авторами.
Fig. 2. Values of total kidney function of AP patients in comparison groups.
Note: performed by the authors.
Отмечено выраженное снижение реабсорбционной функции проксимальных канальцев в обеих группах, но больше было характерно для больных с ОП развившимся на фоне COVID-19. Несмотря на нормальные показатели аминоазота в крови (6,5 ± 0,61 мг/%), уровень аминоацидурии у всех больных был максимальным.
Отмечено, что реакция мочи оставалась в пределах нормы, тогда как уровень титруемых кислот и аммиака значимо снижался, что указывало на большее повреждение выделения водородных ионов в проксимальных тубулах и сохранности его в дистальных, что было наиболее выраженным у больных 2-й группы (табл. 3).
Оставалось в пределах нормы адаптационное свойство тубул к концентрированию и разведению, потому что разница между минимальной и максимальной плотностью мочи была равна 6 и 8 единицам.
Статистически значимо не отличалось рН мочи у пациентов обеих групп, но было более щелочным у больных с ОП (табл. 3).
Более выраженное нарушение выделения титруемых кислот определили у пациентов с ОП на фоне COVID-19 по сравнению с больными без его наличия. Показатели аммониогенеза имели тенденцию к снижению у детей обеих групп, но были более выраженными у детей 2-й группы.
При исследовании мочевого синдрома определили лейкоцитурию нейтрофильного генеза (20–28 и более клеток в п/з соответственно, из них нейтрофилов более 50%), микрогематурию (до 10–16 эритроцитов в п/з). Лейкоцитурия была наиболее заметна по накопительной пробе: минимальное количество клеток составляло 3750 и 6480 в 1 мл, а максимальное — 50 400 и 8970. Протеинурия не превышала 0,18 и 0,76 г/л в одноразовой порции и 567,0 мг/24 часа, а также не более 954 мг/24 часа. Незначительная эритроцитурия — от 860 и 1250 до 1620 и 2300 клеток в 1 мл (1243,75 ± 125,33). У всех обследованных детей определена положительная бактериурия.
Дополнительные результаты исследования
По результатам определения чувствительности микроорганизмов к различным химиопрепаратам в ходе исследования зафиксирована высокая чувствительность к цефотаксиму и цефтриаксону.
Цефотаксим (цефалоспорин Ш поколения) обладает высокой активностью в отношении грамотрицательной флоры (кишечная палочка, клебсиелла, протей), менее чувствительны к нему стафилококки. Для цефотаксима характерны благоприятные фармакокинетические свойства и хорошее проникновение в ткани; хорошие фармакокинетические свойства: высокая биодоступность и длительный период полуэлиминации.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
У больных, перенесших COVID-19, наблюдался высокий процент тубулоинтерстициальных поражений почек (острый пиелонефрит — 49%). У 100% больных ОП на фоне COVID-19 и у 40% детей с ОП без наличия в анамнезе COVID-19 (различие долей в группах статистически значимо по точному критерию Фишера, Р < 0,05) отмечена третья степень активности воспалительного процесса.
Нарушения функции почек у детей, перенесших COVID-19, проявлялись вне зависимости от их клинического полиморфизма, из-за нарушения тубулярных структур почки (обратного всасывания, ацидо-аммониогенеза, осмотического концентрирования), а также из-за поражения клубочковой фильтрации. Для больных острым пиелонефритом на фоне COVID-19 было характерно статистически значимое уменьшение ацидогенеза (р < 0,001).
Ограничения исследования
Результаты настоящего исследования были получены на небольших выборках пациентов. Для дальнейшего развития выполненной работы необходимо проведение исследования с бóльшим объемом выборки, большей продолжительностью и возможным разделением основной группы на подгруппы в зависимости от длительности и активности COVID-19.
Интерпретация результатов исследования
У детей с ОП на фоне COVID-19 происходит снижение скорости клубочковой фильтрации (СКФ), что является результатом патогенетического воздействия токсинов вирусной инфекции. Инфекция SARS-CoV-2 имеет тенденцию поражать почки при тяжелом течении болезни, что проявляется снижением СКФ до 49,59 мл/мин/1,73 м2 по сравнению с не тяжелым (113 мл/мин/1,73 м²). Снижение резистентности к данной патологии у детей объясняется меньшей иммунной дисфункцией и незрелостью рецепторов ангиотензин-превращающего фермента 2 (АПФ2), которые являются местами связывания SARS-CoV-2 [8][9]. Патофизиология дисфункции почек у пациентов с COVID-19 недавно была предположена как вторичная по отношению к перекрестному взаимодействию органов, системным эффектам и прямому тубулогломерулярному повреждению [14][16][17].
Выраженное снижение реабсорбционной функции проксимальных канальцев частично связано с обезвоживанием, которое является вторичным из-за снижения потребления жидкости, рвоты, диареи и чрезмерного использования мочегонных средств для поддержания легких «сухими». Все это предрасполагает к нарушению уровня аминоацидурии [18][19]. Увеличение суточной протеинурии непосредственно связано с системным побочным эффектом вируса, подтвержденным гистопатологическими результатами, что вирус SARS-COV-2 может непосредственно поражать проксимальные канальцы, что подтверждает значимое поражение функции проксимальных канальцев [20][21].
Нарушение функции осмотического концентрирования мочи и суммарной функции почек на высоте воспаления происходит из-за нарушения ацидогенетической функции, которая является результатом взаимодействия между различными органами — интенсивной вентиляцией при тяжелой гипоксемии, что связано с изменением функции почек как компонентом перекрестного взаимодействия органов [22][23].
Снижение уровня титруемых кислот и аммиака на фоне неизмененной реакции мочи указывает на большее повреждение выделения водородных ионов в проксимальных тубулах и сохранность ее в дистальных, что было связано с гемодинамической нестабильностью (в дополнение к проблемам вентиляции может включать кардиомиопатию или миокардит), усугубляемой агрессивным замещением объема, положительным балансом жидкости и коинфекцией бактериальными патогенами с последующим осложнением воспалительного процесса в почечной ткани [24].
Наиболее высокий уровень лейкоцитурии нейтрофильного генеза, микрогематурии у детей с наличием COVID-19 в анамнезе объясняется более выраженным воспалением почек, повышенной проницаемостью сосудов, потерей жидкости, внутрибрюшной гипертензией, гиповолемией и является ведущим патобиохимическим механизмом формирования мочевого синдрома [25].
Также полученные данные подтверждают, что даже после полноценного реабилитационного курса после COVID-19 сохраняется высокий риск формирования ОП, обусловленный относительно высокой вирулентностью коронавирусной инфекции, который указывает на тропизм почечной ткани, особенно у тех, у кого поражено более двух систем органов. Вирусная нагрузка обнаруживается во всех отделах почек с очевидным сродством к клубочкам.
ЗАКЛЮЧЕНИЕ
Требуется применение мониторинга ренальных функций у детей с респираторными симптомами COVID-19 для ранней диагностики и лечения в случае их поражения. Для определения скрытой почечной патологии больным с изолированным мочевым синдромом в острый период необходим длительный контроль.
Мы провели оценку состояния «мочевого синдрома» у детей с острым пиелонефритом и определили более выраженные нарушения всех лабораторных показателей у детей, имевших в анамнезе COVID-19. Следовательно, эти параметры меняются по-разному в зависимости от этиологического фактора болезни.
1. Союз педиатров России; Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии. Инфекции мочевыводящих путей. Клинические рекомендации. Министерство здравоохранения Российской Федерации. М.: 2021 . Available: https://diseases.medelement.com/disease/%D0%B8%D0%BD%D1%84%D0%B5%D0%BA%D1%86%D0%B8%D1%8F-%D0%BC%D0%BE%D1%87%D0%B5%D0%B2%D1%8B%D0%B2%D0%BE%D0%B4%D1%8F%D1%89%D0%B8%D1%85-%D0%BF%D1%83%D1%82%D0%B5%D0%B9-%D1%83-%D0%B4%D0%B5%D1%82%D0%B5%D0%B9-%D0%BA%D1%80-%D1%80%D1%84%E2%80%912021/17052?ysclid=lhub05nlnr810450281
Список литературы
1. Kellum J.A., Romagnani P., Ashuntantang G., Ronco C., Zarbock A., Anders H.J. Acute kidney injury. Nat. Rev. Dis. Primers. 2021; 7(1): 52. DOI: 10.1038/s41572-021-00284-z
2. Cleto-Yamane T.L., Gomes C.L.R., Suassuna J.H.R., Nogueira P.K. Acute Kidney Injury Epidemiology in pediatrics. J. Bras. Nefrol. 2019; 41(2): 275–283. DOI: 10.1590/2175-8239-JBN-2018-0127
3. Pleniceanu O., Twig G., Tzur D., Sherman G., Afek A., Erlich T., Keinan-Boker L., Skorecki K., Vivante A., Calderon-Margalit R. Acute pyelonephritis in children and the risk of end-stage kidney disease. J. Nephrol. 2021; 34(5): 1757–1765. DOI: 10.1007/s40620020-00841-x
4. Millner R., Becknell B. Urinary Tract Infections. Pediatr. Clin. North. Am. 2019; 66(1): 1–13. DOI: 10.1016/j.pcl.2018.08.002
5. Sigurjonsdottir V.K., Chaturvedi S., Mammen C., Sutherland S.M. Pediatric acute kidney injury and the subsequent risk for chronic kidney disease: is there cause for alarm? Pediatr. Nephrol. 2018; 33(11): 2047– 2055. DOI: 10.1007/s00467-017-3870-6
6. Uber A.M., Sutherland S.M. Acute kidney injury in hospitalized children: consequences and outcomes. Pediatr. Nephrol. 2020; 35(2): 213– 220. DOI: 10.1007/s00467-018-4128-7
7. Basu R.K., Bjornstad E.C., Gist K.M., Starr M., Khandhar P., Chanchlani R., Krallman K.A., Zappitelli M., Askenazi D., Goldstein S.L.; SPARC Investigators. Acute kidney injury in critically Ill children and young adults with suspected SARS-CoV2 infection. Pediatr. Res. 2022; 91(7): 1787–1796. DOI: 10.1038/s41390-021-01667-4
8. May R.M., Cassol C., Hannoudi A., Larsen C.P., Lerma E.V., Haun R.S., Braga J.R., Hassen S.I., Wilson J., VanBeek C., Vankalakunti M., Barnum L., Walker P.D., Bourne T.D., Messias N.C., Ambruzs J.M., Boils C.L., Sharma S.S., Cossey L.N., Baxi P.V., Palmer M., Zuckerman J.E., Walavalkar V., Urisman A., Gallan A.J., Al-Rabadi L.F., Rodby R., Luyckx V., Espino G., Santhana-Krishnan S., Alper B., Lam S.G., Hannoudi G.N., Matthew D., Belz M., Singer G., Kunaparaju S., Price D., Chawla S., Rondla C., Abdalla M.A., Britton M.L., Paul S., Ranjit U., Bichu P., Williamson S.R., Sharma Y., Gaspert A., Grosse P., Meyer I., Vasudev B., El Kassem M., Velez J.C.Q., Caza T.N. A multi-center retrospective cohort study defines the spectrum of kidney pathology in Coronavirus 2019 Disease (COVID-19). Kidney Int. 2021; 100(6): 1303–1315. DOI: 10.1016/j.kint.2021.07.015
9. Wu H.H.L., Shenoy M., Kalra P.A., Chinnadurai R. Intrinsic Kidney Pathology Following COVID-19 Infection in Children and Adolescents: A Systematic Review. Children (Basel). 2021; 9(1): 3. DOI: 10.3390/children9010003
10. Mittal A., Nadig P., Singh K. Renal manifestations of COVID 19 in children. J. Family. Med. Prim. Care. 2022; 11(6): 2302–2310. DOI: 10.4103/jfmpc.jfmpc_1777_21
11. Смирнова Н.Н., Галкина О.В., Новикова В.П., Прокопьева Н.Э. Современные биомаркеры повреждения почек в педиатрии. Нефрология. 2019; 23(4): 112–118. DOI: 10.24884/1561-6274-2019-234-112-118
12. Киселева А. В., Лескова А. В., Скворцов В. В. Патология почек у пациентов с COVID-19. Лечащий Врач. 2022; 9 (25): 19–23. DOI: 10.51793/OS.2022.25.9.003
13. Basiratnia M., Derakhshan D., Yeganeh B.S., Derakhshan A. Acute necrotizing glomerulonephritis associated with COVID-19 infection: report of two pediatric cases. Pediatr. Nephrol. 2021; 36(4): 1019–1023. DOI: 10.1007/s00467-021-04944-w
14. Garcia-Vidal C., Sanjuan G., Moreno-García E., Puerta-Alcalde P., Garcia-Pouton N., Chumbita M., Fernandez-Pittol M., Pitart C., Inciarte A., Bodro M., Morata L., Ambrosioni J., Grafia I., Meira F., Macaya I., Cardozo C., Casals C., Tellez A., Castro P., Marco F., García F., Mensa J., Martínez J.A., Soriano A.; COVID-19 Researchers Group. Incidence of co-infections and superinfections in hospitalized patients with COVID-19: a retrospective cohort study. Clin. Microbiol. Infect. 2021; 27(1): 83-88. DOI: 10.1016/j.cmi.2020.07.041
15. Stewart D.J., Hartley J.C., Johnson M., Marks S.D., du Pré P., Stojanovic J. Renal dysfunction in hospitalised children with COVID-19. Lancet Child Adolesc. Health. 2020; 4(8): e28–e29. DOI: 10.1016/S2352-4642(20)30178-4
16. Larkins N.G., Teixeira-Pinto A., Craig J.C. A narrative review of proteinuria and albuminuria as clinical biomarkers in children. J. Paediatr. Child Health. 2019; 55(2): 136–142. DOI: 10.1111/jpc.14293
17. Rowley A.H. Understanding SARS-CoV-2-related multisystem inflammatory syndrome in children. Nat. Rev. Immunol. 2020; 20(8): 453–454. DOI: 10.1038/s41577-020-0367-5
18. Robbins-Juarez S.Y., Qian L., King K.L., Stevens J.S., Husain S.A., Radhakrishnan J., Mohan S. Outcomes for Patients With COVID-19 and Acute Kidney Injury: A Systematic Review and Meta-Analysis. Kidney In.t Rep. 2020; 5(8): 1149–1160. DOI: 10.1016/j.ekir.2020.06.013
19. Kang S.H., Kim S.W., Kim A.Y., Cho K.H., Park J.W., Do J.Y. Association between Chronic Kidney Disease or Acute Kidney Injury and Clinical Outcomes in COVID-19 Patients. J. Korean Med. Sci. 2020; 35(50): e434. DOI: 10.3346/jkms.2020.35.e434
20. Shen Q., Wang M., Che R., Li Q., Zhou J., Wang F., Shen Y., Ding J., Huang S., Yap H.K., Warady B.A., Xu H., Zhang A.; Chinese Society of Pediatric Nephrology and Chinese Medical Doctor Association of Pediatric Nephrology. Consensus recommendations for the care of children receiving chronic dialysis in association with the COVID-19 epidemic. Pediatr. Nephrol. 2020; 35(7): 1351–1357. DOI: 10.1007/s00467020-04555-x
21. Ronco C., Reis T. Kidney involvement in COVID-19 and rationale for extracorporeal therapies. Nat. Rev. Nephrol. 2020; 16(6): 308–310. DOI: 10.1038/s41581-020-0284-7
22. Su H., Yang M., Wan C., Yi L.X., Tang F., Zhu H.Y., Yi F., Yang H.C., Fogo A.B., Nie X., Zhang C. Renal histopathological analysis of 26 postmortem findings of patients with COVID-19 in China. Kidney Int. 2020; 98(1): 219–227. DOI: 10.1016/j.kint.2020.04.003
23. Widiasta A., Sribudiani Y., Nugrahapraja H., Hilmanto D., Sekarwana N., Rachmadi D. Potential role of ACE2-related microRNAs in COVID-19-associated nephropathy. Noncoding RNA Res. 2020; 5(4): 153–166. DOI: 10.1016/j.ncrna.2020.09.001
24. Xiao G., Hu H., Wu F., Sha T., Zeng Z., Huang Q., Li H., Han J., Song W., Chen Z., Cai S. [Acute kidney injury in patients hospitalized with COVID-19 in Wuhan, China: a single-center retrospective observational study]. Nan Fang Yi Ke Da Xue Xue Bao. 2021; 41(2): 157–163. DOI: 10.12122/j.issn.1673-4254.2021.02.01
25. Xu Y., Li X., Zhu B., Liang H., Fang C., Gong Y., Guo Q., Sun X., Zhao D., Shen J., Zhang H., Liu H., Xia H., Tang J., Zhang K., Gong S. Characteristics of pediatric SARS-CoV-2 infection and potential evidence for persistent fecal viral shedding. Nat. Med. 2020; 26(4): 502–505. DOI: 10.1038/s41591-020-0817-4
Об авторах
Н. И. АхмеджановаУзбекистан
Ахмеджанова Наргиза Исмаиловна — доктор медицинских наук, доцент; заведующая кафедрой педиатрии № 2.
Ул. Амира Темура, д. 18, Самарканд, 100400
И. А. Ахмеджанов
Узбекистан
Ахмеджанов Исмаил Ахмеджанович — доктор медицинских наук, профессор кафедры детской хирургии № 2.
Ул. Амира Темура, д. 18, Самарканд, 100400
З. А. Исмаилова
Узбекистан
Исмаилова Зиёда Актамовна — ассистент кафедры педиатрии и высшего сестринского дела.
Ул. Ал-Хоразмий, д. 28, г. Ургенч, 220100
Г. Н. Гаппарова
Узбекистан
Гаппарова Гули Нурмуминовна — ассистент кафедры общей гигиены и экологии.
Ул. Амира Темура, д. 18, Самарканд, 100400
Рецензия
Для цитирования:
Ахмеджанова Н.И., Ахмеджанов И.А., Исмаилова З.А., Гаппарова Г.Н. Оценка функционального состояния почек при ренальных осложнениях у детей в период пандемии COVID-19: обсервационное когортное ретроспективное клиническое исследование. Кубанский научный медицинский вестник. 2023;30(3):25-33. https://doi.org/10.25207/1608-6228-2023-30-3-25-33
For citation:
Axmedjanova N.I., Axmedjanov I.A., Ismailova Z.A., Gapparova G.N. Evaluation of Kidney Functioning in Children with Renal Complications During COVID-19 Pandemic: A Retrospective Observational Cohort Clinical Study. Kuban Scientific Medical Bulletin. 2023;30(3):25-33. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-3-25-33








































