Перейти к:
Осложнения хирургического лечения грыж пищеводного отверстия диафрагмы и тактика их устранения: обсервационное нерандомизированное исследование
https://doi.org/10.25207/1608-6228-2024-31-3-30-43
Аннотация
Введение. С внедрением малоинвазивных технологий количество ежегодно выполняемых оперативных вмешательств по поводу грыж пищеводного отверстия диафрагмы возрастает. Трагизм положения заключается в том, что уровень основных осложнений (болевой синдром, дисфагия и рецидив гастроэзофагеального рефлюкса) стабильный и достигает 32 %. Количество нуждающихся в повторных вмешательствах составляет 19 %, из которых количество не выздоровевших — 60–70 %, а подвергаются оперативным вмешательствам в третий раз — 45 %.
Цель исследования — конкретизировать основные осложнения хирургического лечения грыж пищеводного отверстия диафрагмы и обосновать оптимальные приемы реконструктивных вмешательств для их устранения.
Методы. Обсервационное нерандомизированное исследование проведено на 78 пациентах с диагнозом «Диафрагмальная грыжа без непроходимости или гангрены». Пациенты были распределены на три группы в зависимости от проведенного оперативного вмешательства, первичного или реконструктивного. В первую группу включен 31 пациент, у которых хирургическое лечение осуществлялось с использованием традиционных тактики и методов (методами Nissen, Dor); во вторую — 35 пациентов, которым выполнялась неполная селективная проксимальная ваготомия с фундопликацией по академику А.Ф. Черноусову; в третью — 12 пациентов, у которых выполнены повторные реконструктивные вмешательства по поводу осложнений хирургического лечения грыж пищеводного отверстия диафрагмы. Оперативные вмешательства выполнялись в 5 городских и районных общехирургических стационарах Белгородской области с одинаковой оснащенностью медицинским оборудованием и квалификацией хирургических кадров. Включение пациентов в исследование осуществлялось с 2015 по 2023 г., продолжительность наблюдения каждого больного составляла от 3 месяцев до 8 лет. Результаты хирургического лечения оценивались методом анкетирования. На основании шкалы Dakkak и опросника Gastro Esophageal Reflux Disease (GERD) оценивались наличие и выраженность основных осложнений хирургического лечения грыжи пищеводного отверстия диафрагмы, обобщенная оценка которых выражалась в отличных, хороших, удовлетворительных и не удовлетворительных результатах состояния пациентов. Статистическая обработка данных осуществлялась в программе Microsoft Excel 2019 (Microsoft, США). Статистически значимым считали уровень значимости, для которого р ≤ 0,05.
Результаты. Основными осложнениями оперативных вмешательств по поводу грыж пищеводного отверстия диафрагмы являются: рецидив гастроэзофагеального рефлюкса, болевой синдром и дисфагия, которые в первой группе составляют 54,8, 48,4 и 61,3 % от количества больных в группе соответственно. Суммарное значение долей всех видов осложнений превышает 100 %, так как у трех больных наблюдали все три осложнения, у 12 больных наблюдали два вида осложнений, у 15 больных — одно осложнение. Получены результаты, оценивающие состояние пациента: хорошие — 19,4 %, удовлетворительные — 22,6 % и неудовлетворительные — 58,0 %. Во второй группе получены результаты, оценивающие состояние пациента, только хорошие (22,9 %) и отличные (77,1 %). В третьей группе реконструктивные вмешательства включали: устранение крурорафии; неполная селективная проксимальная ваготомия с модифицированной гастроэзофагофундорафией и фундопликацией по А.Ф. Черноусову; формирование пищеводного отверстия диафрагмы адекватным параметрам фундопликационной манжеты. Получены результаты, оценивающие состояние пациента, только хорошие — 22,2 % и отличные — 77,8 %.
Заключение. Основными осложнениями хирургического лечения грыж пищеводного отверстия диафрагмы являются болевой синдром, дисфагия и рецидив гастроэзофагеального рефлюкса, для устранения которых реконструктивные вмешательства целесообразно составить из следующих приемов: устранение крурорафии; снятие манжеты; неполная селективная проксимальная ваготомия; рефундопликация модифицированным методом академика А.Ф. Черноусова; формирование пищеводного отверстия диафрагмы адекватным параметрам фундопликационной манжеты.
Ключевые слова
Для цитирования:
Колесников С.А., Бугаев В.В., Бугаева С.Р., Ефремов М.В., Румбешт В.В. Осложнения хирургического лечения грыж пищеводного отверстия диафрагмы и тактика их устранения: обсервационное нерандомизированное исследование. Кубанский научный медицинский вестник. 2024;31(3):30-43. https://doi.org/10.25207/1608-6228-2024-31-3-30-43
For citation:
Kolesnikov S.A., Bugaev V.V., Bugaeva S.R., Efremov M.V., Rumbesht V.V. Complications of surgical treatment of hiatal hernia and tactics of its elimination: An observational non-randomized study. Kuban Scientific Medical Bulletin. 2024;31(3):30-43. (In Russ.) https://doi.org/10.25207/1608-6228-2024-31-3-30-43
ВВЕДЕНИЕ
История хирургии грыж пищеводного отверстия диафрагмы (ГПОД) берет начало с первых лет ХХ века и связана с именами W. Mayo, A. Soresi, S. W. Harrington, P. Allison, L. Hill, J Lataste [1]. В основе предложенных ими операций лежали низведение пищевода и желудка в брюшную полость с обязательной их фиксацией к парааортальной фасции, ножкам диафрагмы, передней брюшной стенке и т. д. Крайне неудовлетворительные результаты привели к негативному отношению к этим вмешательствам. Не только не устранялся гастроэзофагеальный рефлюкс как основное проявление грыж пищеводного отверстия диафрагмы, но и появлялись новые осложнения, такие как болевой синдром и дисфагия.
Пересмотр тактики лечения связан с работами Nissen, Rosetti, Dor, Toupet, Belsey. Предложенная ими концепция базировалась на антирефлюксном этапе вмешательства, который заключался в формировании манжеты из дна желудка вокруг дистального сегмента пищевода [1]. Эти методы с воодушевлением были восприняты хирургическим сообществом. Количество гастроэзофагеального рефлюкса сократилось, но послеоперационные болевой синдром и дисфагия продолжали иметь место. Появились новые осложнения: разрушение манжеты, ее соскальзывание (slippage-syndrom), сдавление в пищеводном отверстии диафрагмы, сдавление пищевода самой манжетой, сдавление желудка в суженном пищеводном отверстии диафрагмы. В основе перечисленных осложнений лежат механистические принципы лечения: низведение пищевода в брюшную полость, сужение пищеводного отверстия диафрагмы до диаметра самого пищевода и формирование стандартной фундопликационной манжеты высотой 4 см без учета индивидуальных параметров абдоминального сегмента пищевода [2].
С внедрением малоинвазивных технологий количество ежегодно выполняемых оперативных вмешательств по поводу грыж пищеводного отверстия диафрагмы и гастроэзофагеальной рефлюксной болезни возрастает, что связано, вероятнее всего, не с улучшением ранней диагностики, а с расширением показаний для хирургического лечения. Не менее удручающим является факт, что кажущаяся техническая простота привела к доступности этих вмешательств широкому кругу общих хирургов, не имеющих достаточного опыта в хирургии пищевода и желудка [3][4].
Трагизм положения заключается в том, что уровень основных осложнений стабильный и достигает 32 %. Положение усугубляется тем, что современные лапароскопические и роботические методы не оправдали возложенных надежд, не изменили качественные показатели лечения, так как используются те же способы, основанные на тех же самых механистических принципах. В контексте с этим для дополнительного укрепления пищеводного отверстия диафрагмы применяется аллопластика. При этом доказывается не ее необходимость как таковой, а качественные особенности эксплантатов, способы их размещения и фиксации [5]. Незамеченными остаются сообщения о специфических осложнениях аллопластики: миграция скрепок, фиксирующих имплантат, в перикард и миокард, пролежни в пищеводе и желудке, вызываемые синтетическими материалами, инфильтраты и абсцессы в области пищеводно-желудочного перехода [6].
Разбирая детально осложнения хирургического лечения грыж пищеводного отверстия диафрагмы, главными из которых являются: болевой синдром, дисфагия и рецидив желудочно-пищеводного рефлюкса, приходится констатировать, что в основе первых лежит несоответствие размеров фундопликационной манжеты параметрам абдоминального сегмента пищевода, особенно в условиях суженного пищеводного отверстия диафрагмы. Что касается рефлюкса, согласно эндоскопической классификации А.Ф. Черноусова (1973 г.), основным признаком всех форм рефлюкс-эзофагита является зияние кардии. Что касается полных и неполных традиционных фундопликационных манжет (Nissen, Nissen-Rozetti Toupet, Dor). Доказываемое манометрическими показателями улучшение функции нижнего пищеводного сфинктера является безосновательным [7][8]. Во-первых, синхронность сокращений складки из дна желудка с гладкой мускулатурой пищевода нереальна, во-вторых, существование нижнего пищеводного сфинктера неопределенное. Одни авторы его описывают, другие отрицают, третьи считают, что жомная функция желудочно-пищеводного перехода реализуется особой пращевидной мышцей (петля Виллиса, тракт Гельвеция) [2][3].
В последнее время часто встречается термин «рецидив грыжи пищеводного отверстия диафрагмы». Однако его обозначение неконкретно. Часть авторов под ним понимает рентгенологически установленный факт нахождения пищевода с манжетой выше уровня диафрагмы, другие связывают его с клиническими проявлениями рефлюкса [9]. Но ведь второе (клиническое проявление рефлюкса) не является следствием первого (нахождения пищевода с манжетой выше уровня диафрагмы).
В свое время сам R. Nissen описывал случаи успешного лечения грыж пищеводного отверстия диафрагмы у пациентов с рентгенологически подтвержденным фактом нахождения фундопликационной манжеты в заднем средостении и сохраненными антирефлюксными свойствами. К этому стоит добавить, что при кардиоспазме и ахалазии формируется манжета высотой 8 см и более, то есть выше уровня диафрагмы, с успешными антирефлюксными свойствами и без кардиореспираторных дисфункций [4]. Таким образом, рецидив желудочно-пищеводного рефлюкса, по своей сути, это не «рецидив грыжи», а некорригированное нарушение жомно-клапанной функции кардии [2].
Сложнейшим вопросом хирургической гастроэнтерологии являются реконструктивные вмешательства при осложнениях лечения ГПОД. Большинство больных с рецидивом желудочно-пищеводного рефлюкса лечатся гастроэнтерологами антацидными препаратами и ингибиторами протонной помпы. Только при безуспешности длительных курсов консервативной терапии пациенты направляются для хирургического лечения [10]. С сожалением приходится констатировать, что это сопровождается скептическим отношением со стороны врачей-терапевтов и неверием больных в успех повторной операции. Исключительно хирургическим уделом являются такие осложнения, как болевой синдром и дисфагия. Часть осложнений (соскальзывание манжеты (slippage-syndrom), ее ущемление в пищеводном отверстии диафрагмы, сдавление желудка в нем, тяжелая дисфагия) являются проблемой ургентной хирургии [2].
В общей популяции, среди перенесших хирургическое лечение грыж пищеводного отверстия диафрагмы, количество нуждающихся в повторных вмешательствах составляет 19 %, из которых количество не выздоровевших — 60–70 %, или 11,4–13,3 % среди перенесших хирургическое лечение ГПОД, а подвергаются оперативным вмешательствам в третий раз — 45 %, или 5,1–6,0 % среди перенесших хирургическое лечение ГПОД1 [10]. При этом первоначальные осложнения усугубляются, появляются новые осложнения: пищеводно-желудочные свищи, нагноения, послеоперационные грыжи, что приводит к необходимости новых, повторных вмешательств. Их техническая сложность становится чрезвычайной, а объем — непредсказуемым, вплоть до экстирпации пищевода [11].
Цель исследования — конкретизировать основные осложнения хирургического лечения грыж пищеводного отверстия диафрагмы и обосновать оптимальные приемы реконструктивных вмешательств для их устранения.
МЕТОДЫ
Дизайн исследования
Клиническое обсервационное нерандомизированное исследование проведено на 78 пациентах с диагнозом «Диафрагмальная грыжа без непроходимости или гангрены» (K44.9 по МКБ 10 пересмотра), перенесших первичное или реконструктивное оперативное вмешательство.
Критерии соответствия
Критерии включения
В группы исследования были включены только взрослые больные (старше 18 лет), перенесшие оперативные вмешательства по поводу грыж пищеводного отверстия диафрагмы и осложнений их хирургического лечения (диагноз К 44.9 по МКБ-10); пациенты, подвергшиеся анкетированному опросу; клиническому и инструментальному обследованию (эндоскопическому и рентгенологическому).
Критерии невключения
В исследование не вошли младшая возрастная группа (до 18 лет); пациенты, отказавшиеся от участия в анкетировании.
Критерии исключения
Негативное отношение пациентов или не конкретные ответы на поставленные вопросы.
Условия проведения
Оперативные вмешательства по поводу грыж пищеводного отверстия диафрагмы и осложнений их хирургического лечения выполнялось в 5 городских и районных общехирургических стационарах Белгородской области с одинаковой оснащенностью медицинским оборудованием и квалификацией хирургических кадров. В амбулаторных условиях выполнялись эндоскопические и рентгенологические исследования, а также анкетирование в очном формате. Пациентам, отказавшимся от обследования и личного визита для осмотра, анкетированный опрос осуществлялся в заочной форме. Анализ полученных результатов осуществлялся на кафедре госпитальной хирургии медицинского института федерального государственного бюджетного образовательного учреждения высшего образования «Белгородский государственный национальный исследовательский университет».
Продолжительность исследования
Включение пациентов в исследование осуществлялось с 2015 по 2023 г., продолжительность наблюдения каждого больного составляла от 3 месяцев до 8 лет.
Анкетирование проводилось в период от 6 месяцев до 8 лет после оперативного лечения.
Описание медицинского вмешательства
Оперативные вмешательства, выполненные традиционной тактикой и методами по поводу грыж пищеводного отверстия диафрагмы, осуществлялись малоинвазивным доступом под многокомпонентным интубационным наркозом в стерилизованной операционной. Использовалась лапароскопическая стойка с набором инструментов Aesculap (B| Braun; Германия). Операционная бригада включала хирурга, 2 ассистентов. После укладки больного на спину с приподнятым головным концом на 20–25 градусов и поворотом на правый бок на 25–30 градусов выполнялась интубация желудка толстым зондом диаметром 18–20 мм. Троакары устанавливались следующим образом: 12 мм порт над пупком по средней линии живота, нагнеталось давление в брюшной полости до 10 мм рт. ст. и осуществлялась ревизия брюшной полости оптической трубкой с боковой оптикой; 12 мм порты — по средней ключичной линии справа и по средней подмышечной линии справа в мезогастрии для основных манипуляционных инструментов и зажима Бебкокка; 5 мм порты — под мечевидным отростком для тракции печени, на 2–3 см ниже реберной дуги по среднеключичной линии слева для диссектора, аспиратора-ирригатора и иглодержателя. Осуществлялось низведение содержимого грыжевого мешка в брюшную полость; мобилизация абдоминального отдела пищевода, кардии и дна желудка без пересечения коротких желудочных сосудов, передняя или задняя крурорафия до диаметра пищевода нитью Vi-Lok 2–0 (Ковиденс Ллс, США), формирование манжеты из передней и задней стенок дна желудка вокруг абдоминального отдела пищевода высотой 30–40 мм по Nissen или из передней стенки дна желудка вокруг абдоминального отдела пищевода по Dor. Ранее установленный назогастральный зонд заменялся на более тонкий (диаметром 8–10 см)2.
Операции по поводу грыж пищеводного отверстия диафрагмы методом академика А.Ф. Черноусова выполнены в стерилизованной операционной. Операционная бригада включала хирурга, 2 ассистентов. Больной располагался на спине на операционном столе Mindray UniBase 30 (Mindray, Китай) с выдвижным валиком высотой 10 см, нижняя граница которого располагалась в проекции мечевидного отростка. Под многокомпонентным интубационным наркозом выполнялись назогастральная интубация зондом 18–20 мм, срединная лапаротомия от мечевидного отростка с обходом пупка слева, установка ретрактора реберных дуг Сигала (ООО «МИЗ-Тумботино», Россия). После ревизии брюшной полости осуществлялись: не полная селективная проксимальная ваготомия (СПВ); для исключения натяжения легирование 1 короткого желудочного сосуда; гофрирование кардии 3 швами нитью Prolene 2–0 (Ethicon, США); дозированная гастроэзофагофундорафия с погружением 3 предыдущих швов и модифицированной фундопликацией методом академика А.Ф. Черноусова; формирование пищеводного отверстия диафрагмы адекватным параметрам манжеты [12].
Реконструктивные вмешательства по поводу осложнений хирургического лечения грыж пищеводного отверстия диафрагмы выполнены в стерилизованной операционной. Операционная бригада включала хирурга, 2 ассистентов. Больной располагался на спине на операционном столе Mindray UniBase 30 (Mindray, Китай) с выдвижным валиком высотой 10 см, нижняя граница которого располагалась в проекции мечевидного отростка. Под многокомпонентным интубационным наркозом выполнялись назогастральная интубация зондом 18–20 мм, срединная лапаротомия от мечевидного отростка с обходом пупка слева, установка ретрактора реберных дуг Сигала (ООО «МИЗ-Тумботино», Россия). После ревизии брюшной полости осуществлялись последовательно: неполная селективная проксимальная ваготомия, устранение крурорафии; снятие фундопликационной манжеты; гофрирование кардии 3 швами Prolene 2–0 (Ethicon, США); дозированная гастроэзофагофундорафия с погружением 3 предыдущих швов и модифицированной фундопликацией методом академика А.Ф. Черноусова; формирование пищеводного отверстия диафрагмы адекватным параметрам манжеты.
Исходы исследования
Основной исход исследования
Определение основных осложнений хирургического лечения грыж пищеводного отверстия диафрагмы методами Nissen, Dor и академика А.Ф. Черноусова, их частоты и разработка тактики их устранения.
Дополнительные исходы исследования
Дополнительные исходы исследования не запланированы.
Анализ в подгруппах
В анализ исследования включены 78 пациентов. Этим пациентам были выполнены хирургические вмешательства по поводу грыж пищеводного отверстия диафрагмы и осложнений их хирургического лечения. Все пациенты, вошедшие в исследование, были распределены на 3 группы: в первых двух группах выполнялись первичные оперативные вмешательства (группа 1 — по Nissen (29) и по Dor (2) с крурорафией, n = 31; группа 2 — фундопликация по методу академика А.Ф. Черноусова, n = 35; группа 3 — повторные вмешательства по поводу осложнений хирургического лечения ГПОД, которые осуществлялись оригинальным методом, n = 12).
Проведен сравнительный анализ полученных результатов лечения в трех группах.
Методы регистрации исходов
Результаты хирургического лечения оценивались методом анкетирования. Для определения наличия и выраженности дисфагии использовалась шкала Dakkak, которая представлена 9 блюдами различной консистенции (от воды до стейка из говядины), которым соответствуют баллы от 1 до 9. Каждому виду пищи выставляется коэффициент в зависимости от выраженности дисфагии: 1 — постоянное затруднение проглатывания, 0,5 — периодическое и 0 — отсутствие дисфагии [13]. Опросник Gastro Esophageal Reflux Disease (GERD) состоит из 6 вопросов, составленных на основании симптомов гастроэзофагеальной рефлюксной болезни (ГЭРБ). По каждому из вопросов производится оценка частоты проявлений от 0 до 3 баллов. При сумме баллов 8 и более подтверждался диагноз ГЭРБ. Отдельно по 2 последним устанавливалась необходимость употребления антацидных препаратов. Наличие или отсутствие болевого синдрома определялись по результатам 3 вопроса [14][15].
Результат состояния пациента признавался неудовлетворительным (0 баллов) при 2 осложнениях: при тяжелой дисфагии, при гастроэзофагеальном рефлюксе, проявления которого не купируются антацидными и антисекреторными препаратами; удовлетворительным (1 балл) при наличии одного из следующих осложнений: дисфагия средней степени тяжести или гастроэзофагеальный рефлюкс, проявления которого купируются антисекреторными или антацидными препаратами; хорошим (2 балла) — при легкой дисфагии или гастроэзофагеальном рефлюксе, не требующем медикаментозной коррекции, или периодически появляющемся болевом синдроме; отличным (3 балла) — при отсутствии осложнений.
Статистический анализ
Принципы расчета размеров выборки
Предварительного расчета размеров выборки не производилось.
Методы статистического анализа данных
Статистическая обработка данных осуществлялась в программе Microsoft Excel 2019 (Microsoft, США). Проведены вычисления среднего арифметического (М), стандартного отклонения (SD) для тех характеристик, у которых распределение числовых значений вариантов соответствовало нормальному закону распределения. Центр распределения для таких параметров представляли в виде М ± SD. Анализ распределения количественных исходных данных на вид распределения проводили согласно критерию Шапиро—Уилка или Колмогорова—Смирнова. Сравнение средних значений между всеми группами осуществляли параметрическими методами, а именно с помощью дисперсионного однофакторного анализа, применяя F-критерий Фишера. Сравнение средних значений между двумя группами делали, используя t-критерий Стьюдента для независимых выборок. Если же варианты характеристик пациентов в группах были представлены порядковыми числами или количественными вариантами, у которых распределение не соответствовало нормальному закону (по критерию Шапиро — Уилка или Колмогорова — Смирнова), то центр распределения для таких параметров представляли в виде медианы (Ме), а размах изменений распределения вариантов представляли процентилями (25 и 75 %) в виде: Ме (25 %; 75 %). Сравнения медиан между всеми группами осуществляли непараметрическими методами, а именно с помощью рангового однофакторного анализа, применяя критерий Краскела — Уоллиса. Сравнение значений медиан между двумя группами делали, используя U-критерий Манна — Уитни для независимых выборок. Для анализа и сравнения качественных характеристик использовали значения доли в группе, а при сравнении долей применяли кросстабуляцию типов КхК или RхC, опираясь на критерий хи-квадрат Пирсона. Статистически значимым считали уровень значимости, для которого р ≤ 0,05.
РЕЗУЛЬТАТЫ
Участники исследования
Отобрано для обследования 92 пациента, перенесших операции по поводу грыж пищеводного отверстия диафрагмы или осложнений их лечения. В исследование включены 78 человек, из которых 14 отказались от анкетирования, 2 больных оперированы экстренно по поводу выраженного болевого синдрома и тяжелой дисфагии, причиной чего явилось ущемление фундопликационной манжеты в суженном пищеводном отверстии диафрагмы (выполнено низведение пищевода с фундопликационной манжетой в брюшную полость и дополнительное сужение пищеводного отверстия диафрагмы (ПОД) крурорафией).
В зависимости от характера вмешательства были образованы три группы больных путем их стратификации. Первую группу составил 31 пациент, перенесший оперативные вмешательства по поводу грыж пищеводного отверстия диафрагмы. Всем осуществлялось сужение пищеводного отверстия диафрагмы крурорафией, в 2 случаях дополненное аллопластикой. 29 больным формировалась фундопликационная манжета по Nissen, 2 — по Dor. Во вторую группу включены 35 пациентов, которым выполнялась неполная СПВ с фундопликацией методом А.Ф. Черноусова. 12 пациентам, составившим третью группу, выполнены реконструктивные вмешательства по поводу осложнений хирургического лечения грыжи пищеводного отверстия диафрагмы. Все 12 больных оперированы в плановом порядке по поводу рецидива гатроэзофагеального рефлюкса с болевым синдромом и легкой дисфагией. Объем вмешательств заключался в устранении крурорафии, неполной селективной проксимальной ваготомии с рефундопликацией модифицированным методом А.Ф. Черноусова и формировании пищеводного отверстия диафрагмы, адекватного параметрам манжеты. Одному больному вмешательство дополнено пилоропластикой. Блок-схема дизайна исследования представлена на рисунке 1.
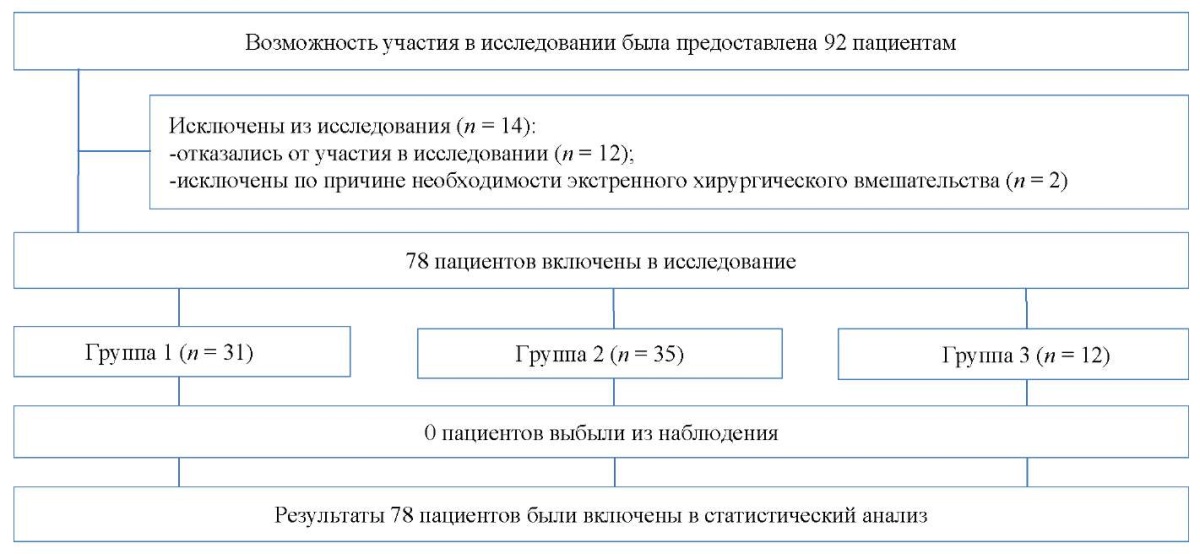
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами (согласно рекомендациям TREND).
Fig. 1. Schematic diagram of the research design
Note: performed by the authors (according to TREND recommendations)
Для установления однородности выборок сравниваемых групп анализировали следующие показатели: половой состав групп, возраст, ИМТ. Первую группу составили 10 мужчин и 21 женщина в возрасте от 20 лет до 71 года, перенесшие оперативные вмешательства по поводу грыж пищеводного отверстия диафрагмы и согласившихся на анкетирование. Во вторую группу включены пациенты в возрасте от 41 года до 89 лет, 13 мужчин и 22 женщины. Третью группу образовали 1 мужчина и 11 женщин в возрасте 43–77 лет.
Проводили сравнение долей мужчин и женщин во всех группах с использованием кросс-табуляции типа RхC. Статистически значимого различия в долях мужчин и женщин по группах не выявлено, так как p = 0,387, что больше уровня p = 0,05. Группы по характеристике пола были одинаковыми (табл. 1).
Таблица 1. Значения некоторых характеристик сравниваемых групп пациентов
Table 1. Values of some characteristics of the compared groups of patients
|
Характеристики |
Группа 1 (сравнения) n = 31 |
Группа 2 (основная) n = 35 |
Группа 3 (реконструктивные вмешательства) n = 12 |
Уровень значимости, р |
|
Пол (муж/жен) |
10/21 |
13/22 |
1/11 |
0,387 |
|
Возраст, М ± SD, лет |
54,6 ± 11,6 |
59,2 ± 11,1 |
54,9 ± 9,3 |
0,407 |
|
ИМТ, М ± SD, у. е. |
27,8 ± 4,5 |
26,9 ± 4,7 |
28,7 ± 4,7 |
0,962 |
Примечание: таблица составлена авторами. Сокращение: ИМТ — индекс массы тела.
Note: compiled by the authors. Abbreviations: ИМТ — body mass index.
Проводя описательную статистику количественных характеристик возраста и индекса массы тела (ИМТ), с помощью критерия Колмогорова — Смирнова установили, что числовые распределения этих характеристик соответствуют нормальному распределению. Это позволило провести сравнение средних величин для групп исследования параметрическим методом дисперсионного анализа. По критерию Фишера для средних значений возраста p = 0,407, что говорит об одинаковости возрастной характеристики в группах. Аналогично по критерию Фишера для средних значений ИМТ p = 0,962, что также говорит об одинаковости характеристики индекса массы тела в группах (табл. 1). Исходя из вышесказанного, можно считать, что сравниваемые группы больных были одинаковыми по полу, возрасту и значению ИМТ.
Основные результаты исследования
В первой группе, в группе сравнения, где использовались традиционная тактика и методы, отличных результатов, оценивающих состояния пациента, не было. Получены такие результаты: 6 хороших, 7 удовлетворительных и 18 неудовлетворительных.
Согласно опроснику GERD, который помогает в диагнозе «гастроэзофагеальная рефлюксная болезнь» и шкала которого измеряется в баллах, описательная статистика проводилась в виде медианы и процентилей [12]. В группе 1 медиана была равна 8 (3; 9), в группе 2–4 (2; 5), в группе 3–4 (3; 6). По критерию Краскела — Уоллиса отличия статистически значимы, p = 0,013 (табл. 2). Попарное сравнение по критерию Манна — Уитни выявило значимое различие значений медиан между группами 1 и 2, а также между группами 1 и 3 (p < 0,05), но нет различия между группами 2 и 3 (p > 0,05). По шкале GERD для группы 1 в 15 (48,4 %) случаях констатирован периодически появляющийся болевой синдром, в 17 (54,8 %) — рецидив гастроэзофагеального рефлюкса, в 12 (38,7 %) — требующий медикаментозного лечения. Необходимо учитывать сочетание указанных фактов наблюдения.
Таблица 2. Значения некоторых итоговых показателей (Ме (25; 75 %)
и долей с итоговыми оценками состояния пациента для сравниваемых групп пациентов
Table 2. Summary measures (Me (25; 75 %)
and shares in patient outcome scores for the compared groups
|
Показатели |
Группа 1 (сравнения) n = 31 |
Группа 2 (основная) n = 35 |
Группа 3 (реконструктивные вмешательства) n = 12 |
Уровень значимости, р |
|
Шкала Dakkak, баллов |
17 (0; 36) |
0 (0; 1) |
0 (0; 0) |
<0,001* |
|
Шкала GERD, баллов |
8 (3; 9) |
4 (2; 5) |
4 (3; 6) |
0,013* |
|
Болевой синдром, баллов |
0 (0; 2) |
0 (0; 1) |
0 (0; 0) |
0,024* |
|
Результат состояния пациента, баллов |
0 (0; 1) |
3 (3; 3) |
3 (3; 3) |
<0,001* |
|
Доля пациентов (отлично) |
0,0 % |
77,1 % |
83,3 % |
<0,001^ |
|
Доля пациентов (хорошо) |
19,4 % |
22,9 % |
16,7 % |
0,882^ |
|
Доля пациентов (удов.) |
22,6 % |
0,0 % |
0,0 % |
0,003^ |
|
Доля пациентов (неудов.) |
58,0 % |
0,0 % |
0,0 % |
<0,001^ |
Примечания: таблица составлена аdторами;
* — по критерию Краскела — Уоллиса; ^ — по критерию хи-квадрат.
Сокращение: GERD — Gastro Esophageal Reflux Disease.
Notes: compiled by the authors;
* — by Kruskal—Wallis test; ^ — by Chi-square test.
Abbreviations: GERD — Gastro Esophageal Reflux Disease.
Применяли модифицированную шкалу Dakkak, которая давала возможность по объему и виду пищи, проглатываемой за определенное время, с помощью присвоения баллов оценить наличие и степень выраженности дисфагии [11]. Выборка значений баллов представлена порядковыми числами, поэтому описательно значение медианы с процентилями в группе 1 было равно 17 (0; 36), в группе 2–0 (0; 1), в группе 3–0 (0; 0). Различие медиан в группах по критерию Краскела — Уоллиса статистически значимо (табл. 2). Попарное сравнение по критерию Манна — Уитни выявило значимое различие значений медиан между группами 1 и 2, а также между группами 1 и 3 (p < 0,05), но нет различия между группами 2 и 3 (p > 0,05). Шкала Dakkak показала, что для группы 1 в 19 (61,3 %) случаях выявлена дисфагия (легкой степени — 5, средней — 12, тяжелой — 2). Причем по Dor во всех случаях получен рецидив гастроэзофагеального рефлюкса, а у 1 пациента — эпизодически возникающий болевой синдром. У двух пациентов, перенесших фундопликации по Nissen с крурорафией и аллопластикой, получены рецидив гастроэзофагеального рефлюкса с дисфагией средней степени и болевым синдромом.
В группе больных, первично оперированных по поводу грыж пищеводного отверстия диафрагмы методом неполной СПВ с фундоплликацией по А.Ф. Черноусову, получены отличные 27 (77,1 %) и хорошие 8 (22,9 %) результаты, оценивающие состояние пациента после лечения (табл. 2). У 1 пациента выявлена дисфагия легкой степени, у 6 больных — периодически появляющийся болевой синдром, не требующий купирования спазмолитическими и анальгетическими препаратами. Один пациент отметил периодически появляющийся рефлюкс, не требующий медикаментозной коррекции. При эндоскопическом и рентгенологическом исследованиях подтверждений последнему не установлено. Всем пациентам выполнено эндоскопическое исследование, констатировано отсутствие зияния кардии и эзофагита. Контрастной рентгеноскопией у всех пациентов установлен факт нахождения манжеты в заднем средостении, выше уровня диафрагмы, с сохраненными антирефлюксными свойствами и порционное поступление контраста через не суженный дистальный сегмент пищевода.
В группе реконструктивных вмешательств у 2-х больных (не включенных в статистическую обработку данных), перенесших фундопликации по Nissen с крурорафией и экстренно оперированных в ночное время по поводу ущемления фундопликационной манжеты в ПОД, выполнено низведение манжеты в брюшную полость и дополнительная крурорафия. Результаты получены крайне неудовлетворительные: болевой синдром рецидивировал через несколько часов после операции, у 1 больного сопровождался тяжелой дисфагией. У остальных 12 пациентов получены хорошие 2 (16,7 %) и отличные 10 (83,3 %) результаты, 1 пациент предъявлял жалобы на легкую дисфагию и 1 — на эпизодический рефлюкс (табл. 2).
Результат состояния пациента в виде медианы с процентилями в группе 1 был равен 0 (0; 1), в группе 2–3 (3; 3), в группе 3–3 (3; 3). Различие медиан в группах по критерию Краскела — Уоллиса статистически значимо (табл. 2). Попарное сравнение по критерию Манна — Уитни выявило значимое различие значений медиан между группами 1 и 2, а также между группами 1 и 3 (p < 0,05), но нет различия между группами 2 и 3 (p > 0,05).
Сравнение долей пациентов в группе между группами с оценкой «хорошо» не выявило значимого различия (p = 0,882). Сравнение же долей пациентов с другими оценками показало значимость различий, что характеризует высокую эффективность методов вмешательств для групп 2 и 3 по сравнению с группой 1.
Для правильной интерпретации результатов операций по поводу осложнений хирургического лечения грыж пищеводного отверстия диафрагмы целесообразно остановиться на основных этапах. Вмешательства выполнялись открытым способом из срединного лапаротомного доступа. Абдоминальный отдел пищевода с манжетой низводились в брюшную полость (рис. 2 А). Устранялась крурорафия для последующего формирования пищеводного отверстия диафрагмы адекватным параметрам фундопликационной манжеты (рис. 2 Б). Для полноценной коррекции жомно-клапанной функции кардии осуществлялось снятие предыдущей манжеты (рис. 2 В) и визуализация пищеводно-желудочного перехода (рис. 2 Г).
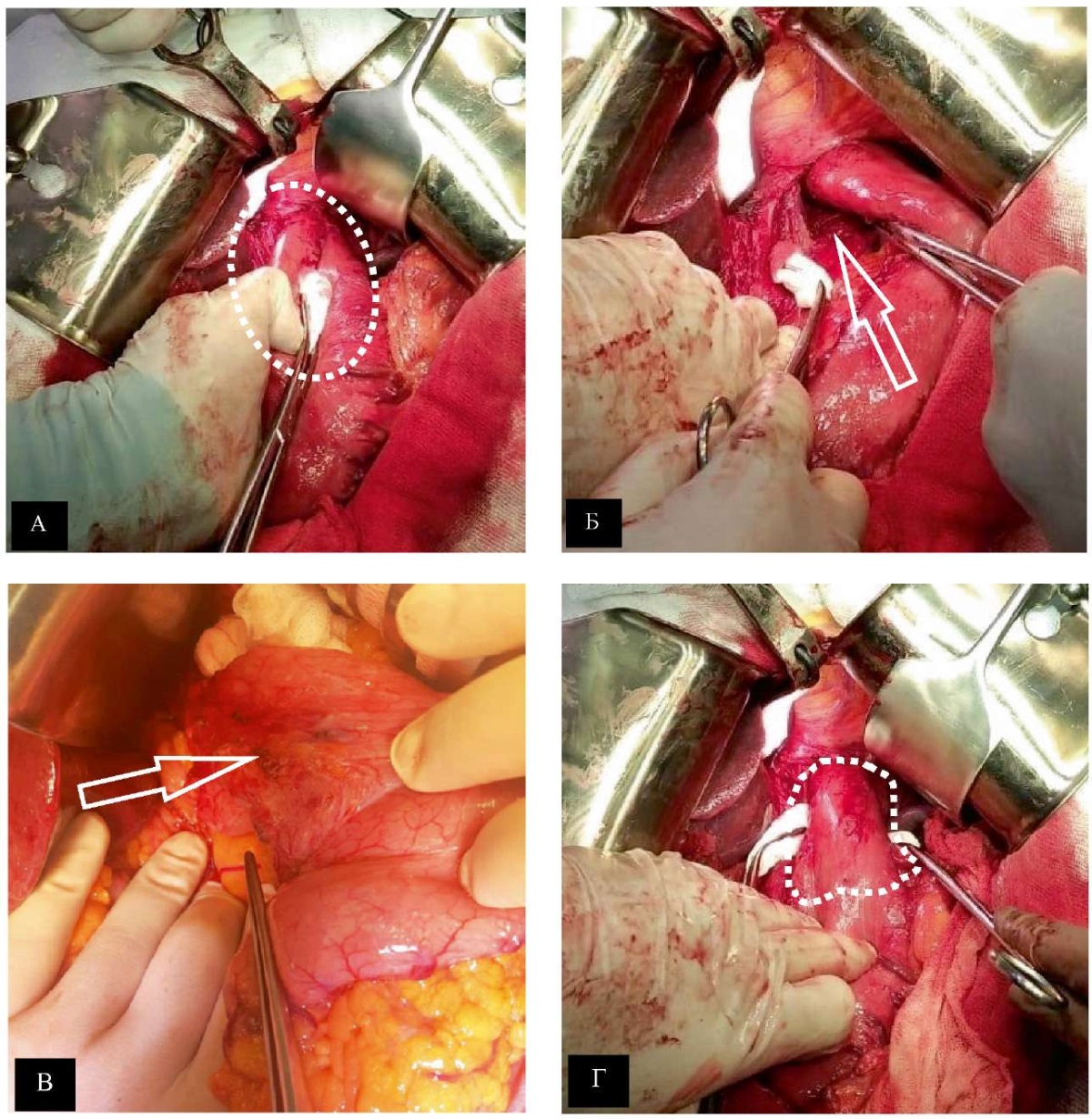
Рис. 2. Интраоперационные фотографии
подготовительного этапа реконструктивного вмешательства:
А — низведение пищевода с фундопликационной манжетой
в брюшную полость (отмечено фигурой);
Б — устранение крурорафии (отмечено стрелкой);
В — снятие фундопликационной манжеты (отмечено стрелкой);
Г — расширенная кардия (отмечено фигурой)
Примечание: фотографии выполнены авторами.
Fig. 2. Intraoperative photographs of the preparatory stage of reconstructive intervention:
A — pulling through the esophagus with the fundoplication cuff
into the abdominal cavity (figure);
Б — elimination of crurorrhaphia (arrow);
C — removal of the fundoplication cuff (arrow);
В — extended cardia (figure)
Note: photos taken by the authors.
С целью исключения натяжения неполная селективная проксимальная ваготомия выполнялась в объеме мобилизации абдоминального отдела пищевода, дна и проксимальных 3-х см малой кривизны желудка (рис. 3 Б) с легированием задней восходящей артерии (рис. 3 А), при необходимости (для обеспечения дополнительной подвижности дна желудка) возможно пересечение одной короткой верхней желудочной артерии.
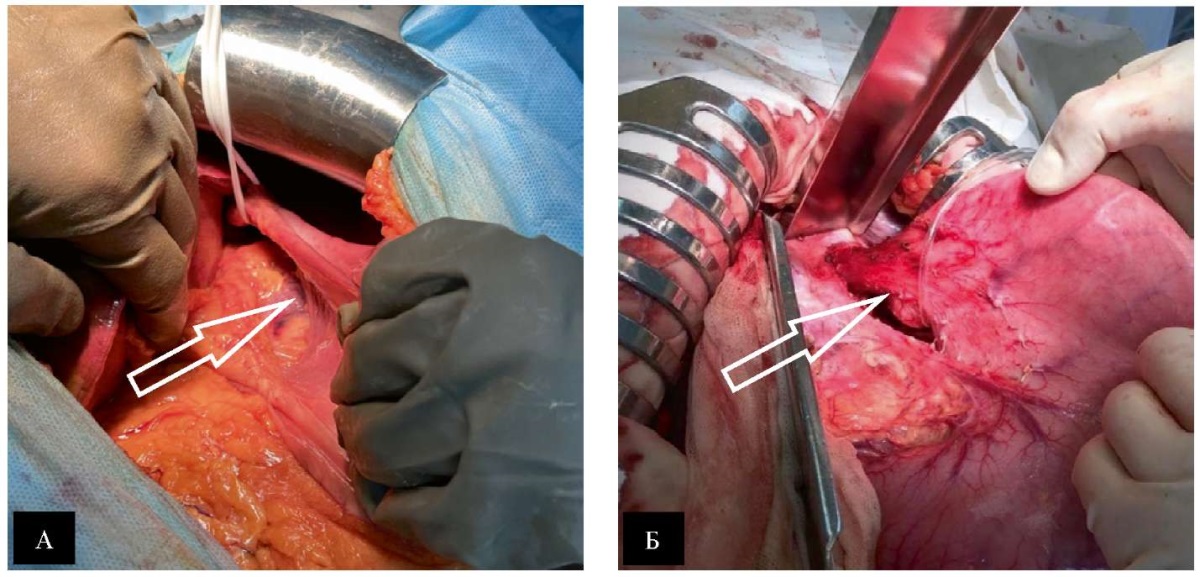
Рис. 3. Интраоперационные фотографии неполной селективной проксимальной ваготомии:
А — задняя восходящая артерия (отмечено стрелкой);
Б — окончательный вид неполной селективной проксимальной ваготомии
(отмечено стрелкой)
Примечание: фотографии выполнены авторами.
Fig. 3. Intraoperative photos of incomplete selective proximal vagotomy:
A — posterior ascending artery (arrow);
Б — final form of incomplete selective proximal vagotomy (arrow)
Note: photos taken by the authors.
На переднюю и заднюю стенки желудка с захватом малой кривизны напротив угла Гиса накладывались 3 гофрирующих шва нитью Prolene 2–0 (рис. 4 А). Они последовательно затягивались, чем достигалось сужение просвета кардии до диаметра желудочного зонда (18–20 мм). Перитонизация малой кривизны осуществлялась непрерывным гофрирующим швом из аналогичного материала с погружением 3 предыдущих и дополнительным гофрированием кардии (рис. 4 Б). Формирование фундопликационной манжеты (рис. 4 В) высотой 35–40 мм достигалось 3–4 узловыми швами с захватом правой боковой стенки пищевода и дополнительной ее фиксацией к передней и задней стенкам последнего двумя узловыми швами. Сужение пищеводного отверстия диафрагмы передней или задней крурорафией не исключается, но диаметр последнего должен быть адекватен размерам фундопликационной манжеты (рис. 4 В).
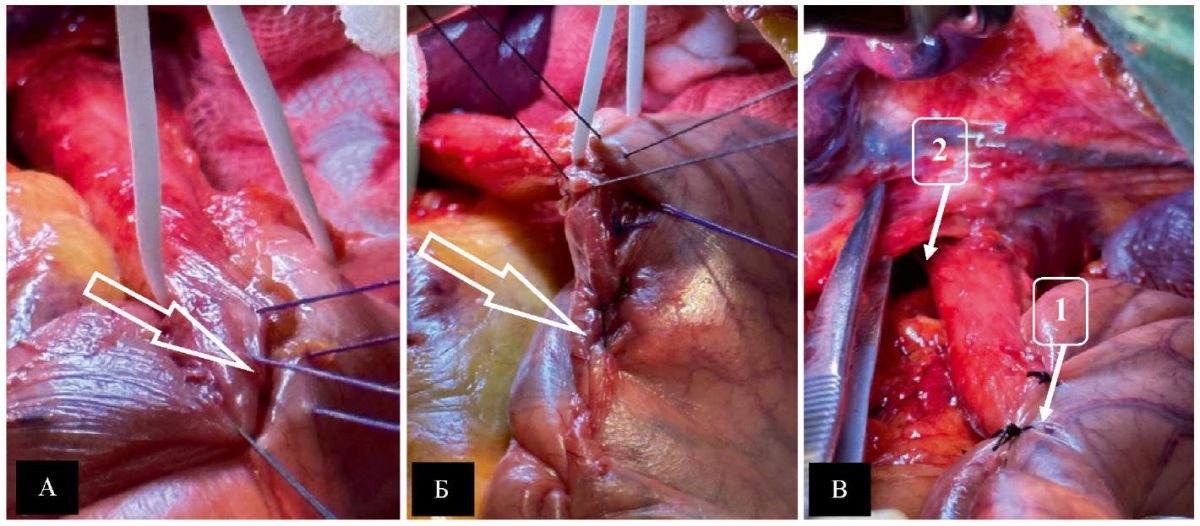
Рис. 4. Интраоперационные фотографии формирования
модифицированной фундапликационной манжеты методом академика А. Ф. Черноусова:
А — гофрирование кардии (отмечено стрелкой);
Б — перитонизация малой кривизны (отмечено стрелкой);
В — сформированная фундопликационная манжета (1)
с пищеводным отверстием диафрагмы, адекватным ее параметрам (2)
Примечание: фотографии выполнены авторами.
Fig. 4. Intraoperative photos of the modified cuff formation according to Chernousov:
A — cardiac corrugation (arrow);
Б — peritonization of lesser curvature (arrow);
В — formed fundoplication cuff (1)
with an esophageal hiatus adequate to its parameters (2)
Note: photos taken by the authors.
Дополнительные результаты исследования
Не получены.
Нежелательные явления
В ходе проведения операций и последующих наблюдений не выявлены.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Основные осложнения хирургического лечения грыж пищеводного отверстия диафрагмы — это дисфагия, болевой синдром и рецидив гастроэзофагеального рефлюкса, частота которых при формировании манжет из дна желудка вокруг абдоминального сегмента пищевода по Nissen и Dor сопоставима с результатами многоцентровых рандомизированных исследований. Оптимальной для коррекции жомно-клапанной функции кардии является фундопликация методом академика А.Ф. Черноусова. Реконструктивные вмешательства по поводу осложнений хирургического лечения грыж пищеводного отверстия диафрагмы должны включать следующие этапы: неполная селективная проксимальная ваготомия, устранение крурорафии, снятие манжеты, гофрирование кардии и рефундопликация методом академика А.Ф. Черноусова, формирование пищеводного отверстия диафрагмы адекватным параметрам манжеты.
Обсуждение основного результата исследования
Полученные результаты лечения ГПОД традиционной тактикой и методами мало отличаются от данных многоцентровых рандомизированных исследований [16–18].
Результаты антропометрических и гистологических исследований позволяют констатировать, что размеры абдоминального отдела пищевода имеют половую и конституциональную зависимость, что не учитывается при формировании стандартных фундопликационных манжет высотой 40 мм [18][19]. При хирургическом лечении грыж пищеводного отверстия диафрагмы зачастую упускается факт разрушения связочного аппарата пищевода и возможность его патологического укорочения, что делает невозможной интраоперационную оценку истинных (нормальных) параметров пищевода, особенно его абдоминального отдела. Чрезмерное сужение пищеводного отверстия диафрагмы ставит последний в заведомо невыгодное функциональное положение и ограничивает его продольную (глотательную) экскурсию [20]. Фундопликационная манжета будет закономерно стремиться переместиться выше уровня диафрагмы, что при сужении hiatus esophageus приведет к ее ущемлению или разрушению в нем, то есть к болевому синдрому и дисфагии [18].
Гистологическими исследованиями сфинктерных структур в абдоминальном сегменте пищевода не обнаружено. Есть незначительное утолщение циркулярного слоя мышечной оболочки в 5 мм над пищеводно-желудочным переходом. Максимальные показатели толщины циркулярного слоя отмечены в кардиальном отделе желудка на протяжении 5 мм (1,026 ± 0,170 мм) от пищеводно-желудочного перехода со снижением показателей в дистальном направлении. Полученные результаты ставят под сомнение возможность улучшения жомной функции «нижнего пищеводного сфинктера» за счет формирования любой манжеты из дна желудка (полной, неполной) вокруг абдоминального сегмента пищевода [21]. На основании чего можно заключить, что все традиционные фундопликационные манжеты направлены на исправление клапанной функции пищеводно-желудочного перехода за счет формирования острого угла Гиса и восстановления газового пузыря дна желудка [18].
Отсутствие гастроэзофагеального рефлюкса в группе оперированных методом академика А.Ф. Черноусова подтверждает правомочность выдвинутой нами гипотезы, заключающейся в возможности коррекции жомной функции кардии путем ее гофрирования [22]. Профилактика болевого синдрома и дисфагии заключается в формировании пищеводного отверстия диафрагмы адекватным параметрам манжеты.
Полученные отличные и хорошие результаты в этой группе вызывают дополнительные вопросы к термину «рецидив рефлюкс-эзофагита». Вероятнее всего, это не что иное как неадекватно выполненная коррекция жомно-клапанной функции пищеводно-желудочного перехода с неустраненным зиянием кардии в ходе первичного оперативного вмешательства. Аналогичные сомнения вызывает термин «рецидив грыжи» у больных с рентгенологически подтвержденным фактом нахождения манжеты в заднем средостении и клиническими проявлениями рефлюкса [20].
Таким образом, традиционная тактика для реконструктивных вмешательств по поводу осложнений хирургического лечения грыж пищеводного отверстия диафрагмы неприемлема, так как одно, вызвавшее осложнение, переделывается в то же самое. Если причиной дисфагии и болевого синдрома является невозможность свободной миграции манжеты через суженное пищеводное отверстие диафрагмы или ее сдавление в нем — необходимо устранить крурорафию. При сдавлении пищевода самой манжетой (что называется «гиперфункция манжеты»), при ее разрушении, а также при неустраненном гастроэзофагеальном рефлюксе необходима рефундопликация. Наилучшим вариантом вмешательства для этого является неполная СПВ с гофрированием кардии, последовательной гастроэзофагофундорафей и фундопликацией по А.Ф. Черноусову. В качестве заключительного этапа вмешательства рекомендуется формирование пищеводного отверстия диафрагмы, адекватного параметрам манжеты, не препятствующего ее свободной миграции в заднее средостение.
Техническая сложность, непредсказуемость объема повторных операций по поводу осложнений хирургического лечения грыж пищеводного отверстия диафрагмы делают целесообразным их выполнение из срединного лапаротомного доступа [20]. Одним из основных требований успешного выполнения любой операции в открытой абдоминальной хирургии является достаточный обзор операционного поля, который зависит от параметров раны и ее освещенности. Ретрактор со светодиодным осветителем на рабочей части должен сочетать функциональность, эргономичность и эстетичный вид, не громоздкий, иметь антибликовую поверхность, что исключает зрительный дискомфорт, обеспечивать широкую площадь оптимального освещения [23].
Ограничения исследования
Не обнаружено.
ЗАКЛЮЧЕНИЕ
Традиционная тактика и методы хирургического лечения ГПОД (крурорафия с фундопликацией по Nissen, Dor) сопровождаются следующими основными осложнениями: рецидив гастроэзофагеального рефлюкса, болевой синдром, дисфагия. Для лечения грыж пищеводного отверстия диафрагмы оптимальной является неполная селективная проксимальная ваготомия с фундопликацией по методу А.Ф. Черноусова, так как позволяет выполнить адекватную коррекцию жомно-клапанной функции пищеводно-желудочного перехода и кардии при гастроэзофагеальной рефлюксной болезни. Для профилактики болевого синдрома и дисфагии пищеводное отверстие диафрагмы следует формировать соответствующим параметрам фундопликационной манжеты. Традиционная тактика и методы для устранения осложнений хирургического лечения грыж пищеводного отверстия диафрагмы неприемлемы. Реконструктивные вмешательства следует составлять из следующих этапов: устранение крурорафии; снятие манжеты; неполная селективная проксимальная ваготомия; рефундопликация модифицированным методом академика А.Ф. Черноусова; формирование пищеводного отверстия диафрагмы адекватным параметрам фундопликационной манжеты.
1. Совпель И.В., Золотухин С.Э., Совпель О.В., Делегойдина А.В., Шумило И.О. Повторные оперативные вмешательства после лапароскопической пластики грыж пищеводного отверстия диафрагмы. Новообразование (Neoplasm).2023;15 (1):23–31.
2. Оскретков В.И., Ганков В.А., Климов А.Г., Гурьянов А.А., Федоров В.В., Казарян В.М. Видеоэндоскопическая хирургия пищевода. Под ред. Оскреткова В.И. Аз Бука. 2004. 159 с.
Список литературы
1. Ахматов А.М., Тарбаев И.С., Василевский Д.И. История развития хирургии грыж пищеводного отверстия диафрагмы. Педиатр. 2018;9(3):77–80. https://doi.org/10.17816/PED9377-80
2. Воеводина А.А. Обзор потенциальных интраоперационных осложнений лапароскопической фундопликации у пациентов с ГЭРБ и ГПОД. Международный научно-исследовательский журнал. 2021;1-3(103):10–14. https://doi.org/10.23670/IRJ.2021.103.1.055
3. Koetje JH, Oor JE, Roks DJ, Van Westreenen HL, Hazebroek EJ, Nieuwenhuijs VB. Equal patient satisfaction, quality of life and objective recurrence rate after laparoscopic hiatal hernia repair with and without mesh. Surg Endosc. 2017;31(9):3673–3680. https://doi.org/10.1007/s00464-016-5405-9
4. Tam V, Winger DG, Nason KS. A systematic review and meta-analysis of mesh vs suture cruroplasty in laparoscopic large hiatal hernia repair. Am J Surg. 2016;211(1):226–238. https://doi.org/10.1016/j.amjsurg.2015.07.007
5. Черкасов Д.М., Черкасов М.Ф., Татьянченко В.К., Старцев Ю.М., Меликова С.Г., Галашокян К.М. Дифференцированный подход к выбору пластики грыж пищеводного отверстия диафрагмы. Эндоскопическая хирургия. 2020;26(1):5–12. https://doi.org/10.17116/endoskop2020260115
6. Розенфельд И.И. Пластика больших и гигантских грыж пищеводного отверстия диафрагмы с использованием полипропиленовых сетчатых имплантатов. Современная наука: актуальные проблемы теории и практики. Серия: Естественные и Технические Науки. 2020;8:194–200. https://doi.org/10.37882/2223-2966.2020.08.26
7. Rerych K, Kurek J, Klimacka-Nawrot E, Błońska-Fajfrowska B, Stadnicki A. High-resolution Manometry in Patients with Gastroesophageal Reflux Disease Before and After Fundoplication. J Neurogastroenterol Motil. 2017;23(1):55–63. https://doi.org/10.5056/jnm16062
8. Смирнов А.А., Кирильцева М.М., Бураков А.Н., Любченко М.Е., Василевский Д.И., Семенихин К.Д., Багненко С.Ф. Aнализ спектра нарушений моторики пищевода у больных ГЭРБ при проведении манометрии пищевода высокого разрешения. Данные одноцентрового проспективного исследования. Экспериментальная и клиническая гастроэнтерология. 2018;158(10):22–26. https://doi.org/10.31146/1682-8658-ecg-158-10-22-26
9. Топаков Е.В., Ооржак О.В., Загорская А.И., Шухова Е.А., Шост С.Ю., Марцияш А.А., Мозес В.Г., Шапкин А.А., Сашко А.А. Опыт лечения грыж пищеводного отверстия диафрагмы. Медицина в Кузбассе. 2020;2:57–62. https://doi.org/10.24411/2687-0053-2020-10019
10. Ерин С.А., Гололобов Г.Ю., Юркулиев Н.А., Чичерина М.А., Бурмистров А.И., Гадлевский Г.С., Овчинникова У.Р., Горбачева И.В., Галлямов Э.А. Эвентрация диафрагмы под маской рецидивной параэзофагеальной грыжи пищеводного отверстия диафрагмы. Хирургическая практика. 2022;4:70–76. https://doi.org/10.38181/2223-2427-2022-4-70-76
11. Васнев О.С., Израилов Р.Е., Домрачев С.А., Кошкин М.А., Белоусов А.М., Соловьев Н.О. Повторные антирефлюксные операции с применением роботических систем: обзор литературы. Доказательная гастроэнтерология. 2022;11(2):44–50. https://doi.org/10.17116/dokgastro20221102144
12. Черноусов А.Ф., Хоробрых Т.В., Ветшев Ф.П., Осминин С.В., Короткий В.И., Абдулхаккимов Н.М., Чесарев А.А., Салихов Р. Лечение рефлюкс-эзофагита у больных с кардиофундальными, субтотальными и тотальными грыжами пищевого отверстия диафрагмы. Хирургия. Журнал им. Н.И. Пирогова. 2019;6:41–48. https://doi.org/10.17116/hirurgia201906141
13. Kalkur C, Sattur AP, Guttal KS, Lakshman AR. “Introducing Modified Dakkak and Bennett Grading System for Indian Food in Oral Submucous Fibrosis: A Dharwad Study. J Diet Suppl. 2019;16(2):207–214. https://doi.org/10.1080/19390211.2018.1448922
14. Loo GH, Rajan R, Deva Tata M, Ritza Kosai N. Changes in the disease-specific quality of life following Dor fundoplication. A multicentre cross-sectional study. Ann Med Surg (Lond). 2020;55:252–255. https://doi.org/10.1016/j.amsu.2020.05.018
15. Ионова Т.И., Никитина Т.П., Маевская Е.А., Черемушкина Н.В., Шабуров Р.И., Кучерявый Ю.А., Маев И.В. Разработка русской версии опросника для оценки качества жизни у больных гастроэзофагеальной рефлюксной болезнью — GERD-HRQL. Терапевтический архив. 2020;92(8):12–17. https://doi.org/10.26442/00403660.2020.08.000658
16. Li G, Jiang N, Chendaer N, Hao Y, Zhang W, Peng C. Laparoscopic Nissen Versus Toupet Fundoplication for Short- and Long-Term Treatment of Gastroesophageal Reflux Disease: A Meta-Analysis and Systematic Review. Surg Innov. 2023;30(6):745–757. https://doi.org/10.1177/15533506231165829
17. Комаров Р.Н., Осминин С.В., Билялов И.Р. Хирургия грыж пищеводного отверстия диафрагмы: лапароскопические или робот-ассистированные операции? Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2022;32(1):15–23. https://doi.org/10.22416/1382-4376-2022-32-1-15-23
18. Бурмистров М.В., Бебезов С.И. Результаты повторных эндохирургических операций у пациентов с ахалазией кардии и грыжей пищеводного отверстия диафрагмы. Znanstvena Misel. 2022;69(69):21–27. https://doi.org/10.5281/zenodo.7009140
19. Мирончев А.О., Каган И.И. Компьютерно-томографическая анатомия абдоминального отдела пищевода, грыж пищеводного отверстия диафрагмы и возможности их ранней диагностики. Оперативная хирургия и клиническая анатомия. 2021;5(3):30–37. https://doi.org/10.17116/operhirurg2021503130
20. Гринцов А.Г., Ищенко Р.В., Совпель И.В., Совпель О.В., Балабан В.В. Причины неудовлетворительных результатов после лапароскопических пластик грыж пищеводного отверстия диафрагмы. Исследования и практика в медицине. 2021;8(1):40–52. https://doi.org/10.17709/2409-2231-2021-8-1-4
21. Siboni S, Ferrari D, Riva CG, Sozzi M, Lazzari V, Milani V, Bonavina L. Reference high-resolution manometry values after magnetic sphincter augmentation. Neurogastroenterol Motil. 2021;33(10):e14139. https://doi.org/10.1111/nmo.14139
22. Хоробрых ТВ, Воеводина АА, Ефремов ДА, Короткий ВИ, Хусаинова НР, Элифханова ХУ, Малюгина АЯ, Мартынов ИА. Коррекция гастрокардиального синдрома у больных с грыжами пищеводного отверстия диафрагмы в ходе антирефлюксных операций. Медицинский Совет. 2021;(21-2):62–71. https://doi.org/10.21518/2079-701X-2021-21-2-62-71
23. Колесников С.А., Бежин А.И., Бугаев В.В., Бугаева С.Р., Куница Е.В. Технические инновации в освещении труднодоступных мест грудной и брюшной полостей в «открытой» торакоабдоминальной хирургии. Оперативная хирургия и клиническая анатомия. 2023;7(2):26–36. https://doi.org/10.17116/operhirurg2023702126
Об авторах
С. А. КолесниковРоссия
Колесников Сергей Анатольевич — доктор медицинских наук, профессор кафедры факультетской хирургии медицинского института
ул. Победы, д. 85, г. Белгород, 308015;
ул. Интернациональная, д.70, г. Короча, 309210
В. В. Бугаев
Россия
Бугаев Виталий Валерьевич, соискатель кафедры факультетской хирургии медицинского института; врач приемного отделения
ул. Победы, д. 85, г. Белгород, 308015;
ул. Интернациональная, д.70, г. Короча, 309210
С. Р. Бугаева
Россия
Бугаева София Робертовна — ассистент кафедры факультетской хирургии медицинского института
ул. Победы, д. 85, г. Белгород, 308015
М. В. Ефремов
Россия
Ефремов Михаил Валентинович — заведующий межрайонным отделением судебно-медицинской экспертизы трупов
ул. Волчанская, д. 159, г. Белгород, 308017
В. В. Румбешт
Россия
Румбешт Вадим Валерьевич — кандидат технических наук, доцент, доцент кафедры математического и программного обеспечения информационных систем института инженерных и цифровых технологий
ул. Победы, д. 85, г. Белгород, 308015
Дополнительные файлы
Рецензия
Для цитирования:
Колесников С.А., Бугаев В.В., Бугаева С.Р., Ефремов М.В., Румбешт В.В. Осложнения хирургического лечения грыж пищеводного отверстия диафрагмы и тактика их устранения: обсервационное нерандомизированное исследование. Кубанский научный медицинский вестник. 2024;31(3):30-43. https://doi.org/10.25207/1608-6228-2024-31-3-30-43
For citation:
Kolesnikov S.A., Bugaev V.V., Bugaeva S.R., Efremov M.V., Rumbesht V.V. Complications of surgical treatment of hiatal hernia and tactics of its elimination: An observational non-randomized study. Kuban Scientific Medical Bulletin. 2024;31(3):30-43. (In Russ.) https://doi.org/10.25207/1608-6228-2024-31-3-30-43








































