Перейти к:
Сравнительная оценка эффективности репарации ожоговых ран при применении гидрогелевого материала на основе дермы: доклиническое экспериментальное исследование
https://doi.org/10.25207/1608-6228-2023-30-6-15-27
Аннотация
Введение. Заживление ожоговых ран представляет собой сложный процесс, включающий синергетические взаимодействия между различными клетками, цитокинами и факторами роста, нарушение которых может привести к хронизации процесса. В связи с этим исследование механизмов действия природных раневых покрытий, способных оказывать влияние на процессы воспаления, ангиогенеза и ремоделирования кожи, достаточно актуально.
Цель исследования — провести сравнительную оценку эффективности репарации ожоговых ран при применении гидрогелевого материала на основе дермы по динамике содержания прои противовоспалительных факторов.
Методы. Для создания гидрогелевого материала были использованы образцы дермы поросенка породы Ландрас, которые подвергали частичному щелочному гидролизу. Для сравнительной оценки эффективности репарации ожоговых ран моделировали контактный термический ожог в трех группах крыс породы Сфинкс: группа 1 — крысы без лечения, или контрольная группа (n = 20), группа 2 — крысы с лечением мазью «Левомеколь», или группа сравнения (n = 20), и группа 3 — крысы с лечением гидрогелевым материалом, или опытная группа (n = 20). До и после нанесения ожоговой раны на 1, 3, 7, 14 сутки определяли в сыворотке содержание цитокинов интерлейкина-1β, интерлейкина-4, интерлейкина-6, интерлейкина-8, интерлейкина-10, фактора некроза опухолей-α методом методом иммуноферментного анализа. Через 3, 7 и 14 дней после начала эксперимента эксплантировались образцы из области раны для гистологического исследования. Статистическую обработку полученных результатов по содержанию ДНК в гидрогеле, содержанию цитокинов в сыворотке и морфометрических данных проводили с помощью компьютерных программ Graph Pad Prism version 6.04, Microsoft Excel 2016 (Microsoft, США).
Результаты. При определении динамики содержания неспецифических системных маркеров воспаления на первые сутки после нанесения гидрогеля был отмечен рост концентраций интерлейкина-1β и фактора некроза опухоли α, на третьи и седьмые — уровня интерлейкина-6, концентрации интерлейкина-8 значимо не изменялись на протяжении всего эксперимента, что говорит об участии компонентов дермы в ингибировании острофазных иммунных реакций. В отношении противовоспалительных факторов наблюдалось уменьшение концентрации интерлейкина-10 на первые и седьмые сутки, рост количества интерлейкина-4 на третьи сутки по сравнению с группой без лечения, что может говорить о выраженном противовоспалительном эффекте и пролонгированном действии гидрогелевого материала.
Заключение. В ходе сравнительного анализа уровней провоспалительных цитокинов (интерлейкина-1β, интерлейкина-8) были показаны выраженные противовоспалительные эффекты компонентов гидрогелевого материала на основе дермы. Внесение экзогенных биологических компонентов внеклеточного матрикса — коллагена и его гидролизатов — оказало значительное влияние на регуляцию синтеза противовоспалительных цитокинов, что, вероятно, способствовало оптимизации сроков успешной эпителизации и заживления раны.
Ключевые слова
Для цитирования:
Мелконян К.И., Алексеенко С.Н., Быков И.М. Сравнительная оценка эффективности репарации ожоговых ран при применении гидрогелевого материала на основе дермы: доклиническое экспериментальное исследование. Кубанский научный медицинский вестник. 2023;30(6):15-27. https://doi.org/10.25207/1608-6228-2023-30-6-15-27
For citation:
Melkonyan K.I., Alekseenko S.N., Bykov I.M. Comparative evaluation of efficiency of burn wound healing with derma-based hydrogel: a preclinical experimental study. Kuban Scientific Medical Bulletin. 2023;30(6):15-27. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-6-15-27
ВВЕДЕНИЕ
Ожоги являются одним из самых распространенных видов травм и представляют собой повреждение тканей, вызванное чаще всего термическим, химическим или электрическим воздействием1 [1]. При этом до 80% пострадавших с термической травмой, госпитализируемых в стационар, имеют поверхностные и/или пограничные ожоги [2]. Заживление ожоговых ран представляет собой динамичный, сложный и многоэтапный процесс, включающий синергетические взаимодействия между различными клетками, цитокинами и факторами роста. Нарушение клеточных и молекулярных сигналов на этих стадиях может привести к образованию хронической раны [3]. Уход за ранами включает в себя выбор соответствующих раневых покрытий (повязок) для поддержания благоприятной среды для заживления ран, инфекционного контроля и очистки тканей. Для этого широко используются традиционные повязки, такие как марля и бинт, из-за простоты их производства, низкой стоимости и значительной гигроскопичности, но к недостаткам можно отнести слабость их антимикробного действия, гемостатической способности и механических свойств. Кроме того, в процессе заживления ран традиционные повязки могут вызвать вторичное повреждение из-за прилипания к вновь выросшей грануляционной ткани и вызывать боль при снятии. Кроме того, они не обладают антибактериальными, антиоксидантными или другими биологически эффективными характеристиками [4]. Таким образом, эффективность существующих методов лечения ограничена и сопряжена со значительными затратами. Подход регенеративной медицины стал альтернативой, предоставляющей дополнительные терапевтические возможности для потенциального улучшения заживления ран и восстановления нормальной архитектуры кожи [5]. На сегодня исследовано множество гидрофильных раневых повязок, таких как гидрогели, пленки, нановолокна, гидроколлоиды, ксерогели и гидроволокна, так как они могут адсорбировать метаболиты, образующиеся в поврежденной ткани, эффективно снижать вероятность бактериальной инфекции раны, обеспечивать влажную среду и оказывать влияние на процессы воспаления, ангиогенеза и ремоделирования, что может быть очень полезно для заживления ран [6].
Цель исследования — провести сравнительную оценку эффективности репарации ожоговых ран при применении гидрогелевого материала на основе дермы по динамике содержания про- и противовоспалительных факторов.
МЕТОДЫ
Экспериментальные животные
Исследование проведено на 60 половозрелых самцах крыс породы Сфинкс массой 160–200 г. Животные получены одной партией из питомника декоративных животных «Добрый Крыс» (ИП Русланова М.А.). Донором дермы было 1 животное — поросенок породы Ландрас (самец, возраст 2 месяца, масса 15,8 кг), полученное в учебно-опытном хозяйстве «Кубань» федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный аграрный университет имени И.Т. Трубилина». Все животные прошли карантин на базе учебно-производственного отдела федерального государственного бюджетного образовательного учреждения «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО КубГМУ Минздрава России) продолжительностью не менее 14 дней.
Размещение и содержание
Содержание животных и проведение экспериментов осуществлялось в соответствии с нормативными документами: Приказ Министерства здравоохранения РФ от 1 апреля 2016 г. № 199н «Об утверждении Правил надлежащей лабораторной практики», ГОСТ 33215-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур», Директива 2010/63/EU Европейского парламента и совета Европейского союза по охране животных, «European Convention for the Protection of Vertebrate Animals Used for Experimental and other Scientific Purposes (ETS 123)», Strasbourg, 1986. Кормление осуществлялось в соответствии с суточными нормами (приказ ректора ГБОУ ВПО КубГМУ Минздрава России от 09.07.2015 г. № 527 «О создании комиссии по определению норм кормления лабораторных животных»). Животные содержались в виварном блоке учебно-производственного отдела ФГБОУ ВО КубГМУ Минздрава России в кювезах (индивидуально вентилируемых клетках (ИВК)) «ВЕНТ-БИО-2М» (AWTech/АВТех, Россия) (по 2 особи). Температурный режим в кювезах, независимо от времени года, поддерживался в пределах 21–24 °С. Влажность воздуха поддерживалась на уровне 55–65%. Объемный расход воздуха составлял 60–65 м3/час. Кювезы в стеллажах были расположены со стороны стойки, куда не попадали прямые солнечные лучи. Животные содержались со свободным доступом к воде и пище. Сбалансированный рацион питания состоял из формируемой extempore зерносмеси.
Дизайн исследования
Моделью были крысы с ожоговым дефектом на коже в межлопаточной области. Длительность исследования составила 14 дней, так как полная эпителизация поверхностных дефектов кожи крыс происходит за 11–14 дней [7]. Забор образцов в области раны для гистологического исследования был проведен через 3, 7 и 14 дней после начала эксперимента. Забор крови для получения сыворотки для иммуноферментного анализа осуществлялся через хвостовую вену до и после нанесения ожоговой раны в динамике репарации на 1, 3, 7, 14-е сутки эксперимента. Блок-схема дизайна исследования представлена на рисунке 1.
Объем выборки
Было обследовано 60 половозрелых самцов крыс, соответствующих критериям включения. Крысы были разделены на три группы: группа 1 — крысы без лечения, или контрольная группа (n = 20), группа 2 — крысы с лечением мазью «Левомеколь», или группа сравнения (n = 20), и группа 3 — крысы с лечением гидрогелевым материалом, или опытная группа (n = 20). Всем животным в области холки наносили стандартизированные контактные ожоговые раны с помощью латунного груза массой 100 г и диаметром 3 см, нагретого до 100 °C в кипящей воде, в течение 15 с, равномерность давления на всей площади контакта обеспечивалась собственной тяжестью цилиндра2. При включении в исследование крысы всех групп были сопоставимыми по породе, полу и визуальному отсутствию патологий. Средние показатели массы в сопоставляемых группах 1, 2 и 3 — 0,174 ± 0,015; 0,174 ± 0,012; 0,180 ± 0,012 кг соответственно, уровень значимости составил p = 0,83573 согласно критерию Краскела — Уоллиса. Анализ сопоставимости по возрасту между группами не проводился, так как по данным ветеринарного свидетельства возраст всех животных составлял 6 месяцев.
Критерии соответствия
Критерии включения
Половозрелые самцы крыс породы Сфинкс без визуальных признаков заболеваний
Критерии невключения
В эксперимент не включались самки, самцы, масса которых была меньше 160 или больше 200 г, самцы с повреждениями кожи, бледными покровами, помутнением глаз.
Критерии исключения
Гибель животного, нанесение самоповреждений.
Рандомизация
Рандомизация проводилась случайным способом (методом «конвертов»). Каждой группе животных соответствовал свой номер, отмеченный на шестидесяти табличках в непрозрачном закрытом конверте. Сотрудник вивария произвольно опускал руку в конверт и присваивал номер очередному животному в зависимости от цифры в конверте, таким образом все животные были разделены на три группы: контрольная группа (n = 20), опытная группа (n = 20) и группа сравнения (n = 20).
Обеспечение анонимности данных
Рандомизация животных проводилась сотрудниками вивария в присутствии руководителя исследования. Интерпретация и анализ данных исследования проводились только авторами.
Итоговые показатели (исходы исследования)
Итоговыми показателями были концентрации цитокинов (интерлейкина-1 бета (IL-1β), интерлейкина-4 (IL-4), интерлейкина-6 (IL-6), интерлейкина-8 (IL-8), интерлейкина-10 (IL-10), фактора некроза опухолей-α (TNFα)) в сыворотке крови животных в пг/мл и морфометрические данные толщины эпидермального слоя в мкм.
Экспериментальные процедуры
Исследование проводилось на базе учебно-производственного отдела и центральной научно-исследовательской лаборатории ФГБОУ ВО КубГМУ Минздрава России.
Основой для создания гидрогеля были лоскуты нативной дермы поросенка (самец, возраст 2 месяца) породы Ландрас. Забор дермы проводили с боковых поверхностей и спины животного, донорский участок кожи предварительно обрабатывали, затем удаляли эпидермис с помощью электродерматома ДЭ-60–01 (ЗАО «Ассоциация Аэрокосмических Инженеров», Россия). Образцы дермы подвергали химической децеллюляризации, для этого ткань обрабатывали 5 % NaOH при соотношении ткань: раствор — 1:5 в течение 22,5 часов. После этого образцы промывали деионизированной водой до стабилизации pH [7]. Полученный гидрогель был прозрачным, плотным и гомогенным. В готовый гидрогель на основе дермы добавляли 1 % раствор антибиотика-антимикотика (Gibco (ThermoScientific), США) и хранили в стерильных условиях при температуре +4 °C. Содержание ДНК в образцах дермального гидрогеля составило 33,19 ± 2,51 нг/мг сухого вещества, что соответствует критериям качества децеллюляризации для ксеногенных тканей [8].
Крысы были разделены на три группы: группа 1 — крысы без лечения, или контрольная группа (n = 20), группа 2 — крысы с лечением мазью «Левомеколь», или группа сравнения (n = 20), и группа 3 — крысы с лечением дермальным гидрогелем, или опытная группа (n = 20). Всем животным под общим газовым наркозом «Изофлуран» (индукция 2–5 %, поток 0,25–4,00 %; ООО «Миралек», Китай) в области холки наносили контактные ожоговые раны с помощью латунного груза массой 100 г и диаметром 3 см, нагретого до 100 °C в кипящей воде, в течение 15 с. Раны крыс групп 2 обрабатывали комбинированной противомикробной мазью «Левомеколь®» (диоксометилтетрагидропиримидин + хлорамфеникол) (ООО «НИЖФАРМ», Россия), а крыс группы 3 — дермальным гидрогелем в объеме 0,3 г каждый день до 7-го дня эксперимента включительно. Всем животным после оперативного вмешательства вводился анальгезирующий препарат «Флексопрофен 2,5 %» (5 мг кетопрофена/кг; «Нита-Фарм», Россия) и антибиотик «Конвения» (5 мг/кг; «Zoetis», США). Через 3, 7 и 14 дней после начала эксперимента эксплантировались образцы из области раны с прилежащими нативными тканями для гистологического исследования в соответствии с нижеприведенной схемой с помощью устройства для биопсии кожи диаметром 6 мм («Medax», Италия) (рис. 2).
Для морфометрической оценки тканей выполняли окрашивание гематоксилином-эозином («БиоВитрум», Россия) по инструкции изготовителя. До и после нанесения ожоговой раны в динамике репарации на 1, 3, 7, 14-е сутки определяли в сыворотке крови животных содержание цитокинов IL1β, IL4, IL6, IL8, IL10 методом твердофазного иммуноферментного анализа на анализаторе FilterMaxF5 («MolecularDevices», США) с использованием наборов реагентов ELISA («Cloud-CloneCorp.», Китай) согласно протоколу производителя и соответствующим калибровочным кривым.
Уход за животными и мониторинг
После нанесения модели ожоговой травмы у крыс последующие манипуляции и наблюдение осуществлялись в виварном блоке учебно-производственного отдела ФГБОУ ВО КубГМУ Минздрава России. Животных содержали в кювезах ИВК «ВЕНТ-БИО-2 М» (AWTech/АВТех, Россия) (по 1 особи). Температурный режим в кювезах поддерживался в пределах 21–24 °C. Влажность воздуха поддерживалась на уровне 55–65 %. Объемный расход воздуха составлял 60–65 м 3/час. Кювезы в стеллажах были расположены со стороны стойки, куда не попадали прямые солнечные лучи. Животные содержались со свободным доступом к воде и пище. Сбалансированный рацион питания состоял из формируемой extempore зерносмеси. Три раза в неделю животные получали подкормку из свежих или сушеных овощей и фруктов из расчета 10 г/сут. Проводились ежедневная смена подстилки.
Крупное лабораторное животное содержалось в отдельном боксе размером примерно 1,5 м 2 в условиях вивария ФГБОУ ВО КубГМУ Минздрава России с обеспечением стандартных условий: 12-часовой световой день, свободный доступ к воде и пище, стандартный пищевой и водный рацион, температурный режим 18–25 °C.
Выведение животных из эксперимента проводилось введением летальных доз золетила (1 мг/кг, Virbac, Франция) и ксилазина (4 мл/кг, RometarSpofa, Чехия).
Статистические процедуры
Принципы расчета размера выборки
Предварительный расчет выборки не производился.
Статистический анализ
Статистическую обработку полученных результатов по содержанию ДНК в гидрогеле, содержанию цитокинов в сыворотке и морфометрических данных проводили с помощью компьютерных программ Graph Pad Prism version 6.04, Microsoft Excel 2016 (Microsoft, США). Соответствие выборок нормальному распределению определялось по критерию Шапиро — Уилка. В случае нормального распределения данных результаты представляли в виде M ± S, где M — среднее арифметическое, S — стандартное отклонение, при отклонении от нормального распределения — в виде медианы с первым и третьим квартилем (Me [Q1; Q3]). Различия считали значимыми при p < 0,05, различия рассчитывали по критерию Манна — Уитни при парном сравнении и по критерию Краскела — Уоллиса при дисперсионном анализе (в случае ненормального распределения данных) для независимых групп, по критерию Вилкоксона для зависимых групп. Для количественной оценки гистологических изменений использовали компьютерную морфометрию с помощью программы ImageJ (National Institution of Health, США) и плагина IHC metrics.
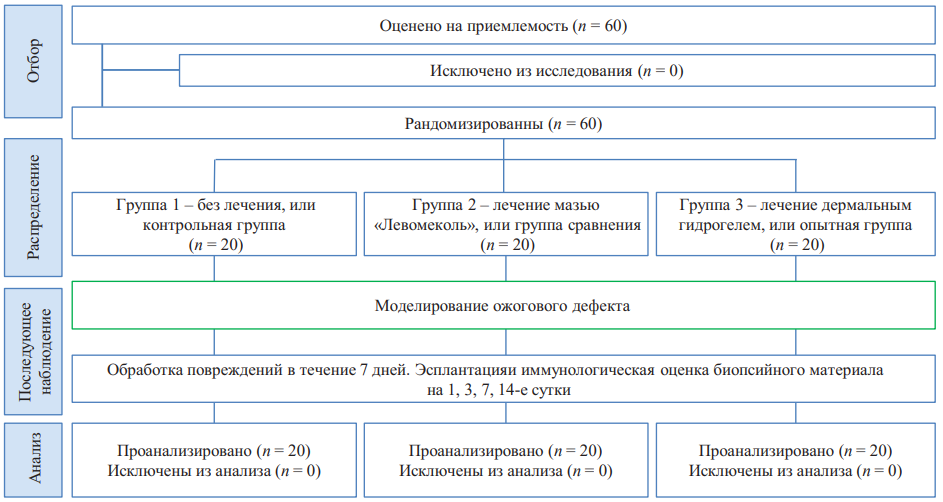
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами (согласно рекомендациям ARRIVE).
Fig. 1. Schematic diagram of the research design
Note: performed by the authors (according to ARRIVE recommendations).
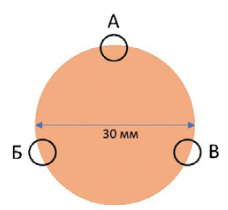
Рис. 2. Схема взятия образцов для гистологического анализа. А, Б, В — эксплантируемый материал на 3, 7, 14-е сутки соответственно
Примечание: рисунок выполнен авторами.
Fig. 2. Sampling scheme for histological analysis. А, Б, В — explanted material on days 3, 7, 14, respectively
Note: performed by the authors.
РЕЗУЛЬТАТЫ
На 3-и сутки эксперимента в образцах кожи животных группы 3 (опытная группа) отмечалось умеренное воспаление с поверхностным отеком, а в контрольной группе и в группе сравнения — выраженное воспаление с гнойным экссудатом. На 7-е сутки эксперимента у крыс группы 1 все еще наблюдалось воспаление, однако отмечались очаги пролиферации многослойного эпителия. На 7-е сутки общая толщина эпидермиса и толщина его рогового слоя была у крыс групп 2 и 3 больше, чем в образцах контрольной группы (p < 0,05). На 14-е сутки эксперимента различия между изучаемыми группами были минимальны (p > 0,05) (табл. 1).
В ходе сравнительного анализа уровней провоспалительного цитокина IL1β было выявлено, что после нанесения ожоговой раны значение данного параметра повышалось в экспериментальных группах относительно контрольной группы (рис. 3, табл. 2). Через три дня лечения в опытной группе и группе сравнения наблюдалось снижение уровня данного цитокина по отношению к предыдущему сроку исследования, при этом не были достигнуты значения контрольной группы, что можно объяснить выраженным противовоспалительным эффектом компонентов гидрогелевого материала на основе дермы.
К 14-м суткам относительные показатели IL-1β в контрольной группе и в группе сравнения не отличались (p > 0,05) и были ниже значений опытной группы (p < 0,05), что может говорить о выраженном противовоспалительном эффекте и пролонгированном действии гидролизатов коллагена и компонентов внеклеточного матрикса (ВКМ), являющихся основой используемого гидрогелевого материала на основе дермы.
Следующим провоспалительным цитокином, для которого был проведен сравнительный анализ динамики, был IL-6 (рис. 4, табл. 2). Известно, что при повреждении тканей в ранние сроки индуцируется синтез IL-6, который способствует активации острофазовых иммунных реакций [9]. В нашем исследовании были выявлены значительные относительные повышения уровней данного цитокина на 3–14-е сутки эксперимента в опытной группе и группе сравнения относительно контрольной группы (p1 < 0,05; p2 < 0,05 соответственно), при этом на 14-е сутки по отношению к дооперационному состоянию наблюдалась стабилизация уровней IL-6 в группе животных, подвергавшихся лечению гидрогелевым материалом на основе дермы. Характер изменения концентраций IL-6 может быть обусловлен его хемотаксическими свойствами по отношению к нейтрофилам на ранних сроках репарации и к макрофагам на более поздних стадиях заживления ожоговой раны.
При сравнении различных групп не было выявлено значимой разницы на 3, 7 и 14-е сутки у крыс с лечением дермальным гидрогелем, а также в группе сравнения по отношению к контрольной группе, что свидетельствовало о более физиологичном затухании воспалительных процессов в группах с экспериментальным лечением, так как у крыс, не получавших лечения, не было отмечено повышений уровня IL-6 на всем протяжении эксперимента.
Уровень провоспалительного цитокин и хемоаттрактанта для нейтрофилов — IL-8 значительно вырос на 1-е сутки после нанесения экспериментальной раны только в контрольной группе (рис. 5, табл. 2). Внесение традиционной и экспериментальной терапии оказало значимое влияние на уровень данного цитокина в течение трех суток репарационного процесса.
Исходя из полученных данных можно сделать вывод о разнице во влиянии гидрогелевого материала на основе гидролизатов коллагена на поздние сроки заживления, так как динамика уровня IL-8 в группе сравнения значимо отличалась по отношению к контрольной и опытной группам на 7-е и 14-е сутки после нанесения ожоговой раны. Таким образом, внесение компонентов ВКМ способствовало негативной регуляции в отношении роста концентрации хемоаттрактанта IL-8 на более поздних сроках заживления и, по-видимому, обеспечивало затухание воспаления.
TNF-α регулирует активность фибробластов, эндотелиальных клеток сосудов и кератиноцитов, а также синтез белков внеклеточного матрикса и матриксных металлопротеиназ, которые принимают непосредственное участие в заживлении поврежденных тканей. Анализ данных, полученных при определении содержания TNF-α, показал, что профили данного провоспалительного фактора в группах с лечением значительно отличаются по отношению к контрольной группе и демонстрируют способность вносимых препаратов влиять на регуляцию воспалительного ответа, тем самым оптимизируя сроки эпителизации (рис. 6, табл. 2). Кроме того, динамика изменения концентраций TNF-α в экспериментальных группа не коррелировала с другими провоспалительными цитокинами — IL-1β, IL-6 и IL-8.
В группе сравнения уровень TNF-α отличался резкими колебаниями, что могло оказать влияние на увеличение сроков формирования всех слоев эпителия, при этом на 1-е сутки после нанесения ожоговой раны относительное содержание TNF-α в сыворотке крови животных этой и опытной групп было выше по отношению к контрольной группе. В опытной группе на 7-е сутки наблюдалось снижение концентрации TNF-α в отличие от предыдущего срока исследования (p < 0,05), а также его повышение к 14-му дню эксперимента. Общая динамика данного цитокина свидетельствует о том, что лечение биополимерами ингибирует синтез TNF-α, снижает интенсивность воспалительного процесса. Так как сроки заживления в экспериментальных группах были меньше, чем в группе без лечения, то данная тенденция может иметь регуляторное значение.
Следующим этапом исследования была сравнительная оценка уровней противовоспалительных цитокинов на различных сроках экспериментального лечения ожоговой раны. Для изучения процесса восстановления кожи необходимо учитывать вклад типичного противовоспалительного цитокина IL-4, т. к. изменения его уровня влияют как на ранние, так и на поздние стадии восстановления. Изменение уровней противовоспалительного фактора IL4 продемонстрировало его положительное влияние на динамику заживления раны, так как он значительно повысился на первые сутки исследования, а затем к 14-м суткам не оказывал влияния в группе крыс, не получавших лечения (рис. 7, табл. 2). В группе сравнения наблюдалось самое позднее повышение уровня IL-4, он был значимо выше контрольной группы на 7-е сутки эксперимента. На стадии ремоделирования и активного коллагеногенеза (вторая неделя после нанесения раны) IL-4 активно синтезировался в опытной группе, но не достиг значения первых суток после нанесения раны.
IL-4 является распространенным иммунным цитокином, который может индуцировать противовоспалительный фенотип макрофагов, уменьшая воспалительный ответ и ускоряя восстановление тканей после имплантации. Было обнаружено, что интерферон-γ, высвобождаемый из гидрогелевой системы, стимулирует переключение макрофагов на провоспалительные фенотипы, тогда как IL-4 поляризует макрофаги на противовоспалительные фенотипы [10]. Таким образом, дополнительное внесение гидрогелевого материала на основе дермы позволило значимо улучшить количество синтеза IL-4 на 3-и сутки, но не способствовало процессам заживления на 14-е сутки, так как наблюдалась отрицательная динамика изменения его концентрации, как и в группе сравнения, при этом относительные значения не отличались от контрольной группы на 14-е сутки эксперимента.
Основным противовоспалительным маркером для сравнительной оценки процессов заживления ожоговой раны был IL-10. Анализ полученных данных о концентрациях IL-10 показал, что группы крыс, получавших лечение гидрогелевым материалом на основе дермы и лечение мазью «Левомеколь», не имели значимых различий на 1-е и 3-и сутки исследования (рис. 8, табл. 2). В группе без лечения не наблюдалось пиков повышения уровня данного цитокина на 7-е сутки в отличие от группы сравнения (p < 0,05) и опытной группы (p < 0,05), что может быть обусловлено участием противовоспалительных макрофагов на данном этапе заживления ожоговой раны, на которые препараты оказывают положительное влияние. В группе сравнения, так же как и в опытной, было значительное повышение уровня IL-10 на 7-е сутки по сравнению с первым днем лечения. При лечении гидрогелем наблюдалось сначала снижение концентрации IL-10, затем к 7-м суткам ее увеличение и стабилизация на 14-е сутки эксперимента.
Таким образом, в ходе сравнительного анализа уровней провоспалительных цитокинов (IL-1β, IL-8) были показаны выраженные противовоспалительным эффекты компонентов исследуемого гидрогелевого материала. Внесение экзогенных биологических компонентов ВКМ — коллагена и его гидролизатов, гиалуроновой кислоты и др. оказало значительное влияние на регуляцию синтеза противовоспалительных цитокинов, что, вероятно, способствовало оптимизации сроков успешной эпителизации и заживления раны.
Таблица 1. Толщина эпидермального слоя кожи крыс исследуемых групп на различных сроках экспериментального лечения ожоговых ран (M ± S), мкм
Table 1. Thickness of rat epidermis in the studied groups at different periods of experimental treatment for burn wounds (M ± S), μm
|
Группы/Сроки |
3-и сутки |
7-и сутки |
14-е сутки |
|
Контрольная группа (n = 20) |
- |
365,78 ± 63,14 |
1523,14 ± 147,95^ |
|
Опытная группа (n = 20) |
- |
1329,17 ± 147,33*# |
1486,74 ± 153,47 |
|
Группа сравнения (n = 20) |
- |
736,88 ± 54,00* |
1617,81 ± 212,30^ |
Примечания: таблица составлена авторами; * — p < 0,05, различия значимы по отношению к соответствующим значениям контрольной группы, # — p < 0,05, различия значимы по отношению к соответствующим значениям в группе сравнения, ^ — p < 0,05, различия значимы по отношению к значениям на предыдущем сроке в данной группе.
Notes: table compiled by the authors; * — p<0.05, differences are significant for the corresponding values of the control group, # — p<0.05, differences are significant for the corresponding values in the comparison group, ^ — p<0.05, differences are significant for the values at the previous time period in this group.
Таблица 2. Медианные значения концентраций про- и противовоспалительных цитокинов в динамике при экспериментальном лечении ожоговых ран крыс (Me [Q1; Q3])
Table 2. Median values of pro- and anti-inflammatory cytokine concentration in dynamics during experimental treatment for burn wounds in rats (Me [Q1; Q3])
|
Сроки |
До операции |
1-е сутки |
3-и сутки |
7-е сутки |
14-е сутки |
|
Группы |
IL-1β, пг/мл |
||||
|
Контрольная группа (n = 20) |
2976,00 [ 2967,00; 3000,50] |
1435,00 [ 1428,75; 1498,25] |
1467,00 [ 1450,75; 1491,50] |
1733,00 [ 1708,00; 1750,50] |
2577,00 [ 2569,05; 2626,00] |
|
Опытная группа (n = 20) |
2559,00 [ 2552,50; 2601,75] |
2210,50*^ [ 2200,75; 2226,25] |
1909,00* [ 1895,00; 1924,25] |
1696,00* [ 1690,00; 1755,75] |
1709,00*# [ 1695,75; 1739,25] |
|
Группа сравнения (n = 20) |
3137,00 [ 3126,75; 3157,25] |
2581,10*^ [ 2574,75; 2592,00] |
1998,00* [ 1981,50; 2046,75] |
1468,00*^ [ 1464,50; 1504,00] |
1973,00 [ 1962,00; 2012,25] |
|
|
IL-6, пг/мл |
||||
|
Контрольная группа (n = 20) |
1312,00 [ 1288,50; 1320,75] |
1346,00 [ 1318,75; 1355,75] |
1022,60 [ 1000,50; 1044,50] |
873,55 [ 858,25; 888,75] |
594,00 [ 586,75; 601,75] |
|
Опытная группа (n = 20) |
458,00 [ 449,75; 475,25] |
530,00 [ 526,75; 545,25] |
961,00*^ [ 942,75; 970,75] |
1185,00*^ [ 1159,25; 1197,25] |
973,00*^ [ 960,00; 981,00] |
|
Группа сравнения (n = 20) |
403,25 [ 382,50; 431,00] |
378,00 [ 362,25; 398,75] |
988,00*^ [ 978,00; 1002,25] |
1162,35*^ [ 1154,00; 1171,50] |
756,20*^ [ 740,25; 770,25] |
|
IL-8, пг/мл |
|||||
|
Контрольная группа (n = 20) |
52,0 [ 40,5; 67,1] |
255,7^ [ 229,0; 283,5] |
0,0^ [ 0,0; 0,0] |
47,0 [ 29,5; 69,0] |
60,7^ [ 35,8; 84,0] |
|
Опытная группа (n = 20) |
27,0 [ 14,5; 31,0] |
12,0*^ [ 6,75; 17,0] |
0,0^ [ 0,0; 0,0] |
0,0*# [ 0,0; 0,0] |
74,0*^# [ 47,5; 96,25] |
|
Группа сравнения (n = 20) |
10,0 [ 6,0; 13,0] |
15,0* [ 9,75; 16,0] |
0,0^ [ 0,0; 0,0] |
65,0*^ [ 57,5; 77,75] |
60,0*^ [ 53,75; 71,5] |
|
TNF-α, пг/мл |
|||||
|
Контрольная группа (n = 20) |
38,0 [ 29,5; 49,0] |
36,0 [ 16,5; 44,5] |
9,0^ [ 6,5; 11,25] |
33,0 [ 27,0; 40,5] |
9,0 [ 6,25; 10,0] |
|
Опытная группа (n = 20) |
12,0 [ 8,5; 13,0] |
31,0*^ [ 19,5; 45,25] |
32,0*# [ 28,75; 40,0] |
10,0*# [ 7,5; 10,25] |
40,0* [ 39,75; 41,0] |
|
Группа сравнения (n = 20) |
35,0 [ 32,0; 42,0] |
111,0* [ 104,0; 124,75] |
9,0^ [ 5,75; 10,25] |
208,0*^# [ 206,0; 217,5] |
185,0*^# [ 177,25; 192,0] |
|
IL-4, пг/мл |
|||||
|
Контрольная группа (n = 20) |
100,0 [ 95,0; 112,75] |
492,0^ [ 474,75; 501,0] |
222,5 [ 212,75; 236,5] |
216,5 [ 197,5; 221,75] |
206,5 [ 202,2; 211,5] |
|
Опытная группа (n = 20) |
102,0 [ 95,0; 114,25] |
156,5* [ 141,5; 166,0] |
524,5*^# [ 519,0; 531,25] |
406,4*^ [ 397,25; 412,0] |
191,2^ [ 187,1; 201,4] |
|
Группа сравнения (n = 20) |
131,0 [ 121,25; 138,75] |
135,0* [ 120,75; 143,5] |
184,5*^ [ 177,5; 198,25] |
421,0*^ [ 411,0; 429,25] |
187,2*^ [ 186,0; 201,25] |
|
IL-10, пг/мл |
|||||
|
Контрольная группа (n = 20) |
2317,0 [ 2231,0; 2393,25] |
667,0^ [ 584,75; 686,0] |
1041,5 [ 942,25; 1105,75] |
875,0 [ 783,0; 970,5] |
696,5 [ 700,0; 709,5] |
|
Опытная группа (n = 20) |
1717,5 [ 1599,0; 1751,5] |
246,5*^ [ 138,25; 344,5] |
798,0 [ 666,25; 857,75] |
1151,5*# [ 1071,75; 1219,25] |
1928,0*^# [ 1930,0; 1944,0] |
|
Группа сравнения (n = 20) |
1314,0 [ 1217,75; 1359,75] |
253,2*^ [ 176,0; 327,75] |
605,5 [ 541,5; 698,75] |
2203,8*^ [ 2101,75; 2244,5] |
992,5*^ [ 985,0; 992,8] |
Примечание: таблица составлена авторами; * — p < 0,05, различия значимы по отношению к соответствующим значениям контрольной группы, # — p < 0,05, различия значимы по отношению к соответствующим значениям в группе сравнения, ^ — p < 0,05, различия значимы по отношению к значениям на предыдущем сроке в данной группе. Сокращение: IL — интерлейкин; TNFα — фактор некроза опухоли α.
Note: table compiled by the authors; * — p<0.05, differences are significant for the corresponding values of the control group, # — p<0.05, differences are significant for the corresponding values in the comparison group, ^ — p<0.05, differences are significant for the values at the previous time period in this group. Abbreviation: IL — interleukin; TNFα — tumor necrosis factor α.
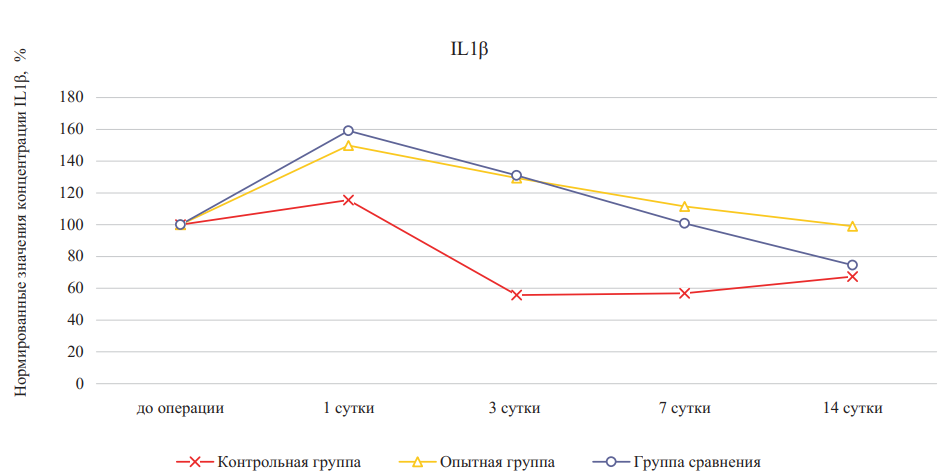
Рис. 3. Относительное изменение концентраций инерлейкина-1β при лечении ожоговых ран крыс в динамике (значения до эксперимента приняты за 100 %)
Примечание: рисунок выполнен авторами. Сокращение: IL — интерлейкин.
Fig. 3. Percentage change of interleukin-1β concentrations during burn wound treatment in rats in dynamics (pre-experiment values are taken as 100 %)
Note: performed by the authors. Abbreviation: IL — interleukin.
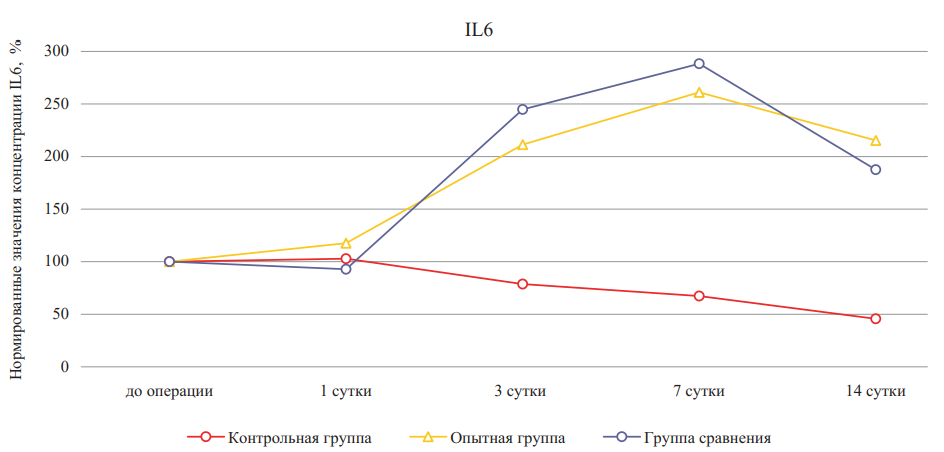
Рис. 4. Относительное изменение концентраций интерлейкина-6 при лечении ожоговых ран крыс в динамике (значения до эксперимента приняты за 100 %)
Примечание: рисунок выполнен авторами. Сокращение: IL — интерлейкин.
Fig. 4. Percentage change of interleukin-6 concentrations during burn wound treatment in rats in dynamics (pre-experiment values are taken as 100 %)
Note: performed by the authors. Abbreviation: IL — interleukin.
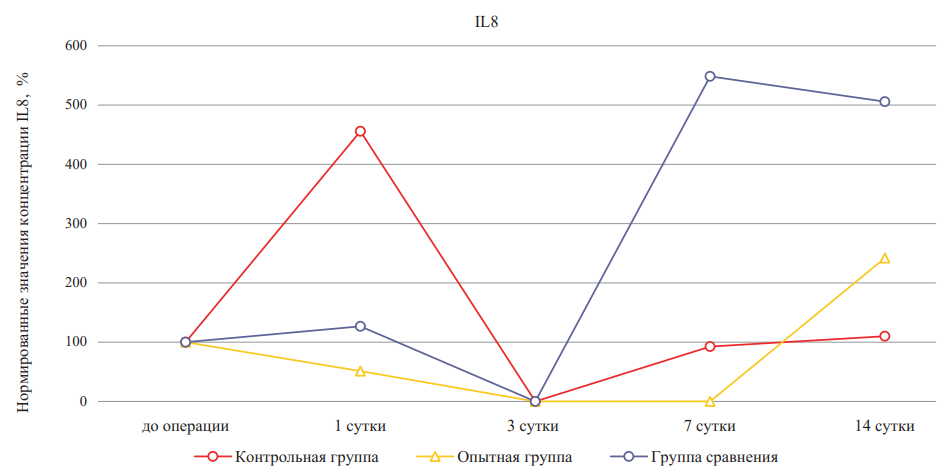
Рис. 5. Относительное изменение концентраций интерлейкина-8 при лечении ожоговых ран крыс в динамике (значения до эксперимента приняты за 100 %)
Примечание: рисунок выполнен авторами. Сокращение: IL — интерлейкин.
Fig. 5. Percentage change of interleukin-8 concentrations during burn wound treatment in rats in dynamics (pre-experiment values are taken as 100 %).
Note: performed by the authors. Abbreviation: IL — interleukin.
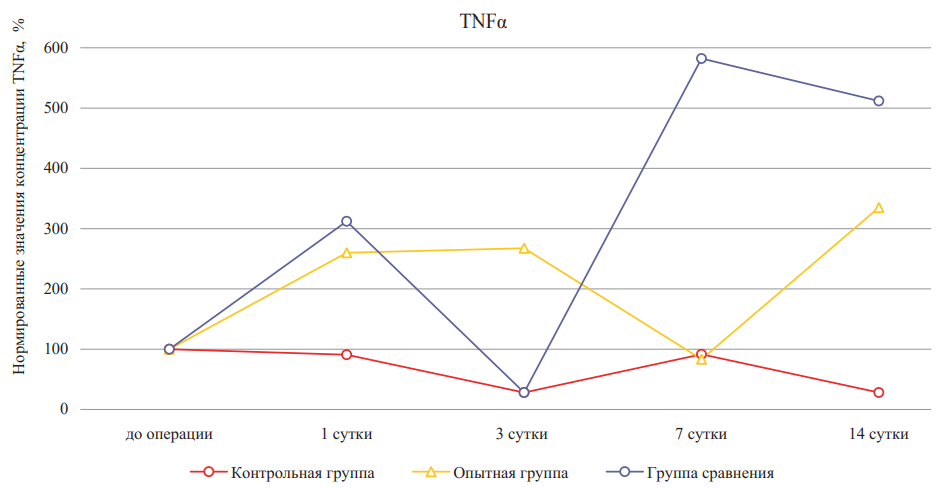
Рис. 6. Относительное изменение концентраций фактора некроза опухоли -α при лечении ожоговых ран крыс в динамике (значения до эксперимента приняты за 100 %)
Примечание: рисунок выполнен авторами. TNF — фактор некроза опухоли.
Fig. 6. Percentage change of concentrations of TNF-α during burn wound treatment in rats in dynamics (pre-experiment values are taken as 100 %)
Note: performed by the authors. Abbreviation: TNF — tumor necrosis factor.
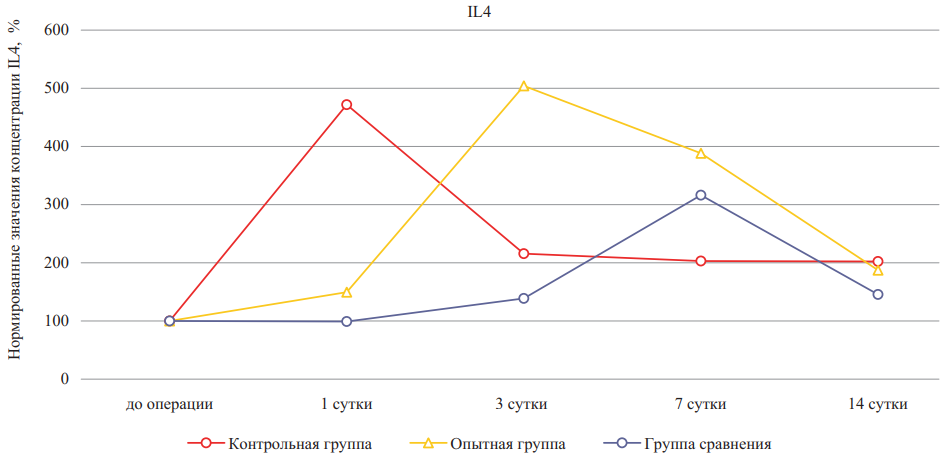
Рис. 7. Относительное изменение концентраций интерлейкина-4 при лечении ожоговых ран крыс в динамике (значения до эксперимента приняты за 100 %)
Примечание: рисунок выполнен авторами. Сокращение: IL — интерлейкин.
Fig. 7. Percentage change of interleukin-4 concentrations during burn wound treatment in rats in dynamics (pre-experiment values are taken as 100 %)
Note: performed by the authors. Abbreviation: IL — interleukin.
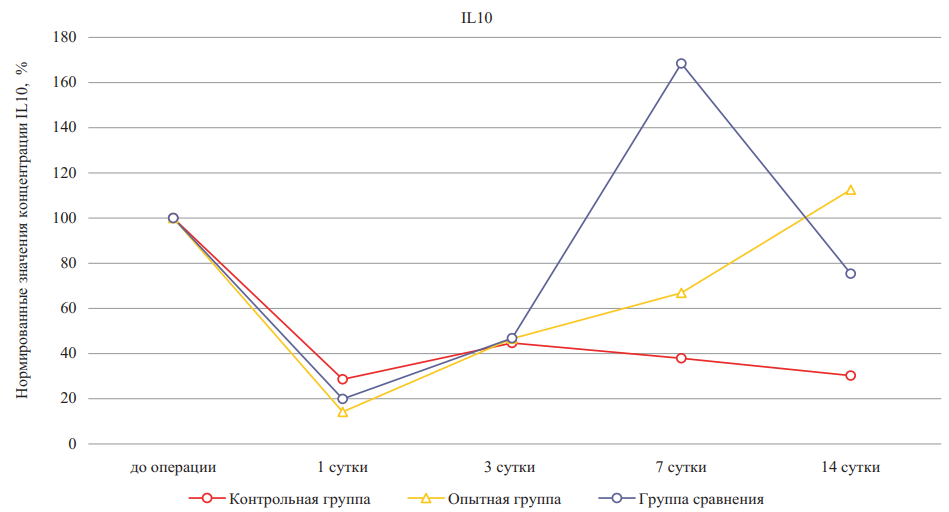
Рис. 8. Относительное изменение концентраций интерлейкина-10 при лечении ожоговых ран крыс в динамике (значения до эксперимента приняты за 100 %)
Примечание: рисунок выполнен авторами. Сокращение: IL — интерлейкин.
Fig. 8. Percentage change of interleukin-10 concentrations during burn wound treatment in rats in dynamics (pre-experiment values are taken as 100 %)
Note: performed by the authors. Abbreviation: IL — interleukin.
ОБСУЖДЕНИЕ
Интерпретация/научная значимость
По классическим представлениям ВКМ зачастую рассматривается как поддерживающая структура для стабилизации расположения клеток в тканях и сохранения архитектуры тканей. Эта концепция резко изменилась за последние несколько десятилетий с открытием того, что протеолитические фрагменты ВКМ оказывают глубокое влияние на структуру, жизнеспособность и функции клеток. Классические примеры взаимодействия ВКМ с клетками включают семейство рецепторов клеточной поверхности интегринов [11, 12]. Однако существуют также взаимодействия, не основанные на интегринах, так как домен лиганда в компоненте ВКМ может становиться биологически активным только после модификации ВКМ. Считается, что многие свойства биологических матриксов на основе ВКМ обусловлены небольшими остатками скрытых пептидов в молекулах коллагена, которые вступают в действие после биодеградации исходной молекулы. Протеолитический гидролиз белка ВКМ высвобождает криптические пептиды, которые включают ангиогенные, антимикробные, митогенные и хемотаксические свойства [13][14]. При этом биопластические материалы на основе внеклеточного матрикса дермы способны индуцировать процесс, называемый «конструктивное ремоделирование» — формирование функциональной ткани соответственно в зоне имплантации [15].
Ограничения исследования
Ограничений исследования не было.
Обобщаемость/экстраполяция
В проведенном исследовании при использовании гидрогеля на основе ВКМ дермы при лечении ожоговых ран на 14-е сутки наблюдалось полное восстановление кожи в пораженной области, было зарегистрировано большое количество фибробластов, а эпидермис был заметно утолщен относительно группы без лечения. Это подтверждается и данными других исследователей, например Н. Fujisaki et al. [16], которые отмечали, что коллагеновые гидрогели, в основном коллаген IV и коллаген I, поддерживают адгезию, пролиферацию и рост фибробластов. Известно, коллаген оказывает положительное влияние на ранние этапы заживления ран, так как способствует агрегации тромбоцитов, стимулирует образование грануляционной ткани на месте раны, поскольку является матрицей для ее образования. Лизис коллагена способствует обогащению раны аминокислотами, что приводит к увеличению биосинтеза пластических веществ.
Так, в исследовании Т. М. Черданцевой и др. [17] в опытной группе отмечались такие морфологические особенности, как отставание увеличения площади грануляционной ткани, меньшее количество тучных клеток, снижение их площади и коэффициент дегрануляции по сравнению с контрольной группой без лечения. Автор отмечала, что в других исследованиях влияния коллагенсодержащих раневых покрытий была выявлена способность коллагена обратимо связывать факторы роста, защищая их от протеолиза, чем объясняется отставание формирования грануляционной ткани в опытной группе. Тем не менее натуральный коллаген имеет плохие механические свойства и слабую устойчивость к биодеградации. Более того, чистый коллаген легко портится из-за бактериальной эрозии во влажной среде [18]. Поэтому исследователи в настоящее время разрабатывают различные методики химической сшивки для улучшения гидрогелей на основе коллагена, но используемые для этого вещества являются достаточно токсичными, что требует дальнейшего научного поиска [4].
Таким, образом, дальнейшие исследования применения гидрогеля в качестве терапевтического препарата для ожоговых ран позволят создать высокоэффективное ранозаживляющее средство, обладающее значительными преимуществами среди раневых покрытий.
ЗАКЛЮЧЕНИЕ
Таким образом, результаты сравнительного исследования позволили продемонстрировать достаточную эффективность применения гидрогелевого материала на основе дермы в качестве репаранта ожоговых ран по динамике содержания про- и противовоспалительных факторов и получить новые данные о механизмах регенерации кожи и о патогенетической природе возникающих в организме метаболических эффектов в ответ на воздействие гидролизованного коллагена внеклеточного матрикса дермы на пораженные участки кожи.
1. Агаджанова К.В. Международные стандарты для лечения ожогов. E-Scio. 2019;39(12):453–458. Available: https://cyberleninka.ru/article/n/mezhdunarodnye-standarty-dlya-lecheniya-ozhogov
2. Павленко С. Г., Шаблин Д. В., Хуранов А. А., Зобенко В. Я., Евглевский А. А. Приспособление для моделирования экспериментальной ожоговой раны на животном. Патент на полезную модель № 151026, зарегистрирован 11.02.2015 г. Патентообладатели: Павленко С. Г., Шаблин Д. В.
Список литературы
1. Abazari M, Ghaffari A, Rashidzadeh H, Badeleh SM, Maleki Y. A Systematic Review on Classification, Identification, and Healing Process of Burn Wound Healing. Int J Low Extrem Wounds.2022;21(1):18–30. https://doi.org/10.1177/1534734620924857
2. Богданов С.Б., Афаунова О.Н. Пути совершенствования хирургического лечения пограничных ожогов конечностей. Кубанский научный медицинский вестник. 2016;3:154–159. https://doi.org/10.25207/1608-6228-2016-3-154-159
3. Nourian Dehkordi A, Mirahmadi Babaheydari F, Chehelgerdi M, Raeisi Dehkordi S. Skin tissue engineering: wound healing based on stemcell-based therapeutic strategies. Stem Cell Res Ther. 2019;10(1):111. https://doi.org/10.1186/s13287-019-1212-2
4. Su J, Li J, Liang J, Zhang K, Li J. Hydrogel Preparation Methods and Biomaterials for Wound Dressing. Life (Basel). 2021;11(10):1016. https://doi.org/10.3390/life11101016
5. Lau K, Paus R, Tiede S, Day P, Bayat A. Exploring the role of stem cells in cutaneous wound healing. ExpDermatol. 2009;18(11):921–933. https://doi.org/10.1111/j.1600-0625.2009.00942.x
6. Zhang Y, Jiang M, Zhang Y, Cao Q, Wang X, Han Y, Sun G, Li Y, Zhou J. Novel lignin-chitosan-PVA composite hydrogel for wound dressing. Mater SciEng C Mater Biol Appl. 2019;104:110002. https://doi.org/10.1016/j.msec.2019.110002
7. Мелконян К.И., Козмай Я.А., Русинова Т.В., Чупрынин Г.П., Карташевская М.И., Карташевскаий И.И., Сторожук С.В., Селезнева И.И., Гуревич К.Г. Применение гидрогеля на основе дермы свиньи для экспериментального лечения поверхностных ран. Бюллетень сибирской медицины. 2023;22(3):54–60. https://doi.org/10.20538/1682-0363-2023-3-54-60
8. Crapo PM, Gilbert TW, Badylak SF. An overview of tissue and whole organ decellularization processes. Biomaterials. 2011;32(12):3233– 3243. https://doi.org/10.1016/j.biomaterials.2011.01.057
9. Seiser S, Janker L, Zila N, Mildner M, Rakita A, Matiasek J, Bileck A, Gerner C, Paulitschke V, Elbe-Bürger A. Octenidine-based hydrogel shows anti-inflammatory and protease-inhibitory capacities in wounded human skin. Sci Rep. 2021;11(1):32. https://doi.org/10.1038/s41598020-79378-9
10. Chen J, Li M, Yang C, Yin X, Duan K, Wang J, Feng B. Macrophage phenotype switch by sequential action of immunomodulatory cytokines from hydrogel layers on titania nanotubes. Colloids Surf B Biointerfaces. 2018;163:336–345. https://doi.org/10.1016/j.colsurfb.2018.01.007
11. Adorno-Cruz V, Liu H. Regulation and functions of integrin α2 in cell adhesion and disease. Genes Dis. 2018;6(1):16–24. https://doi.org/10.1016/j.gendis.2018.12.003
12. de Castro Brás LE, Frangogiannis NG.Extracellular matrix-derived peptides in tissue remodeling and fibrosis.Matrix Biol. 2020;(91– 92):176–187. https://doi.org/10.1016/j.matbio.2020.04.006
13. Banerjee P, Shanthi C. Cryptic Peptides from Collagen: A Critical Review. Protein Pept Lett. 2016;23(7):664–672. https://doi.org/10.2174/0929866522666160512151313
14. Kumai J, Yamada Y, Hamada K, Katagiri F, Hozumi K, Kikkawa Y, Nomizu M. Identification of active sequences in human lamininα5 G domain. J Pept Sci. 2019;25(12):e3218. https://doi.org/10.1002/psc.3218
15. Новоселецкая Е.С. Григорьева О.А., Ефименко А.Ю., Калинина Н.И. Внеклеточный матрикс в регуляции дифференцировки стволовых клеток. Биохимия. 2019;84(3):232–240. https://doi.org/10.1134/S0320972519030059
16. Fujisaki H, Adachi E, Hattori S. Keratinocyte differentiation and proliferation are regulated by adhesion to the three-dimensional meshwork structure of type IV collagen. Connect Tissue Res. 2008;49(6):426–436. https://doi.org/10.1080/03008200802324998
17. Черданцева Т.М., Чернов И.П., Громова Т.М., Шеломенцев В.В. Морфофункциональные особенности тучных клеток в ожоговой ране при применении коллагеновой матрицы. Наука молодых (Eruditio Juvenium). 2022;10(1):5–14. https://doi.org/10.23888/HMJ20221015-14
18. Liu T, Shi L, Gu Z, Dan W, Dan N. A novel combined polyphenol-aldehyde crosslinking of collagen film-Applications in biomedical materials. Int J BiolMacromol. 2017;101:889–895. https://doi.org/10.1016/j.ijbiomac.2017.03.166
Об авторах
К. И. МелконянРоссия
Мелконян Карина Игоревна — кандидат медицинских наук, заведующая центральной научно-исследовательской лабораторией, доцент кафедры фундаментальной и клинической биохимии.
Ул. им. Митрофана Седина, д. 4, Краснодар, 350063
С. Н. Алексеенко
Россия
Алексеенко Сергей Николаевич — доктор медицинских наук, доцент, заведующий кафедрой профилактики заболеваний, здорового образа жизни и эпидемиологии.
Ул. им. Митрофана Седина, д. 4, Краснодар, 350063
И. М. Быков
Россия
Быков Илья Михайлович — доктор медицинских наук, профессор, заведующий кафедрой фундаментальной и клинической биохимии.
Ул. им. Митрофана Седина, д. 4, Краснодар, 350063
Дополнительные файлы
Рецензия
Для цитирования:
Мелконян К.И., Алексеенко С.Н., Быков И.М. Сравнительная оценка эффективности репарации ожоговых ран при применении гидрогелевого материала на основе дермы: доклиническое экспериментальное исследование. Кубанский научный медицинский вестник. 2023;30(6):15-27. https://doi.org/10.25207/1608-6228-2023-30-6-15-27
For citation:
Melkonyan K.I., Alekseenko S.N., Bykov I.M. Comparative evaluation of efficiency of burn wound healing with derma-based hydrogel: a preclinical experimental study. Kuban Scientific Medical Bulletin. 2023;30(6):15-27. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-6-15-27








































