Перейти к:
Влияние глутатион-содержащего динитрозильного комплекса железа на состояние окислительного метаболизма и кристаллогенные свойства плазмы крови крыс: доклиническое экспериментальное исследование
https://doi.org/10.25207/1608-6228-2023-30-6-28-40
Аннотация
Введение. Многогранная регуляторная роль оксида азота в биологических системах предопределяет высокую ценность изучения возможностей внешнего управления уровнем соединения в органах и тканях. Существует несколько принципиально различных путей экзогенной модуляции метаболизма оксида азота. В частности, наиболее перспективным является применение фармакологических доноров. Особое место среди последних принадлежит динитрозильным комплексам железа с различными лигандами, рассматриваемым как естественная депонированная форма оксида азота.
Цель исследования — изучение действия глутатион-содержащего динитрозильного комплекса железа на параметры окислительного метаболизма и кристаллогенную активность крови крыс.
Методы. Доклиническое экспериментальное рандомизированное исследование проведено на 60 половозрелых крысах-самцах линии Wistar массой около 250 г. Животные были разделены на 6 групп, состоящих из 10 особей: группа 1 — интактная (без каких-либо манипуляций), группа 2 — в течение 10 дней ежедневно крысам осуществляли внутрибрюшинное введение 1 мл 0,9 % раствора хлорида натрия. Крысам, включенным в остальные группы, в течение 10 дней ежедневно осуществляли внутрибрюшинное введение 1 мл динитрозильных комплексов железа с глутатионовыми лигандами в изотоническом растворе хлорида натрия с различной концентрацией агента: 0,15 мМ — группа 3; 0,30 мМ — группа 4, 0,45 мМ — группа 5 и 0,60 мМ — группа 6. Итоговым показателем исследования явилась оценка окислительного потенциала и кристаллогенных свойств крови в условиях введения различных доз глутатион-содержащих динитрозильных комплексов железа. В качестве оценочных параметров активности прои антиоксидантных систем использовали: интенсивность перекисного окисления липидов; общую активность антиоксидантных систем, концентрацию малонового диальдегида. Параметрами оценки собственной кристаллизации служили: индекс структурности фасции, кристаллизуемость, оценка краевой зоны фасции и степень деструкции элементов фасции. Расчет полученных данных проводили при использовании программных комплексов MS Office 2013 (Microsoft Corporation, США), Statistica, v. 10 (StatSoft, США).
Результаты. В ходе проведенных исследований установлено наличие антиоксидантного эффекта у глутатион-содержащих динитрозильных комплексов железа, причем выраженность этих свойств демонстрирует нелинейную зависимость от их дозы с возможным оптимумом, лежащим в диапазоне 0,3–0,45 мМ. Также выявлена тенденция к активации кристаллогенных свойств данным агентом, соответствующая концентрациям 0,3 и 0,45 мМ.
Заключение. Проведенные исследования свидетельствуют о наличии антиоксидантного эффекта у глутатион-содержащих динитрозильных комплексов железа, причем выраженность этих свойств демонстрирует зависимость от их дозы с возможным оптимумом, лежащим в диапазоне 0,3–0,45 мМ. Установлено активирующее действие инъекций глутатион-содержащих динитрозильных комплексов железа на кристаллогенный потенциал сыворотки крови здоровых крыс, проявляющееся в увеличении плотности кристаллических элементов и их усложнении, причем, как и для метаболических показателей, максимальная выраженность данной тенденции соответствовала концентрациям 0,3 и 0,45 мМ.
Ключевые слова
Для цитирования:
Мартусевич А.К., Суровегина А.В., Кононец В.В., Давыдюк А.В., Перетягин С.П. Влияние глутатион-содержащего динитрозильного комплекса железа на состояние окислительного метаболизма и кристаллогенные свойства плазмы крови крыс: доклиническое экспериментальное исследование. Кубанский научный медицинский вестник. 2023;30(6):28-40. https://doi.org/10.25207/1608-6228-2023-30-6-28-40
For citation:
Martusevich A.K., Surovegina A.V., Kononets V.V., Davydyuk A.V., Peretyagin S.P. Effect of a glutathione-containing dinitrosyl iron complex on the oxidative metabolic state and crystallogenic properties of rat blood plasma: a preclinical experimental study. Kuban Scientific Medical Bulletin. 2023;30(6):28-40. https://doi.org/10.25207/1608-6228-2023-30-6-28-40
ВВЕДЕНИЕ
Многогранная регуляторная роль оксида азота в биологических системах предопределяет высокую ценность изучения возможностей внешнего управления уровнем соединения в органах и тканях. Для данного соединения, помимо наиболее известного биологического эффекта — вазодилатационной активности, показано участие в нейротрансмиссии, модификации процессов свертывания крови, осуществлении внутриклеточного киллинга в рамках фагоцитарного «респираторного взрыва», мембранотропное действие и др. [1–4]. При этом важно отметить крайне малое время жизни молекулы монооксида азота, составляющее в среднем 6 секунд в свободном состоянии [5][6], что предъявляет высокие требования к регуляции метаболизма данного соединения и обеспечивает необходимость присутствия в организме веществ, временно депонирующих NO либо создающих условия для его синтеза в случае необходимости [7][8].
В настоящее время существует несколько принципиально различных путей экзогенной модуляции NO-метаболизма, в том числе введение в организм субстрата NO-синтазы — L-аргинина, применение селективных ингибиторов данного фермента, влияние на высвобождение соединения, а также использование широкого спектра фармакологических доноров [9–11]. Особое место среди последних принадлежит динитрозильным комплексам железа (ДНКЖ) с различными лигандами, рассматриваемым как естественная депонированная форма оксида азота [12–15]. В то же время биологические эффекты экзогенных ДНКЖ раскрыты недостаточно подробно [16]. Экспериментальные данные, полученные в исследованиях in vivo и опубликованные рядом авторов, дают основание полагать наличие у динитрозильных комплексов железа выраженных антиоксидантных свойств [17][18]. Эта гипотеза была подтверждена при моделировании окислительного стресса in vitro (путем введения в образцы биологической жидкости озонированного физиологического раствора в высокой концентрации) и in vivo (при моделировании термической травмы у крыс) [19]. С другой стороны, указанные сведения нуждаются в подтверждении in vivo и у здоровых животных.
Цель исследования — изучение действия глутатион-содержащего динитрозильного комплекса железа на параметры окислительного метаболизма и кристаллогенную активность крови крыс.
МЕТОДЫ
Экспериментальные животные
Эксперимент выполнен на 60 половозрелых крысах-самцах линии Wistar массой около 250 г, полученных из питомника «Столбовая» — филиала федерального государственного бюджетного учреждения науки «Научный центр биомедицинских технологий Федерального медико-биологического агентства» в осенне-зимний период.
Размещение и содержание
Животные содержались в условиях вивария Университетской экспериментально-биологической клиники федерального государственного бюджетного образовательного учреждения высшего образования «Приволжский исследовательский медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО «ПИМУ» Минздрава России) (далее вивария) в соответствии с руководством ARRIVE (Animal Research: Reporting of In Vivo Experiments) и правилами работы с животными на основе положений Хельсинкской декларации и рекомендаций, содержащихся в Директиве ЕС 86/609/ECC и Конвенции Совета Европы по защите позвоночных животных, используемых для экспериментальных и других научных целей, на стандартном водном и пищевом рационе со свободным доступом к пище и воде.
Дизайн исследования
Исследование являлось рандомизированным. Введение препаратов и забор биологического материала осуществлялось в условиях вивария. Лабораторный этап исследований проведен на базе Лаборатории медицинской биофизики Университетской клиники ФГБОУ ВО «ПИМУ» Минздрава России. Блок-схема дизайна исследования представлена на рисунке 1.
Объем выборки
Животные были разделены на 6 групп, состоящих из 10 особей, по методу «конвертов». Группа 1 — интактная (без каких-либо манипуляций), группа 2 — в течение 10 дней ежедневно крысам осуществляли внутрибрюшинное введение 1 мл 0,9 % раствора хлорида натрия. Крысам, включенным в остальные группы, в течение 10 дней ежедневно осуществляли внутрибрюшинное введение 1 мл динитрозильных комплексов железа с глутатионовыми лигандами в изотоническом растворе хлорида натрия с различной концентрацией агента: 0,15 мМ — группа 3; 0,30 мМ — группа 4, 0,45 мМ — группа 5 и 0,60 мМ — группа 6.
Предварительно проведенный анализ на нормальность распределений для величин возраста и массы крыс в группах по критерию Шапиро — Уилка показал, что нормального закона распределения нет в трех группах по возрасту (р < 0,05) и в одной группе по массе (р < 0,05). Для доказательства того факта, что возраст и масса крыс однородны, применялся непараметрический метод сравнения по критерию Краскела — Уоллиса. Данные о центре распределения в виде медианы и квартилей (Q1 — первая квартиль, или 25-й процентиль, и Q3 — третья квартиль, или 75-й процентиль) приведены в таблице 1.
Для возраста и веса различия в значениях медиан для различных групп крыс статистически не значимы: р = 0,253 и р = 0,778 соответственно.
Критерии соответствия
Критерии включения
В исследование включались крысы линии Wistar массой около 250 г мужского пола в возрасте двух месяцев без видимых патологий в физическом развитии и травм.
Критерии невключения
В исследование не включались животные массой более 250 ± 1 г в возрасте менее 56 и более 64 дней, самки, с визуализируемыми патологиями развития и травмами.
Рандомизация
В соответствии с критериями включения и исключения было отобрано 60 животных. Распределение животных на группы осуществлялась случайным образом («методом конвертов»). Каждому животному был присвоен один из шести номеров группы, извлекаемых из непрозрачного конверта с 60 листками с номером группы. В зависимости от указанной группы в конверте все животные были разделены на шесть групп по 10 животных в каждой.
Обеспечение анонимности данных
Информацией о распределении животных на группы располагал руководитель исследования А. К. Мартусевич. Оценка результатов и анализ полученных данных проводились коллективом авторов без введения дополнительных лиц.
Итоговые показатели (исходы исследования)
Итоговым показателем исследования явилась оценка кристаллогенных свойств и окислительного потенциала крови в условиях введения различных доз ДНКЖ.
Экспериментальные процедуры
Оценка кристаллогенных свойств и окислительного потенциала крови осуществлялась в биологической жидкости (крови). У животных всех групп проводили получение образцов крови из подъязычной вены, причем у крыс первой (интактной) группы — однократно, а у представителей остальных групп — двукратно (до и сразу по завершении курса воздействий). Введение изучаемых растворов осуществлялось ежедневно в течение 10 дней в объеме 1 мл раствора.
Динитрозильные комплексы железа с глутатионовыми лигандами синтезировали по методике А. Ф. Ванина [20]. Концентрация соединения в физиологическом растворе, определяемая спектрофотометрически при длинах волны 310 и 360 нм по известной экстинкции, составляла 3,1 ммоль/л.
В плазме крови крыс методом Fe 2+-индуцированной биохемилюминесценции (БХЛ-06, Россия) изучали активность про- и антиоксидантных систем. В качестве оценочных параметров использовали: светосумму биохемилюминесценции за 30 с, которую принято рассматривать как индикатор интенсивности перекисного окисления липидов (ПОЛ) (усл. ед.); общую активность антиоксидантных систем (АОА) (усл. ед.), рассматриваемую как критерий интенсивности, а также тангенс угла наклона кинетической кривой хемилюминесценции tg 2α; концентрацию малонового диальдегида (МДА) в плазме крови (мМоль/л).
Кристаллогенные свойства сыворотки крови изучали методом классической кристаллоскопии. Оценку результатов собственной структуризации биологической жидкости осуществляли критериально, с использованием специализированной системы параметров [21]: кристаллизуемость (КР) (баллы) — плотность кристаллических элементов в микропрепарате; индекс структурности (ИС) (баллы) — параметр, характеризующий сложность формирующихся структур — от аморфных тел до высокоразветвленных дендритов; степень деструкции фации (СДФ) (баллы) — указывает на уровень разрушения элементов микропрепарата; выраженность краевой зоны (КЗ) (баллы).
Уход за животными и мониторинг
Животные содержались в условиях вивария со свободным доступом к пище и воде. По окончанию исследований животных из эксперимента выводили под общей анестезией с применением препаратов тилетамина гидрохлорид в дозировке 60 мг/кг и ксилазина гидрохлорид — 6 мг/кг, внутримышечно.
Статистические процедуры
Принципы расчета размера выборки
Предварительный расчет выборки не производился.
Статистические методы
Числовые выборки проверялись на соответствие нормальному закону распределения с помощью критериев Колмогорова и Смирнова или Шапиро — Уилка. При отклонении от нормальности описательную статистику представляли в виде медианы и первой и третьей квартили Ме (Q1–Q3). В случае соответствия нормальности описательную статистику представляли в виде среднего значения и стандартного отклонения (М ± SD). При анализе влияния фактора на все группы использовали однофакторный дисперсионный анализ по критерию Фишера для выборок с законом распределения, близким к нормальному. Попарно сравнивали с помощью критерия Стьюдента для независимых выборок. При анализе влияния фактора на все группы использовали однофакторный дисперсионный анализ по критерию Краскела — Уоллиса для выборок с законом распределения не соответствующим нормальному. Попарно сравнивали с помощью критерия Манна — Уитни для независимых выборок. Уровень статистической значимости р ≤ 0,05. Расчеты проводились при использовании программных комплексов MS Office 2013 (Microsoft Corporation, США), Statistica, v. 10 (StatSoft, США). Показатели приведены к нормированному показателю. Средние значения показателей для группы нативных животных приняты за 100 %. Данные представлены в виде гистограмм.
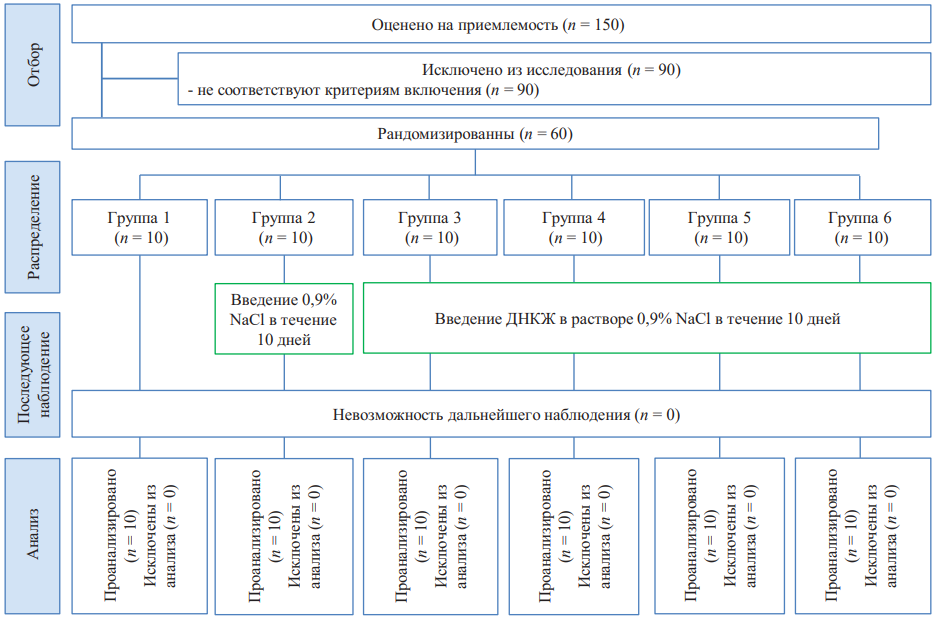
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема составлена авторами (согласно рекомендациям ARRIVE). Сокращения: NaCl — изотонический раствор хлорида натрия; ДНКЖ — динитрозильные комплексы железа с глутатионовыми лигандами.
Fig. 1. Block diagram of the research design
Note: the block diagram was created by the authors (in compliance with the ARRIVE quidelines). Abbreviations: NaCl — isotonic sodium chloride solution; ДНКЖ — dinitrosyl iron complexes with glutathione ligands.
Таблица 1. Медианы, первая и третья квартили (Ме (Q1–Q3)) для возраста и веса крыс в исследуемых группах
Table 1. Medians, first and third quartiles (Me (Q1–Q3)) for the age and weight of rats in the study groups
Величины | Группы | Критерий Краскела — Уоллиса | |||||
1 | 2 | 3 | 4 | 5 | 6 | ||
Возраст, дни | 57,0 (57,0–60,3) | 59,0 (58,0–63,0) | 57,0 (56,3–57,0) | 57,5 (57,0–60,5) | 60,0 (57,0–62,0) | 58,5 (57,0–60,5) | 0,253 |
Масса, г | 249,8 (249,6–250,2) | 250,2 | 250,3 | 250,2 | 250,0 (249,7–250,3) | 250,2 | 0,778 |
Примечание: таблица составлена авторами.
Note: the table was compiled by the authors.
РЕЗУЛЬТАТЫ
Установлено, что инфузии физиологического раствора, не содержащего изучаемого вещества, не оказывают значимого действия как на интенсивность перекисного окисления липидов в плазме крови крыс, так и на ее общую антиоксидантную активность. Напротив, применение физиологического донора оксида азота во всех используемых дозировках изменяло значения указанных параметров (табл. 2). В частности, интенсивность липопероксидации демонстрировала выраженную статистически значимую зависимость от концентрации вводимых ДНКЖ (по критерию Фишера для однофакторного дисперсионного анализа р = 0,049, где в виде фактора выступает концентрация раствора ДНКЖ).
Так, при введении животным минимальной дозы соединения (1 мл 0,15 мМ раствора) не наблюдали значимых отклонений показателя от показателя для группы интактных животных (р = 0,940). В случае увеличения концентрации вещества в растворе (0,3 мМ и выше) отмечали снижение интенсивности процессов липопероксидации, достигающее минимума при проведении курса инфузий 0,45 мМ раствора ДНКЖ или у животных группы 5 (p < 0,05 по критерию Стьюдента для независимых выборок между парами показателя для группы 5 и показателями для первой, второй и третьей групп животных, кроме групп 4 и 6). Дальнейшее увеличение дозы вводимого донора NO оказывает менее выраженное действие на уровень параметра, что может быть обусловлено формированием избытка вещества за счет частичного разрушения комплексов с высвобождением оксида азота и трансформацией последнего в пероксинитрит, один из наиболее сильных окислителей-биорадикалов [19][21].
Средние значения общей антиоксидантной активности плазмы крови оказалась зависимыми от концентрации раствора ДНКЖ. В частности, не наблюдали существенных отличий показателя у крыс, получавших инфузии только физиологического раствора (по критерию Стьюдента р = 0,915), тогда как при добавлении в него ДНКЖ в любой из изученных концентраций отмечали увеличение значения указанного параметра (по критерию Фишера для однофакторного дисперсионного анализа р = 0,005, где в виде фактора выступает концентрация раствора ДНКЖ) (табл. 2). В наименьшей степени данная тенденция была выражена для минимальной дозы соединения (0,15 мМ). Так, в диапазоне 0,15–0,45 мМ ДНКЖ регистрировали увеличение общей антиоксидантной активности плазмы: для концентраций 0,15; 0,30 и 0,45 мМ оно составило 1,07; 1,24 и 1,31 раза соответственно по отношению к значениям показателя для группы нативных животных. Для группы 6 увеличение составило 1,13 раза. Для групп 4–6 по критерию Стьюдента различия статистически значимы (р < 0,05). Дальнейшее нарастание количества вводимого соединения (до 0,6 мМ) обеспечивало обратный эффект: общая антиоксидантная активность в этом случае возрастала лишь на 13 % относительно здоровых животных (p < 0,05). По нашему мнению, механизм этих сдвигов аналогичен представленному выше в отношении динамики процессов липопероксидации рассматриваемым донором оксида азота.
Результаты биохемилюминесцентного анализа, характеризующие компоненты окислительного метаболизма, были дополнительно верифицированы путем оценки концентрации стабильного продукта перекисного окисления липидов — малонового диальдегида (МДА) в плазме крови животных сформированных групп (табл. 2). В частности, по данному параметру не выявлено существенной динамики у крыс, получавших инъекции только физиологического раствора (р = 0,655). Также незначительные изменения показателя были зафиксированы в группе животных, которым вводили минимальную концентрацию ДНКЖ (р = 0,533). В то же время двукратное увеличение действующей концентрации соединения (до 0,3 мМ) существенно усиливает степень снижения уровня малонового диальдегида в плазме крови (-24 %; р = 0,049 по сравнению со здоровыми особями). Аналогичное поведение отмечено и при использовании концентрации 0,45 мМ (-14 %; но р = 0,247 и статистически не значимо). При этом дальнейшее увеличение дозы ДНКЖ (до 4-кратной от минимальной) способствовало менее выраженному уменьшению уровня изучаемого метаболита перекисного окисления липидов (-5 %; р = 0,717 и также статистически не значимо). Изменение значения малонового диальдегида по дисперсионному однофакторному анализу, где фактор — концентрация раствора ДНКЖ, статистически значимо (р = 0,050).
Так как значения показателей окислительного метаболизма в абсолютных единицах отличались между собой на несколько порядков, то привели все значения к нормированному показателю. Приняли средние значения показателей для группы нативных животных за 100 %. Получили гистограмму (рис. 2–4) для всех показателей окислительного метаболизма. Наиболее статистически значимы (р = 0,005) изменения для показателя АОА (рис. 3).
Установлено, что введение животным физиологического раствора, не содержащего естественного донора оксида азота, не оказывало значимого воздействия на параметры собственной кристаллизации биологической жидкости. Так, различия значений медиан для показателей между группами 1 и 2 были статистически незначимы, для показателя ИС по критерию Манна — Уитни р = 0,650, для показателя Кр р = 0,705, для показателя СДФ р = 0,706 и для показателя Кз р = 0,571 (табл. 3).
В то же время применение растворов ДНКЖ изменяло значения этих показателей по сравнению с интактными животными. Однако не для всех показателей влияние растворов различной концентрации как фактора было статистически значимым.
В частности, значение медианы показателя индекса структурности фаций сыворотки крови или показателя ИС в сравниваемых группах по критерию Краскела — Уоллиса отличалось, но статистической значимости не показывало р = 0,306. Этот параметр отражает сложность структуропостроения элементов фации, а диапазон от 1 до 2 усл. ед. характеризуется присутствием в микропрепарате как одиночно-кристаллических, так и дендритных элементов, причем увеличение значения показателя свидетельствует о повышении доли последних в кристаллограмме. Максимальное значение медианы индекса структурности определялось при введении крысам физиологического раствора, включающего 0,3 мМ ДНКЖ (табл. 3 и рис. 5). В этом случае медиана параметра превышала медиану для группы животных с физиологическими значениями в 2,0 раза (p = 0,029), что статистически значимо, а значение показателя, достигнутое при концентрации агента 0,15 мМ, превышало также в 2,0 раза, но статистически не значимо (p = 0,098). Следует отметить, что при концентрации ДНКЖ 0,6 мМ данный показатель, с одной стороны, был больше по значению медианы, чем характерный для интактных крыс, и, с другой стороны меньше, чем значение медианы для группы животных с раствором 0,3 мМ ДНКЖ.
Изменения была зафиксированы и в отношении кристаллизуемости фаций сыворотки крови или показателя Кр — основного количественного критерия оценки собственной кристаллизации последней (табл. 3 и рис. 6). Для этого показателя изменения в соответствии с дисперсионным однофакторным анализом по критерию Краскела — Уоллиса показали бóльшую статистическую значимость влияния фактора концентрации раствора ДНКЖ (р < 0,001).
В этом плане значимо, что изменения индексов структурности и кристаллизуемости, выражающиеся в повышении обоих параметров при внутрибрюшинном введении животным ДНКЖ, однонаправлены и указывают на активацию кристаллогенных свойств биологической жидкости. В то же время если наибольшее значение медианы индекса структурности отмечено при использовании ДНКЖ в концентрации 0,3 мМ, то наибольшее значение медианы кристаллизуемости было зарегистрировано при введении 0,45 мМ ДНКЖ (отличие медианы кристаллизуемости для группы 5 по сравнению с медианой кристаллизуемости для интактных животных статистически значимо; p = 0,002). Следует заметить, что и при применении иных концентраций агента изменения параметра существенны.
Влияние концентраций физиологического донора оксида азота на степень деструкции кристаллоскопических фаций в виде медиан присутствует, но статистически не значимо по критерию Краскела — Уоллиса, по которому р = 0,102 для всех групп сравнения (табл. 3 и рис. 7). Установлено, что данный показатель увеличивается с увеличением дозы ДНКЖ, однако остается в пределах среднего значения показателя в 0,7 усл. ед. при всех концентрациях, кроме 0,6 мМ. Подобный уровень параметра свидетельствует о слабой выраженности деструктивных процессов при формировании кристаллических элементов фации, косвенно указывая на отсутствие значимого токсического эффекта соединения. Умеренное разрушение структур образца отмечается лишь при введении крысам наиболее высокой из примененных концентраций вещества (0,6 мМ).
Однотипность выявлена и для выраженности краевой белковой зоны микропрепарата при действии различных концентраций ДНКЖ (табл. 3 и рис. 8). Так, при всех используемых дозах соединения регистрировали уменьшение значения медиан данного показателя, однако статистической значимости влияния фактора в виде концентраций ДНКЖ на показатель краевой белковой зоны микропрепарата или показатель Кз не выявлено, т. к. р = 0,258.
Таблица 2. Средние значения (М ± SD) показателей окислительного метаболизма в сравниваемых группах животных
Table 2. Mean values (M ± SD) of oxidative metabolism parameters in the compared animal groups
Группы | Показатели окислительного метаболизма | ||
ПОЛ (у. е.) | АОА (у. е.) | МДАпл (мМ/л) | |
Гр. 1 (интактные) (n = 10) | 10,57 ± 1,89 | 0,45 ± 0,06 | 0,96 ± 0,32 |
Гр. 2 (контроль) (n = 10) | 10,88 ± 1,98 | 0,46 ± 0,07 | 1,02 ± 0,25 |
Гр. 3 (0,15 мМ) (n = 10) | 10,32 ± 2,61 | 0,48 ± 0,07 | 0,89 ± 0,17 |
Гр. 4 (0,30 мМ) (n = 10) | 8,76 ± 2,24 | 0,56 ± 0,12 | 0,73 ± 0,10 |
Гр. 5 (0,45 мМ) (n = 10) | 7,53 ± 2,45 | 0,59 ± 0,08 | 0,83 ± 0,13 |
Гр. 6 (0,60 мМ) (n = 10) | 9,61 ± 3,31 | 0,51 ± 0,05 | 0,91 ± 0,11 |
Уровень значимости | р = 0,049 | р = 0,005 | р = 0,050 |
Примечание: таблица составлена авторами. Сокращения: Гр. — группа; у. е. — условные единицы измерения; ПОЛ — перекисное окисление липидов; АОА — общая активность антиоксидантных систем; МДА — концентрация малонового диальдегида.
Note: the table was compiled by the authors. Abbreviations: Гр. — group; c. u. — common units of measurement; LPO — lipid peroxidation; AOA — total activity of antioxidant systems; МДА — malondialdehyde concentration.
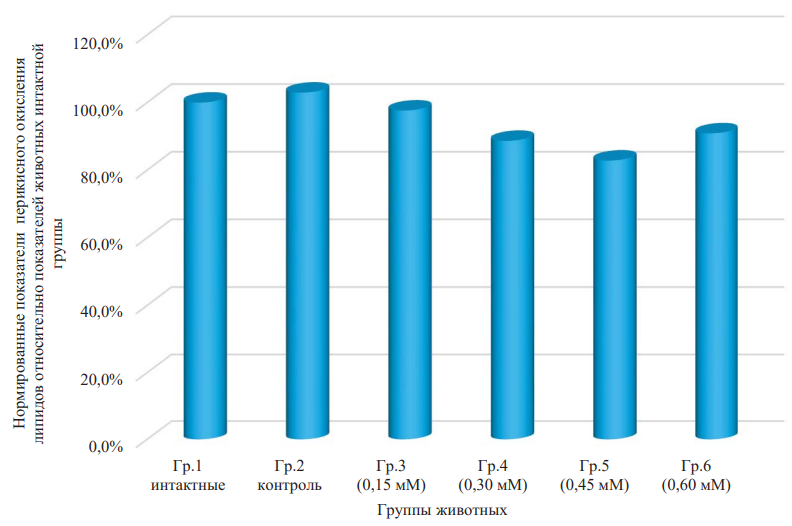
Рис. 2. Нормированные показатели перекисного окисления липидов относительно показателей животных интактной группы
Примечание: рисунок выполнен авторами. Сокращение: Гр. — группа.
Fig. 2. Standardized lipid peroxidation indices relative to those of the intact group animals
Note: the figure was created by the authors. Abbreviation: Гр. — group.
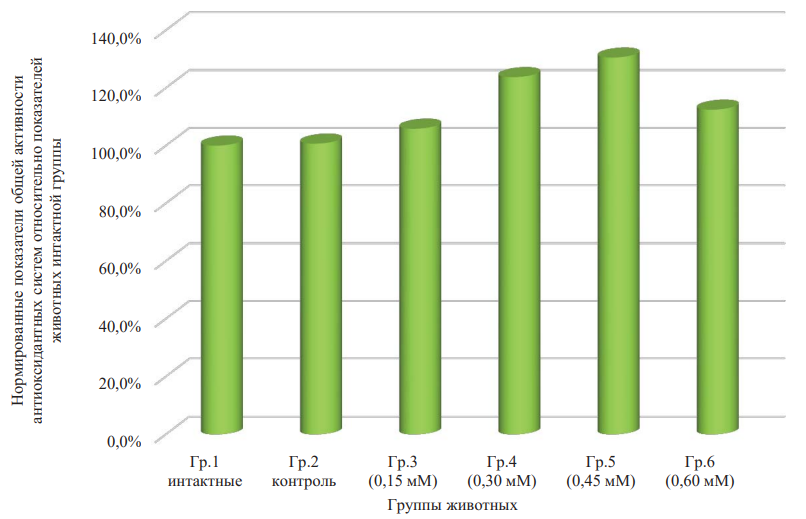
Рис. 3. Нормированные показатели общей активности антиоксидантных систем относительно показателей животных интактной группы
Примечание: рисунок выполнен авторами. Сокращение: Гр. — группа.
Fig. 3. Standardized indices of the total activity of antioxidant systems relative to the indices of the intact group animals
Note: the figure was created by the authors. Abbreviation: Гр. — group.
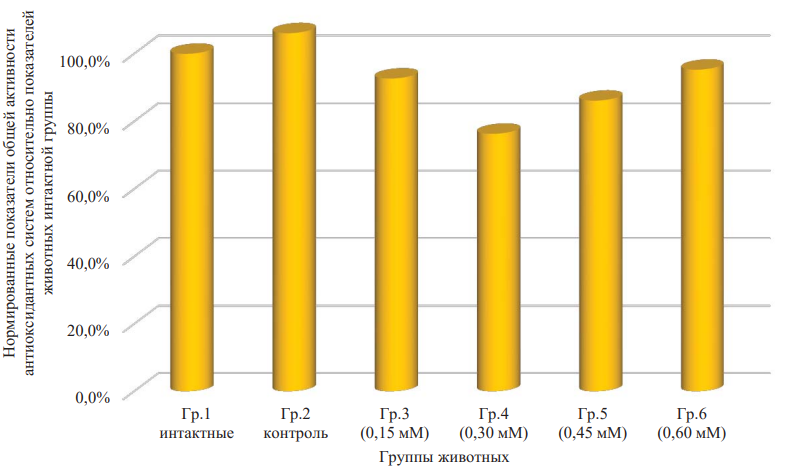
Рис. 4. Нормированные показатели концентрации малонового деальдегида относительно показателей животных интактной группы
Примечание: рисунок выполнен авторами. Сокращение: Гр. — группа.
Fig. 4. Standardized indices of malondialdehyde concentration relative to the indices of the intact group animals
Note: the figure was created by the authors. Abbreviation: Гр. — group.
Таблица 3. Медианы, первая и третья квартили (Ме (Q1–Q3)) показателей собственной кристаллизации в сравниваемых группах животных
Table 3. Medians, first and third quartiles (Ме (Q1–Q3)) of intrinsic crystallization indices in the compared animal groups
Группы | Показатели собственной кристаллизации | |||
ИС (баллы) | Кр (баллы) | СДФ (баллы) | Кз (баллы) | |
Гр. 1 (интактные) (n = 10) | 1,0 (0,0–2,0) | 0,0 (0,0–1,0) | 0,0 (0,0–0,8) | 3,0 (2,3–3,0) |
Гр. 2 (контроль) (n = 10) | 1,0 (1,0–2,0) | 0,5 (0,0–1,0) | 0,0 (0,0–1,0) | 2,5 (2,0–3,0) |
Гр. 3 (0,15 мМ) (n = 10) | 1,0 (1,0–2,0) | 1,0 (1,0–1,8) | 1,0 (0,0–1,0) | 2,0 (2,0–3,0) |
Гр. 4 (0,30 мМ) (n = 10) | 2,0 (2,0–2,0) | 1,0 (1,0–2,0) | 1,0 (0,3–1,0) | 3,0 (2,3–3,0) |
Гр. 5 (0,45 мМ) (n = 10) | 1,5 (1,0–2,0) | 1,5 (1,0–2,0) | 1,0 (0,0–1,0) | 2,5 (2,0–3,0) |
Гр. 6 (0,60 мМ) (n = 10) | 1,5 (1,0–2,0) | 1,0 (1,0–2,0) | 1,0 (1,0–1,0) | 3,0 (1,5–3,0) |
Уровень значимости | р = 0,306 | р < 0,001 | р = 0,102 | р = 0,258 |
Примечание: таблица составлена авторами. Сокращения: Гр. — группа; ИС — индекс структурности; КР — кристаллизуемость; СДФ — степень деструкции фации; Кз — выраженность краевой зоны микропрепарата.
Note: the table was compiled by the authors. Abbreviations: Гр. — group; c. u. — common units of measurement; ИС — structural index; КР — crystallizability; СДФ — degree of serum facies destruction; Кз — pronouncedness of the marginal facies zone on the microscope slide.
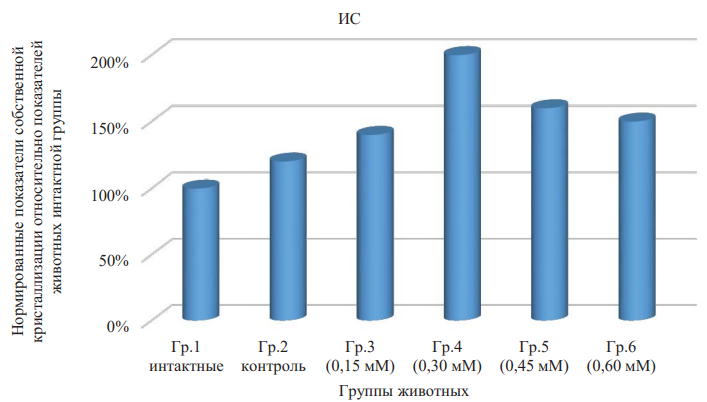
Рис. 5. Нормированные показатели собственной кристаллизации относительно показателей животных интактной группы. Показатель индекса структурности
Примечание: рисунок выполнен авторами. Сокращения: Гр. — группа; ИС — индекс структурности.
Fig. 5. Standardized indices of intrinsic crystallization relative to the indices of the intact group animals. Structural index indicator
Note: the figure was created by the authors. Abbreviations: Гр. — group; ИС — structural index.
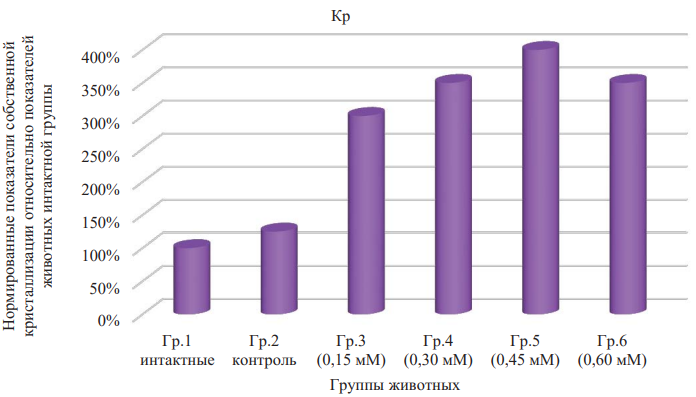
Рис. 6. Нормированные показатели собственной кристаллизации относительно показателей животных интактной группы. Показатель кристаллизуемости
Примечание: рисунок выполнен авторами. Сокращения: Гр. — группа; Кр — кристаллизуемость.
Fig. 6. Standardized indices of intrinsic crystallization relative to the indices of the intact group animals. Crystallizability index
Note: the figure was created by the authors. Abbreviations: Гр. — group; Кр — crystallizability.
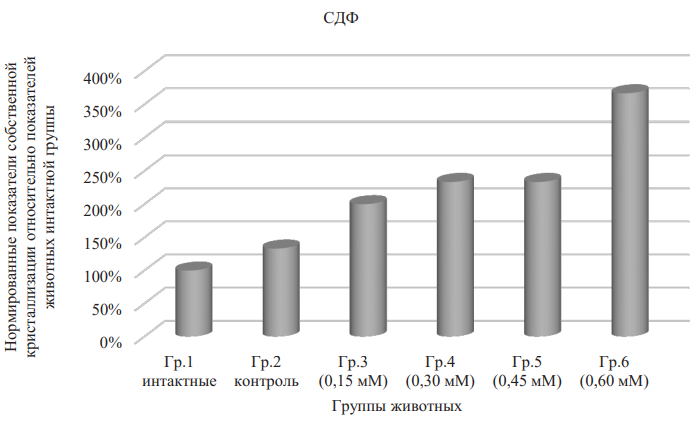
Рис. 7. Нормированные показатели собственной кристаллизации относительно показателей животных интактной группы. Степень деструкции фаций
Примечание: рисунок выполнен авторами. Сокращения: Гр. — группа; СДФ — степень деструкции фаций.
Fig. 7. Standardized indices of intrinsic crystallization relative to the indices of the intact group animals. Degree of facies destruction
Note: the figure was created by the authors. Abbreviations: Гр. — group; СДФ — degree of facies destruction.
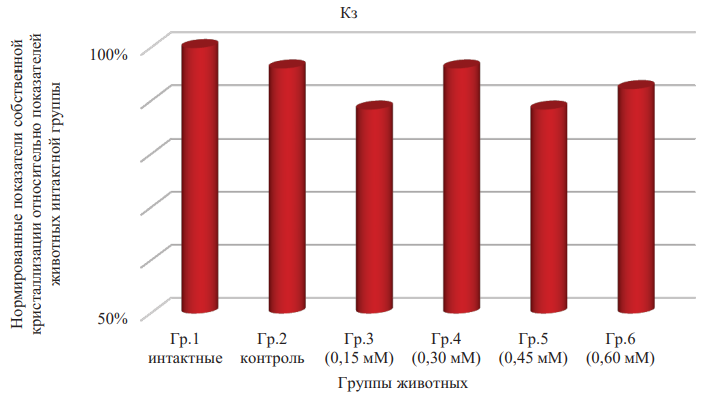
Рис. 8. Нормированные показатели собственной кристаллизации относительно показателей животных интактной группы. Выраженность краевой зоны
Примечание: рисунок выполнен авторами. Сокращения: Гр. — группа; Кз — выраженность краевой зоны.
Fig. 8. Standardized indices of intrinsic crystallization relative to the indices of the intact group animals. Pronouncedness of the marginal serum facies zone
Note: the figure was created by the authors. Abbreviations: Гр. — group; Кз — pronouncedness of the marginal facies zone.
ОБСУЖДЕНИЕ
Интерпретация/научная значимость
Несмотря на уже установленную многочисленность биологических эффектов ДНКЖ, связанных с возможностью высвобождения ими монооксида азота [1][22–28], сравнительно мало внимания уделяется антиоксидантным эффектам соединения. Они были впервые обнаружены нами ранее в экспериментах, выполненных на модели термической травмы [19, 21], а настоящее исследование, проведенное с использованием в качестве тест-биообъекта здоровых лабораторных животных, позволило визуализировать этот эффект. По нашему мнению, он складывается из двух компонентов: непосредственных антиоксидантных свойств самих динитрозильных комплексов железа и соответствующей активности глутатионовых лигандов. В совокупности это и способно обеспечить функционирование ДНКЖ как фармакологического агента с выраженным антиоксидантным потенциалом.
Ограничения исследования
В рамках проведенного исследования был учтен фактор инъецирования животных физиологическим раствором без изучаемого агента (динитрозильных комплексов железа), однако для тестирования был выбран ограниченный диапазон доз соединения (от 0,15 до 0,60 мМ). На основании предшествующих исследований предполагалось, что этот диапазон соответствует наибольшей биорегуляторной активности вещества, однако выход за его пределы может дать дополнительную информацию о биологических эффектах ДНКЖ в более широком диапазоне доз. Кроме того, в связи с необходимостью максимального уменьшения количества групп животных по соображениям биоэтики нами были использованы только 4 концентрации соединения. При увеличении количества точек внутри рассматриваемого диапазона могут быть получены дополнительные данные, уточняющие выделенные зависимости «доза — эффект».
Обобщаемость/экстраполяция
Известно, что ДНКЖ, используемые в качестве естественного донора оксида азота, могут выступать стимуляторами коррекции антиоксидантного статуса путем качественного угнетения процессов свободнорадикального окисления липидов [18][19][21]. В данном эксперименте было выявлено, что показатели интенсивности перекисного окисления липидов дозозависимо снижались относительного таковых у интактных животных по мере увеличения концентрации агента ДНКЖ. Однако исключением стала наивысшая использованная концентрация (0,6 мМ), повлиявшая на показатель ПОЛ в плазме крови в меньшей степени, чем предшествующая доза ДНКЖ (0,45 мМ), но и в этом случае наблюдалось снижение показателя относительно аналогичного у интактных крыс. Анализ уровня малонового диальдегида в плазме крови также подтвердил снижение и ослабление интенсификации ПОЛ с увеличением вводимой концентрации ДНКЖ. Сходная тенденция изменений фиксировалась и в отношении параметра общей антиоксидантной активности плазмы крови. Способность ДНКЖ к антиоксидантному воздействию обусловлена возможностью комплексов перехвата свободных радикалов и последующего восстановления оксоферрильной формы миоглобина. Перехват О2-, образующийся в ходе разложения супероксида, является характерным для ДНКЖ с тиол-содержащими лигандами [29][30].
В отношении кристаллогенных свойств сыворотки крови крыс были зафиксированы изменения, свидетельствующие о положительном влиянии введения ДНКЖ в концентрациях 0,3 и 0,45 мМ. Это выражалось в повышении ключевых параметров: индекса структурности и кристаллизуемости фаций. При этом индикаторы возможного токсического воздействия используемого агента (показатели степени деструкции фации и выраженности краевой белковой зоны) продемонстрировали умеренные отклонения в сравнении с аналогичными у интактных животных.
ЗАКЛЮЧЕНИЕ
В целом проведенные исследования свидетельствуют о наличии антиоксидантного эффекта у глутатион-содержащих ДНКЖ, причем выраженность этих свойств демонстрирует зависимость от их дозы с возможным оптимумом, лежащим в диапазоне 0,3–0,45 мМ (доза агента — 2,86–4,29 мкг/г массы животного). Установлено активирующее действие инъекций глутатион-содержащих ДНКЖ на кристаллогенный потенциал сыворотки крови здоровых крыс. Оно проявилось в увеличении плотности кристаллических элементов и их усложнении, причем как и для метаболических показателей, максимальная выраженность данной тенденции соответствовала концентрациям 0,3 и 0,45 мМ.
Список литературы
1. Saldanha C. Physiological role of erythrocyte nitric oxide. Clin Hemorheol Microcirc. 2016;64(4):517–520. https://doi.org/10.3233/CH-168028
2. Piacenza L, Zeida A, Trujillo M, Radi R. The superoxide radical switch in the biology of nitric oxide and peroxynitrite. Physiol Rev. 2022;102(4):1881–1906. https://doi.org/10.1152/physrev.00005.2022
3. Soundararajan L, Dharmarajan A, Samji P. Regulation of pleiotropic physiological roles of nitric oxide signaling. Cell Signal. 2023;101:110496. https://doi.org/10.1016/j.cellsig.2022.110496
4. Maher A, Abdel Rahman MF, Gad MZ. The Role of Nitric Oxide from Neurological Disease to Cancer. Adv Exp Med Biol. 2017;1007:71–88. https://doi.org/10.1007/978-3-319-60733-7_5
5. Radi R. Oxygen radicals, nitric oxide, and peroxynitrite: Redox pathways in molecular medicine. Proc Natl Acad Sci USA. 2018;115(23):5839– 5848. https://doi.org/10.1073/pnas.1804932115
6. Wu G, Meininger CJ, McNeal CJ, Bazer FW, Rhoads JM. Role of L-Arginine in Nitric Oxide Synthesis and Health in Humans. Adv Exp Med Biol. 2021;1332:167–187. https://doi.org/10.1007/978-3-03074180-8_10
7. Tejero J, Shiva S, Gladwin MT. Sources of Vascular Nitric Oxide and Reactive Oxygen Species and Their Regulation. Physiol Rev. 2019;99(1):311–379. https://doi.org/10.1152/physrev.00036.2017
8. Li W, Wang D, Lao KU, Wang X. Inclusion Complexation of S-Nitrosoglutathione for Sustained Nitric Oxide Release from Catheter Surfaces: A Strategy to Prevent and Treat Device-Associated Infections. ACS Biomater Sci Eng. 2023;9(3):1694–1705. https://doi.org/10.1021/acsbiomaterials.2c01284
9. Gupta KJ, Kolbert Z, Durner J, Lindermayr C, Corpas FJ, Brouquisse R, Barroso JB, Umbreen S, Palma JM, Hancock JT, Petrivalsky M, Wendehenne D, Loake GJ. Regulating the regulator: nitric oxide control of post-translational modifications. New Phytol. 2020 Sep;227(5):1319–1325. https://doi.org/10.1111/nph.16622
10. Barandov A, Ghosh S, Jasanoff A. Probing nitric oxide signaling using molecular MRI. Free Radic Biol Med. 2022;191:241–248. https://doi.org/10.1016/j.freeradbiomed.2022.08.042
11. Wu M, Lu Z, Wu K, Nam C, Zhang L, Guo J. Recent advances in the development of nitric oxide-releasing biomaterials and their application potentials in chronic wound healing. J Mater Chem B. 2021;9(35):70637075. https://doi.org/10.1039/d1tb00847a
12. Vanin AF. Physico-Chemistry of Dinitrosyl Iron Complexes as a Determinant of Their Biological Activity. Int J Mol Sci. 2021;22(19):10356. https://doi.org/10.3390/ijms221910356
13. Tat’yanenko LV, Sanina NA, Dobrokhotova OV, Kotelnikov AI, Goryachev NS, Pihteleva II, Kozub GI, Kondrateva TA. Action of Iron Nitrosyl Complexes, NO Donors, on the Activity of Sarcoplasmic Reticulum Ca2+-ATPase and Cyclic Guanosine Monophosphate Phosphodiesterase. Dokl Biochem Biophys. 2018;478(1):8–13. https://doi.org/10.1134/S1607672918010039
14. Vanin AF. Dinitrosyl iron complexes with thiol-containing ligands as a “working form” of endogenous nitric oxide. Nitric Oxide. 2016;54:15– 29. https://doi.org/10.1016/j.niox.2016.01.006
15. Borodulin RR, Kubrina LN, Mikoyan VD, Poltorakov AP, Shvydkiy VО, Burbaev DSh, Serezhenkov VA, Yakhontova ER, Vanin AF. Dinitrosyl iron complexes with glutathione as NO and NO+ donors. Nitric Oxide. 2013;29:4-16. http://dx.doi.org/10.1016/j.niox.2012.11.001
16. Vanin AF. EPR Characterization of Dinitrosyl Iron Complexes with Thiol-Containing Ligands as an Approach to Their Identification in Biological Objects: An Overview. Cell Biochem Biophys. 2018;76(1–2):3– 17. https://doi.org/10.1007/s12013-017-0811-8
17. Titov VY, Dolgorukova AM, Osipov AN, Kochish II. Putative Role of Ligands of DNIC in the Physiological Action of the Complex. Bull Exp Biol Med. 2021;171(5):606–610. https://doi.org/10.1007/s10517-02105278-1
18. Ходос М.Я., Казаков Ян.Е., Видревич М.Б., Брайнина Х.З. Окислительный стресс и его роль в патогенезе. Вестник уральской медицинской академической науки. 2017;14(4):381–398. https://doi.org/10.22138/2500-0918-2017-14-4-381-398
19. Мартусевич А.К., Соловьева А.Г., Перетягин С.П. Оценка модификации каталитических свойств альдегиддегидрогеназы эритроцитов крыс в условиях ингаляционного воздействия оксида азота. Бюллетень экспериментальной биологии и медицины. 2016;161(1):4–6. https://doi.org/10.1007/s10517-016-3331-4
20. Мартусевич А.К., Давыдюк А.В., Мартусевич А.А., Ковалева Л.К. Влияние физиологического донора оксида азота на окислительный метаболизм крови крыс. Бюллетень экспериментальной биологии и медицины. 2017;163(5):602–604. https://doi.org/10.1007/s10517-0173858-z
21. Vanin AF, Borodulin RR, Mikoyan VD. Dinitrosyl iron complexes with natural thiol-containing ligands in aqueous solutions: Synthesis and some physico-chemical characteristics (A methodological review). Nitric Oxide. 2017;66:1–9. https://doi.org/10.1016/j.niox.2017.02.005
22. Martusevich A., Kovaleva L., Karuzin K., Feofilova M., Bocharin I., Surovegina A., Nazarov V., Kashirina A. Digital technology for processing dried drops of biofluids. Archiv Euromedica. 2022;12(2):9–11. http://dx.doi.org/10.35630/2199-885X/2022/12/2.2
23. Vanin AF. Positive (Regulatory) and Negative (Cytotoxic) Effects of Dinitrosyl Iron Complexes on Living Organisms. Biochemistry (Mosc). 2022;87(11):1367–1386. http://dx.doi.org/10.1134/S0006297922110153
24. Igrunkova A, Fayzullin A, Serejnikova N, Lipina T, Pekshev A, Vanin A, Zaborova V, Budanova E, Shestakov D, Kastyro I, Shekhter A. Beneficial Effects of Dinitrosyl Iron Complexes on Wound Healing Compared to Commercial Nitric Oxide Plasma Generator. Int J Mol Sci. 2023;24(5):4439. http://dx.doi.org/10.3390/ijms24054439
25. Borodulin RR, Kubrina LN, Shvydkiy VO, Lakomkin VL, Vanin AF. A simple protocol for the synthesis of dinitrosyl iron complexes with glutathione: EPR, optical, chromatographic and biological characterization of reaction products. Nitric Oxide. 2013;35:110–115. http://dx.doi.org/10.1016/j.niox.2013.08.007
26. Thomas DD, Corey C, Hickok J, Wang Y, Shiva S. Differential mitochondrial dinitrosyliron complex formation by nitrite and nitric oxide. Redox Biol. 2018;15:277–283. http://dx.doi.org/10.1016/j.redox.2017.12.007
27. Pisarenko O, Studneva I, Timoshin A, Veselova O. Protective efficacy of dinitrosyl iron complexes with reduced glutathione in cardioplegia and reperfusion. Pflugers Arch. 2019;471(4):583–593. http://dx.doi.org/10.1007/s00424-018-02251-2
28. Mikoyan VD, Burgova EN, Borodulin RR, Vanin AF. The binuclear form of dinitrosyl iron complexes with thiol-containing ligands in animal tissues. Nitric Oxide. 2017;62:1–10. http://dx.doi.org/10.1016/j.niox.2016.10.007
29. Padmaja S, Huie RE. The reaction of nitric oxide with organic peroxyl radicals. Biochem Biophys Res Commun. 1993;195(2):539–544. http://dx.doi.org/10.1006/bbrc.1993.2079
30. Vladimir T, Anatoly O, Larisa I, Vladimir P, Anna D, Аnna O. Hypothetical mechanism of light action on nitric oxide physiological effects. Lasers Med Sci. 2021;36(7):1389–1395. http://dx.doi.org/10.1007/s10103-020-03169-x
Об авторах
А. К. МартусевичРоссия
Мартусевич Андрей Кимович — доктор биологических наук, доцент, руководитель лаборатории медицинской биофизики Университетской клиники Приволжский исследовательский медицинский университет; профессор кафедры физиологии и биохимии животных и акушерства Нижегородский государственный агротехнологический университет.
Пл. Минина и Пожарского, д. 10/1, Нижний Новгород, 603000; пр. Гагарина, д. 97, Нижний Новгород, 603117
А. В. Суровегина
Россия
Суровегина Александра Владимировна — лаборант-исследователь лаборатории медицинской биофизики Университетской клиники Приволжский исследовательский медицинский университет; аспирант кафедры физиологии и биохимии животных и акушерства Нижегородский государственный агротехнологический университет.
Пл. Минина и Пожарского, д. 10/1, Нижний Новгород, 603000; пр. Гагарина, д. 97, Нижний Новгород, 603117
В. В. Кононец
Россия
Кононец Bладимир Bладимирович — заведующий кафедрой физического воспитания.
Пр. Минина, д. 24, г. Нижний Новгород, 603155
А. В. Давыдюк
Россия
Давыдюк Алексей Викторович — кандидат биологических наук, научный сотрудник кафедры физиологии и биохимии животных и акушерства.
Пр. Гагарина, д. 97, Нижний Новгород, 603117
С. П. Перетягин
Россия
Перетягин Сергей Петрович — доктор медицинских наук, профессор, президент Ассоциации российских озонотерапевтов.
Ул. Б. Панина, д. 9, г. Нижний Новгород, 603097
Рецензия
Для цитирования:
Мартусевич А.К., Суровегина А.В., Кононец В.В., Давыдюк А.В., Перетягин С.П. Влияние глутатион-содержащего динитрозильного комплекса железа на состояние окислительного метаболизма и кристаллогенные свойства плазмы крови крыс: доклиническое экспериментальное исследование. Кубанский научный медицинский вестник. 2023;30(6):28-40. https://doi.org/10.25207/1608-6228-2023-30-6-28-40
For citation:
Martusevich A.K., Surovegina A.V., Kononets V.V., Davydyuk A.V., Peretyagin S.P. Effect of a glutathione-containing dinitrosyl iron complex on the oxidative metabolic state and crystallogenic properties of rat blood plasma: a preclinical experimental study. Kuban Scientific Medical Bulletin. 2023;30(6):28-40. https://doi.org/10.25207/1608-6228-2023-30-6-28-40
JATS XML








































