Перейти к:
Характеристики онкологической заболеваемости у пациентов с раком предстательной железы в Республике Марий Эл: ретроспективное обсервационное исследование
https://doi.org/10.25207/1608-6228-2023-30-6-56-65
Аннотация
Введение. Рак предстательной железы характеризуется относительно высокими показателями доли пациентов, находящихся на учете 5 и более лет, и индекса накопления. В результате на отдаленные исходы у этих пациентов начинают оказывать влияние другие факторы, отличные от основного заболевания.
Цель исследования — анализ онкологической заболеваемости пациентов с раком предстательной железы дополнительными злокачественными новообразованиями как одной из вероятных причин снижения их выживаемости в Республике Марий Эл.
Методы. Включено 1434 пациента с раком предстательной железы, впервые взятых на учет в период с 2012 по 2021 год. В этой выборке была идентифицирована группа пациентов, имевших дополнительные злокачественные новообразования (помимо рака предстательной железы), диагноз которых был установлен в период начиная за 6 месяцев до постановки диагноза рака предстательной железы и завершая концом 2021 года. Сравнение частоты злокачественных новообразований среди пациентов с раком предстательной железы и в общей популяции осуществляли в рамках анализа перекрестных таблиц 2 × 2 путем расчета относительного риска и его 95 % доверительного интервала. Достоверность различия констатировали, если рассчитанный 95 % доверительный интервал не включал 1. Кроме того, рассчитывали значения критерия хи-квадрат и соответствующие значения р. Статистические анализы выполняли в программных пакетах SPSS 13.0 (SPSS Inc., США) и Microsoft Excel 2007 (Microsoft Corporation, США).
Результаты. В период начиная за 6 месяцев до постановки диагноза рака предстательной железы и до истечения 6 месяцев после этого было зарегистрировано 31 (32,29 %) дополнительное злокачественное новообразование (либо рак предстательной железы был констатирован в течение 6 месяцев после постановки диагноза другого злокачественного новообразования), через 6 месяцев — 1 год после постановки диагноза рака предстательной железы — 7 (7,29 %) дополнительных злокачественных новообразований и в более поздний период — 61 (63,54 %) дополнительное злокачественное новообразование. Наиболее распространенными первичными злокачественными новообразованиями среди всех пациентов являлись: рак мочевого пузыря (относительный риск (ОР) = 15,23 [95 % доверительный интервал (ДИ): 10,42–22,26]), немеланомный рак кожи (ОР = 3,77 [95 % ДИ 2,34–6,07]), колоректальный рак (ОР = 2,10 [95 % ДИ 1,24–3,54]), рак желудка (ОР = 2,01 [85 % ДИ 1,08–3,73]) и почки (ОР = 4,69 [95 % ДИ 2,51–8,75]).
Заключение. Дополнительные злокачественные новообразования в течение 7,1 года (медиана) наблюдения развиваются у 6,7 % пациентов с раком предстательной железы, у которых данный риск выше среднепопуляционных значений, что делает данных пациентов группой риска.
Ключевые слова
Для цитирования:
Пасынков Д.В., Фатыхов Р.И. Характеристики онкологической заболеваемости у пациентов с раком предстательной железы в Республике Марий Эл: ретроспективное обсервационное исследование. Кубанский научный медицинский вестник. 2023;30(6):56-65. https://doi.org/10.25207/1608-6228-2023-30-6-56-65
For citation:
Pasynkov D.V., Fatykhov R.I. Prostate cancer morbidity in the Mari El Republic: A retrospective observational study. Kuban Scientific Medical Bulletin. 2023;30(6):56-65. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-6-56-65
ВВЕДЕНИЕ
В 2020 году, согласно данным Международного проекта по статистическому учету злокачественных опухолей (GLOBOCAN), в мире было зарегистрировано 1 414 259 случаев рака предстательной железы (РПЖ), что составило 7,3%. В этот же период было зарегистрировано 375 304 летальных исхода, обусловленных данной патологией, что соответствовало 3,8% всех летальных исходов, обусловленных злокачественными новообразованиями (ЗНО). Однако при пересчете этих данных на мужскую популяцию РПЖ выходил на второе место по заболеваемости (14,1% всех ЗНО), лишь незначительно уступая ближайшему конкуренту (раку легкого — 14,3% всех ЗНО) и был ответствен за 6,8% всех летальных исходов, обусловленных ЗНО, занимая при этом пятое место в структуре общей онкологической смертности [1].
В Российской Федерации в период с 2010 по 2020 годы распространенность РПЖ неуклонно росла с 84,6 до 187,3 случая на 100 000 населения. За этот же период доля РПЖ, выявленного в I–II стадиях, возросла с 47,7 до 60,7%. При этом РПЖ характеризуется относительно высокими показателями доли пациентов, находящихся на учете 5 и более лет (63,7%), и индекса накопления (7,7) [2]. В результате на отдаленные исходы у этих пациентов начинают оказывать влияние другие факторы, отличные от основного заболевания, что делает актуальным анализ любых факторов, негативно влияющих на выживаемость пациентов с данной патологией, и возможную их коррекцию.
С целью лечения РПЖ могут проводиться простатэктомия, лучевая терапия и андрогенодепривационная терапия (АДТ) [3]. Они характеризуются различными побочными эффектами, ряд из которых может приводить к госпитализации пациентов [4]. Кроме того, в качестве одного из осложнений лучевой терапии у онкологических пациентов описывались индуцированные ей ЗНО [5].
Цель исследования — анализ онкологической заболеваемости дополнительными ЗНО как одной из вероятных причин снижения выживаемости у пациентов с РПЖ в Республике Марий Эл.
МЕТОДЫ
Дизайн исследования
Проведено ретроспективное обсервационное исследование с двумя группами. Опытной группой являлась выборка пациентов с РПЖ, зарегистрированных в Республике Марий Эл (РМЭ), контрольной — общая популяция мужчин РМЭ в возрасте старше 39 лет.
Условия проведения исследования
Исследование проводилось на базе государственного бюджетного учреждения Республики Марий Эл «Республиканский клинический онкологический диспансер».
Критерии соответствия
Критерии включения
Пациенты с РПЖ, впервые взятые на учет в период с 2012 по 2021 годы в РМЭ.
Критерии невключения
Не применялись.
Критерии исключения
Не применялись.
Описание критериев соответствия (диагностические критерии)
Наличие гистологически верифицированного диагноза РПЖ в соответствии с общепринятой методикой.
Подбор участников в группы
В анализ было включено 1434 пациента с РПЖ, данные которых были вынесены в канцер-регистр РМЭ (опытная группа). Контрольную группу составило все мужское население РМЭ.
Целевые показатели исследования
Основной показатель исследования
Среднегодовая заболеваемость ЗНО на 100 000 населения в общей популяции РМЭ и у пациентов с РПЖ и относительный риск (ОР) ЗНО у них по сравнению с контрольной группой.
Дополнительные показатели исследования
Среднегодовая заболеваемость ЗНО на 100 000 населения в общей популяции РМЭ и у пациентов с РПЖ и относительный риск ЗНО у них в зависимости от вида проводившегося лечения (дистанционная лучевая терапия, радикальная простатэктомия, андрогенодепривационная терапия.
Методы измерения целевых показателей
В группе больных РПЖ была идентифицирована выборка пациентов, имевших дополнительные ЗНО (помимо РПЖ), диагноз которых был установлен в период начиная за 6 месяцев до постановки диагноза РПЖ и завершая концом 2021 года. В результате были рассчитаны значения частоты дополнительных ЗНО. Аналогичные значения для этих ЗНО были рассчитаны и для контрольной группы.
Переменные (предикторы, конфаундеры, модификаторы эффекта)
Оценивалось влияние вида проведенного лечения РПЖ (лучевая терапия, простатэктомия, другие) и возраста на момент постановки диагноза РПЖ на риск развития дополнительных ЗНО.
Статистические процедуры
Принципы расчета размера выборки
Для полученных значений объемов большей и меньшей сравниваемых выборок (общая популяция мужчин и выборка пациентов с РПЖ соответственно), а также общей частоты ЗНО в них (0,003 и 0,084 соответственно) статистическая мощность основного анализа при уровне значимости α = 0,05 составила 96,6% и была расценена как адекватная.
Статистические методы
Оценку нормальности распределения выборок проводили с помощью критерия Колмогорова ― Смирнова. В качестве параметров описательной статистики для нормально распределенных непрерывных показателей рассчитывали среднее арифметическое (стандартное отклонение), для ненормально распределенных ― медиану и размах вариации. Для категориальных показателей рассчитывали частоты. Оценку достоверности различия для нормально распределенных переменных осуществляли с помощью t-критерия Стьюдента.
Сравнение частоты ЗНО среди пациентов с РПЖ и в общей популяции осуществляли в рамках анализа перекрестных таблиц 2 × 2 путем расчета относительного риска (ОР) и его 95% доверительного интервала (ДИ). Достоверность различия констатировали, если рассчитанный 95% ДИ не включал 1. Кроме того, рассчитывали значения критерия хи-квадрат и соответствующие значения р.
Также проводили многофакторный бинарный логистический регрессионный анализ с целью идентификации статистически значимых регрессоров (факторов, влияющих на риск дополнительных ЗНО).
Статистические анализы выполняли в программных пакетах SPSS 13.0 (SPSS Inc., США) и Microsoft Excel 2007 (Microsoft Corporation, США) с использованием встроенных функций.
РЕЗУЛЬТАТЫ
Формирование выборки исследования
В исследование было включено 317 675 пациентов, соответствовавших критериям отбора по социально-демографическим данным. Все они были разделены на две группы: основную (группу больных РПЖ) и контрольную (все остальные). После исключения из группы больных РПЖ лиц, не имевших другие ЗНО, в данной группе осталось 96 пациентов (финальная группа больных РПЖ). Затем из контрольной группы исключили всех, не имевших ЗНО, которые были зарегистрированы в финальной группе больных РПЖ. Эти пациенты (n = 893) составили финальную контрольную группу (рис. 1).
Характеристики выборки (групп) исследования
Средний возраст включенных в анализ пациентов с РПЖ на момент постановки диагноза составлял 69,83 ± 5,20 года. Превалирующим гистологическим типом РПЖ являлась ацинарная аденокарцинома. Медиана длительности наблюдения соответствовала 7,1 года. В течение этого периода 96 (6,70%) пациентов имели как минимум одну другую первичную злокачественную опухоль.
Основные результаты исследования
Характеристики пациентов и ЗНО, зарегистрированные у них, представлены в таблице 1.
В период начиная за 6 месяцев до постановки диагноза РПЖ и до истечения 6 месяцев после этого было зарегистрировано 31 (32,29%) дополнительное ЗНО (либо РПЖ был констатирован в течение 6 месяцев после постановки диагноза другого ЗНО), через 6 месяцев — 1 год после постановки диагноза РПЖ — 7 (7,29%) дополнительных ЗНО и в более поздний период — 61 (63,54%) дополнительное ЗНО (табл. 2).
Наиболее распространенными первичными ЗНО, зарегистрированными у пациентов с РПЖ, являлись: рак мочевого пузыря, немеланомный рак кожи, колоректальный рак, рак желудка и почки. Этот спектр не соответствует спектру наиболее частых ЗНО у мужчин в общей популяции (рак кожи и почки не входят в пятерку наиболее частых в ней, в то время как для пациентов с РПЖ менее характерен рак легкого, являющийся наиболее частым ЗНО у мужчин общей популяции).
В таблице 3 представлены сведения о частоте и значениях ОР всех зарегистрированных ЗНО у пациентов с РПЖ и в общей популяции. У пациентов с РПЖ среднегодовая частота дополнительных ЗНО составила 0,67%, что достоверно выше, чем в общей мужской популяции (0,03%; ОР = 16,65, P < 0,001).
После исключения ЗНО, встречавшихся у пациентов с РПЖ только в виде единичных случаев, были рассчитаны значения заболеваемости и относительного риска наиболее распространенных вторых первичных ЗНО у пациентов с РПЖ и в общей популяции. Соответствующие сведения приведены в таблице 4. Пятью наиболее частыми ЗНО, относительный риск которых у пациентов с РПЖ был достоверно выше такового в общей популяции, являлись: рак мочевого пузыря, кожи (немеланомный), колоректальный рак, рак желудка и почки. Значения заболеваемости и ОР большинства встречавшихся с меньшей частотой ЗНО также были выше среднепопуляционных значений.
Дополнительно к этому было констатировано достоверное повышение заболеваемости следующими ЗНО у больных РПЖ: меланома (ОР = 4,42; 95% ДИ: 1,65–11,88); миеломная болезнь (ОР = 4,42; 95% ДИ: 1,65–11,88), рак анального канала (ОР = 11,07; 95% ДИ: 1,49–82,43); почечной лоханки (ОР = 11,07; 95% ДИ: 1,49–82,43), грушевидного синуса (ОР = 22,14; 95% ДИ: 2,84–172,83) и злокачественное новообразование костной ткани (ОР = 22,14; 95% ДИ: 2,84–172,83). Однако четыре последних ЗНО были зарегистрированы среди пациентов с РПЖ только однократно, поэтому при интерпретации полученных сведений, по нашему мнению, следует соблюдать осторожность ввиду высокой вероятности систематической погрешности, обусловленной малым количеством наблюдаемых случаев.
Случаев достоверного снижения заболеваемости отдельными ЗНО у пациентов с РПЖ по сравнению со среднепопуляционными показателями зафиксировано не было, однако отмечалось недостоверное снижение риска рака легкого у пациентов с РПЖ (ОР = 0,64; 95% ДИ: 0,29–1,42).
Дополнительные результаты исследования
В течение года после постановки диагноза РПЖ 22 (22,92%) пациента получили дистанционную лучевую терапию (ДЛТ). Среди пациентов, которым ДЛТ не выполнялась, 48 (50,00%) пациентам была выполнена радикальная простатэктомия, остальные пациенты получали только андрогенодепривационную терапию в постоянном или интермиттирующем режимах либо только симптоматическую терапию.
Возраст пациентов когорт простатэктомии и ДЛТ был аналогичен (66,25 ± 7,98 года — в когорте простатэктомии и 68,97 ± 8,03 года — в когорте ДЛТ, P = 0,360). Однако пациенты когорты ДЛТ имели более высокие значения индекса Глиссона по сравнению с когортой простатэктомии (>8 баллов: 14 из 48 пациентов [ 29,17%] по сравнению с 16 из 22 пациентов [72,73%]; P = 0,039) и более высокую опухолевую массу (стадии T2 и T3: 8 из 48 пациентов [ 16,67%] по сравнению с 16 из 22 пациентов [ 72,73%]; P = 0,004).
При раздельном анализе ЗНО, зарегистрированных у пациентов с РПЖ, перенесших простатэктомию и ДЛТ, достоверного различия спектров онкологической заболеваемости констатировано не было, однако отмечено значительное номинальное повышение относительной частоты рака мочевого пузыря, желудка и поджелудочной железы (табл. 5). При этом в рамках многофакторного анализа у пациентов когорты ДЛТ отмечалось достоверное повышение риска дополнительных ЗНО по сравнению с пациентами, не получавшими ДЛТ (ОР = 1,33; 95% ДИ, 1,07–1,49; P < 0,001). Возраст на момент постановки диагноза РПЖ также ассоциировался с повышением риска развития дополнительных ЗНО (ОР = 1,03 на каждый дополнительный год жизни; 95% ДИ: 1,01–1,04 на каждый дополнительный год жизни; P < 0,001).
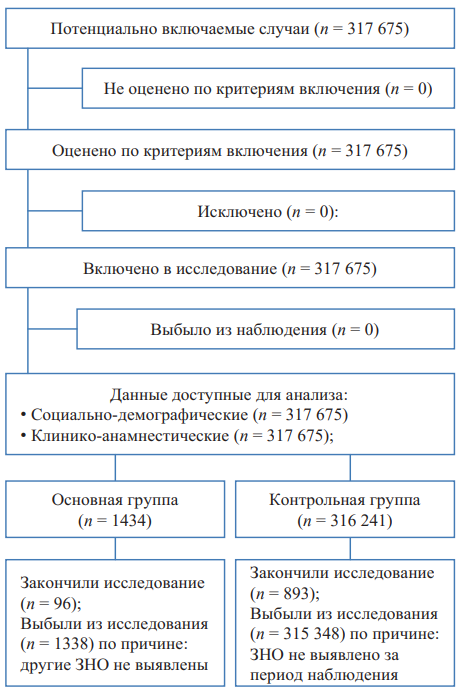
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами (согласно рекомендациям STROBE). Сокращения: ЗНО — злокачественное новообразование; РПЖ — рак предстательной железы.
Fig. 1. Schematic diagram of the research design
Note: performed by the authors (according to STROBE recommendations). Abbreviations: ЗНО — malignant neoplasm; РПЖ — prostate cancer.
Таблица 1. Демографические и клинико-патологические характеристики пациентов с раком предстательной железы, у которых были зарегистрированы дополнительные злокачественные новообразования
Table 1. Demographic and clinicopathological characteristics of prostate cancer patients diagnosed with additional malignancies
|
|
Пациенты, n (%) |
Заболеваемость /105 случаев РПЖ в год |
|
Количество пациентов |
1434 |
|
|
Возраст, среднее ± стандартное отклонение |
69,83 ± 5,20 |
|
|
Стадия |
||
|
0 + I + II |
904 (63,04%) |
|
|
III + IV |
312 (21,76%) |
|
|
Не известно |
58 (4,04%) |
|
|
Зарегистрированы дополнительные злокачественные новообразования |
||
|
Одно дополнительное злокачественное новообразование |
87 (6,07%) |
606,69 |
|
Два или более дополнительных злокачественных новообразования |
9 (0,63%) |
62,76 |
|
Индекс Глиссона |
||
|
≤6 |
31 (35,63%) |
|
|
7 |
18 (20,69%) |
|
|
≥8 |
28 (32,18%) |
|
|
Данные отсутствуют |
10 (11,49%) |
|
|
Гистологический тип |
||
|
Ацинарная аденокарцинома |
76 (87,36%) |
|
|
Протоковая аденокарцинома |
3 (3,45%) |
|
|
Уротелиальная карцинома |
1 (1,15%) |
|
|
Другие |
1 (1,15%) |
|
|
Проведено оперативное лечение |
48 (50,00%) |
|
|
Проведена дистанционная лучевая терапия |
22 (22,92%) |
|
|
Дополнительные зарегистрированные злокачественные новообразования |
||
|
Рак мочевого пузыря |
28 (1,95%) |
195,26 |
|
Рак кожи (немеланомный) |
17 (1,19%) |
118,55 |
|
Колоректальный рак |
14 (0,98%) |
97,63 |
|
Рак желудка |
10 (0,70%) |
69,74 |
|
Рак почки |
10 (0,70%) |
69,74 |
|
Рак легкого |
6 (0,42%) |
41,84 |
|
Меланома |
4 (0,28%) |
27,89 |
|
Рак пищевода |
2 (0,14%) |
13,95 |
|
Рак поджелудочной железы |
2 (0,14%) |
13,95 |
|
Миеломная болезнь |
2 (0,14%) |
13,95 |
|
Хронический лимфобластный лейкоз |
2 (0,14%) |
13,95 |
|
Рак желчевыводящих путей |
1 (0,07%) |
6,97 |
|
Рак анального канала |
1 (0,07%) |
6,97 |
|
Рак губы |
1 (0,07%) |
6,97 |
|
Рак почечной лоханки |
1 (0,07%) |
6,97 |
|
Рак грушевидного синуса |
1 (0,07%) |
6,97 |
|
Злокачественное новообразование костной ткани |
1 (0,07%) |
6,97 |
|
Увеальная меланома |
1 (0,07%) |
6,97 |
|
Рак щитовидной железы |
1 (0,07%) |
6,97 |
|
Рак ротоглотки |
1 (0,07%) |
6,97 |
Примечание: таблица составлена авторами; суммы процентов могут не соответствовать 100% ввиду округления. Сокращение: РПЖ — рак предстательной железы.
Note: compiled by the authors; total percent may not correspond to 100% due to rounding. Abbreviation: РПЖ — prostate cancer.
Таблица 2. Сроки выявления дополнительных злокачественных новообразований у пациентов с раком предстательной железы
Table 2. Detection timing of additional malignancies in patients with prostate cancer patients
|
Сроки выявления дополнительных ЗНО |
Когорта |
Всего |
||
|
Простатэктомия |
ДЛТ |
Только андрогенодепривационная и/или симптоматическая терапия |
||
|
За 6 месяцев до — 6 месяцев после постановки диагноза РПЖ |
12 (25,00%) |
5 (22,73%) |
10 (38,46%) |
27 (28,13%) |
|
Через 6 месяцев — 1 год после постановки диагноза РПЖ |
2 (4,17%) |
2 (9,09%) |
3 (10,71%) |
7 (7,30%) |
|
Через ≥1 года после постановки диагноза РПЖ |
34 (70,83) |
15 (68,18%) |
11 (42,31%) |
59 (62,50%) |
|
Всего |
48 (100%) |
22 (100%) |
26 (100%) |
96 (100%) |
Примечание: таблица составлена авторами. Сокращения: ЗНО — злокачественное новообразование; РПЖ — рак предстательной железы; ДЛТ — дистанционная лучевая терапия.
Note: compiled by the authors. Abbreviations: ЗНО — malignant neoplasm; РПЖ — prostate cancer; ДЛТ — remote radiation therapy.
Таблица 3. Сравнительный среднегодовой риск множественных злокачественных новообразований у пациентов с раком предстательной железы и в общей популяции мужчин в Республике Марий Эл
Table 3. Comparative average annual risk of multiple malignancies in prostate cancer patients and in the general male population in the Mari El Republic
|
|
Пациенты с РПЖ, (n) |
Общая популяция (n) |
Относительный риск (95% ДИ) |
Р |
|
Все пациенты |
1434 |
317 675 |
16,65 (18,94–28,52) |
<0,0001 |
|
Множественные ЗНО |
96 |
863 |
|
|
Примечание: таблица составлена авторами. Сокращения: ЗНО — злокачественное новообразование; РПЖ — рак предстательной железы; ДИ — доверительный интервал.
Note: compiled by the authors. Abbreviations: ЗНО — malignant neoplasm; РПЖ — prostate cancer; ДИ — confidence interval.
Таблица 4. Сравнение рисков встречавшихся дополнительных первичных злокачественных новообразований у пациентов с раком предстательной железы и в общей популяции мужчин в Республике Марий Эл
Table 4. Comparison of risks of additional primary malignancies in prostate cancer patients and in the general male population in the Mari El Republic
|
|
Дополнительные первичные ЗНО у пациентов с РПЖ (n) |
ЗНО в общей популяции (n) |
Заболеваемость / 105 случаев РПЖ |
Заболеваемость / 105 в общей популяции |
Относительный риск (95% ДИ) |
P |
|
Рак мочевого пузыря |
28 |
403 |
1952,58 |
12,59 |
15,23 (10,42–22,26) |
<0,0001 |
|
Рак кожи (немеланомный) |
17 |
993 |
1185,50 |
311,64 |
3,77 (2,34–6,07) |
<0,0001 |
|
Колоректальный рак |
14 |
1471 |
976,29 |
462,74 |
2,10 (1,24–3,54) |
0,0056 |
|
Рак желудка |
10 |
1104 |
697,35 |
346,27 |
2,01 (1,08–3,73) |
0,0286 |
|
Рак почки |
10 |
473 |
697,35 |
147,95 |
4,69 (2,51–8,75) |
<0,0001 |
|
Рак легкого |
6 |
2090 |
418,41 |
657,91 |
0,64 (0,29–1,42) |
0,2698 |
|
Меланома |
4 |
201 |
278,94 |
62,96 |
4,42 (1,65–11,88) |
0,0033 |
|
Рак пищевода |
2 |
374 |
139,47 |
116,47 |
1,20 (0,30–4,80) |
0,0863 |
|
Рак поджелудочной железы |
2 |
352 |
139,47 |
110,18 |
1,27 (0,32–5,08) |
0,0665 |
|
Миеломная болезнь |
2 |
202 |
139,47 |
22,04 |
4,42 (1,65–11,88) |
0,0034 |
|
Хронический лимфобластный лейкоз |
2 |
141 |
139,47 |
44,07 |
3,16 (0,78–12,76) |
0,1079 |
|
Рак желчевыводящих путей |
1 |
52 |
69,74 |
15,74 |
4,43 (0,61–32,03) |
0,1511 |
|
Рак анального канала |
1 |
23 |
69,74 |
6,30 |
11,07 (1,49–82,43) |
0,0266 |
|
Рак губы |
1 |
151 |
69,74 |
47,22 |
1,48 (0,21–10,54) |
0,7025 |
|
Рак почечной лоханки |
1 |
20 |
69,74 |
6,30 |
11,07 (1,49–82,43) |
0,0189 |
|
Рак грушевидного синуса |
1 |
13 |
69,74 |
3,15 |
22,14 (2,84–172,83) |
0,0063 |
|
Злокачественное новообразование костной ткани |
1 |
14 |
69,74 |
3,15 |
22,14 (2,84–172,83) |
0,0076 |
|
Увеальная меланома |
1 |
33 |
69,74 |
9,44 |
7,38 (1,01–54,08) |
0,0607 |
|
Рак щитовидной железы |
1 |
74 |
69,74 |
22,04 |
3,16 (0,44–22,76) |
0,2761 |
|
Рак ротоглотки |
1 |
33 |
69,74 |
9,44 |
7,38 (1,01–54,08) |
0,0607 |
Примечание: таблица составлена авторами. Сокращения: ЗНО — злокачественное новообразование; РПЖ — рак предстательной железы; ДИ — доверительный интервал.
Note: compiled by the authors. Abbreviations: ЗНО — malignant neoplasm; РПЖ — prostate cancer; ДИ — confidence interval.
Таблица 5. Злокачественные новообразования, выявленные у пациентов с раком предстательной железы, перенесших простатэктомию и дистанционную лучевую терапию
Table 5. Malignancies identified in prostate cancer patients underwent prostatectomy and remote radiation therapy
|
Злокачественные новообразования |
Когорта |
|||
|
Простатэктомия |
ДЛТ |
|||
|
абсолютное количество |
% |
абсолютное количество |
% |
|
|
Рак кожи |
16 |
33,33 |
2 |
9,09 |
|
Рак почки |
7 |
14,58 |
3 |
13,64 |
|
Рак легкого |
7 |
14,58 |
2 |
9,09 |
|
Рак мочевого пузыря |
5 |
10,42 |
5 |
22,73 |
|
Колоректальный рак |
4 |
8,33 |
3 |
13,64 |
|
Меланома |
3 |
6,25 |
0 |
0,00 |
|
Миеломная болезнь |
2 |
4,17 |
0 |
0,00 |
|
Рак желудка |
2 |
4,17 |
5 |
22,73 |
|
Рак поджелудочной железы |
1 |
2,01 |
2 |
9,09 |
|
Хронический лимфобластный лейкоз |
1 |
2,01 |
0 |
0,00 |
|
Всего |
48 |
100,00 |
22 |
100,00 |
Примечание: таблица составлена авторами. Сокращение: ДЛТ — дистанционная лучевая терапия.
Note: compiled by the authors. Abbreviation: ДЛТ — remote radiation therapy.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
В исследовании продемонстрировано достоверное повышение заболеваемости отдельными ЗНО у пациентов с РПЖ по сравнению с таковой в общей мужской популяции. При этом структура онкологической заболеваемости у данных пациентов отличается от таковой в общей популяции.
Ограничения исследования
Во-первых, данное исследование являлось ретроспективным и проводилось на базе канцер-регистра только одного субъекта РФ (РМЭ). Кроме того, в канцер-регистре, откуда брались данные для анализа, отсутствовала важная клиническая информация, в частности, о сопутствующих заболеваниях и их клинических проявлениях. Длительный период наблюдения мог ассоциироваться с изменением подходов к диагностике и лечению как РПЖ (особенно ввиду внедрения современных методик лучевой терапии, таких как модулированная по интенсивности, объемно-модулированная ротационная и стереотаксическая, характеризующихся более высокой конформностью), так и других ЗНО, что может вносить систематическую погрешность.
Определенным ограничением исследования является сравнение частоты ЗНО между выборкой пациентов с РПЖ и общей мужской популяцией. Однако все значения стандартизованной заболеваемости ЗНО, которые используются для планирования скрининговых программ, рассчитываются именно для общей популяции. Поэтому, несмотря на возможную систематическую погрешность проведенного формального статистического анализа, обусловленную дизайном данного сравнения, использованный подход мы расценили как оправданный и позволяющий проанализировать особенности онкологической заболеваемости у пациентов с РПЖ и наметить принципы их динамического наблюдения исходя из выявленных закономерностей.
Интерпретация результатов исследования
Согласно оценкам, у 2,8–3,6% пациентов, страдающих ЗНО, развиваются последующие злокачественные опухоли [6], что согласуется с полученными нами данными. При этом полученные результаты, очевидно, определяются объемом обследования пациентов, поскольку в последнем исследовании максимальные значения были получены у пациентов, регулярно наблюдавшихся посредством лучевых методов (рентгенографии, компьютерной и/или магнитно-резонансной томографии), и эти опухоли имели меньший размер и более благоприятную стадию заболевания [7].
Экспозиция ионизирующему излучению является хорошо известным фактором риска злокачественных опухолей. Наше исследование показало, что у пациентов, перенесших ДЛТ, по сравнению с пациентами, перенесшими простатэктомию, возрастает риск развития дополнительных ЗНО, вероятно, во многом за счет повышения риска рака мочевого пузыря и прямой кишки. Хотя сравнительно короткий период наблюдения (медиана — 7,1 года) не позволил нам полностью оценить данный риск, результаты других исследований подтверждают эти наблюдения [8]. Moon et al. отметили повышение риска рака мочевого пузыря после ДЛТ по сравнению с брахитерапией. Эти же авторы отмечали при длительности наблюдения 10,6 года повышение риска меланомы и рака прямой кишки, слепой кишки, поперечной ободочной кишки, желудка и легкого у пациентов, перенесших ДЛТ, по сравнению с не получавшими лучевой терапии пациентами, при отсутствии повышения данного риска при использовании брахитерапии [9]. Brenner et al. при средней длительности наблюдения 4 года показали, что по сравнению с хирургическим лечением ДЛТ ассоциируется с небольшим повышением риска солидных опухолей, в частности, рака мочевого пузыря, прямой кишки, легкого и сарком [10]. Neugut et al. использовали данные американской программы «Наблюдение, эпидемиология и конечные результаты» (SEER) для оценки риска дополнительных ЗНО после постановки диагноза рака простаты и выявили повышение риска рака мочевого пузыря и хронического лимфолейкоза, но не рака прямой кишки и острого нелимфоцитарного лейкоза, у мужчин, получавших лучевую терапию. При этом отмечалось прогрессивное увеличение риска рака мочевого пузыря по мере удлинения периода наблюдения с ОР = 1,0 (95% ДИ: 0,8–1,2) — в период через 0,5–5 лет после лечения до ОР = 1,3 (95% ДИ: 1,0–1,7) — через 5–8 лет после лечения и ОР = 1,5 (95% ДИ: 1,0–2,0) — через >8 лет после лечения, что согласуется с полученными нами результатами [11]. Baxter et al. при средней длительности наблюдения 9 лет оценивали влияние лучевой терапии на риск рака прямой кишки, ректосигмоидного отдела / слепой кишки и остальных отделов ободочной кишки. Эти авторы также показали достоверное повышение риска рака прямой кишки у мужчин, перенесших лучевую терапию, по сравнению с пациентами, не получавшими такого лечения (ОР = 1,7; 95% ДИ: 1,4–2,2). При этом повышения риска рака остальных отделов ободочной кишки зафиксировано не было [12]. В то же время, учитывая большое количество описанных случаев синхронного РПЖ и рака мочевого пузыря (частота которого может достигать 8,8%), нельзя исключить наличие альтернативных механизмов данного феномена [13].
Кроме того, ранее отмечалось, что экспозиция костного мозга тазовой области потенциально высоким дозам ионизирующего излучения при радиотерапии повышает частоту анемии [14]. При этом экспозиция ионизирующего излучения является также фактором риска лимфом [15], и в ретроспективном исследовании у пациентов с РПЖ, получавших лучевую терапию в период с 1999 по 2011 год, отмечалось повышение риска миелодиспластического синдрома и острого миелолейкоза (ОР = 1,51). В этом исследовании медиана времени до развития миелодиспластического синдрома или острого миелолейкоза была неожиданно короткой (приблизительно 3 года), в результате неясно, ассоциировано ли это повышение риска с лучевой терапией или другими факторами [16]. В нашем исследовании достоверного повышения риска гемобластозов не отмечалось, однако это может быть обусловлено относительно небольшим объемом популяции. Тем не менее данная информация, как представляется, была бы полезна для клиницистов с целью оптимизации программы последующего наблюдения пациентов с РПЖ.
Продемонстрированное нами более чем 4-кратное повышение риска рака почки у пациентов с РПЖ не кажется неожиданным, учитывая выявление в ткани почки андрогеновых рецепторов [17–20]. Также отмечалась и обратная ассоциация, что является дополнительным подтверждением наличия общего механизма обоих феноменов.
Заключение
Дополнительные ЗНО развиваются у значительной доли пациентов с РПЖ, у которых данный риск выше среднепопуляционных значений, что делает данных пациентов группой риска. Обращает на себя внимание также изменение структуры онкологической заболеваемости у пациентов с РПЖ.
У пациентов, получавших ДЛТ по поводу РПЖ, риск дополнительных ЗНО (в частности, рака мочевого пузыря и колоректального рака) возрастает по сравнению с пациентами, не получавшими данного лечения.
Все это требует дальнейших исследований механизмов выявленных феноменов, а также разработки программы скрининга наиболее актуальных ЗНО у пациентов с РПЖ в процессе их диспансерного наблюдения с учетом выявленных феноменов.
Список литературы
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209–249. https://doi.org/10.3322/caac.21660.
2. Barchuk A, Belyaev A, Gretsova O, Tursun-zade R, Moshina N, Znaor A. History and current status of cancer registration in Russia. Cancer Epidemiology. 2021;73:101963. https://doi.org/10.1016/j.canep.2021.101963
3. Wallis C, Cheung P, Herschorn S, Saskin R, Su J, Klotz L, Kulkarni G, Lee Y, Kodama R, Narod S. Complications following surgery with or without radiotherapy or radiotherapy alone for prostate cancer. British journal of cancer. 2015;112:977. https://doi.org/10.1038/bjc.2015.54
4. Wallis CJ, Herschorn S, Saskin R, Su J, Klotz LH, Chang M, Kulkarni GS, Lee Y, Kodama RT, Narod SA. Complications after radical prostatectomy or radiotherapy for prostate cancer: results of a population-based, propensity score–matched analysis. Urology. 2015;85:621– 628. https://doi.org/10.1016/j.urology.2014.11.037
5. de Gonzalez AB, Curtis RE, Kry SF, Gilbert E, Lamart S, Berg CD, Stovall M, Ron E Proportion of second cancers attributable to radiotherapy treatment in adults: a cohort study in the US SEER cancer registries. The Lancet Oncology. 2011;12:353–360. https://doi.org/10.1016/S1470-2045(11)70061-4
6. Mukaiyama Y, Suzuki M, Morikawa T, Mori Y, Takeshima Y, Fujimura T, Fukuhara H, Nakagawa T, Nishimatsu H, Kume H, Homma Y. Multiple primary malignant neoplasms of the glottis, renal pelvis, urinary bladder, oral floor, prostate, and esophagus in a Japanese male patient: a case report. World J Surg Oncol. 2014;12:294. https://doi.org/10.1186/1477-7819-12-294
7. Liu KL, Huang KH, Lu YC, Tsai YC, Chow PM, Weng WC, Huang WY, Chueh SCJ. The risk of subsequent malignancies in patients with renal cell carcinoma: A nationwide, population-based study. Urological Science. 2022;33(3):124. http://dx.doi.org/10.4103/uros.uros_135_21
8. Davis EJ, Beebe-Dimmer JL, Yee CL, Cooney KA. Risk of second primary tumors in men diagnosed with prostate cancer: a population-based cohort study. Cancer. 2014;120(17):2735–2741. http://dx.doi.org/10.1002/cncr.28769
9. Bagshaw HP, Arnow KD, Trickey AW, Leppert JT, Wren SM, Morris AM. Assessment of Second Primary Cancer Risk Among Men Receiving Primary Radiotherapy vs Surgery for the Treatment of Prostate Cancer. JAMA Netw Open. 2022;5(7):e2223025. http://dx.doi.org/10.1001/jamanetworkopen.2022.23025
10. Wallis CJ, Mahar AL, Choo R, Herschorn S, Kodama RT, Shah PS, Danjoux C, Narod SA, Nam RK. Second malignancies after radiotherapy for prostate cancer: systematic review and meta-analysis. BMJ. 2016;352:i851. http://dx.doi.org/10.1136/bmj.i851
11. Shin TJ, Choe M, Kim BH, Byun SJ. Early Detection of Secondary Bladder Urothelial Carcinoma and Disseminated Bone Metastases with Normal Prostate-Specific Antigen Level after Pelvic Salvage Radiotherapy in Prostate Cancer. Life (Basel). 2023;13(6):1249. http://dx.doi.org/10.3390/life13061249
12. Omer DM, Thompson HM, Verheij FS, Yuval JB, Rosen R, Beets NRA, Luthra A, Romesser PB, Paty PB, Garcia-Aguilar J, Sanchez-Vega F. Rectal Cancer after Prostate Radiation: A Complex and Controversial Disease. Cancers (Basel). 2023;15(8):2214. http://dx.doi.org/10.3390/cancers15082214
13. Алексеев Б.Я., Русаков И.Г., Франк Г.А., Андреева Ю.Ю., Нюшко К.М. Первично-множественный рак мочевого пузыря и предстательной железы у больных, перенесших радикальную цистэктомию. Онкоурология. 2005;1(2):40–45. https://doi.org/10.17650/17269776-2005-1-2-40-45.
14. Makubi A, Shiyo A, Kahesa C. Anaemia prevalence and factors associated with haemoglobin change following radiotherapy in individuals with cancers at the Ocean Road Cancer Institute in Tanzania. Tanzania Journal of Health Research. 2016;18(2). http://dx.doi.org/10.4314/thrb.v18i2.3
15. Harbron RW, Pasqual E. Ionising radiation as a risk factor for lymphoma: a review. J Radiol Prot. 2020;40(4). https://doi.org/10.1088/13616498/abbe37
16. Wang R, Zeidan AM, Yu JB, Soulos PR, Davidoff AJ, Gore SD, Huntington SF, Gross CP, Ma X. Myelodysplastic Syndromes and Acute Myeloid Leukemia After Radiotherapy for Prostate Cancer: A Population-Based Study. Prostate. 2017;77(5):437–445. https://doi.org/10.1002/pros.23281
17. Zhu G, Liang L, Li L, Dang Q, Song W, Yeh S, He D, Chang C. The expression and evaluation of androgen receptor in human renal cell carcinoma. Urology. 2014;83(2):510.e19–24. https://doi.org/10.1016/j.urology.2013.10.022
18. You B, Sun Y, Luo J, Wang K, Liu Q, Fang R, Liu B, Chou F, Wang R, Meng J, Huang CP, Yeh S, Chang C, Xu W. Androgen receptor promotes renal cell carcinoma (RCC) vasculogenic mimicry (VM) via altering TWIST1 nonsense-mediated decay through lncRNA-TANAR. Oncogene. 2021;40(9):1674–1689. https://doi.org/10.1038/s41388-020-01616-1
19. Foersch S, Schindeldecker M, Keith M, Tagscherer KE, Fernandez A, Stenzel PJ, Pahernik S, Hohenfellner M, Schirmacher P, Roth W, Macher-Goeppinger S. Prognostic relevance of androgen receptor expression in renal cell carcinomas. Oncotarget. 2017;8(45):78545–78555. https://doi.org/10.18632/oncotarget.20827
20. Bialek J, Piwonka M, Kawan F, Fornara P, Theil G. Differential Expression of the Androgen Receptor, Splice Variants and Relaxin 2 in Renal Cancer. Life (Basel). 2021;11(8):731. https://doi.org/10.3390/life11080731
Об авторах
Д. В. ПасынковРоссия
Пасынков Дмитрий Валерьевич — кандидат медицинских наук, доцент, заведующий отделением лучевой диагностики Республиканский клинический онкологический диспансер; заведующий кафедрой лучевой диагностики и онкологии Марийский ГУ; ассистент кафедры ультразвуковой диагностики Казанской государственной медицинской академии — филиала РАНПО.
Ул. Осипенко, д. 22, Йошкар-Ола, 424037; ул. Муштари, д. 11, г. Казань; Пл. Ленина, д. 1, Йошкар-Ола, 424000
Р. И. Фатыхов
Россия
Фатыхов Руслан Ильгизарович — кандидат медицинских наук, доцент кафедры лучевой диагностики и онкологии Марийский ГУ; ассистент кафедры общей хирургии Казанский ГМУ.
Пл. Ленина, д. 1, г. Йошкар-Ола, 424000; ул. Бутлерова, д. 49, Казань, 420012
Рецензия
Для цитирования:
Пасынков Д.В., Фатыхов Р.И. Характеристики онкологической заболеваемости у пациентов с раком предстательной железы в Республике Марий Эл: ретроспективное обсервационное исследование. Кубанский научный медицинский вестник. 2023;30(6):56-65. https://doi.org/10.25207/1608-6228-2023-30-6-56-65
For citation:
Pasynkov D.V., Fatykhov R.I. Prostate cancer morbidity in the Mari El Republic: A retrospective observational study. Kuban Scientific Medical Bulletin. 2023;30(6):56-65. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-6-56-65
JATS XML








































