Перейти к:
Клиническое значение эндокринных нарушений в развитии синдрома раннего сосудистого старения у мужчин с абдоминальным ожирением и сопутствующей артериальной гипертензией: обсервационное когортное исследование
https://doi.org/10.25207/1608-6228-2024-31-1-74-87
Аннотация
Введение. Висцеральное ожирение — известный предрасполагающий фактор для возникновения комплекса метаболических и эндокринологических нарушений, приводящих к артериальной гипертензии и сердечно-сосудистым осложнениям, а увеличение жесткости сосудистой стенки и появление синдрома раннего сосудистого старения являются современными ранними предикторами их развития. В литературе практически не встречаются исследования, отражающие изучение влияния изменений содержания тестостерона, кортизола, альдостерона в сыворотке крови на жесткость сосудистой стенки и развитие синдрома раннего сосудистого старения у пациентов с висцеральным ожирением. Цель исследования — определить связь гиперкортизолемии, гиперальдостеронемии и гипотестостеронемии с жесткостью сосудистой стенки и наличием синдрома раннего сосудистого старения у мужчин с висцеральным ожирением. Методы. Проведено обсервационное когортное исследование 78 мужчин в возрасте от 35 до 45 лет (средний возраст 38,1 ± 6,5 года) с диагнозами «абдоминальное ожирение» и «артериальная гипертензия 1-й степени». Среднее значение окружности талии составило 105,5 ± 6,9 см, артериального давления — систолического 152,5 ± 5,0 мм рт. ст., диастолического 92,5 ± 5,0. Сосудистый возраст у исследуемых пациентов (n = 78) составил 44,1 ± 6,2 года, что было статистически выше показателей паспортного возраста ( р < 0,001). Исследуемые были разделены на подгруппы по уровню общего тестостерона (подгруппа 1 А, n = 49 — общий тестостерон < 12,1 нмоль/л, подгруппа 1 Б, n = 29, — общий тестостерон ≥ 12,1 нмоль/л) и по содержанию кортизола в вечерней порции слюны (подгруппа 2 А, n = 24, — кортизол > 4,5 нмоль/л, подгруппа 2 Б, n = 24, — кортизол ≤ 4,5 нмоль/л). Все пациенты, включенные в группы исследования, завершили его. Для оценки гормонального статуса в утренних образцах сыворотки крови исследовалось содержание общего тестостерона, глобулина, связывающего половые стероиды, и инсулина. Для оценки инсулинорезистентности рассчитывался индекс НОМА-IR (Homeostasis model assessment of insulin resistance). Концентрация общего тестостерона определялась методом усиленной хемилюминесценции (Ortho-Clinical Diagnostics, J&J), а общего тестостерона глобулина, связывающего половые стероиды, и инсулина — методом отсроченной во времени флюоресценции. Содержание альдостерона определялось методом радиоиммунологического анализа, свободного кортизола и тестостерона — люминесцентным LIA-методом, расчет концентрации свободного и биодоступного тестостерона в сыворотке крови — с помощью интернет-калькулятора (issam.ch/freetesto.htm). Сердечно-лодыжечный сосудистый индекс определялся на сфигмометре VaSera VS-15000N, сосудистый возраст рассчитывался автоматически на данном аппарате. Статистический анализ проводился на базе пакета прикладных программ Statistica 10.0 Windows (StatSoft, Inc., США). Результаты. Сосудистый возраст у пациентов с гипогонадизмом статистически значимо ( р < 0,001) превышал показатели паспортного возраста и величину сосудистого возраста мужчин без гипогонадизма. Сердечно-лодыжечный сосудистый индекс и сосудистый возраст также были статистически значимо выше у мужчин с признаками функционального гиперкортицизма ( р < 0,001) в сравнении с подгруппой пациентов без гиперкортицизма. Сосудистый возраст и сердечно-лодыжечный сосудистый индекс увеличивались при росте концентрации кортизола слюны 2200 (r = 0,5; р < 0,05) и уменьшались при увеличении уровня кортизола слюны 900 (r = –0,5; р < 0,05). При увеличении концентрации альдостерона в сыворотке крови, полученной утром, данные параметры уменьшались (r = –0,4; р < 0,05), а при увеличении альдостерона в сыворотке крови в вечернее время — повышались (r = 0,4; р < 0,05). У 23 % (n = 18) наблюдалась «инверсия» суточного ритма продукции кортизола — у данных мужчин уровень кортизола слюны 2200 превышал уровень кортизола слюны 900. Величины сосудистого возраста пациентов с «инверсией» продукции кортизола (49,4 ± 4,4 года) статистически значимо ( p < 0,001) отличались от сосудистого возраста пациентов с нормальными изменениями концентрации кортизола в слюне (41,9 ± 4,9 года). Сердечно-лодыжечный сосудистый индекс также был выше ( p < 0,001) у мужчин с инвертированными колебаниями уровня кортизола в слюне (7,51 ± 0,62) в сравнении с пациентами с нормальным суточным ритмом (6,45 ± 0,69). При оценке концентрации альдостерона выявлено, что у 17 % мужчин (n = 13) содержание альдостерона в вечерней порции сыворотки крови было выше, чем в утренней. У данных пациентов сосудистый возраст (45,8 ± 5,1 года) был выше ( p < 0,001), чем аналогичный показатель у мужчин с нормальными физиологическими изменениями уровня альдостерона (41,6 ± 5,7 года). Такая же закономерность наблюдалась при сравнении показателей жесткости сосудистой стенки: сердечно-лодыжечный сосудистый индекс у мужчин с инвертированными изменениями концентрации альдостерона (6,9 ± 0,8) был значимо выше ( p < 0,001) в сравнении с данным показателем у мужчин с физиологическими изменениями уровня альдостерона в крови (6,4 ± 0,8). Заключение. Эндокринологические нарушения у мужчин с висцеральным ожирением и сопутствующей артериальной гипертензией (функциональный гипогонадизм, функциональный гиперкортицизм, инвертированный суточный ритм продукции кортизола и альдостерона) способствуют развитию синдрома раннего сосудистого старения посредством повышения жесткости сосудистой стенки.
Ключевые слова
Для цитирования:
Ионов А.Ю., Кузнецова Е.А., Киндалёва О.Г., Крючкова И.В., Поплавская Э.Э., Авагимян А.А. Клиническое значение эндокринных нарушений в развитии синдрома раннего сосудистого старения у мужчин с абдоминальным ожирением и сопутствующей артериальной гипертензией: обсервационное когортное исследование. Кубанский научный медицинский вестник. 2024;31(1):74-87. https://doi.org/10.25207/1608-6228-2024-31-1-74-87
For citation:
Ionov A.Yu., Kuznetsova E.A., Kindalyova O.G., Kryuchkova I.V., Poplavskaya E.E., Avagimyan A.A. Clinical significance of endocrine disorders in the development of early vascular aging in males with abdominal obesity and concomitant arterial hypertension: An observational cohort study. Kuban Scientific Medical Bulletin. 2024;31(1):74-87. (In Russ.) https://doi.org/10.25207/1608-6228-2024-31-1-74-87
ВВЕДЕНИЕ
Широко известно, что висцеральное ожирение является плацдармом для развития комплекса метаболических и эндокринологических нарушений, приводящих к развитию артериальной гипертензии, сахарного диабета 2-го типа и их сердечно-сосудистых осложнений.
Поскольку висцеральное ожирение относят к так называемому «мужскому» типу, данная патология широко распространена в мужской популяции. По данным эпидемиологических исследований, ожирением страдают от 14 до 36 % мужчин, причем его распространенность увеличивается с возрастом [1]. В развитии ожирения одну из ведущих ролей играют гормональные нарушения, так как жировая ткань является эндокринным органом, при этом висцеральные адипоциты хорошо кровоснабжаются и имеют большую плотность рецепторов к стероидным гормонам [2]. К эндокринным аспектам патогенеза висцерального ожирения относят гиперпродукцию кортизола, альдостерона, а также дефицит тестостерона у мужчин.
Многими исследователями обнаружена не только высокая распространенность гипогонадизма у мужчин с ожирением (до 100 % при окружности талии (ОТ) более 102 см) [3], но и связь между уровнем общего тестостерона в плазме, сердечно-сосудистыми заболеваниями и сахарным диабетом 2-го типа [4][5].
Сходство метаболических нарушений, развивающихся при висцеральном ожирении и синдроме гиперкортицизма, не позволяет недооценивать вклад хронической гиперсекреции кортизола в его патогенез. Хроническая гиперкортизолемия способствует постепенному развитию инсулинорезистентности, гиперинсулинемии, гиперглюкагонемии, лептинорезистентности, благоприятствует дифференцировке преадипоцитов, подавляет термогенез [6].
Минералокортикоидные рецепторы обнаружены во многих тканях, в том числе в жировой [7]. Чрезмерная активация минералокортикоидных рецепторов, наблюдаемая при ожирении, способствует гипертрофии и дисфункции адипоцитов [7], усилению оксидативного стресса, высвобождению провоспалительных адипокинов и нарушению регуляции аутофагии адипоцитов [8]. Было выявлено, что гиперальдостеронизм способствует развитию гипертриглицеридемии, что, в свою очередь, играет непосредственную роль в развитии АГ и атеросклероза [9].
Учитывая, что одним из важнейших факторов формирования атеросклероза являются морфофункциональные изменения в стенках сосудов, прогностическое и клиническое значение этих изменений у больных с висцеральным ожирением является предметом многочисленных научных исследований [10–12]. Еще в 2008 г. P. M. Nilsson предложил понятие «раннего сосудистого старения» (РСС) (Early vascular aging, EVA) [13]. Оно предложено в качестве определения изменений сосудистой стенки, не свойственных человеку данного возраста и пола, и является новой концепцией для изучения больных с высоким сердечно-сосудистым риском, к которым относятся пациенты с метаболическим синдромом. Понятие «сосудистый возраст» (СВ) представляет собой маркер кумулятивного воздействия факторов риска и общего интегрального показателя развития многих хронических болезней (сердечно-сосудистой патологии, сахарного диабета 2-го типа, онкологических заболеваний) [14]. Расчет сосудистого возраста у пациентов может проводиться с использованием различных подходов. Однако многие существующие протоколы оценки жесткости сосудов не стандартизированы, для них не установлены процедуры контроля качества; существуют проблемы воспроизводимости результатов и их зависимости от оператора, а также сохраняется необходимость определения пороговых значений показателей. Большинства из этих недостатков лишен новый маркер жесткости артерий — сердечно-лодыжечный сосудистый индекс (СЛСИ), который является наиболее современным параметром жесткости сосудистой стенки [15]. СЛСИ не зависит от уровня артериального давления, что делает его более точным и удобным при динамической оценке состояния больных [16].
Практически не проводились исследования, где изучалось бы влияние гипотестостеронемии, гиперкортицизма и гиперальдостеронизма на жесткость сосудистой стенки и, соответственно, на наличие синдрома раннего сосудистого старения, у пациентов с висцеральным ожирением, что и определило научно-практическое направление данного исследования.
Цель исследования — определить связь гиперкортизолемии, гиперальдостеронемии и гипотестостеронемии с жесткостью сосудистой стенки и наличием синдрома раннего сосудистого старения у мужчин с висцеральным ожирением и эссенциальной артериальной гипертензией 1-й степени.
МЕТОДЫ
Дизайн исследования
Работа выполнена по дизайну обсервационного когортного клинического исследования. В исследование включены 78 мужчин в возрасте от 35 до 45 лет с диагнозами «абдоминальное ожирение» и «артериальная гипертензия 1-й степени». Исследование носило одномоментный характер.
Условия проведения исследования
Исследование проводилось на базе терапевтического и эндокринологического отделений государственного бюджетного учреждения здравоохранения «Городская клиническая больница № 1» Министерства здравоохранения Краснодарского края (ГБУЗ «ГКБ№ 1» МЗ КК) и заключалось в изучении связи гиперкортизолемии, гиперальдостеронемии и гипотестостеронемии с жесткостью сосудистой стенки и наличием синдрома раннего сосудистого старения у мужчин с висцеральным ожирением и эссенциальной артериальной гипертензией 1-й степени, I–II стадии, находившихся на лечении в 2022–2023 гг. Все исследуемые пациенты поступали в медицинскую организацию в плановом порядке с целью уточнения диагноза и корректировки лечения.
Критерии соответствия
Критерии включения
Мужчины в возрасте от 35 до 45 лет с окружностью талии более 94 см, ИМТ = 30–39,9 кг/м² (1–2-й степени ожирения), эссенциальной артериальной гипертензией 1-й степени, I–II стадии, получающие антигипертензивную терапию ингибиторами АПФ и тиазидоподобным диуретиком, наличие письменного информированного согласия пациента.
Критерии невключения
В исследование не включались пациенты с 3-й степенью ожирения, с эссенциальной артериальной гипертензией 2-й и 3-й степеней, артериальной гипертензией III стадии, артериальной гипертензией вторичного генеза, сахарным диабетом, гипер- и гипотиреозом, заболеваниями гипофиза и надпочечников, принимающие гормональные препараты, верошпирон, работающие в ночную смену.
Критерии исключения
Отказ от участия в исследовании, отсутствие письменного добровольного согласия на участие в исследовании.
Описание критериев соответствия (диагностические критерии)
Отбор пациентов включал установление диагноза на основе клинических данных, результатов лабораторно-инструментального обследования в соответствии с национальными рекомендациями и принятыми клиническими протоколами.
Подбор участников в группы
Подбор участников исследования проводился на основании критериев соответствия. Проведено обследование 78 мужчин. Для определения влияния функционального гипогонадизма и гиперкортицизма на сосудистый возраст исследуемые пациенты были разделены на четыре подгруппы по уровню общего тестостерона (подгруппы 1 А и 1 Б) и по содержанию кортизола (подгруппы 2 А и 2 Б) в вечерней порции слюны. Точка разделения концентрации общего тестостерона (12 ммоль/л) использовалась в соответствии с рекомендациями по диагностике гипогонадизма у мужчин [17], для вечернего кортизола слюны точка разделения соответствовала верхней границе референсного диапазона 4,5 нмоль/л.
Целевые показатели исследования
Основные показатели исследования
Основными показателями исследования явились содержание общего тестостерона и глобулина, связывающего половые стероиды (ГСПГ), в сыворотке крови и свободных форм тестостерона в сыворотке крови и слюне, свободного кортизола в слюне, альдостерона в сыворотке крови, а также сердечно-лодыжечный сосудистый индекс и сосудистый возраст. Так же определялись в ходе исследования липопротеины низкой (ЛПНП) и высокой (ЛПВП) плотности, триглицериды, глюкоза, инсулин, индекс НОМА-IR, систолическое артериальное давление (САД) и диастолическое артериальное давление (ДАД).
Дополнительные показатели исследования
Настоящим исследованием не предусмотрены.
Методы измерения целевых показателей
Концентрация общего тестостерона определялась методом усиленной хемилюминесценции (Ortho-Clinical Diagnostics, J&J), а ГСПГ и инсулина — методом отсроченной во времени флюоресценции. Содержание альдостерона в утренних и вечерних образцах сыворотки крови определялось методом радиоиммунологического анализа. Содержание свободного кортизола и тестостерона в утренней (900) и вечерней (22 00) порциях слюны определялось люминесцентным LIA-методом (IBL-Гамбург, Германия). Расчет концентрации свободного и биодоступного тестостерона в сыворотке крови проводился математическим методом с помощью интернет-калькулятора (issam.ch/freetesto.htm) с использованием полученных значений общего тестостерона, ГСПГ и альбумина (формула 1):
FT = ([T] – (N × [FT]))/(Kt {SHBG – [T] + N [FT]}),(1)
где K t — константа ассоциации SHBG для T, Т — общий тестостерон, SGHB — глобулин, связывающий половые стероиды, а N = Ka Ca + 1, Ka — константа ассоциации альбумина для Т, Ca — концентрация альбумина, а FT — фракция свободного Т (пмоль/л).
Для оценки инсулинорезистентности рассчитывался индекс НОМА-IR (Homeostasis Model Assessment of Insulin Resistance) [11] (формула 2):
HOMA-IR = инсулин натощак (Ед/л) × глюкоза натощак (ммоль/л)/22,5.(2)
Сердечно-лодыжечный сосудистый индекс (СЛСИ) определялся на сфигмометре VaSera VS-15000N (Fukuda, Япония), сосудистый возраст рассчитывался автоматически на данном аппарате. СЛСИ рассчитывается на основании параметра жесткости β с учетом модифицированного уравнения Bramwell-Hill’s [12] (формула 3):
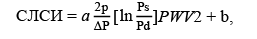 (3)
(3)
где Ps и Pd — систолическое и диастолическое артериальное давление соответственно (мм рт. ст.), PWV — скорость пульсовой волны между сердцем и лодыжкой (м/с), ΔP: Ps – Pd, ρ — плотность крови (г/см³), a и b — константы. Аппарат VS-1500N позволяет определить сосудистый возраст исходя из жесткости сосудистой стенки.
Переменные (предикторы, конфаундеры, модификаторы эффекта)
Факторы, искажающие результаты проводимого исследования, были внесены в состав критериев невключения, таким образом, их влияние было устранено.
Статистические процедуры
Принципы расчета размера выборки
Предварительного расчета размера выборки не проводилось.
Статистические методы
Статистический анализ проводился на базе пакета прикладных программ Statistica 10.0 Windows (StatSoft, Inc., США) Статистическая значимость различий определялась с помощью критерия Манна — Уитни. Корреляционные показатели рассчитывались методом ранговой корреляции Спирмена. Различия считались статистически значимыми при уровне р < 0,05. Описательная статистика представлена в таблицах в виде медианы и интерквартильного размаха, в тексте — в виде среднего арифметического и стандартного отклонения.
РЕЗУЛЬТАТЫ
Формирование выборки исследования
Выборка исследования формировалась в соответствии с критериями включения и невключения. В зависимости от содержания общего тестостерона в сыворотке крови и свободного кортизола в вечерней порции слюны выделены следующие подгруппы: подгруппа 1 А — мужчины с гипогонадизмом — общий тестостерон < 12,1 нмоль/л, подгруппа 1 Б (подгруппа сравнения) — мужчины без гипогонадизма — общий тестостерон ≥ 12,1 нмоль/л; подгруппа 2 А — пациенты с функциональным гиперкортицизмом — кортизол > 4,5 нмоль/л, подгруппа 2 Б (подгруппа сравнения) — кортизол ≤ 4,5 нмоль/л). Дизайн исследования представлен на рисунке 1.
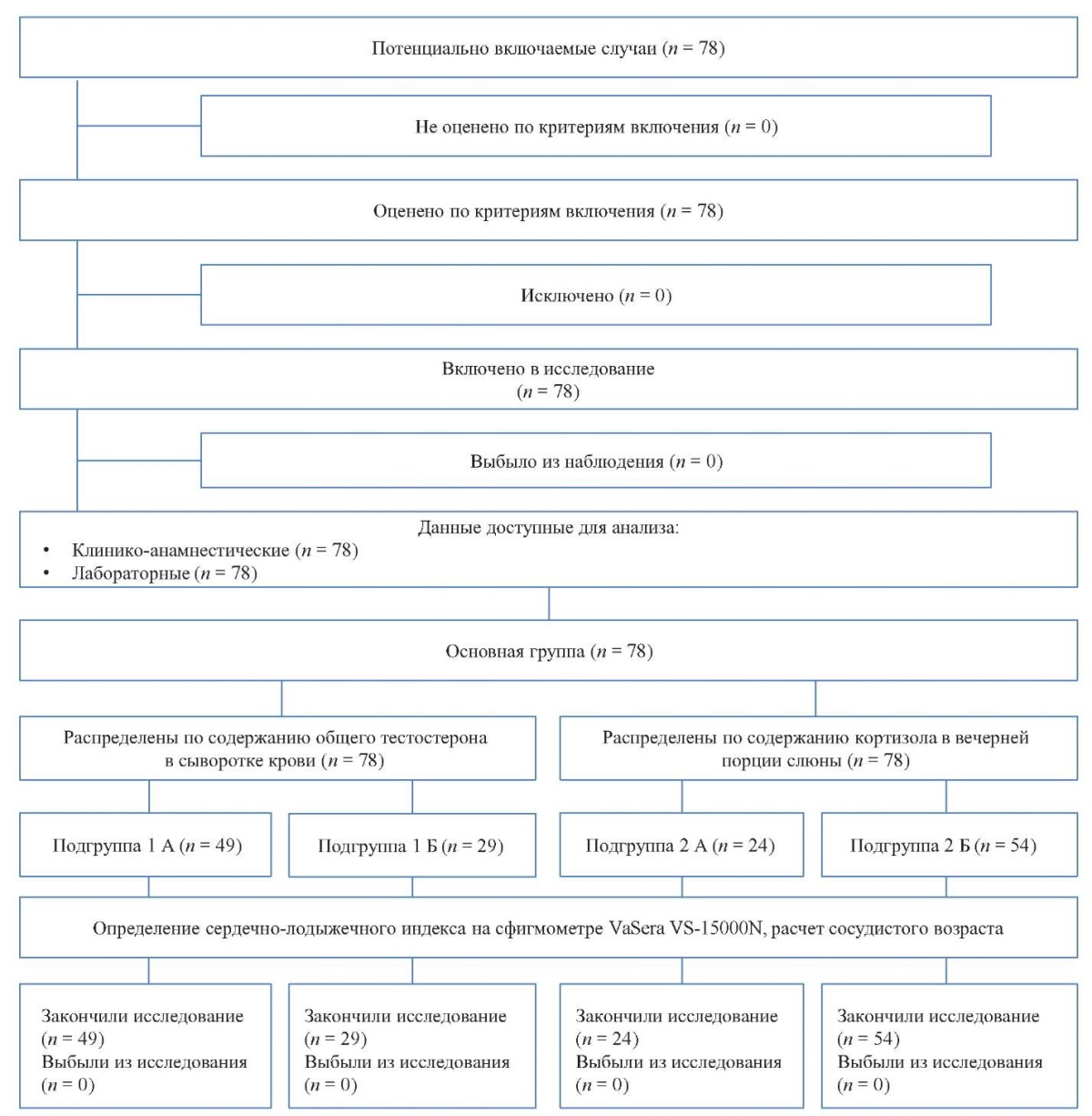
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами
(согласно рекомендациям STROBE).
Fig. 1. Research design
Note: compiled by the authors
(according to the STROBE recommendations).
Характеристика выборки (групп) исследования
Всего в исследование были включены 78 мужчин от 35 до 45 лет (средний возраст 38,1 ± 6,5 года). Ограниченный десятилетний возрастной интервал был выбран в связи с регламентируемой методикой расчета, т. е. прямой зависимостью жесткости сосудистой стенки и сосудистого возраста с паспортным возрастом, и предполагал корректность сравнения. Пациенты имели признаки абдоминального ожирения (окружность талии более 94 см), эссенциальной артериальной гипертензии 1-й степени, I–II стадии. Среднее значение окружности талии составило 105,5 ± 6,9 см. Средние значения артериального давления — САД 152,5 ± 5,0 мм рт. ст., ДАД 92,5 ± 5,0. Сосудистый возраст у исследуемых пациентов (n = 78) составил 44,1 ± 6,2 года, что было статистически значимо выше показателей паспортного возраста (р < 0,001).
Среди исследуемых пациентов были выделены мужчины с дефицитом тестостерона (n = 49) и без дефицита тестостерона (n = 29), мужчины с увеличением содержания свободного кортизола в вечерней порции слюны (n = 24) и с нормальными значениями содержания свободного кортизола в слюне (n = 54). Показатели возраста и ИМТ в изучаемых подгруппах представлены в таблицах 1, 2.
Таблица 1. Медианные значения Ме (25–75 %) параметров
в отобранных подгруппах пациентов 1 А и 1 Б
Table 1. Median values Me (25–75 %) in the selected patient subgroups 1 A and 1 B
|
Параметры Ме (25–75 %) |
Подгруппа 1 А (общий тестостерон < 12,1 нмоль/л) (n = 49) |
Подгруппа 1 Б (подгруппа сравнения) (общий тестостерон ≥ 12,1 нмоль/л) (n = 29) |
р |
|
Общий тестостерон, нмоль/л |
9 (8,1–10,35) |
14,2 (13,3–16,0) |
<0,001 |
|
Возраст, лет |
38,9 (36,1–44,8) |
37,8 (35,2–43,1) |
=0,056 |
|
Окружность талии, см |
110 (106,5–114) |
102 (100–110) |
<0,001 |
|
ИМТ, кг/м² |
36,7 (33,9–39,2) |
34,3 (31,8–37,4) |
=0,063 |
|
Ожирение 1-й степени (абс./отн.) |
19 (38,8 %) |
15 (51,7 %) |
=0,453 |
|
Ожирение 2-й степени (абс./отн.) |
30 (61,2 %) |
14 (48,3 %) |
=0,420 |
Примечание: таблица выполнена авторами.
Сокращение: ИМТ — индекс массы тела.
Note: compiled by the authors.
Abbreviations: ИМТ — Body Mass Index.
Таблица 2. Медианные значения Ме (25–75 %) параметров
в отобранных подгруппах пациентов 2 А и 2 Б
Table 2. Median values Me (25–75 %) in the selected patient subgroups 2 A and 2 B
|
Параметры Ме (25–75 %) |
Подгруппа 2 А (вечерний кортизол слюны > 4,5 нмоль/л) (n = 24) |
Подгруппа 2 Б (подгруппа сравнения) (вечерний кортизол слюны ≤ 4,5 нмоль/л) (n = 54) |
р |
|
Вечерний кортизол слюны, нмоль/л |
5,8 (4,8–8,7) |
2,4 (1,5–3,4) |
<0,001 |
|
Возраст, лет |
38,9 (36,1–44,8) |
37,8 (35,2–43,1) |
=0,056 |
|
Окружность талии, см |
110 (108–112) |
103 (100–110) |
=0,004 |
|
ИМТ, кг/м² |
36,7 (33,9–39,2) |
34,3 (31,8–37,4) |
=0,063 |
|
Ожирение 1-й степени (абс./отн.) |
10 (41,7 %) |
36 (66,7 %) |
=0,151 |
|
Ожирение 2-й степени (абс./отн.) |
14 (58,3 %) |
18 (33,3 %) |
=0,157 |
Примечание: таблица выполнена авторами.
Сокращение: ИМТ — индекс массы тела.
Note: compiled by the authors.
Abbreviations: ИМТ — Body Mass Index.
Основные результаты исследования
Результаты сравнительного анализа изучаемых показателей представлены в таблицах 3, 4.
Таблица 3. Медианные значения изучаемых параметров
в сравниваемых подгруппах пациентов с наличием и отсутствием дефицита тестостерона
Table 3. Median values of the studied parameters
in the compared patient subgroups with and without testosterone deficiency
|
Параметры Ме (25–75 %) |
Подгруппа 1 А (общий тестостерон < 12,1 нмоль/л) (n = 49) |
Подгруппа 1 Б (подгруппа сравнения) (общий тестостерон ≥ 12,1 нмоль/л) (n = 29) |
р |
|
Свободный расчетный тестостерон, пмоль/л |
212,5 (197–242) |
305 (272–368) |
<0,001 |
|
Биодоступный тестостерон, нмоль/л |
5,80 (5,18–6,50) |
8,14 (7,15–9,54) |
<0,001 |
|
Тестостерон слюны 900, пмоль/л |
278 (243–332) |
344 (284,5–397) |
<0,001 |
|
Тестостерон слюны 22 00, пмоль/л |
227,5 (196–274,5) |
316 (269–369) |
<0,001 |
|
Триглицериды, ммоль/л |
2,4 (1,4–3,9) |
1,5 (1,2–1,8) |
<0,001 |
|
ЛПВП, ммоль/л |
1,02 (0,73–1,12) |
0,89 (0,78–1,04) |
=0,456 |
|
ЛПНП, ммоль/л |
2,9 (2,7–3,5) |
2,7 (2,4–2,9) |
<0,001 |
|
САД, мм рт. ст. |
155 (150–160) |
145 (140–150) |
<0,001 |
|
ДАД, мм рт. ст. |
95 (92,5–105) |
100 (90–100) |
=0,144 |
|
Глюкоза, ммоль/л |
5,9 (5,7–6,4) |
5,1 (4,8–5,6) |
<0,001 |
|
ИРИ, Ед/л |
12,8 (8,5–17,15) |
10,4 (5,7–14,1) |
=0,036 |
|
НОМА-IR |
2,95 (1,9–4,6) |
2,32 (1,37–3,13) |
=0,002 |
|
Кортизол слюны 900, нмоль/л |
9,25 (6,65–13,15) |
16,2 (9,9–19,5) |
<0,001 |
|
Кортизол слюны 22 00, нмоль/л |
4,8 (2,7–7,8) |
3,1 (1,9–3,9) |
<0,001 |
|
Альдостерон сыворотки крови утро, пмоль/л |
266 (148–518) |
439 (167–679) |
=0,208 |
|
Альдостерон сыворотки крови вечер, пмоль/л |
410 (219–651) |
213 (176–356) |
=0,007 |
|
СЛСИ |
7,15 (6,69–7,69) |
6,27 (5,91–6,79) |
<0,001 |
|
СВ, лет |
46,8 (43,6–50,6) |
40,66 (38,1–44,3) |
<0,001 |
Примечание: таблица выполнена авторами.
Сокращения: ЛПВП — липопротеины высокой плотности;
ЛПНП — липопротеины низкой плотности;
САД — систолическое артериальное давление;
ДАД — диастолическое артериальное давление:
ИРИ — иммунореактивный инсулин;
HOMA-IR — индекс инсулинорезистентности;
СЛСИ — сердечно-лодыжечный сосудистый индекс, определенный инструментально;
СВ — сосудистый возраст, определенный инструментально.
Note: compiled by the authors.
Abbreviations: ЛПВП — high-density lipoproteins;
ЛПНП — low density lipoprotein; САД — systolic blood pressure;
ДАД — diastolic blood pressure; ИРИ — immunoreactive insulin;
HOMA-IR — Homeostasis Model Assessment of Insulin Resistance;
СЛСИ — CAVI determined instrumentally;
СВ — vascular age determined instrumentally.
Таблица 4. Медианные значения изучаемых параметров
в сравниваемых подгруппах пациентов
с наличием и отсутствием функционального гиперкортицизма
Table 4. Median values of the studied parameters in the compared patient subgroups
with and without functional hypercortisolism
|
Параметры Ме (25–75 %) |
Подгруппа 2 А (вечерний кортизол слюны > 4,5 нмоль/л) (n = 24) |
Подгруппа 2 Б (вечерний кортизол слюны ≤ 4,5 нмоль/л) (n = 5 4) |
р |
|
Глюкоза, ммоль/л |
5,6 (5,2–6,3) |
5,2 (4,8–5,9) |
=0,004 |
|
ИРИ, Ед/л |
11,8 (8,5–16,7) |
9,3 (5,7–14,9) |
=0,011 |
|
НОМА-IR |
2,96 (2,07–4,55) |
2,32 (1,38–3,30) |
=0,003 |
|
Общий тестостерон, нмоль/л |
9,2 (8,1–11,2) |
13,0 (10,4–14,9) |
<0,001 |
|
Свободный расчетный тестостерон, пмоль/л |
213 (196–281) |
272 (221–333) |
<0,001 |
|
Биодоступный тестостерон, нмоль/л |
5,81 (5,18–7,24) |
7,25 (6,04–8,91) |
<0,001 |
|
Тестостерон слюны 900, пмоль/л |
291,5 (244–372) |
311,5 (260,2–378,2) |
=0,263 |
|
Тестостерон слюны 22 00, пмоль/л |
237 (190–295) |
278,5 (235,9–364,0) |
=0,002 |
|
Альдостерон сыворотки крови утро, пмоль/л |
251 (148–543) |
413 (168–577) |
=0,394 |
|
Альдостерон сыворотки крови вечер, пмоль/л |
450 (219–651) |
222 (155–395) |
=0,037 |
|
СЛСИ |
7,11 (6,67–7,55) |
6,53 (6,15–7,19) |
=0,001 |
|
СВ, лет |
46,6 (43,5–49,6) |
42,5 (39,8–47,1) |
=0,001 |
Примечание: таблица выполнена авторами.
Сокращения: ИРИ — иммунореактивный инсулин; H
OMA-IR — индекс инсулинорезистентности;
СЛСИ — сердечно-лодыжечный сосудистый индекс, определенный инструментально;
СВ — сосудистый возраст, определенный инструментально,
ИМТ — индекс массы тела.
Note: compiled by the authors.
Abbreviations: ИРИ — immunoreactive insulin;
HOMA-IR — Homeostasis Model Assessment of Insulin Resistance;
СЛСИ — CAVI determined instrumentally;
СВ — vascular age determined instrumentally,
ИМТ — Body Mass Index.
В подгруппе мужчин с дефицитом общего тестостерона выявлено статистически значимое снижение содержания свободного расчетного, биодоступного тестостерона, свободного тестостерона в утренней и вечерней порциях слюны. У мужчин с гипогонадизмом, в сравнении с пациентами без гипогонадизма, выявлено статистически значимое увеличение уровня триглицеридов, холестерина ЛПНП, гликемии натощак, инсулина и индекса НОМА, САД, вечернего кортизола в слюне, альдостерона в вечерних образцах сыворотки крови. При этом кортизол в утренней порции слюны в данной подгруппе был статистически значимо ниже. Обращало на себя внимание значимое увеличение показателей сосудистого возраста и СЛСИ у пациентов с гипогонадизмом (табл. 3).
Умеренные статистически значимые отрицательные корреляции выявлены между содержанием глюкозы натощак и общим, свободным расчетным и биодоступным тестостероном (r = –0,5; р < 0,05); между уровнем триглицеридов и ЛПНП и общим, свободным расчетным и биодоступным тестостероном (r = –0,4; р < 0,05); между САД и свободным расчетным тестостероном (r = –0,5; р < 0,05), свободным тестостероном в утреней и вечерней порции слюны (r = –0,4; р < 0,05).
Установлена зависимость сосудистого возраста и СЛСИ от уровней САД и ДАД (r = 0,5; р < 0,05), гликемии натощак (r = 0,5; р < 0,05), общего тестостерона и свободного тестостерона слюны 22 00 (r = –0,5; р < 0,05), свободного расчетного (r = –0,6; р < 0,05) и биодоступного тестостерона (r = –0,7; р < 0,05).
СЛСИ и сосудистый возраст также были выше у мужчин с признаками функционального гиперкортицизма (табл. 4).
В подгруппе пациентов с функциональным гиперкортицизмом наблюдалось статистически значимое увеличение показателей гликемии натощак, индекса НОМА, инсулина, альдостерона в вечерних образцах сыворотки крови и снижение концентрации общего, биодоступного и свободных форм тестостерона (в слюне 22 00 и расчетного уровня).
Путем корреляционного анализа выявлено, что при повышении содержания кортизола в вечерней порции слюны у исследуемых пациентов (n = 78) снижается уровень общего, свободного расчетного и биодоступного тестостерона и тестостерона слюны 22 00 (r = –0,4; р < 0,05). Напротив, перечисленные параметры андрогенного статуса увеличивались вместе с ростом уровня кортизола слюны 900 (r = 0,4; р < 0,05). Таким образом, уровни кортизола и тестостерона зависели от времени суток. В таблице 3 также показано, что в подгруппе 1 А мужчин с гипогонадизмом концентрация кортизола в слюне в вечернее время была статистически значимо выше, а в утренние часы статистически значимо ниже в сравнении с пациентами 1 Б подгруппы без андрогенного дефицита.
Аналогичная тенденция прослеживалась между уровнем СЛСИ, сосудистым возрастом и концентрацией кортизола в слюне. Так, сосудистый возраст и СЛСИ положительно коррелировали с концентрацией кортизола слюны 22 00 (r = 0,5; р < 0,05) и отрицательно коррелировали с уровнем кортизола слюны 900 (r = –0,5; р < 0,05) (рис. 2). Похожие корреляции наблюдались между сосудистым возрастом, СЛСИ и концентрацией альдостерона (рис. 3): изменения уровня альдостерона в сыворотке крови, полученной утром, отрицательно коррелировали с СЛСИ и сосудистым возрастом (r = –0,4; р < 0,05), а изменения концентрации альдостерона в утренних образцах сыворотки крови положительно коррелировали с указанными параметрами (r = 0,4; р < 0,05).
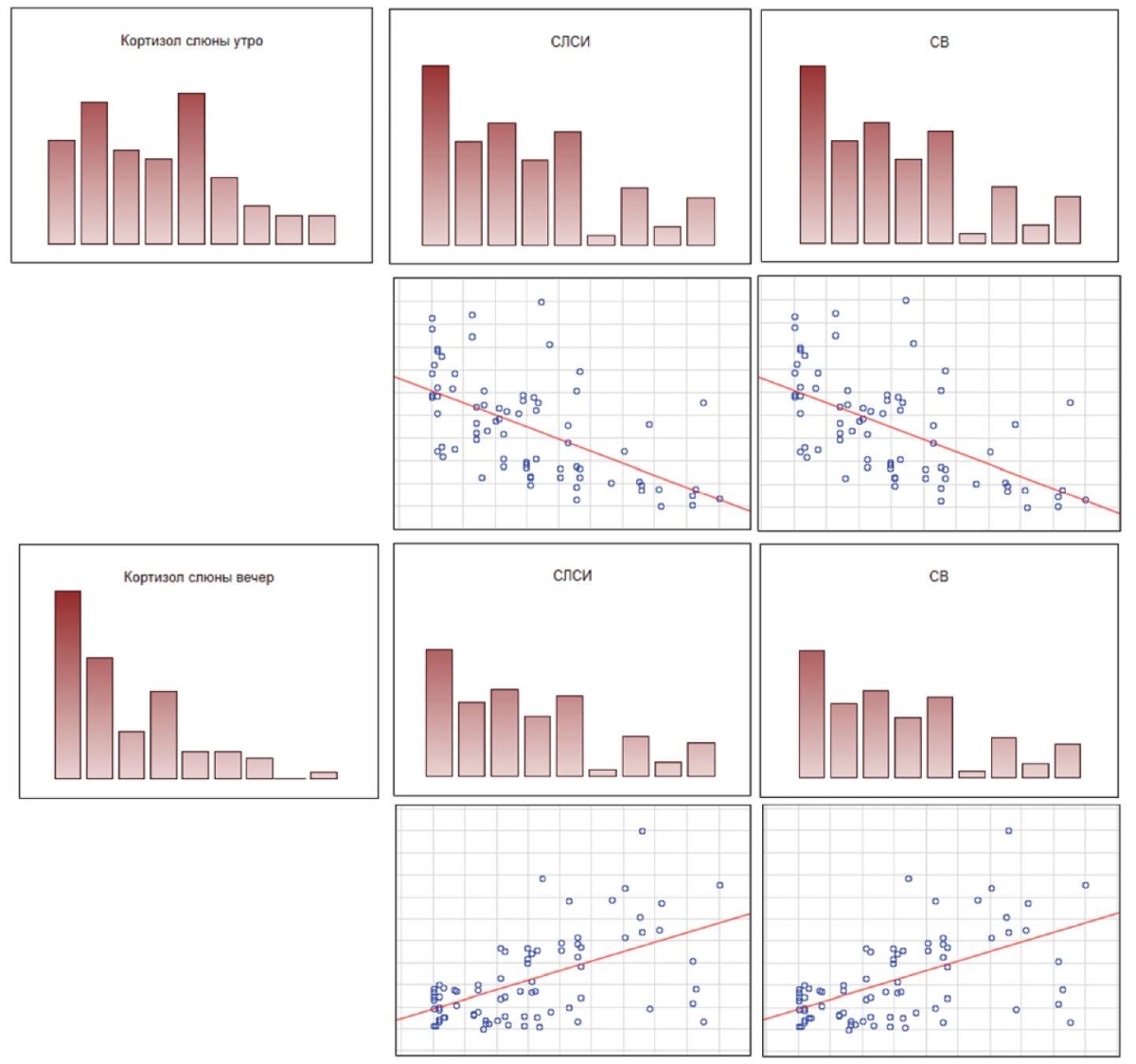
Рис. 2. Корреляции сосудистого возраста пациентов, СЛСИ
и концентрации кортизола в слюне в утреннее и вечернее время (p < 0,05)
Примечание: рисунок выполнен авторами.
Сокращения: СЛСИ — сердечно-лодыжечный сосудистый индекс,
СВ — сосудистый возраст.
Fig. 2. Correlations of vascular age of patients, cardio-ankle vascular index (СAVI),
and cortisol concentrations in saliva in the morning and evening (р < 0.05)
Note: compiled by the authors.
Abbreviations: СЛСИ — CAVI, СВ — vascular age.
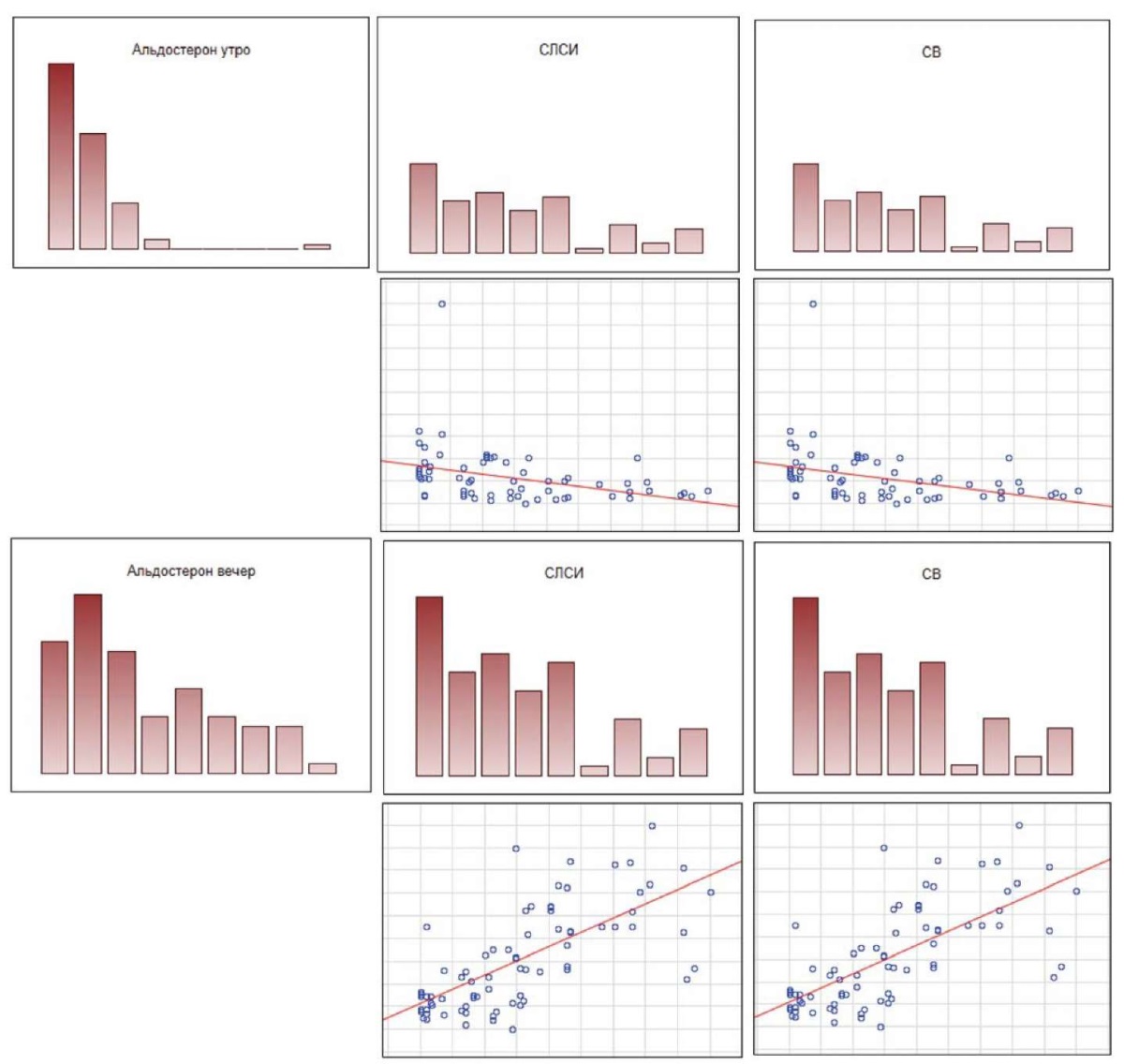
Рис. 3. Корреляции сосудистого возраста пациентов, СЛСИ
и концентрации уровня альдостерона в сыворотке крови
в утреннее и вечернее время (p < 0,05)
Примечание: рисунок выполнен авторами.
Сокращения: СЛСИ — сердечно-лодыжечный сосудистый индекс,
СВ — сосудистый возраст.
Fig. 3. Correlations of vascular age of patients, CAVI,
and serum aldosterone levels in the morning and evening (р < 0.05)
Note: compiled by the authors.
Abbreviations: СЛСИ — CAVI, СВ — vascular age.
При оценке концентрации кортизола в утренней и вечерней порциях слюны у изучаемых пациентов выявлено, что у 23 % (n = 18) наблюдалась «инверсия» суточного ритма продукции кортизола — у данных мужчин уровень кортизола слюны 22 00 превышал уровень кортизола слюны 900. Величины сосудистого возраста пациентов с «инверсией» продукции кортизола (49,4 ± 4,4 года) статистически значимо (p < 0,001) отличались от сосудистого возраста пациентов с нормальными изменениями концентрации кортизола в слюне (41,9 ± 4,9 года). СЛСИ также был выше (p < 0,001) у мужчин с инвертированными колебаниями уровня кортизола в слюне (7,51 ± 0,62) в сравнении с пациентами с нормальным суточным ритмом (6,45 ± 0,69).
У всех исследуемых пациентов уровень альдостерона находился в пределах референсных значений. При оценке концентрации альдостерона выявлено, что у 17 % мужчин (n = 13) содержание альдостерона в вечерней порции сыворотки крови было выше, чем в утренней, т. е. наблюдалась инверсия суточных изменений концентрации альдостерона. У данных пациентов сосудистый возраст (45,8 ± 5,1 года) был выше (p < 0,001), чем аналогичный показатель у мужчин с нормальными физиологическими изменениями уровня альдостерона (41,6 ± 5,7 года). Такая же закономерность наблюдалась при сравнении показателей жесткости сосудистой стенки: СЛСИ у мужчин с инвертированными изменениями концентрации альдостерона (6,9 ± 0,8) был значимо выше (p < 0,001) в сравнении с данным показателем у мужчин с физиологическими изменениями уровня альдостерона в крови (6,4 ± 0,8).
Дополнительные результаты исследования
Дополнительные результаты в ходе исследования не получены.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
У пациентов с функциональным гипогонадизмом выявлено повышение жесткости сосудистой стенки (СЛСИ выше, чем в подгруппе сравнения (p < 0,001)), наблюдается увеличение сосудистого возраста по сравнению с паспортным (p < 0,001) и величиной сосудистого возраста подгруппы сравнения (p < 0,001). У пациентов с функциональным гиперкортицизмом выявлено повышение жесткости сосудистой стенки (СЛСИ выше, чем в подгруппе сравнения (p = 0,001)), увеличение сосудистого возраста по сравнению с паспортным (p < 0,001) и величиной сосудистого возраста подгруппы сравнения (p = 0,001).
Как у пациентов с инвертированным суточным ритмом продукции кортизола, так и у пациентов с инвертированным суточным ритмом продукции альдостерона выявлено повышение жесткости сосудистой стенки: сердечно-лодыжечный сосудистый индекс выше, чем в группе с сохраненным физиологическим ритмом продукции кортизола (p < 0,001). Таким образом, эндокринологические нарушения у мужчин с висцеральным ожирением и сопутствующей АГ (функциональный гипогонадизм, функциональный гиперкортицизм, инвертированный суточный ритм продукции кортизола и альдостерона) способствуют развитию синдрома раннего сосудистого старения посредством повышения жесткости сосудистой стенки.
Ограничение исследования
Данное исследование было проведено на небольшой выборке пациентов. Кроме того, в исследование включались пациенты только мужского пола. Для продолжения работы требуется увеличение объема выборки и включение в исследование пациентов женского пола.
Интерпретация результатов исследования
Ранее при изучении синдрома раннего сосудистого старения основную роль в патогенезе его возникновения отводили повышению параметров жесткости сосудистой стенки, высокому уровню С-реактивного белка и других провоспалительных цитокинов, длине теломер. Наше исследование показало, что в развитии синдрома сосудистого старения важную роль играют также эндокринологические нарушения: гиперкортизолемия, гипотестостеронемия, а также гиперальдостеронемия. Данные нарушения приводят к увеличению жесткости сосудистой стенки, тем самым опосредовано способствуя увеличению сосудистого возраста. Влияние дефицита тестостерона на состояние сосудистой стенки можно объяснить изменением продукции цитокинов, что было показано в других исследованиях. Так, тестостерон повышает уровень противовоспалительных цитокинов и снижает уровень провоспалительных цитокинов [18], поэтому у мужчин с ожирением и гипогонадизмом его протекторное действие на сосудистую стенку нивелируется, что приводит к увеличению СЛСИ и сосудистого возраста.
Доказано, что повышение концентрации кортизола при висцеральном ожирении ассоциировано с повышенным уровнем систолического и диастолического артериального давления, снижением уровня ЛПВП в сочетании с гипертриглицеридемией, гипергликемией натощак и увеличением резистентности к инсулину [19].
Наше исследование подтверждает данные об увеличении концентрации кортизола в вечерние и ночные часы при висцеральном ожирении [20][21]. В ранее опубликованном нами исследовании были выявлены разнонаправленные корреляционные тенденции между уровнем кортизола в слюне в утренние и вечерние часы и содержанием тестостерона в крови и слюне [22]. В настоящей работе показано не только влияние утренних и вечерних концентраций кортизола на уровень тестостерона, но и изменение направления корреляций между СЛСИ, сосудистым возрастом и содержанием кортизола в слюне от времени суток. Выявлено, что сосудистый возраст выше у пациентов с инвертированными изменениями концентрации кортизола в слюне, когда вечерние уровни кортизола превышают утренние. Полученные данные можно объяснить нарушением циркадных ритмов активности оси гипоталамус — гипофиз — надпочечники, которым в настоящее время отводится одна из ведущих ролей в развитии висцерального ожирении [23].
Известно, что основным регулятором секреции альдостерона является система ренин-ангиотензин-II. Однако есть данные, свидетельствующие о стимуляции секреции альдостерона в надпочечниках при повышении продукции адренокортикотропного гормона или его экзогенном введении. Таким образом, продемонстрированные нами разнонаправленные зависимости сосудистого возраста, СЛСИ и уровня альдостерона в сыворотке крови в утренние и вечерние часы можно также связать с дерегуляцией циркадной активности гипоталамо-гипофизарно-надпочечниковой оси. При проведении литературного поиска нами найдено крайне мало сведений о нарушении циркадных ритмов продукции альдостерона. Похожие данные были получены только в исследовании, проведенном профессором Н. П. Гончаровым и соавторами на модели болезни Иценко — Кушинга, где в когорте пациентов с артериальной гипертензией было получено значимое многократное повышение концентрации альдостерона в ночные часы, в то время как у больных с нормальным артериальным давлением суточная динамика секреции альдостерона сохранялась [24–26].
Поскольку минералокортикоидные рецепторы присутствуют в жировой ткани и сосудах [7], а гиперальдостеронемия способствует развитию фиброза сосудистой стенки [8], то справедливым будет предположение, что избыточная продукция альдостерона при ожирении приводит к увеличению жесткости сосудистой стенки, что, в свою очередь, повышает сосудистый возраст. Еще одним патогенетическим механизмом повышения жесткости сосудистой стенки и сосудистого возраста является чрезмерная активация минералокортикоидных рецепторов в жировой ткани [7], способствующая высвобождению провоспалительных адипокинов и увеличению окислительного стресса [27–29].
ЗАКЛЮЧЕНИЕ
Жесткость сосудистой стенки — один из факторов, определяющих прогрессирование сердечно-сосудистых заболеваний. Выявление дополнительных клинических и лабораторных критериев, влияющих на формирование раннего сосудистого старения, расширяет возможности диагностики и своевременных лечебно-профилактических мероприятий у пациентов с ожирением в исследуемом возрастном диапазоне. В данном исследовании выявлено, что эндокринологические нарушения у мужчин с висцеральным ожирением и сопутствующей артериальной гипертензией (функциональный гипогонадизм, функциональный гиперкортицизм, инвертированный суточный ритм продукции кортизола и альдостерона) способствуют развитию синдрома раннего сосудистого старения посредством повышения жесткости сосудистой стенки. Таким образом, исследование дополнило представления о патогенетических механизмах снижения эластичности сосудистой стенки. Перспективой продолжения данной работы является изучение влияния коррекции эндокринологических нарушений на жесткость сосудистой стенки.
Список литературы
1. Баланова Ю.А ., Шальнова С. А., Деев А.Д., Имаева А.Э., Концевая А. В., Муромцева Г. А., Капустина А.В., Евстифеева С.Е., Драпкина О. В. Ожирение в российской популяции — распространенность и ассоциации с факторами риска хронических неинфекционных заболеваний. Российский кардиологический журнал. 2018;6:123-130. https://doi.org/10.15829/1560-4071-2018-6-123-130
2. Reyes-Farias M, Fos-Domenech J, Serra D, Herrero L, Sánchez-Infantes D. White adipose tissue dysfunction in obesity and aging. Biochem Pharmacol. 2021;192:114723. https://doi.org/10.1016/j.bcp.2021.114723
3. Wang ZY, Li BC, Xing JJ, Liu SY, Zhang TT, Xu AM, Wang ZJ. Associations of waist circumference with sex steroid hormones among 4031 USA children and adolescents. Asian J Androl. 2023;25(4):505-511. https://doi.org/10.4103/aja202284
4. Хрипун И. А., Воробьев С. В. Гипогонадизм как коморбидность сахарного диабета 2-го типа. FOCUS Эндокринология. 2020;1:16-20. https://doi.org/10.47407/ef2020.1.1.0002
5. Gencer B, Bonomi M, Adorni MP, Sirtori CR, Mach F, Ruscica M. Cardiovascular risk and testosterone — from subclinical atherosclerosis to lipoprotein function to heart failure. Rev Endocr Metab Disord. 2021;22(2):257-274. https://doi.org/10.1007/s11154-021-09628-2
6. Abulizi A, Camporez JP, Jurczak MJ, H0yer KF, Zhang D, Cline GW, Samuel VT, Shulman GI, Vatner DF. Adipose glucocorticoid action influences whole-body metabolism via modulation of hepatic insulin action. FASEB J. 2019;33(7):8174-8185. https://doi.org/10.1096/fj.201802706R
7. Armani A, Marzolla V, Fabbri A, Caprio M. Cellular mechanisms of MR regulation of adipose tissue physiology and pathophysiology. J Mol Endocrinol. 2015;55(2):R1-10. https://doi.org/10.1530/JME-15-0122
8. Jia G, Aroor AR, Hill MA, Sowers JR. Role of Renin-Angiotensin-Aldosterone System Activation in Promoting Cardiovascular Fibrosis and Stiffness. Hypertension. 2018;72(3):537-548. https://doi.org/10.1161/HYPERTENSIONAHA.118.11065
9. Lunenfeld B, Mskhalaya G, Zitzmann M, Arver S, Kalinchenko S, Tishova Y, Morgentaler A. Recommendations on the diagnosis, treatment and monitoring of hypogonadism in men. Aging Male. 2015;18(1):5-15. https://doi.org/10.3109/13685538.2015.1004049
10. Jenkins HN, Rivera-Gonzalez O, Gibert Y, Speed JS. Endothelin-1 in the pathophysiology of obesity and insulin resistance. Obes Rev. 2020;21(12):e13086. https://doi.org/10.1111/obr.13086
11. Майоров А.Ю., Урбанова К.А., Галстян Г.Р. Методы количественной оценки инсулинорезистентности. Ожирение и метаболизм. 2009;6(2):19-23. https://doi.org/10.14341/2071-8713-5313
12. Гома Т.В., Цыренова А.А. Оценка взаимосвязи сосудистого возраста, определенного методом объемной сфигмографии, атерогенного индекса плазмы с основными клинико-лабораторными и гемодинамическими показателями при артериальной гипертензии. Атеросклероз. 2023;19(3):198-200. https://doi.org/10.52727/2078-256X-2023-19-3-198-200
13. Laurent S, Boutouyrie P, Cunha PG, Lacolley P, Nilsson PM. Concept of Extremes in Vascular Aging. Hypertension. 2019;74(2):218-228. http://dx.doi.org/10.1161/HYPERTENSIONAHA.119.12655
14. Недогода С.В., Саласюк А.С., Барыкина И.Н., Лутова В.О., Попова Е. А. Синдром раннего сосудистого старения у пациентов с метаболическим синдромом: особенности течения и диагностики. Южно-Российский журнал терапевтической практики. 2021;2(1):50-62. https://doi.org/10.21886/2712-8156-2021-2-1-50-62
15. Заирова А. Р., Рогоза А. Н., Ощепкова Е. В., Яровая Е. Б., Куценко В. А., Шальнова С. А., Трубачева И. А., Кавешников В. С., Серебрякова В. Н., Бойцов С. А. Значение показателя артериальной жесткости «сердечно-лодыжечный сосудистый индекс — CAVI» для прогноза сердечно-сосудистых событий в популяционной выборке взрослого городского населения (по материалам исследования ЭССЕ- РФ, Томск). Кардиоваскулярная терапия и профилактика. 2021;20(5):2967. https://doi.org/10.15829/1728-8800-2021-2967
16. Вернер В.А., Мельник М. В., Князева С. А. Сердечно-лодыжечный сосудистый индекс в диагностике, определении степени тяжести и риска поражения магистральных сосудов у пациентов с сердечно-сосудистыми заболеваниями и сахарным диабетом 2-го типа. Терапевтический архив. 2021;93(1):87-93. https://doi.org/10.26442/00403660.2021.01.20059
17. Дедов И.И., Мокрышева Н.Г., Мельниченко Г.А., Роживанов Р.В., Камалов А .А., Мкртумян А. М ., Халимов Ю.Ш., Ворохобина Н.В. Проект клинических рекомендаций «Синдром гипогонадизма у мужчин». Ожирение и метаболизм. 2021;18(4):496-507. https://doi.org/10.14341/omet12817
18. Bianchi VE. The Anti-Inflammatory Effects of Testosterone. J Endocr Soc. 2018;3(1):91-107. https://doi.org/10.1210/js.2018-00186
19. Inoue K, Horwich T, Bhatnagar R, Bhatt K, Goldwater D, Seeman T, Watson KE. Urinary Stress Hormones, Hypertension, and Cardiovascular Events: The Multi-Ethnic Study of Atherosclerosis. Hypertension. 2021;78(5):1640-1647. https://doi.org/10.1161/HYPERTENSIONAHA.121.17618
20. Белая Ж. Е., Малыгина А. А., Гребенникова Т. А., Ильин А. В., Рожинская Л. Я., Фадеев В. В., Мельниченко Г. А ., Дедов И . И . Диагностические возможности исследования кортизола слюны в ходе малой пробы с дексаметазоном. Ожирение и метаболизм. 2020;17(1):13-21. https://doi.org/10.14341/omet10117
21. Anderson AJ, Andrew R, Homer NZM, Hughes KA, Boyle LD, Nixon M, Karpe F, Stimson RH, Walker BR. Effects of Obesity and Insulin on Tissue-Specific Recycling Between Cortisol and Cortisone in Men. J Clin Endocrinol Metab. 2021;106(3):e1206-e1220. https://doi.org/10.1210/clinem/dgaa896
22. Кузнецова Е.А., Адамчик А.С., Гончаров Н.П., Кация Г.В. Диагностическое значение суточных колебаний свободных форм тестостерона и кортизола при ожирении и метаболическом синдроме у мужчин до 50 лет. Андрология и генитальная хирургия. 2016;17(1):28-33. https://doi.org/10.17650/2070-9781-2016-17-1-2833
23. Kalsbeek A, Su Y, Fliers E, Fleur S. The Hypothalamic-Pituitary-Adrenal Axis: Circadian Dysregulation and Obesity. In Russell J, Shipston M., editors. Neuroendocrinology of Stress. 2015;219-244. https://doi.org/10.1002/9781118921692.ch10
24. Гончаров П. П. Альдостерон и функция сердечно-сосудистой системы (к 50-летию открытия альдостерона). Проблемы Эндокринологии. 2004;50(6):29-32. https://doi.org/10.14341/probl11621
25. Jia G, Aroor AR, Sowers JR. The role of mineralocorticoid receptor signaling in the cross-talk between adipose tissue and the vascular wall. Cardiovasc Res. 2017;113(9):1055-1063. https://doi.org/10.1093/cvr/cvx097
26. Киреева В. В., Лепехова, С. А., Мансурова Л. Н., Дугарова С.Ч. Эпигенетические и молекулярно-генетические аспекты ожирения как фактор риска сердечно-сосудистых катастроф. Евразийский Союз Ученых. 2020;5(7(76)):39-44. https://doi.org/10.31618/esu.2413-9335.2020.5.76.926
27. Ding YN, Tang X, Chen HZ, Liu DP. Epigenetic Regulation of Vascular Aging and Age-Related Vascular Diseases. Adv Exp Med Biol. 2018;1086:55-75. https://doi.org/10.1007/978-981-13-1117-8_4
28. Min SH, Kim SH, Jeong IK, Cho HC, Jeong JO, Lee JH, Kang HJ, Kim HS, Park KS, Lim S. Independent Association of Serum Aldosterone Level with Metabolic Syndrome and Insulin Resistance in Korean Adults. Korean Circ J. 2018;48(3):198-208. http://dx.doi.org/10.4070/kcj.2017.0200
29. Keevil BG, Adaway J. Assessment of free testosterone concentration. J Steroid Biochem Mol Biol. 2019;190:207-211. http://dx.doi.org/10.1016/j.jsbmb.2019.04.008
Об авторах
А. Ю. ИоновРоссия
Ионов Алексей Юрьевич — кандидат медицинских наук, доцент, заведующий кафедрой пропедевтики внутренних болезней.
ул. им. Митрофана Седина, д. 4, Краснодар, 350055
Е. А. Кузнецова
Россия
Кузнецова Елена Анатольевна — кандидат медицинских наук, ассистент кафедры пропедевтики внутренних болезней.
ул. им. Митрофана Седина, д. 4, Краснодар, 350055
О. Г. Киндалёва
Россия
Киндалёва Ольга Генриковна — кандидат медицинских наук, ассистент кафедры пропедевтики внутренних болезней.
ул. им. Митрофана Седина, д. 4, Краснодар, 350055
И. В. Крючкова
Россия
Крючкова Ирина Валерьевна - кандидат медицинских наук, доцент кафедры пропедевтики внутренних болезней.
ул. им. Митрофана Седина, д. 4, Краснодар, 350055
Э. Э. Поплавская
Беларусь
Поплавская Эвелина Эдмундовна — кандидат медицинских наук, старший преподаватель первой кафедры внутренних болезней.
ул. Максима Горького, д. 80, Гродно, 230009
А. А. Авагимян
Армения
Авагимян Ашот Арманович — кандидат медицинских наук, ассистент кафедры патологической анатомии и клинической морфологии.
ул. Корюна, д. 2а, Ереван, 0025
Дополнительные файлы
Рецензия
Для цитирования:
Ионов А.Ю., Кузнецова Е.А., Киндалёва О.Г., Крючкова И.В., Поплавская Э.Э., Авагимян А.А. Клиническое значение эндокринных нарушений в развитии синдрома раннего сосудистого старения у мужчин с абдоминальным ожирением и сопутствующей артериальной гипертензией: обсервационное когортное исследование. Кубанский научный медицинский вестник. 2024;31(1):74-87. https://doi.org/10.25207/1608-6228-2024-31-1-74-87
For citation:
Ionov A.Yu., Kuznetsova E.A., Kindalyova O.G., Kryuchkova I.V., Poplavskaya E.E., Avagimyan A.A. Clinical significance of endocrine disorders in the development of early vascular aging in males with abdominal obesity and concomitant arterial hypertension: An observational cohort study. Kuban Scientific Medical Bulletin. 2024;31(1):74-87. (In Russ.) https://doi.org/10.25207/1608-6228-2024-31-1-74-87








































