Перейти к:
Инфантильная форма болезни Помпе с CRIM-отрицательным статусом, долгосрочное наблюдение за эффектом ферментозаместительной терапии: клинический случай
https://doi.org/10.25207/1608-6228-2024-31-2-107-117
Аннотация
Введение. Инфантильная форма болезни Помпе — прогрессирующее и фатальное заболевание при отсутствии патогенетического лечения. Ферментозаместительная терапия рекомбинантной человеческой кислой альфа-глюкозидазой является способом лечения, увеличивающим продолжительность жизни пациентов при ранней диагностике и своевременном старте терапии.
Описание клинического случая. Ребенок в возрасте 5 месяцев доставлен в кардиологическое отделение в государственное бюджетное учреждение здравоохранения «Детская республиканская клиническая больница» Министерства здравоохранения Республики Татарстан для обследования и уточнения диагноза. Родители пациентки жаловались на его одышку, малопродуктивный кашель, цианоз носогубного треугольника при беспокойстве, слабость, вялость при кормлении грудью, а также снижение аппетита вплоть до отказа от еды, постоянно увеличенный язык. При осмотре обнаружена макроглоссия и гиперсаливация, псевдогипертрофия икроножных мышц, одышка с участием вспомогательной мускулатуры, гепатомегалия, диффузная мышечная гипотония. Лабораторные исследования выявили у пациентки увеличение уровня аланинаминотрансферазы более четырех норм, аспартатаминотрансферазы более девяти норм, значимый подъем уровня креатинфосфокиназы и лактатдегидрогеназы, а также натрийуретического пептида. По данным эхокардиографии выявлена значительная гипертрофия миокарда как левого, так и правого желудочков. Принимая во внимание данные жалоб, анамнеза заболевания и клинического обследования, все вышеперечисленные изменения в лабораторных и инструментальных обследованиях, заподозрена группа наследственных болезней обмена (болезнь Помпе), что было подтверждено выраженным снижением активности фермента альфа-глюкозидазы до 0,12 мкмоль/л/ч в сухих пятнах крови с последующим проведением молекулярно-генетического исследования и выявлением компаунд-гетерозиготных мутаций в гене GAA. Было принято решение по жизненным показаниям начать специфическую ферментозаместительную терапию путем внутривенного введения рекомбинантной формы человеческой кислой альфа-глюкозидазы (алглюкозидазы альфа) в дозе 20 мг/кг/введение кратностью 1 раз в 2 недели. Кроме того, учитывая CRIM (cross-reactive immunological material)-отрицательный статус пациентки, для ответа на ферментозаместительную терапию проведена индукция иммунной толерантности, включающая в себя наиболее изученную комбинацию из трех препаратов: ритуксимаб, метотрексат и внутривенный иммуноглобулин. Результаты долгосрочного наблюдения за эффектом ферментозаместительной терапии дали положительный эффект в виде появления новых моторных навыков, снижения содержания внутриклеточных ферментов и натрийуретического пептида, уменьшения гипертрофии миокарда левого и правого желудочков. В дальнейшем ребенок нуждается в лечении пожизненно.
Заключение. Информированность врачей о болезни Помпе предупредит рост диагностических ошибок и запущенных случаев. При раннем подтверждении возрастает эффективность имеющейся на сегодняшний день ФЗТ: возможность приостановить прогрессирование болезни, получить обратное развитие ее отдельных клинических проявлений, улучшить качество жизни пациента.
Ключевые слова
Для цитирования:
Сабирова Д.Р., Садыкова Д.И., Кучерявая А.А., Кашина А.А., Сабирова Л.А. Инфантильная форма болезни Помпе с CRIM-отрицательным статусом, долгосрочное наблюдение за эффектом ферментозаместительной терапии: клинический случай. Кубанский научный медицинский вестник. 2024;31(2):107-117. https://doi.org/10.25207/1608-6228-2024-31-2-107-117
For citation:
Sabirova D.R., Sadykova D.I., Kucheryavaya A.A., Kashina A.A., Sabirova L.A. CRIM-negative infantile Pompe disease, long-term observation of the effect of enzyme replacement therapy: a clinical case. Kuban Scientific Medical Bulletin. 2024;31(2):107-117. (In Russ.) https://doi.org/10.25207/1608-6228-2024-31-2-107-117
ВВЕДЕНИЕ
Болезнь Помпе (БП), или гликогеноз II типа, — редкая аутосомно-рецессивная лизосомальная болезнь накопления с полисистемными проявлениями. БП вызывается мутациями в гене GAA, который кодирует синтез фермента кислой альфа-глюкозидазы (GAA). Распространенность заболевания составляет от 1:40 000 до 1:140 000 живорожденных в зависимости от формы заболевания, этнической принадлежности и региона. Например, зарегистрированные случаи в Австрии и на Тайване составили 1 на 8684 и 1 на 17 000 соответственно, что намного выше общемировой оценки [1][2].
Синтез фермента GAA начинается в эндоплазматическом ретикулуме, а сам процесс, при котором происходит распад гликогена до глюкозы, — в лизосомах. Мутация в гене GAA, расположенном на длинном плече 17-й хромосомы 17q25 и кодирующем синтез фермента, приводит к массивному накоплению гликогена в органах-мишенях, которыми являются скелетные мышцы, печень, сердечная мышца в результате отсутствия или дефицита кислой альфа-глюкозидазы [3]. На сегодняшний день ген GAA является единственным, связанным с болезнью Помпе.
Различают два фенотипа заболевания: с ранним (инфантильная форма БП) и поздним началом. БП с поздним началом подразделяют на детскую, ювенильную и взрослую. Инфантильная форма болезни Помпе отличается острым и быстро прогрессирующим течением заболевания в первые 6 месяцев жизни с развитием тяжелой кардио-респираторной недостаточности, что служит причиной летального исхода [1][4–6]. Стандартом диагностики инфантильной формы БП является определение уровня активности фермента GAA методом сухих пятен крови с последующим проведением молекулярно-генетического исследования детей с пониженной активностью фермента для выявления мутации в гене GAA [7][8].
Ферментозаместительная терапия (ФЗТ) алглюкозидазой альфа на сегодня является одним из доступных методов лечения инфантильной формы болезни. Опыт зарубежных коллег хорошо продемонстрировал эффект от ФЗТ: она улучшает выживаемость пациентов и улучшает качество их жизни. Рекомендуемая дозировка составляет 20 мг/кг 1 раз в две недели [2].
Всем пациентам при выявлении мутаций в гене GAA, характерных для БП, также необходимо оценивать CRIM-STATUS — Cross-reactive immunological material (статус перекрестно-реактивного иммунологического материала). Пациенты с остаточной активностью фермента GAA классифицируются как CRIM-положительные, пациенты с полным отсутствием фермента относятся к CRIM-отрицательным. CRIM-STATUS напрямую влияет на тактику дальнейшего ведения и прогноз жизни детей с инфантильной формой болезни Помпе, поскольку дети с CRIM-отрицательным статусом показывают слабый ответ на проводимую ФЗТ, т. к. их организм распознает рекомбинантную человеческую кислую альфа-глюкозидазу (алглюкозидазу альфа) как чужеродный иммуногенный материал и вырабатывает к ней высокий титр нейтрализующих антител [4–7]. Наиболее изучена сегодня комбинация из трех препаратов, включающая в себя ритуксимаб (RTX), метотрексат (MTX) и внутривенный иммуноглобулин (IVIG) [2].
«Золотым стандартом» определения CRIM-статуса является вестерн-блоттинг лизатов фибробластов кожи. На сегодняшний день это исследование в России не проводится. Однако с высокой точностью его также можно предсказать на основании выявленных мутаций гена GAA более чем у 90 % пациентов в соответствии с базой мутаций, созданных Центром Помпе в Роттердаме [6][7][9].
Актуальность информирования врачей о болезни Помпе обоснована необходимостью ее ранней диагностики и своевременном старте патогенетической ферментозаместительной терапии рекомбинантной человеческой кислой альфа-глюкозидазой.
КЛИНИЧЕСКИЙ ПРИМЕР
Информация о пациенте
Пациентка Ф., 5 мес., поступила в государственное бюджетное учреждение здравоохранения «Детская республиканская клиническая больница» Министерства здравоохранения Республики Татарстан (ГАУЗ «ДРКБ МЗ РТ») в порядке перевода из государственного автономного учреждения здравоохранения «Кукморская центральная районная больница» (Кукморская ЦРБ) с жалобами на одышку, малопродуктивный кашель, цианоз носогубного треугольника при беспокойстве, слабость, вялость при кормлении грудью, а также снижение аппетита вплоть до отказа от еды, повышенную потливость, увеличенный язык.
Анамнез жизни: ребенок рожден от 2-й беременности, от 2-х срочных родов на сроке 39 нед. Масса при рождении 3640 г, рост 50 см. Оценка по шкале Апгар 8/9 баллов. Пренатально при ультразвуковом исследовании плода патологии не выявлено. После рождения отмечалась вялость во время акта сосания, срыгивание, умеренная брадикардия, ввиду чего была переведена в отделение патологии новорожденных, где по данным лабораторно-инструментальных методов обследования были выявлены следующие изменения (референсные значения указаны в скобках): увеличение уровня аланинаминотрансферазы (АЛТ)/аспартатаминотрансферазы (АСТ) — 134,4/229,1 Ед/л (<56 Ед/л/<58 Ед/л), подъем креатинфосфокиназы (КФК) — 688 Ед/л (<652 Ед/л), лактатдегидрогеназы (ЛДГ) — 597 Ед/л (<451 Ед/л). При проведении эхокардиографии (ЭХО-КГ) — гипертрофия миокарда правого желудочка (ПЖ) и левого желудочка (ЛЖ). По стабилизации состояния была выписана на амбулаторный этап для дальнейшего наблюдения с рекомендациями контрольного обследования.
Анамнез заболевания: со слов мамы, у ребенка с рождения наблюдался пониженный аппетит, низкие прибавки в весе, полуоткрытый рот с увеличенным языком, отставание в моторном развитии. В возрасте 5 мес. ребенок заболел остро с появления влажного кашля, стонущего дыхания, вялости, цианоза носогубного треугольника. Госпитализирована в государственное автономное учреждение здравоохранения «Кукморская центральная районная больница» 31.08.2022 г. с диагнозом «Острый обструктивный бронхит. ДН II. Дефект межпредсердной перегородкии (далее ДМПП). Гипертрофия миокарда левого и правого желудочков». В связи с отсутствием эффекта от получаемой терапии (антибиотикотерапия, ингаляции) 2.09.2022 г. ребенок направлен в приемное отделение ГАУЗ «ДРКБ МЗ РТ». По тяжести состояния госпитализирована в отделение реанимации, после стабилизации состояния переведена в кардиологическое отделение 5.09.2022 г.
Аллергологический анамнез: не отягощен.
Наследственный анамнез: среди известных родственников проявления генетических заболеваний не отмечены.
Физикальная диагностика
Данные объективного осмотра: состояние тяжелое за счет признаков хронической сердечной недостаточности (ХСН), респираторного синдрома, белково-энергетической недостаточности умеренной степени (вес — 5300 г, вес к возрасту по z-score — 3.33). При осмотре беспокоится, голос тихий, плач непродолжительный, малоэмоциональный, обращает на себя внимание макроглоссия и гиперсаливация, псевдогипертрофия икроножных мышц. Выраженная диффузная мышечная гипотония, сухожильные рефлексы живые, D = S, реакция на болевые раздражители замедлена и снижена, не ест, отсутствует интерес к еде и к игрушкам. Подкожно-жировая клетчатка развита слабо. Периферических отеков нет. Тургор мягких тканей снижен. Кожные покровы бледно-серой окраски, цианоз носогубного треугольника при беспокойстве. В акте дыхания участвует вспомогательная мускулатура. Частота дыхательных движений (ЧДД) — 66 в минуту, насыщение кислородом (SpО2) — 88–94 %. Легкие — ясный легочный звук. Аускультативно — ослабление дыхания в верхних отделах спереди, единичные мелкопузырчатые хрипы в верхних отделах легких, больше справа. Тоны сердца — ясные, ритмичные, систолический шум средней интенсивности вдоль левого края грудины, умеренная тахикардия, частота сердечных сокращений (ЧСС) — 154–178 уд/мин. Живот мягкий, безболезненный. Печень пальпируется на 2 см из-под края реберной дуги. Селезенка не пальпируется. Мочеиспускание не нарушено, стул регулярный.
Предварительный диагноз
Предварительный диагноз: гипертрофическая кардиомиопатия. недостаточность кровообращения (НК) 2 Б, III функциональный класс (ФК) по Ross. болезнь Помпе (?).
Временная шкала
Хронология развития болезни и прогноз пациентки Ф. представлены на рисунке 1.
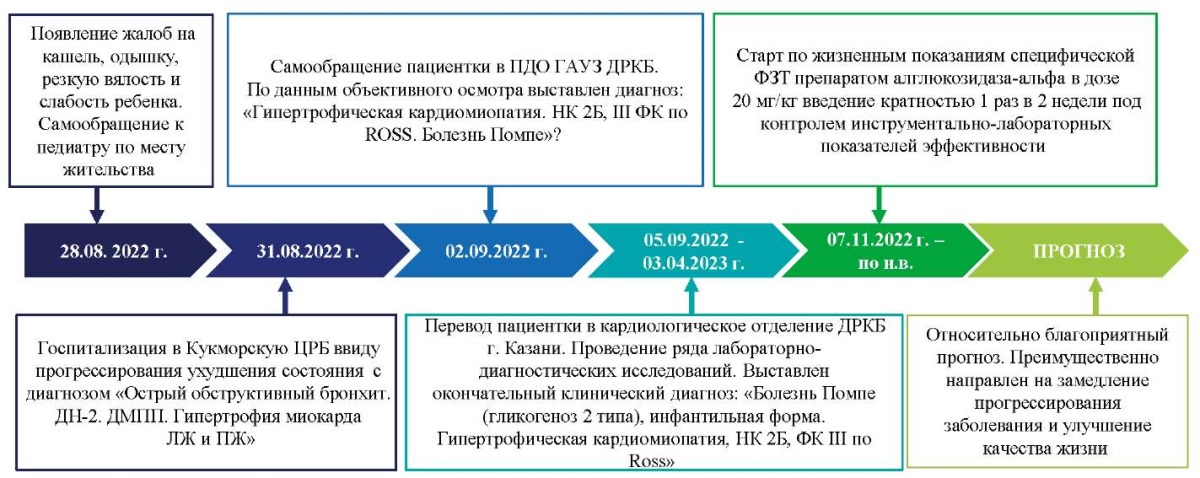
Рис. 1. Хронология развития болезни у пациентки Ф.: ключевые события и прогноз
Примечание: блок-схема временной шкалы выполнена авторами (согласно рекомендациям CARE).
Сокращения: Кукморская ЦРБ — государственное автономное учреждение здравоохранения
«Кукморская центральная районная больница»;
БОС — бронхообструктивный синдром; ДН — дыхательная недостаточность;
ДМПП — дефект межпредсердной перегородки;
ЛЖ — левый желудочек; ПЖ — правый желудочек;
ГАУЗ «ДРКБ МЗ РТ» — приемно-диагностическое отделение
государственного автономного учреждения здравоохранения
«Детская республиканская клиническая больница»
Министерства здравоохранения Республики Татарстан;
НК — нарушение кровообращения; ФЗТ — ферментозаместительная терапия.
Fig. 1. Patient F: course of disease, key events and prognosis
Note: the schematic diagram was performed by the authors (according to SCARE recommendations).
Abbreviations: Кукморская ЦРБ — Kukmorskaya Central District Hospital;
БОС — broncho-obstructive syndrome; ДН — respiratory failure; ДМПП — atrial septal defect;
ЛЖ — left ventricle; РЖ — right ventricle;
ГАУЗ «ДРКБ МЗ РТ» — Reception and Diagnostic Department
of Children’s Republican Clinical Hospital (Tatarstan, Russia);
НК — impaired circulation; ФЗТ — enzyme replacement therapy.
Диагностические процедуры
Лабораторные исследования (выполнены по прибытии пациентки в ГАУЗ «ДРКБ МЗ РТ», референсные значения указаны в скобках).
Клинический анализ крови, клинический анализ мочи (проведены в приемном покое) — без патологии.
Биохимический анализ крови (проведен в приемном покое): зарегистрировано значимое увеличение уровня КФК — 995 Ед/л (38–174 Ед/л), АЛТ — 187,9 Ед/л (0–41 Ед/л), АСТ — 384,5 Ед/л (0–40 Ед/л), натрийуретического пептида (NT-proBNP) (от 05.09.2022 г.) — 15000 пг/мл (<200 пг/мл).
Инструментальные исследования (выполнены в ГАУЗ «ДРКБ МЗ РТ»).
Электрокардиограмм (ЭКГ) (от 02.09.2022 г.): ЧСС 108–120 уд/мин. Нормальное положение электрической оси сердца (НПЭОС). Нарушение проведения по правой ножке пучка Гисса (ПНПГ). Признаки увеличения желудочков сердца и правого предсердия. Нарушение процессов реполяризации подъем сегмента ST в AVR — 2 mm, V1–V2–1,5–2 mm. Депрессия сегмента ST в большинстве отведений до 2,0 мм (рис. 2).
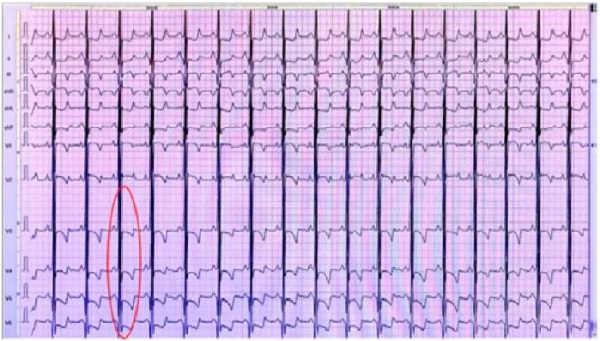
Рис. 2. Нарушение проведения по правой ножке пучка Гиса.
Признаки увеличения желудочков сердца и правого предсердия.
Нарушение процессов реполяризации подъем сегмента ST в AVR — 2 mm, V1–V2–1,5–2 mm.
Депрессия сегмента ST в большинстве отведений до 2,0 мм (выделено фигурой)
Примечание: фотография выполнена авторами.
Fig. 2. Conduction disturbance along the right bundle branch.
Signs of enlarged ventricles of the heart and right atrium.
Repolarization disorder: ST segment elevation in AVR — 2 mm, V1–V2–1.5–2 mm.
ST segment depression in most leads up to 2.0 mm (highlighted)
Note: photo taken by the authors
Трансторакальная эхокардиография (ЭхоКГ) (от 02.09.2022 г.): при проведении трансторакальной ЭхоКГ выявлена выраженная гипертрофия стенок ЛЖ и ПЖ с уменьшением объема полостей желудочков (рис. 3).
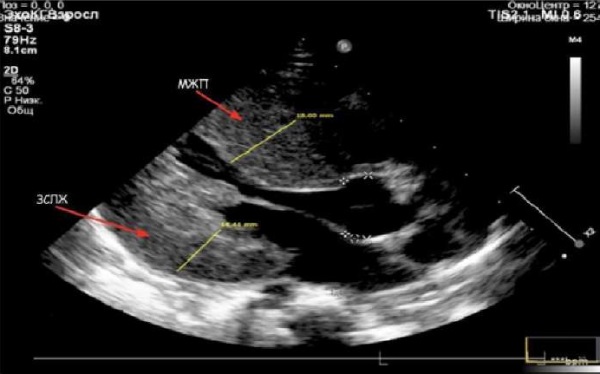
Рис. 3. Трансторакальная эхокардиография.
Выраженная гипертрофия миокарда межжелудочковой перегородки (МЖП)
и задней стенки левого желудочка (ЗСЛЖ)
Примечание: фотография выполнена авторами.
Fig. 3. Transthoracic echocardiography.
Severe myocardial hypertrophy of interventricular septum (МЖП)
and the posterior wall of the left ventricle (ЗСЛЖ)
Note: photo taken by the authors
Магнитно-резонансная томография (МРТ) сердца (05.09.2022 г.): при проведении МРТ сердца выявлена диффузная гипертрофия миокарда левого желудочка (ЛЖ), межжелудочковая перегородка (МЖП) 9,5–10 мм, задняя стенка левого желудочка (ЗСЛЖ) 8–8,5 мм (рис. 4).
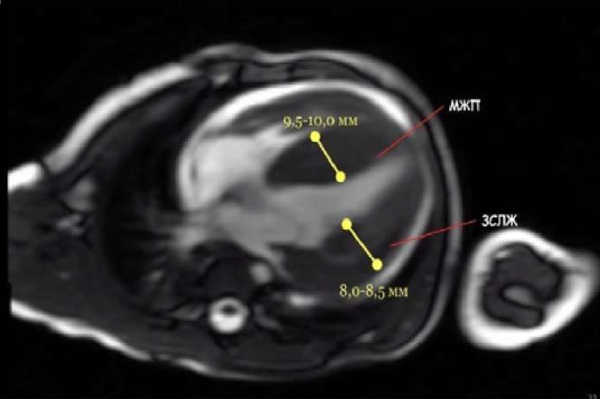
Рис. 4. Магнитно-резонансная томография сердца.
Диффузная гипертрофия миокарда левого желудочка,
умеренная гипертрофия стенки правого желудочка
(9,5–10,0 мм; 8,0–8,5 мм соответственно)
Примечание: фотография выполнена авторами.
Сокращение: МЖП — миокард межжелудочковой перегородки;
ЗСЛЖ — задняя стенка левого желудочка.
Fig. 4. Magnetic resonance imaging of the heart.
Diffuse left ventricular myocardial hypertrophy,
moderate right ventricular wall hypertrophy
(9.5–10.0 mm; 8.0–8.5 mm, respectively)
Note: photo taken by the authors
Abbreviations: МЖП — interventricular septal myocardium;
ЗСЛЖ — posterior wall of the left ventricle
Рентгеновский снимок органов грудной клетки (02.09.2022 г.): снимок выполнен в прямой проекции, обращает на себя внимание выраженная кардиомегалия. Увеличение КТИ до 65 % (рис. 5).
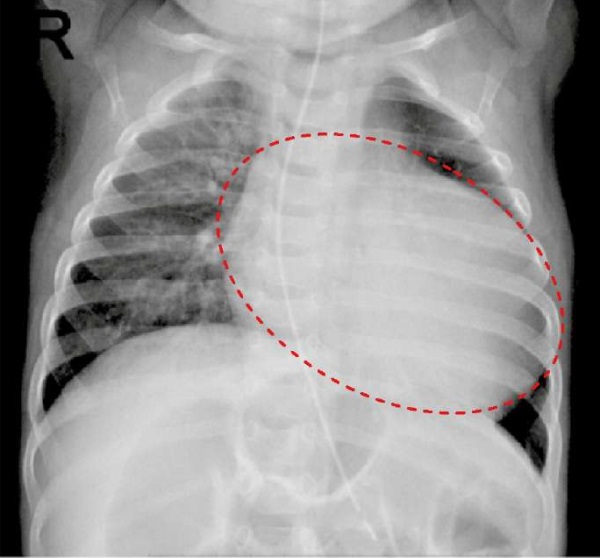
Рис. 5. Кардиомегалия (выделено фигурой)
Примечание: фотография выполнена авторами.
Fig. 5. Cardiomegaly (highlighted)
Note: photo taken by the authors
Принимая во внимание данные анамнеза заболевания и клинического обследования, все вышеперечисленные изменения в лабораторных и инструментальных обследованиях, заподозрена болезнь Помпе из группы наследственных болезней обмена. Было проведено молекулярно-генетическое обследование.
Генетический скрининг и определение активности фермента
19.09.2023 г. проведена тандемная масс-спектрометрия (ТМС) (федеральное государственное бюджетное научное учреждение «Медико-генетический научный центр», Лаборатория наследственных болезней обмена веществ). Выявлено снижение активности фермента альфа-глюкозидазы до 0,12 мкмоль/л/ч (норма 1–25 мкмоль/л/ч). 3.10.2023 молекулярно-генетическим исследованием (Федеральное государственное бюджетное научное учреждение «Медико-генетический научный центр», Лаборатория селективного скрининга) методом прямого автоматического секвенирования проведен полный анализ гена GAA — в экзоне 16 выявлен вариант c.2269C > T (p.Gln757Ter), описанный в базе данных о мутациях генов человека (HGMD) как патогенный (CM074877); в экзоне 19 выявлен вариант с. 2662G > T (p.Glu888Ter), описанный в HGMD как патогенный (CM074881). Ребенок унаследовал компаунд гетерозиготную мутацию (две разные мутации в одном гене). В анализе выявленных мутаций в соответствии с базой данных мутаций, созданных Центром Помпе в Роттердаме, отмечена ассоциация с потенциально очень тяжелым течением заболевания, оба нуклеотидных варианта имеют CRIM-отрицательный статус [9].
Клинический диагноз
На основании полученных результатов обследования диагноз был верифицирован: Инфантильная форма болезни Помпе с CRIM-отрицательным статусом. Гипертрофическая кардиомиопатия, НК 2 Б, ФК III по Ross. Белково-энергетическая недостаточность умеренной степени, смешанной этиологии.
Дифференциальная диагностика
Дифференциальная диагностика младенческой формы болезни Помпе проводится со всеми заболеваниями, основным клиническим проявлением которых является синдром вялого ребенка: 1) дефицит мембранного белка 2, связанный с лизосомами, который проявляется гипертрофической кардиомиопатией, мышечной слабостью и гипотонией (гликогеноз IIb, Данона); 2) нарушения митохондриальной и дыхательной цепей, которые могут проявляться гипотонией, кардиомиопатией, гепатомегалией и судорогами; 3) нарушения окисления жирных кислот, включая дефицит ацил-КоА-дегидрогеназы с очень длинной цепью, дефицит длинноцепочечной 3-гидрокси-ацил-КоА-дегидрогеназы, дефицит переносчика карнитина, дефицит карнитин-ацилкарнитинтранслоказы и дефицит карнитинпальмитоилтрансферазы типа 2, которые могут проявляться в младенчестве с гипертрофической кардиомиопатией с некетотической гипогликемией; 4) другая детская гипотония без кардиомиопатии, включая спинальную мышечную атрофию 1 типа и гликогеноз типа IIIa.
При других врожденных миопатиях может отсутствовать поражение сердца, и поэтому они не так часто учитываются при дифференциальной диагностике классического инфантильного дефицита GAA [3].
Медицинские вмешательства
При поступлении в ГАУЗ «ДРКБ МЗ РТ» пациентке назначена терапия хронической сердечной недостаточности согласно Федеральным клиническим рекомендациям «Хроническая сердечная недостаточность у детей» от 2016 г.: каптоприл (из расчета 0,8 мг/кг/сут) в дозе 2,5 мг 2 раза/день; спиронолактон (из расчета 2 мг/кг/сут) дважды в день: в 16:00 — в дозе 6,25 мг (¼ табл.), в 20:00 — в дозе 6,25 мг (¼ табл.); анаприлин (1,25 мг/кг/сут) в дозе 2,5 мг 3 раза/день в 6:00–14:00–22:00; фуросемид (из расчета 2,5 мг/кг/сут) в дозе 5 мг 3 раза/день. После молекулярно-генетического подтверждения диагноза «Болезнь Помпе» решено назначить по жизненным показаниям специфическую ферментозаместительную терапию (ФЗТ) путем внутривенного введения рекомбинантной формы человеческой кислой альфа-глюкозидазы (алглюкозидазы альфа) в дозе 20 мг/кг/введение кратностью 1 раз в 2 недели (10.11.2022 г.). Кроме того, учитывая CRIM-отрицательный статус пациентки, для ответа на ФЗТ проведена индукция иммунной толерантности, включающая в себя наиболее изученную комбинацию из трех препаратов: ритуксимаб (с целью селективного ингибирования В-лимфоцитов) в дозе 12,5 мг/кг внутривенно за 2 дня до первого введения алглюкозидазы альфа (08.11.2022 г.), затем курсом на 6–13–20 день; метотрексат (для устранения делящихся лимфоцитов, теоретически устраняя rhGAA-специфические Т-клетки и остаточные В-клетки) в дозе 0,4 мг/кг подкожно схематично в 1–2–3-й день от старта ФЗТ, затем на 14–15–16 и 28–29–30-й день; внутривенный иммуноглобулин (с целью иммунной модуляции и защиты от инфекционных агентов) в дозе 0,5 г/кг внутривенно в 1-й день старта ФЗТ, затем курсом на 28–56–84-й день, В комплексе с основным лечением ребенок получал реабилитационные мероприятия: постуральный контроль, включащий в себя поддержание определеннного постурального положения, облегчение произовльных движений, возвращение равновения в ответ на внешние воздействия, общеукрепляющий массаж, биоптрон «зеленым цветом» на область ладоней, стоп, глазниц, шейного отдела позвоночника. После стабилизации состояния пациентка была выписана домой с рекомендациями продолжения терапии ХСН и госпитализацией в ГАУЗ «ДРКБ МЗ РТ» каждые 2 недели для продолжения ФЗТ алглюкозидазой альфа.
Динамика и исходы
На фоне проводимой ФЗТ и симптоматической терапии отмечается клиническое улучшение: уменьшение выраженности макроглоссии, гипертрофии икроножных мышц, уменьшение выраженности симптомов дыхательной недостаточности, снижение активности ферментов в лабораторных анализах (рис. 6, 7).
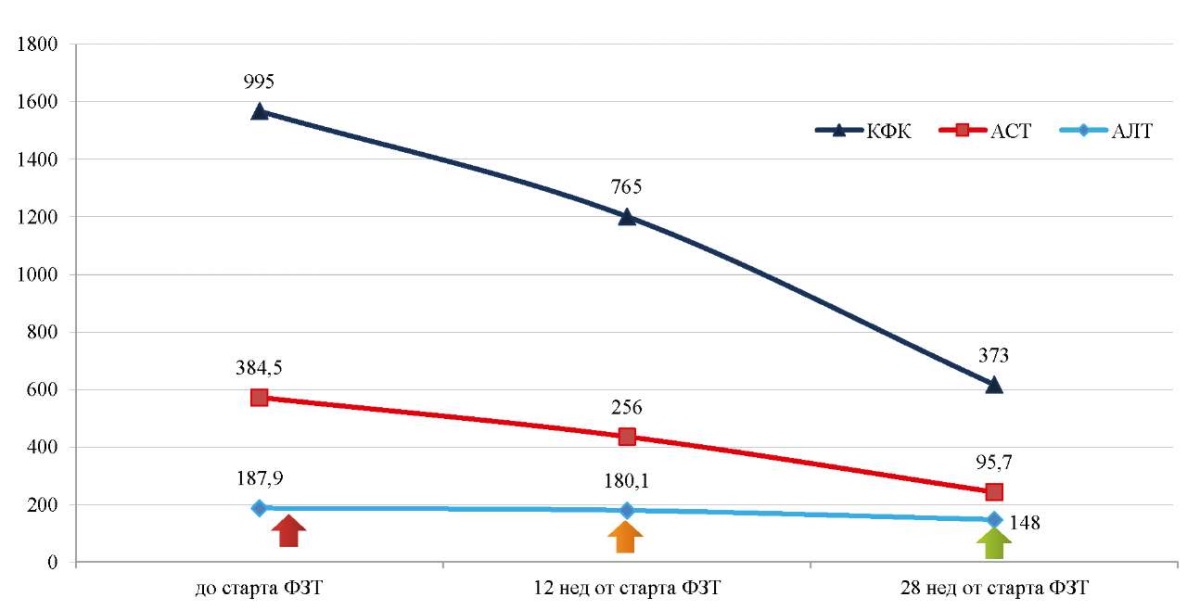
Рис. 6. Динамика биохимических (аланинаминотрансферазы, аспартатаминотрансферазы,
креатинфосфокиназы) показателей крови (Ед/л) пациентки Ф.
на фоне проведения ферментозаместительной терапии
Примечание: рисунок выполнен авторами.
Сокращения: АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза;
КФК — креатинфосфокиназа.
Fig. 6. Dynamics of biochemical (alanine aminotransferase, aspartate aminotransferase,
creatine phosphokinase) blood parameters (U/L) of patient F.
against the background of enzyme replacement therapy
Note: performed by the authors.
Abbreviations: АЛТ — alanine aminotransferase; АСТ — aspartate aminotransferase;
КФК — creatine phosphokinase
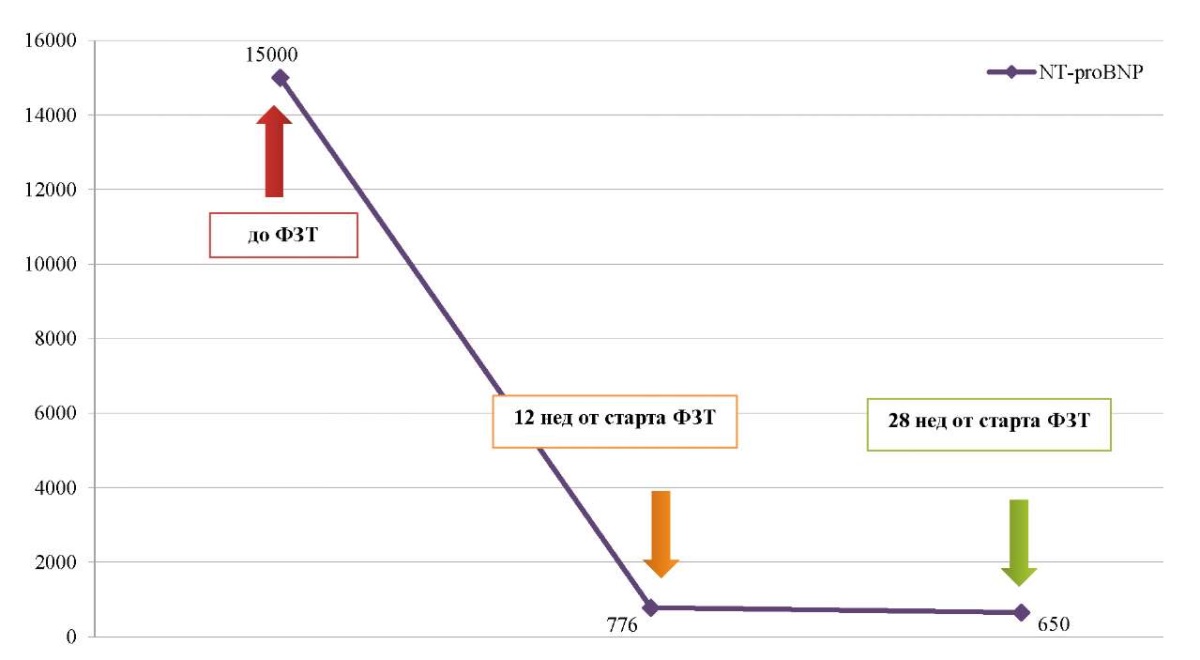
Рис. 7. Динамика содержания натрийуретического пептида (пг/мл) в крови пациентки Ф.
на фоне проведения ферментозаместительной терапии
Примечание: рисунок выполнен авторами.
Сокращения: NT-proBNP — натрий уретический пептид.
Fig. 7. Dynamics of natriuretic peptide content (pg/mL) in the blood of patient F.
against the background of enzyme replacement therapy
Note: performed by the authors. A
bbreviations: NT-proBNP — natriuretic peptide
Ребенок стал самостоятельно сидеть, появились игровые навыки, заинтересованность, стала понимать обращенную к ней речь, улучшился эмоциональный статус, появились новые моторные навыки. Мышечный тонус диффузно снижен. Сухожильные рефлексы снижены, больше с ног, S = D. Чувствительность сохранена. По ЭхоКГ — значимое уменьшение выраженности гипертрофии миокарда и снижении массы миокарда (рис. 8, табл.). В настоящее время толщина межжелудочковой перегородки 11 мм, которая остается стабильной в течение последних 5 месяцев и значительно уменьшилась по сравнению с самым высоким значением (19 мм) непосредственно перед началом ФЗТ. Учитывая вышеперечисленные данные, отмечается положительная динамика на фоне проведения ФЗТ.
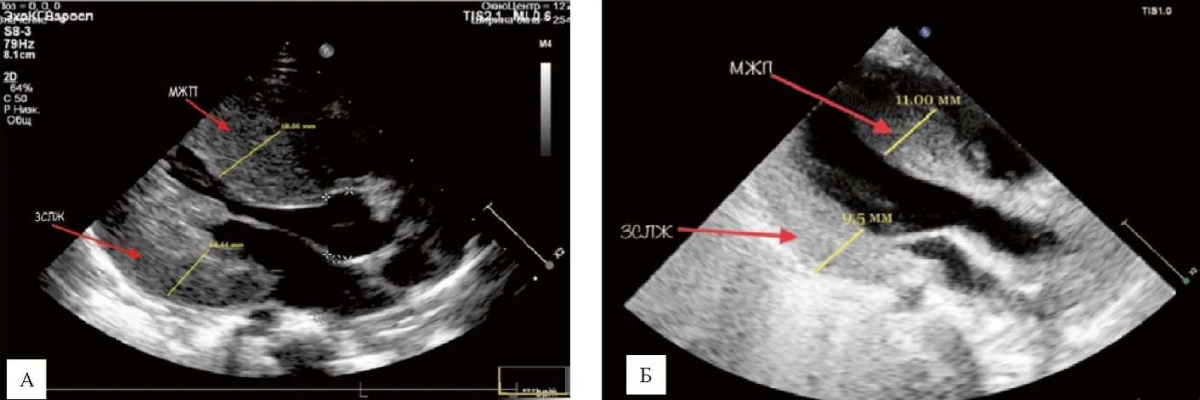
Рис. 8. Динамика трансторакальной эхокардиографии
на фоне проводимой ферементозаместительной терапии:
А — до ферментозаместительной терапии;
Б — на фоне проводимой ферментозаместительной терапии,
отмечается уменьшение выраженности гипертрофии миокарда —
МЖП (11 мм) и ЗСЛЖ (9,5 мм)
Примечание: фотографии выполнены авторами.
Сокращение: МЖП — миокард межжелудочковой перегородки;
ЗСЛЖ — задняя стенка левого желудочка.
Fig. 8. Dynamics of transthoracic echocardiography
against the background of ferment replacement therapy:
A — before enzyme replacement therapy;
B — against the background of enzyme replacement therapy,
a decrease in the severity of myocardial hypertrophy —
МЖП (11 mm) and ЗСЛЖ (9.5 mm)
Note: photos taken by the authors.
Abbreviations: МЖП — interventricular septal myocardium;
ЗСЛЖ — posterior wall of the left ventricle
Таблица. Динамика показателей трансторакальной эхокардиографии
на фоне проводимой ферементозаместительной терапии
Table. Dynamics of transthoracic echocardiography
against the background of ferment replacement therapy
|
Показатели |
ЕД изм. |
02.09.2022 |
21.10.2022 |
18.04.2023 |
01.09.2023 |
|
Толщина ММЖП |
мм |
18,0 |
19,0 |
15,9 |
11,0 |
|
Толщина ЗСЛЖ |
мм |
14,4 |
13,6 |
10,0 |
9,5 |
|
Толщина передней стенки ПЖ |
мм |
7,7 |
7,5 |
6,3 |
5,5 |
|
Масса миокарда ЛЖ |
гр |
92,0 |
91,0 |
75,4 |
53,6 |
Примечание: ММЖП — миокард межжелудочковой перегородки;
ЗСЛЖ — задняя стенка левого желудочка;
ПЖ — правый желудочек; ЛЖ — левый желудочек.
Note: ММЖП — interventricular septal myocardium;
ЗСЛЖ — posterior wall of the left ventricle;
ПЖ — right ventricle; ЛЖ — left ventricle
На момент написания статьи пациентке 1 год 6 мес., она получила уже 21 инфузию ФЗТ препаратом алглюкозидаза альфа в дозе 20 мг/кг/введение кратностью 1 раз в 2 недели (в условиях ГАУЗ «ДРКБ МЗ РТ») в/в капельно медленно. Инфузии переносит удовлетворительно. Кроме того, ежедневно получает терапию хронической сердечной недостаточности: бисопролол в дозе 0,9 мг однократно утром; спиронолактон дважды в день в дозе 6,25 мг (в 16:00, 20:00); каптоприл в дозе 2,5 мг 3 р/день (7:00–15:00–23:00), гидрохлортиазид в дозе 6,25 мг однократно днем. В комплексе с основным лечением получает общеукрепляющий массаж в домашних условиях. В дальнейшем лечение необходимо продолжить пожизненно.
Прогноз
Прогноз относительно благоприятный. При ранней диагностике возрастает эффективность имеющейся на сегодняшний день ферментозаместительной терапии: возможность приостановить прогрессирование болезни, получить обратное развитие ее отдельных клинических проявлений, улучшить качество жизни пациентки.
ОБСУЖДЕНИЕ
Описанный клинический случай демонстрирует первый опыт ведения и лечения пациентки с инфантильной формой болезни Помпе с CRIM-отрицательным статусом в Республике Татарстан. Симптомы заболевания обычно развиваются в течение первых нескольких месяцев жизни, средний возраст составляет 2 месяца, а диагноз ставится в 4,7 месяца. Было продемонстрировано, что раннее появление симптомов увеличивает риск ранней смерти на 1-м году жизни, в основном из-за кардиореспираторной недостаточности [1]. Клиническое течение в значительной степени зависит от конкретной мутации и уровня остаточной активности фермента GAA.
Инфантильная форма болезни Помпе является наиболее тяжелой, характеризуется быстро прогрессирующей гипертрофической кардиомиопатией, сопровождается обструкцией оттока из левого желудочка, мышечной гипотонией и выраженной слабостью, дыхательной недостаточностью и прогрессирующей потерей самостоятельного дыхания. Частыми проявлениями являются одышка, проблемы с кормлением и макроглоссия. Моторное развитие значительно задерживается, а такие навыки, как переворачиваться, самостоятельно сидеть или стоять, часто не достигаются. Лишь небольшой процент пациентов, не получающих лечения, доживает до 1 года. Основной причиной смерти является сердечная и дыхательная недостаточность.
Доступная на сегодняшний день ферментозаместительная терапия существенно изменила течение БП, значительно увеличив выживаемость и улучшив качество жизни пациентов, долгосрочные клинические результаты: отмечено стойкое улучшение сердечных показателей с выраженным снижением индекса массы левого желудочка и толщины стенки левого желудочка, коррекция аномальных параметров ЭКГ, улучшение сердечной функции. К сожалению, ответ на ФЗТ неоднороден и зависит от множества факторов: возраст пациента на момент старта ФЗТ, степень выраженности ХСН, CRIM-статус, вид мутации гена в соответствии с базой данных мутаций, созданных Центром Помпе в Роттердаме, дозы ФЗТ и выработки нейтрализующих антител в ответ на введение рекомбинантной человеческой алглюкозидазы-альфа [10–13].
На основе литературных данных зарубежных коллег и опыта федеральных центров Российской Федерации, перед стартом ФЗТ однозначно необходимо проведение индукции иммунной толерантности для уменьшения выработки к рекомбинантной форме человеческой кислой альфа-глюкозидазе (алглюкозидазе альфа) титра нейтрализующих антител. Разработаны различные схемы лечения у пациентов с инфантильной формой БП с CRIM-отрицательным статусом [11]. Например, описана схема: ритуксимаб, микофенолат, внутривенный иммуноглобулин. Одним из ограничений протокола является задержка начала ФЗТ на 3 недели, что может привести к необратимому повреждению мышц. Быстрое определение CRIM-статуса важно и должно быть проведено до инициации ФЗТ, но не должно задерживать начало ФЗТ.
Консилиумом было принято решение использовать схему из трех препаратов, включающую ритуксимаб, метотрексат, внутривенный иммуноглобулин, коротким курсом в течение 5 недель. Данная комбинированная терапия направлена на различные клетки иммунной системы (В- и Т-клетки).
Впервые сообщили об этом протоколе итальянские коллеги (Banugaria et al., 2013) на примере личного клинического опыта. Комбинация из данных трех препаратов значительно предотвращала образование антител и улучшила исходы заболевания, минимизировала нежелательные реакции, снижала потребность в искусственной вентиляции легких, улучшала двигательные способности и увеличивала общую выживаемость пациентов. Данная комбинация доказала свою безопасность и эффективность для достижения долгосрочной иммунной толерантности к ФЗТ. Конечно, перед выбором данного протокола необходимо оценивать клиническое состояние пациента, наличие факторов риска и соотношение риска и пользы для конкретного случая [11].
Алглюкозидаза альфа — это жизненно важный препарат, который продлевает выживаемость и замедляет прогрессирование заболевания, но не является оптимально эффективным для лечения болезни Помпе. Поэтому в будущем существует необходимость в разработке препаратов следующего поколения, которые преодолевают вышеупомянутые препятствия для повышения клинической эффективности [14][15].
ЗАКЛЮЧЕНИЕ
Инфантильная форма болезни Помпе, несомненно, требует обширного дифференциально-диагностического поиска. Опыт применения алглюкозидазы альфа привел к лучшему пониманию болезни Помпе и проблем, которые необходимо преодолеть для разработки более совершенных методов лечения, таких как ФЗТ нового поколения. Благодаря широкому внедрению в медицинскую практику генетических методов исследования и имеющейся на сегодняшний день ФЗТ возможна ранняя диагностика
и своевременный старт лечения данного заболевания, а индукция иммунной толерантности у CRIM-негативных пациентов может уменьшить образование нейтрализующих антител к алглюкозидазе-альфа, усилив эффективность терапии. Это приведет к улучшению качества жизни пациентов и замедлению прогрессирования заболевания, что мы наглядно продемонстрировали на примере нашего клинического случая.
Список литературы
1. Marques JS. The Clinical Management of Pompe Disease: A Pediatric Perspective. Children (Basel). 2022;9(9):1404. https://doi.org/10.3390/children9091404
2. Gragnaniello V, Deodato F, Gasperini S, Donati MA, Canessa C, Fecarotta S, Pascarella A, Spadaro G, Concolino D, Burlina A, Parenti G, Strisciuglio P, Fiumara A, Casa RD. Immune responses to alglucosidase in infantile Pompe disease: recommendations from an Italian pediatric expert panel. Ital J Pediatr. 2022;48(1):41. https://doi.org/10.1186/s13052-022-01219-4
3. Kohler L, Puertollano R, Raben N. Pompe Disease: From Basic Science to Therapy. Neurotherapeutics. 2018;15(4):928–942. https://doi.org/10.1007/s13311-018-0655-y
4. Poelman E, Hoogeveen-Westerveld M, Kroos-de Haan MA, van den Hout JMP, Bronsema KJ, van de Merbel NC, van der Ploeg AT, Pijnappel WWMP. High Sustained Antibody Titers in Patients with Classic Infantile Pompe Disease Following Immunomodulation at Start of Enzyme Replacement Therapy. J Pediatr. 2018;195:236–243.e3. https://doi.org/10.1016/j.jpeds.2017.11.046
5. Kazi ZB, Desai AK, Troxler RB, Kronn D, Packman S, Sabbadini M, Rizzo WB, Scherer K, Abdul-Rahman O, Tanpaiboon P, Nampoothiri S, Gupta N, Feigenbaum A, Niyazov DM, Sherry L, Segel R, McVie-Wylie A, Sung C, Joseph AM, Richards S, Kishnani PS. An immune tolerance approach using transient low-dose methotrexate in the ERTnaïve setting of patients treated with a therapeutic protein: experience in infantile-onset Pompe disease. Genet Med. 2019;21(4):887–895. https://doi.org/10.1038/s41436-018-0270-7
6. Li C, Desai AK, Gupta P, Dempsey K, Bhambhani V, Hopkin RJ, Ficicioglu C, Tanpaiboon P, Craigen WJ, Rosenberg AS, Kishnani PS. Transforming the clinical outcome in CRIM-negative infantile Pompe disease identified via newborn screening: the benefits of early treatment with enzyme replacement therapy and immune tolerance induction. Genet Med. 2021;23(5):845–855. https://doi.org/10.1038/s41436-020-01080-y
7. Савостьянов К.В., Никитин С.С., Карпачёва К.Е. Лабораторные исследования и болезнь Помпе: от подозрения до мониторинга терапии. Журнал нервно-мышечные болезни. 2019;9(4):26–33. https://doi.org/10.17650/2222-8721-2016-6-1-54-62
8. Meena NK, Raben N. Pompe Disease: New Developments in an Old Lysosomal Storage Disorder. Biomolecules. 2020;10(9):1339. https://doi.org/10.3390/biom10091339
9. Савостьянов К.В., Пушков А.А., Басаргина Е.Н., Кузенкова Л.М., Мазанова Н.Н., Гандаева Л.А., Жарова О.П., Рябова Е.Е., Жанин И.С., Фисенко А.П. Селективный скрининг и молекулярная характеристика российских пациентов с болезнью Помпе. Неврологический журнал имени Л.О. Бадаляна. 2021;2(4):203–215. https://doi.org/10.46563/2686-8997-2021-2-4-203-215
10. Desai AK, Baloh CH, Sleasman JW, Rosenberg AS, Kishnani PS. Benefits of Prophylactic Short-Course Immune Tolerance Induction in Patients With Infantile Pompe Disease: Demonstration of Long-Term Safety and Efficacy in an Expanded Cohort. Front Immunol. 2020;11:1727. https://doi.org/10.3389/fimmu.2020.01727
11. Poelman E, Hoogeveen-Westerveld M, van den Hout JMP, Bredius RGM, Lankester AC, Driessen GJA, Kamphuis SSM, Pijnappel WWM, van der Ploeg AT. Effects of immunomodulation in classic infantile Pompe patients with high antibody titers. Orphanet J Rare Dis. 2019;14(1):71. https://doi.org/10.1186/s13023-019-1039-z
12. Park KS. Carrier frequency and predicted genetic prevalence of Pompe disease based on a general population database. Mol Genet Metab Rep. 2021;27:100734. https://doi.org/10.1016/j.ymgmr.2021.100734
13. Darwish RK, Rabie WA, El Abd DM, Selim LA, Seliem ZS, Lotfy SA, Mehaney DA. Genetic variants of Pompe disease among a sample of Egyptian pediatric patients. Gene Reports. 2022 Jun;27:101631. Available from: http://dx.doi.org/10.1016/j.genrep.2022.101631
14. Do HV, Khanna R, Gotschall R. Challenges in treating Pompe disease: an industry perspective. Ann Transl Med. 2019;7(13):291. https://doi.org/10.21037/atm.2019.04.15
15. Tiraboschi G, Marchionni D, Tuffal G, Fabre D, Martinez JM, Haack KA, Miossec P, Kittner B, Daba N, Hurbin F. Population pharmacokinetic modeling and dosing simulation of avalglucosidase alfa for selecting alternative dosing regimen in pediatric patients with late-onset pompe disease. J Pharmacokinet Pharmacodyn. 2023;50(6):461–474. https://doi.org/10.1007/s10928-023-09874-8
Об авторах
Д. Р. СабироваРоссия
Сабирова Дина Рашидовна - кандидат медицинских наук, доцент кафедры госпитальной педиатрии; врач - детский кардиолог
ул. Бутлерова, д. 49, г. Казань, 420012
Оренбургский тракт, д. 140, г. Казань, 420138
Д. И. Садыкова
Россия
Садыкова Динара Ильгизаровна - доктор медицинских наук, профессор, главный внештатный детский специалист-кардиолог ПФО, заведующий кафедрой госпитальной педиатрии
ул. Бутлерова, д. 49, г. Казань, 420012
Оренбургский тракт, д. 140, г. Казань, 420138
А. А. Кучерявая
Россия
Кучерявая Анна Александровна - врач-педиатр
Оренбургский тракт, д. 140, г. Казань, 420138
А. А. Кашина
Россия
Кашина Анжела Александровна - ординатор второго года обучения кафедры госпитальной педиатрии
ул. Бутлерова, д. 49, г. Казань, 420012
Л. А. Сабирова
Россия
Сабирова Ляйсан Анваровна - врач-педиатр
Оренбургский тракт, д. 140, г. Казань, 420138
Рецензия
Для цитирования:
Сабирова Д.Р., Садыкова Д.И., Кучерявая А.А., Кашина А.А., Сабирова Л.А. Инфантильная форма болезни Помпе с CRIM-отрицательным статусом, долгосрочное наблюдение за эффектом ферментозаместительной терапии: клинический случай. Кубанский научный медицинский вестник. 2024;31(2):107-117. https://doi.org/10.25207/1608-6228-2024-31-2-107-117
For citation:
Sabirova D.R., Sadykova D.I., Kucheryavaya A.A., Kashina A.A., Sabirova L.A. CRIM-negative infantile Pompe disease, long-term observation of the effect of enzyme replacement therapy: a clinical case. Kuban Scientific Medical Bulletin. 2024;31(2):107-117. (In Russ.) https://doi.org/10.25207/1608-6228-2024-31-2-107-117
JATS XML








































