Перейти к:
Микробиологический пейзаж пародонтальных карманов на фоне локальной антибактериальной терапии хронического генерализованного пародонтита: многоцентровое клиническое исследование
https://doi.org/10.25207/1608-6228-2024-31-2-55-68
Аннотация
Введение. Микробная природа пародонтита требует точной оценки патогенного потенциала микрофлоры пародонтального кармана для диагностики и подбора наиболее эффективного фармакологического препарата для лечения хронического пародонтита. Известно, что в борьбе с анаэробными микроорганизмами в пародонтальном кармане отличные результаты показывает метронидазол, а с аэробными — миноциклина гидрохлорид, моксифлоксацин и амоксициллин/клавуланат. Однако существенный интерес представляет анализ взаимоотношения между отдельными ассоциациями микроорганизмов в пародонтальном кармане на фоне проводимой локальной антибактериальной терапии, а также отслеживание содержимого пародонтальных карманов в отдаленные сроки после проведенной антибактериальной терапии. Учитывая вышесказанное, микробиологическая оценка содержимого пародонтальных карманов необходима для выбора и контроля эффективности локальной антибактериальной терапии.
Цель исследования — оценка эффективности локальной антибактериальной терапии хронического генерализованного пародонтита по данным изменения микробиологического состава пародонтальных карманов.
Методы. Проведено клиническое исследование 144 пациентов с хроническим генерализованным пародонтитом. Осмотр пациентов и анализ данных осуществлялся на клинических базах кафедры стоматологии общей практики федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации и кафедры стоматологии федерального государственного бюджетного образовательного учреждения высшего образования «Ставропольский государственный медицинский университет» Министерства здравоохранения Российской Федерации. В исследование включали пациентов в возрасте от 30 до 60 лет с диагнозом «хронический генерализованный пародонтит» различной степени тяжести. Все больные пародонтитом в зависимости от проводимой терапии распределены на 2 группы: основную и контрольную. Каждая из групп, в свою очередь, разделена на 3 подгруппы в зависимости от степени тяжести патологического процесса. Первую подгруппу контрольной группы (хронический генерализованный пародонтит легкой степени) составили 16 человек (11,1 %), вторую подгруппу (хронический генерализованный пародонтит средней степени) — 31 человек (21,5 %), третью подгруппу (хронический генерализованный пародонтит тяжелой степени) — 7 человек (4,9 %); в основной группе первая, вторая и третья подгруппы составили 28 (19,4 %), 48 (33,3 %) и 14 человек (9,7 %) соответственно. Степень тяжести пародонтита определяли по глубине пародонтального кармана, степени резорбции костной ткани (по данным рентгенологического исследования), патологической подвижности зубов. В качестве местной противовоспалительной терапии пациентам контрольной группы назначены ротовые ванночки с прополисом (15–20 капель 10 %-ной настойки прополиса, разбавленные в 100 мл теплой воды) 3 раза в день в течение 7 дней начиная с первого посещения. Пациентам контрольной группы на завершающем этапе лечения после предварительного скейлинга и рутплейнинга в пародонтальные карманы глубиной свыше 4 мм вводили антисептический гель с 10 % метронидазолом и 2 % хлоргексидина биглюконатом. Дополнительно назначались аппликации адгезивных стоматологических пленок «Диплен Дента Л» (с линкомицином) и «Диплен Дента М» (с метронидазолом) в домашних условиях. Больным основной группы дополнительно к вышеупомянутой комплексной терапии производили однократную инсуффляцию микросфер миноциклина гидрохлорида в каждый пародонтальный карман. Аппаратное обеспечение для терапии пациентов основной группы включало использование пластиковых канюль с микросферами миноциклина гидрохлорида в виде порошка, заключенного в наконечник картриджа, и специального шприца-инсуффлятора, отработку методики инсуффляции антибиотика в пародонтальный карман предварительно производили на модели челюстей с исследуемой патологией. Статистический анализ результатов исследования проводили с помощью программ вариационной статистики Excel Microsoft Office 2016 (Microsoft, США).
Результаты. Систематическое наблюдение за пациентами контрольной группы показало, что периодические колебания изменения численности микробов в большинстве патологических карманов имели определенную закономерность: уменьшение числа микроорганизмов на 21‑е сутки сменялось его увеличением в последующий срок наблюдения, в сроки 30 и особенно 60 суток. Динамическое наблюдение за пациентами основной группы показало, что колебания изменения численности микробов в большинстве патологических карманов имели некую закономерность: существенное уменьшение числа микроорганизмов на 21‑е сутки изменялось незначительным увеличением в последующий срок наблюдения, в срок 30 и незначительным увеличением в срок 60 суток. Главной особенностью колебания численности микроорганизмов пародонтальных карманов в основной группе является то, что она на протяжении всего наблюдения оставалась неизменно ниже аналогичной численности контрольной группы при уменьшении общего числа выявленных форм пародонтопатогенов.
Заключение. Установленные конфигурации корреляционных связей между основными показателями микробиологического статуса пародонтального кармана и тяжестью течения хронического генерализованного пародонтита в различные сроки после начала локальной терапии подтверждают положительную динамику проводимого лечения в основной группе, где больным проводились инсуффляции микросфер с миноциклина гидрохлоридом, что подтверждается изменением типологии микробного статуса пародонтальных карманов и количеством пародонтопатогенных микроорганизмов.
Ключевые слова
Для цитирования:
Шаманова З.К., Рисованная О.Н., Ленев В.Н., Перикова М.Г., Цымбалов О.В. Микробиологический пейзаж пародонтальных карманов на фоне локальной антибактериальной терапии хронического генерализованного пародонтита: многоцентровое клиническое исследование. Кубанский научный медицинский вестник. 2024;31(2):55-68. https://doi.org/10.25207/1608-6228-2024-31-2-55-68
For citation:
Shamanova Z.K., Risovannaya O.N., Lenev V.N., Perikova M.G., Tsymbalov O.V. Microbial landscape of periodontal pockets against local antibacterial therapy of chronic generalized periodontitis: a multicenter clinical trial. Kuban Scientific Medical Bulletin. 2024;31(2):55-68. (In Russ.) https://doi.org/10.25207/1608-6228-2024-31-2-55-68
ВВЕДЕНИЕ
Распространенность острого и хронического воспаления в тканях пародонта остается на высоком уровне несмотря на совершенствование профилактических мероприятий по предупреждению причин возникновения заболеваний пародонта. В последние десятилетия пародонтит значительно помолодел: первые клинические признаки появляются у пациентов уже после 30 лет, что может быть связано как с общей слабой иммунной реакцией организма и алиментарными факторами, так и с неэффективностью современных противомикробных средств, назначаемых для лечения и профилактики воспалительных заболеваний пародонта [1].
В настоящее время микробная природа пародонтита не вызывает сомнений, а своевременная и точная оценка патогенного потенциала микрофлоры пародонтального кармана является приоритетной для диагностики и определения тактики лечения пародонтита [2]. Установлено, что только целевое терапевтическое воздействие на микробные ассоциации возбудителей различных нозологических
форм воспалительных заболеваний тканей пародонта позволяет добиться повышения качества пародонтологической помощи [3][4].
Многочисленные микробиологические исследования видового состава микрофлоры зубодесневого кармана при пародонтите свидетельствуют о преобладании у большинства пациентов с хроническим пародонтитом анаэробных возбудителей: Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Peptostreptococcus spp., Fusobacterium nucleatum, Bacteroides caccae, Prevotella intermedia, Staphylococcus aureus, Streptococcus pyogenes, Candida non-albicans, Candida albicans [5][6].
Традиционно используемыми микробиологическими методами при хроническом пародонтите выявляются некоторые анаэробные возбудители из группы пародонтопатогенов; по данным ряда исследователей, тяжесть хронического генерализованного пародонтита сопряжена с наличием в зубодесневых карманах представителей Tannerella forsythia, Porphyromonas spp., Aggregatibacter actinomycetemcomitans и Treponema denticola [7–9].
Наиболее эффективным препаратом в отношении аэробных микроорганизмов, по данным литературы, являются миноциклина гидрохлорид, моксифлоксацин, амоксициллин/клавуланат, достаточно большая эффективность обнаружена у метронидазола за счет высокой активности против анаэробов [10][11].
Имеются научные данные, что замедленное высвобождение миноциклина гидрохлорида в виде микросфер в пародонтальных карманах позволяет поддерживать оптимальную концентрацию препарата в пародонтальном кармане в течение 20 дней, что может оказаться очень эффективным при лечении хронического пародонтита [12–14].
Также установлено, что традиционно используемые в стоматологии макролиды, линкомицин, доксициклин и ципрофлоксацин имеют наименьшую эффективность в отношении большинства анаэробных микроорганизмов пародонтального кармана [15][16].
Таким образом, патогенетическая целесообразность локального использования антибактериальных средств подтверждается многочисленными исследованиями, в которых даны как подробные характеристики видового состава, так и оценка специфической чувствительности пародонтопатогенов к антибиотикам [17–19].
Данное обстоятельство априори позволяет опираться на уже известные факты о микробной природе пародонтита и проводить научное исследование без подробного повторения микробиологических исследований видового состава содержимого пародонтальных карманов в исследуемой популяции и определения индивидуальной чувствительности пародонтопатогенных микроорганизмов к антибактериальным средствам [20][21]. Вместе с этим существенный интерес представляет анализ взаимоотношения между отдельными ассоциациями микроорганизмов в пародонтальном кармане на фоне проводимой локальной антибактериальной терапии [22].
Кроме этого, актуальным является отслеживание содержимого пародонтальных карманов в отдаленные сроки после проведенной антибактериальной терапии [23]. Однако значительное снижение числа пародонтопатогенных микроорганизмов в патологическом кармане на начальных этапах лечения антибактериальными средствами не всегда гарантирует стойкий терапевтический эффект спустя 12 месяцев [24]. Как правило, клинические проявления зависят не только от общего количества микроорганизмов в пародонтальном кармане, но и от их видового состава и количественных взаимоотношений [25]. Задача врача — обеспечить более стойкую ремиссию пародонтита за счет снижения микробной агрессии на соединительнотканные и костные структуры пародонта.
Цель исследования — оценка эффективности локальной антибактериальной терапии хронического генерализованного пародонтита по данным изменения микробиологического состава пародонтальных карманов.
МЕТОДЫ
Дизайн исследования
Работа выполнена по дизайну многоцентрового клинического исследования, в которое включены 144 пациента с диагнозом «хронический генерализованный пародонтит» различной степени тяжести.
Условия проведения исследования
Пациенты наблюдались на клинических базах кафедры стоматологии общей практики федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации и кафедры стоматологии федерального государственного бюджетного образовательного учреждения высшего образования «Ставропольский государственный медицинский университет» Министерства здравоохранения Российской Федерации. Продолжительность наблюдения составила 36 месяцев, с января 2020 по январь 2023 г.
Критерии соответствия
Критерии включения
Возраст от 30 до 65 лет, хронический генерализованный пародонтит различной степени тяжести, наличие добровольного информированного согласия.
Критерии невключения
Возраст до 30 и старше 65 лет, наличие онкологических заболеваний в стадии декомпенсации, психиатрические и неврологические заболевания, отягощенный аллергологический анамнез, в том числе в отношении используемых антибактериальных средств терапии, наличие острых или обострение хронических инфекционных, аутоиммунных заболеваний, длительная гормональная терапия кортикостероидами, беременность, лактация.
Критерии исключения
Добровольный отказ от дальнейшего участия в исследовании, уклонение от выполнения врачебных рекомендаций.
Описание критериев соответствия (диагностические критерии)
Критериями соответствия приняты подтвержденные при клиническом обследовании и на основе данных рентгенологических исследований признаки хронического пародонтита: все пациенты из выборки обследованы по единому алгоритму с помощью опроса, изучения истории болезни, инструментальной диагностики. Степень тяжести пародонтита определяли по глубине пародонтального кармана с помощью градуированного пуговчатого зонда, резорбцию костной ткани определяли по данным рентгенологического исследования (обзорная рентгенография), патологическую подвижность зубов — инструментальным методом с помощью пинцета и пальпаторно. Распространенность и тяжесть поражения тканей пародонта у пациентов выборки представлены в виде процента или числа выявленных случаев к общему числу человек с 95 % доверительным интервалом и вероятностью ошибки 0,05.
Подбор участников в группы
Выборка пациентов для исследования формировалась последовательным методом. Все больные пародонтитом в зависимости от проводимой терапии распределены на 2 группы: контрольную (n = 54) и основную (n = 90). Авторы исследования при получении и дальнейшей обработке первичных данных обследованных пациентов проводили обезличивание и устранение локализации, если таковая имелась. Вводился новый цифровой код для параметров пациентов в случае исследования, без оглашения привязки кода к персональным данным. Отбор участников исследования включал в себя осмотр полости рта врачом-стоматологом для оценки пародонтального статуса пациента. Выполнялся сбор анамнеза для исключения противопоказаний. План лечения для всех 144 пациентов предполагал однотипные процедуры и включал следующие этапы, предусмотренные клиническими рекомендациями при диагнозе «хронический генерализованный пародонтит»: 1-е посещение — индексная оценка пародонтологического статуса пациента; профессиональная гигиена полости рта с ультразвуковым удалением над- и поддесневых зубных отложений; обучение индивидуальной гигиене полости рта; 2-е посещение — инструментальный контроль качества соблюдения индивидуальной гигиены полости рта; устранение преждевременных контактов — функциональное избирательное пришлифовывание; 3-е посещение — проведение закрытого, открытого кюретажа, лоскутной операции в зависимости от показаний; 4-е — шинирование зубов с подвижностью 2-й и 3-й степени с использованием стекловолоконной ленты.
Учитывая индивидуальные особенности состояния твердых тканей зубов, коррекция и устранение факторов, способствующих поддержанию воспалительных процессов в пародонте (нависающие края пломб, кариозные полости, клиновидные дефекты) проводились параллельно с пародонтологическими процедурами.
В качестве местной противовоспалительной терапии пациентам обеих групп назначались ротовые ванночки с прополисом (15–20 капель 10 %-ной настойки прополиса, разбавленные 100 мл теплой воды) 3 раза в день в течение 7 дней начиная с первого посещения.
В связи с необходимостью устранения агрессивного воздействия пародонтопатогенных микроорганизмов при хроническом генерализованном пародонтите пациентам контрольной группы на завершающем этапе лечения после предварительного скейлинга и рутплейнинга в пародонтальные карманы глубиной свыше 4 мм вводили антисептический гель с 10 % метронидазолом и 2 % хлоргексидина биглюконатом. Дополнительно назначались аппликации адгезивных стоматологических пленок «Диплен Дента Л» (с линкомицином) («Норд-Ост», Россия) и «Диплен Дента М» (с метронидазолом) («Норд-Ост», Россия) в домашних условиях по следующей схеме: ежедневно в течение 7 дней утром после чистки зубов наносили «Диплен Дента Л» на вестибулярную и оральную поверхности альвеолярной десны в области зубов, имеющих наиболее глубокие пародонтальные карманы, вечером после чистки зубов — «Диплен Дента М» также на области, определенные и рекомендованные врачом.
Больным основной группы дополнительно к проводимой комплексной терапии после предварительного скейлинга и рутплейнинга проводили инсуффляцию микросфер миноциклина гидрохлорида в каждый пародонтальный карман. Аппаратное обеспечение для терапии пациентов основной группы включало использование пластиковых канюль с микросферами миноциклина гидрохлорида в виде порошка, заключенного в наконечник картриджа, и специального шприца-инсуффлятора (рис. 1).
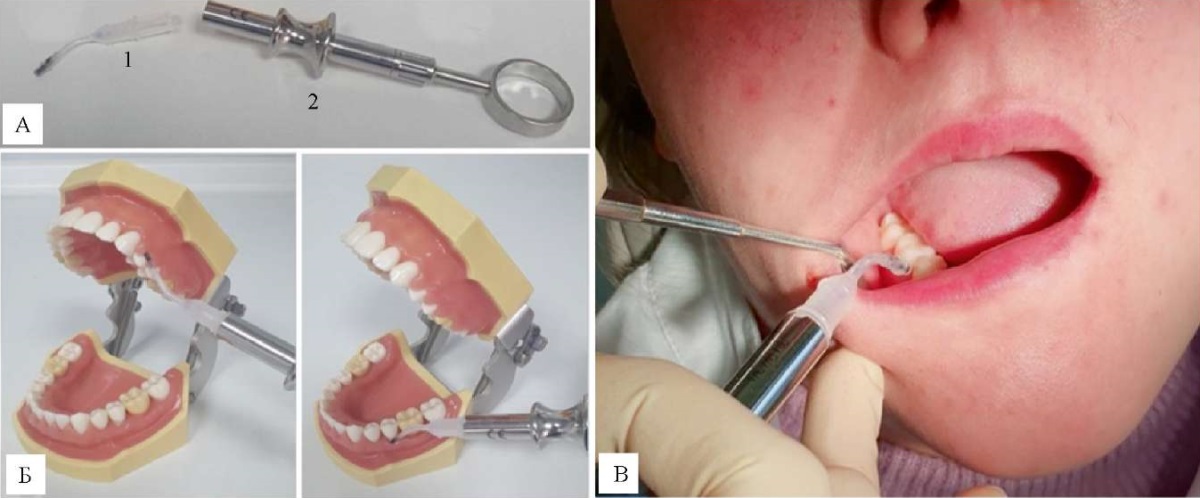
Рис. 1. Инсуффляция микросфер миноциклина гидрохлорида:
А — устройство для введения микросфер
(1 — пластиковая канюля с лекарственным веществом, 2 — шприц для инсуффляции);
Б — отработка методики на симуляционной модели челюстей;
В — введение в пародонтальный карман
Примечание: фотографии выполнены авторами.
Fig. 1. Insufflation of minocycline hydrochloride:
A — tool for microsphere injection
(1 — plastic cannula with the drug, 2 — syringe for insufflation);
Б — training on the jaw simulation model;
В — introduction into periodontal pocket
Note: photos taken by the authors.
Целевые показатели исследования
Основной показатель исследования
Анализ эффективности локальной антибактериальной терапии хронического генерализованного пародонтита по данным изменения микробиологического состава пародонтальных карманов.
Дополнительные показатели исследования
Не предусмотрены.
Методы измерения целевых показателей
Микробиологический статус пародонтальных карманов различной глубины исследовали после забора содержимого с помощью стерильных бумажных пинов, транспортировку которых на микробиологическое исследование осуществляли в соответствии с методическими указаниями МУ 4.2.2039–05 (техника сбора и транспортирования биоматериалов в микробиологические лаборатории). В содержимом каждого пародонтального кармана (далее — локус) с помощью фазово-контрастной микроскопии регистрировали численность 4 видов микроорганизмов: неподвижные и подвижные палочки, кокки и извитые формы.
Численность микроорганизмов каждого кармана определяли до начала лечения, через 21, 30 и 60 суток. Первичный посев биологического материала и выделение чистых культур микроорганизмов осуществляли секторальным методом для выявления количественных титров.
Идентификацию возбудителей пародонтальной инфекции производили с помощью диагностических наборов «Стрептотест-16» (Россия), каждый из которых позволяет провести идентификацию до 60 культур микроорганизмов.
Переменные (предикторы, конфаундеры, модификаторы эффекта)
Категориальные предикторные показатели
Возрастные группы, наличие общих соматических заболеваний, а также поставленный диагноз хронического генерализованного пародонтита различной степени тяжести в качестве основной категориальной предикторной переменной, принимающей одно из заданных значений, используемой при определении откликов наиболее зависимых переменных (значения гигиенических индексов, число микроорганизмов в пародонтальном кармане, тип проводимой терапии, показатели рентгенологического исследования, рецидив заболевания).
Конфаундеры
Неустранимых переменных, связанных как с откликом, так и с основным действующим фактором, не обнаружено.
Модификаторы эффекта
Используемые для антибактериальной терапии микросферы миноциклина гидрохлорида, инсуффляцию которых проводили в каждый пародонтальный карман с использованием пластиковых канюль с микросферами миноциклина гидрохлорида в виде порошка, заключенного в наконечник картриджа, и специального шприца-инсуффлятора. Рекомендуемая продолжительность курса лечения хронического генерализованного пародонтита различной степени тяжести — 21 сутки.
Статистические процедуры
Принцип расчета размера выборки
Размер выборки предварительно не рассчитывался
Статистические методы
Результаты исследования подвергали статистической обработке с применением дисперсионного анализа, структурного коэффициента асимметрии Пирсона, моментного коэффициента асимметрии, критерия Фридмана — непараметрического аналога дисперсионного анализа повторных измерений для сравнения нескольких зависимых выборок, критерия Хи-квадрат Пирсона, параметрического критерия множественных сравнений Ньюмена — Кейсла в программе «Primer of Biostatistics 4.03» (Stanton A. Glantz, McGraw Hill) для Windows. Нормальность распределения проверяли с помощью критерия Фишера. Для анализа корреляции между исследуемыми показателями использовали множественный корреляционный анализ с подсчетом совокупного коэффициента множественной корреляции. Результаты различия считали значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
Формирование выборки исследования
Формирование выборки проведено в соответствии с критериями включения и невключения. Все 144 пациента с диагнозом «хронический генерализованный пародонтит» различной степени тяжести были распределены на 2 группы (контрольную и основную), каждая из групп, в свою очередь, разделена на 3 подгруппы, в зависимости от степени тяжести патологического процесса. Первую подгруппу контрольной группы (хронический генерализованный пародонтит легкой степени тяжести (ХГПЛСТ)) составили 16 человек (29,6 %), вторую подгруппу (хронический генерализованный пародонтит средней степени тяжести (ХГПССТ)) — 31 человек (57,4 %), третью подгруппу (хронический генерализованный пародонтит тяжелой степени тяжести (ХГПТСТ)) — 7 человек (13,0 %); в основной группе первая, вторая и третья подгруппы составили 28 (31,1 %), 48 (53,3 %) и 14 человек (15,6 %) соответственно. Все пациенты дошли до конца исследования (рис. 2).
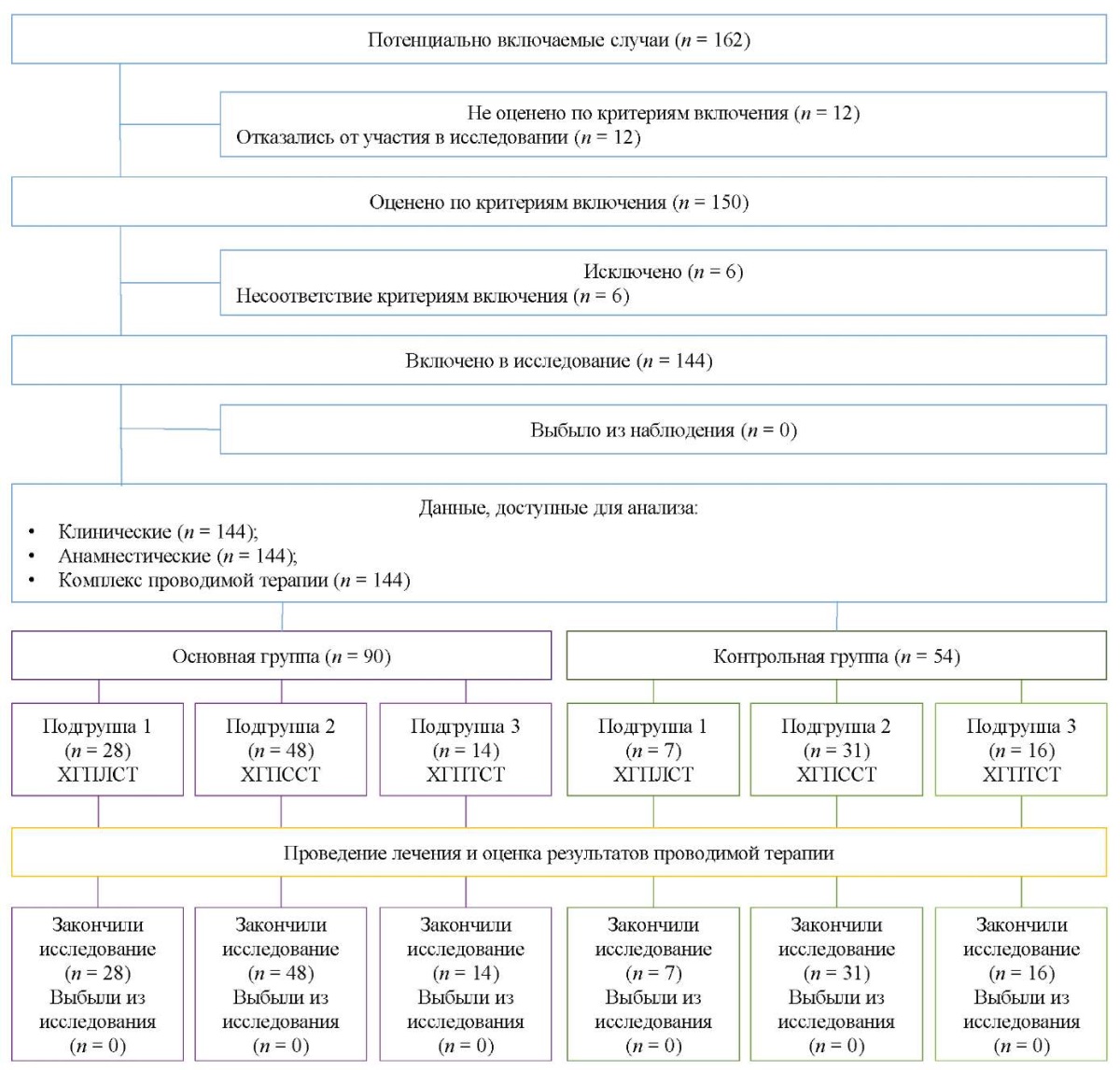
Рис. 2. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами (согласно рекомендациям STROBE).
Сокращения: ХГПЛСТ — хронический генерализованный пародонтит легкой степени;
ХГПССТ — хронический генерализованный пародонтит средней степени;
ХГПТСТ — хронический генерализованный пародонтит тяжелой степени.
Fig. 2. Schematic diagram of the research design
Note: performed by the authors (according to STROBE recommendations).
Abbreviations: ХГПЛСТ — chronic generalized periodontitis of mild severity;
ХГПССТ — chronic generalized periodontitis of moderate severity;
ХГПТСТ — chronic generalized periodontitis of high severity.
Характеристики выборки (групп) исследования
Все больные распределены на 2 группы: контрольная группа n = 54 (возраст от 30 до 65 лет, 28 женщин и 26 мужчин). Средний возраст составил 52,4 ± 3,7 года, гипотеза о нормальности не отклоняется (р = 0,158), основная группа (n = 90, возраст от 30 до 65 лет, 51 женщина, 39 мужчин), средний возраст 51,1 ± 3,6 года, гипотеза о нормальности не отклоняется (р = 0,447). Дисперсионный анализ не выявил статистически значимого различия среднего возраста среди двух групп (р = 0,164 по критерию Фишера). Парное сравнение по возрасту между группами (для контрольной и основной р = 0,413) также показало статистическую незначимость различий средних значений. По возрасту группы контрольная и основная оказались сопоставимы.
Сравнение долей мужчин и женщин в группах по критерию хи-квадрат Пирсона не выявило статистически значимого различия долей мужчин и женщин в контрольной и основной группах (р = 0,575). По полу группы оказались сопоставимы.
Сравнение долей ХПГ легкой, средней и тяжелой степени по критерию Хи-квадрат Пирсона не выявило статистически значимого различия долей подгрупп в контрольной и основной группах (для подгрупп с легкой степенью ХПГ р = 0,852, для подгрупп со средней степенью ХПГ р = 0,635, для подгрупп с тяжелой степенью ХПГ р = 0,670).
Основные результаты исследования
При исследовании микробных ассоциаций в контрольной группе среднее число микроорганизмов в содержимом пародонтальных карманов через 21 сутки изменялось наиболее значительно. Если в первое посещение до начала лечения число микробных ассоциаций составляло 195,0 в единице объема (95 % доверительный интервал 155,8–248,4), то через 21 сутки после введения антисептического геля с 10 % метронидазолом и 2 % хлоргексидина биглюконатом — уже 102,3 (55,4–134,6), через 30 суток — 118,8 (77,2–142,7) и через 60 суток — 148,3 (122,4–171,9).
Исходный уровень общего числа микроорганизмов в каждом кармане (в первое посещение) использован в качестве главного нормообразующего делителя для всех последующих численностей через 21, 30, 60 суток после начала лечения. Численность микроорганизмов в пародонтальном кармане превышает исходную, еcли нормированный таким образом показатель оказывается больше единицы (1). Через 21 сутки после начала лечения общая численность микроорганизмов достигла наименьшей вариабельности (дисперсия нормообразующего показателя ∑² = 0,595). В содержимом части карманов общее число микроорганизмов оказалось меньше исходного уровня. В последующие сроки наблюдения произошло увеличение численности и дисперсии, характеризующей вариабельность нормированного показателя численности микроорганизмов, до 0,988, что значимо при 5 % уровне значимости ∑² = 2,38 через 60 суток (р < 0,05).
Систематическое наблюдение за пациентами контрольной группы показало, что колебания изменения численности микробов в большинстве патологических карманов имели определенную закономерность: уменьшение числа микроорганизмов на 21-е сутки изменялось его увеличением в последующий срок наблюдения, в сроки 30 и особенно 60 суток. Динамика нормированного показателя (%) численности микроорганизмов в указанные сроки наблюдения отображена на рисунке 3.
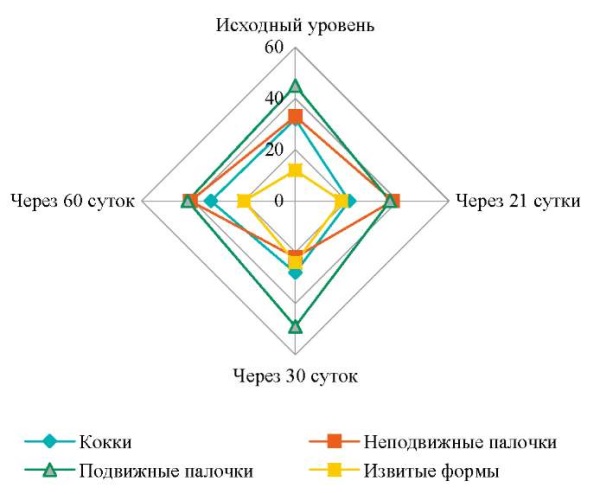
Рис. 3. Динамика нормированного показателя численности
пародонтопатогенных микроорганизмов пародонтального кармана
в различные сроки в контрольной группе (%)
Примечание: рисунок выполнен авторами.
Fig. 3. Dynamics of the norm-based number
of periodontopathogenic microorganisms of the periodontal pocket
in different periods in the control group (%)
Note: performed by the authors.
Локальное введение антисептического геля с 10 % метронидазолом и 2 % хлоргексидина биглюконатом в пародонтальные карманы пациентов контрольной группы на 21-е сутки привело к резкому изменению соотношения численности видов микроорганизмов, прежде всего кокков и извитых форм. Однако на 30-е и особенно 60-е сутки после начала терапии структура ассоциации микробов практически вернулась к исходной.
При исследовании микробных ассоциаций в основной группе среднее число микроорганизмов в содержимом пародонтальных карманов через 21 сутки так же, как и в контрольной группе, изменялось наиболее значительно.
Так, если в первое посещение до начала лечения число микробных ассоциаций составляло 196,5 в единице объема (95 % доверительный интервал 159,2–252,7), то через 21 сутки после инсуффляции микросфер с миноциклина гидрохлоридом — 30,4 (15,6–44,8), через 30 суток — 26,2 (12,2–34,7) и через 60 суток — 48,3 (32,4–55,3).
Таким образом, в основной группе выявлена противоположная контрольной группе динамика распределения индивидуальных значений общего числа микроорганизмов в пародонтальных карманах.
Через 21 сутки после начала лечения общая численность микроорганизмов достигла в основной группе наименьшей вариабельности (дисперсия нормообразующего показателя ∑² = 0,733). В содержимом части карманов на 21-е сутки общее число микроорганизмов оказалось значительно меньше исходного уровня, а также на 65,8 % меньше аналогичного показателя в контрольной группе. В последующие сроки наблюдения произошло последовательное уменьшение дисперсии, характеризующей вариабельность нормированного показателя численности микроорганизмов, до 0,0448, что значимо при 5 % уровне значимости ∑² = 1,03 (р < 0,05) через 30 суток, и ее незначительное увеличение через 60 суток, ∑² = 1,37.
Динамическое наблюдение за пациентами основной группы показало, что колебания изменения численности микробов в большинстве патологических карманов имели закономерность: существенное уменьшение числа микроорганизмов на 21-е сутки изменялось незначительным увеличением в последующий срок наблюдения, в срок 30 суток, и незначительным увеличением в срок 60 суток. Главной особенностью колебания численности микроорганизмов пародонтальных карманов в основной группе является то, что она на протяжении всего наблюдения оставалась неизменно ниже при существенном уменьшении общего числа выявленных форм пародонтопатогенов.
Изменение нормированного показателя численности микроорганизмов пародонтальных карманов в основной группе в указанные сроки наблюдения в процентах отображено на рисунке 4. Локальная инсуффляция микросфер с миноциклина гидрохлоридом в пародонтальные карманы пациентов основной группы на 21-е сутки привела к резкому изменению соотношения численности видов микроорганизмов, прежде всего кокков и всех извитых форм. На 30-е сутки данная тенденция продолжилась, на 60-е сутки после начала терапии структура ассоциации микробов осталась практически неизменной по отношению к данным, полученным на 21-е сутки.
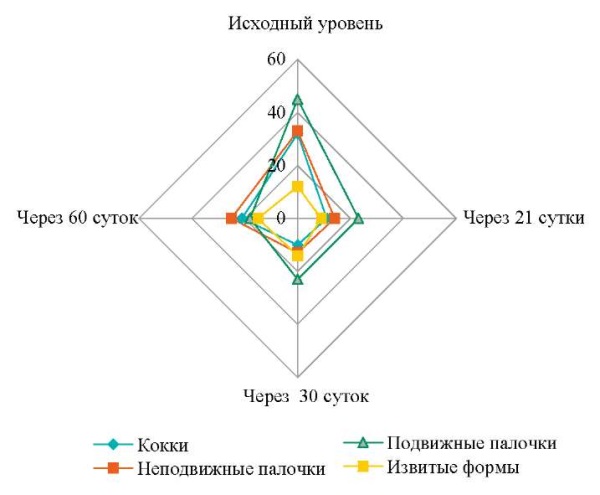
Рис. 4. Динамика нормированного показателя численности
пародонтопатогенных микроорганизмов пародонтального кармана
в различные сроки в основной группе (%)
Примечание: рисунок выполнен авторами.
Fig. 4. Dynamics of the norm-based number
of periodontopathogenic microorganisms of the periodontal pocket
in different periods in the main group (%)
Note: performed by the authors.
Исходя из полученных данных, очевидно, что в период хронического течения патологии пародонта число и соотношение видов микроорганизмов в пародонтальном кармане можно считать уравновешенным, отражающими конкурентные взаимоотношения и уровень местных и общих факторов защиты организма. Локальная терапия, проводимая введением в патологический карман антисептического геля с 10 % метронидазолом и 2 % хлоргексидина биглюконатом в контрольной группе и инсуффляции микросфер с миноциклина гидрохлоридом в основной группе, нарушает данное равновесие.
Однако численность микроорганизмов в контрольной группе постепенно восстанавливается до исходных значений через 60 суток. Напротив, в основной группе к этому сроку не наблюдается колебаний численности пародонтопатогенов.
Для лучшего понимания выявленной закономерности проведен дисперсный анализ, который представляет собой соотношение всех выявленных корреляций между основными показателями, характеризующими микробиологический статус пародонтального кармана и тяжесть течения хронического генерализованного пародонтита до начала лечения и в различные сроки после проведения локальной терапии (табл. 1).
Таблица 1. Значения коэффициентов корреляции связей между основными показателями,
характеризующими микробиологический статус пародонтального кармана,
и тяжестью течения хронического генерализованного пародонтита
Table 1. Correlation coefficients between the main indicators
characterizing the microbiological status of periodontal pocket
and the severity of chronic generalized periodontitis
|
Исследуемый показатель |
Группы |
||
|
1 |
2 |
3 |
|
|
Численность кокков |
0,55 |
1,48 |
1,54 |
|
Численность неподвижных форм |
0,48 |
0,92 |
2,15 |
|
Численность подвижных палочек |
1,05 |
1,29 |
1,96 |
|
Численность извитых форм |
0,44 |
0,78 |
1,16 |
|
Глубина пародонтального кармана |
0,33 |
0,67 |
1,89 |
|
Нормообразующий показатель общего числа микроорганизмов до начала терапии, ∑² |
0,672 |
0,712 |
0,785 |
|
Дисперсионный показатель, α |
2,38 |
1,56 |
2,66 |
|
Доля дисперсии, % |
31,9 |
36,9 |
14,7 |
|
Прирост доли дисперсии, % |
69,1 |
63,1 |
86,3 |
Примечания: таблица составлена авторами;
1 — хронический генерализованный пародонтит легкой степени;
2 — хронический генерализованный пародонтит средней степени;
3 — хронический генерализованный пародонтит тяжелой степени.
Notes: compiled by the authors;
1 — chronic generalized periodontitis of mild severity;
2 — chronic generalized periodontitis of moderate severity;
3 — chronic generalized periodontitis of high severity.
После процедуры дисперсного анализа показатели дисперсии интерпретируются следующим образом. Тяжесть течения хронического генерализованного пародонтита до начала терапии в равной степени коррелирует с численностями кокков, неподвижных палочек, извитых форм микроорганизмов, глубиной кармана и динамической характеристикой общей численности микробов.
При ХГПЛСТ самый высокий коэффициент корреляции выявлен с числом подвижных палочек, при ХГПССТ — с количеством кокков, при ХГПТСТ — неподвижных форм. Очевидно, что выявленная корреляция характеризует тяжесть патологии, поскольку положительно связана не только с числом, но и с видом выявленных микроорганизмов, а также с глубиной пародонтального кармана. При анализе конфигурации корреляционных взаимоотношений между основными показателями, характеризующими микробиологический статус пародонтального кармана, и тяжестью течения хронического генерализованного пародонтита в основной и контрольной группах через 21 сутки после начала локальной терапии, установлено следующее (табл. 2).
Таблица 2. Значения коэффициентов корреляции связей между основными показателями,
характеризующими микробиологический статус пародонтального кармана,
и тяжестью течения хронического генерализованного пародонтита
через 21 сутки после начала локальной терапии
Table 2. Correlation coefficients between the main indicators
characterizing the microbiological status of periodontal pocket
and the severity of chronic generalized periodontitis 21 days after the start of local therapy
|
Исследуемый показатель |
Контрольная группа |
Основная группа |
||||
|
1 |
2 |
3 |
1 |
2 |
3 |
|
|
Численность кокков |
0,36 |
1,03 |
1,49 |
0,11 |
0,23 |
1,01 |
|
Численность неподвижных палочек |
0,12 |
0,26 |
0,59 |
0,06 |
0,11 |
0,34 |
|
Численность подвижных палочек |
0,73 |
1,16 |
0,98 |
0,21 |
0,33 |
0,29 |
|
Численность извитых форм |
0,44 |
0,78 |
1,16 |
-0,94 |
-0,35 |
0,15 |
|
Глубина пародонтального кармана |
0,29 |
0,66 |
1,92 |
0,26 |
0,59 |
1,28 |
|
Нормообразующий показатель общего числа микроорганизмов через 21 сутки после начала терапии, ∑² |
0,572 |
0,612 |
0,715 |
0,217 |
0,302 |
0,344 |
|
Дисперсионный показатель, α |
1,04 |
1,49 |
2,52 |
0,25 |
0,79 |
1,03 |
|
Доля дисперсии, % |
54,8 |
65,3 |
74,9 |
18,4 |
22,9 |
30,6 |
|
Прирост доли дисперсии, % |
45,2 |
34,7 |
25,1 |
71,6 |
71,1 |
69,4 |
Примечания: таблица составлена авторами;
1 — хронический генерализованный пародонтит легкой степени тяжести;
2 — хронический генерализованный пародонтит средней степени тяжести;
3 — хронический генерализованный пародонтит тяжелой степени тяжести.
Notes: compiled by the authors;
1 — chronic generalized periodontitis of mild severity;
2 — chronic generalized periodontitis of moderate severity;
3 — chronic generalized periodontitis of high severity.
В контрольной и основной группах через 21 сутки после начала локальной терапии выявленная дисперсия отражает весьма существенную конкуренцию между кокками и извитыми формами микроорганизмов, причем она определяется независимо от глубины кармана и численности других форм микроорганизмов.
Через 30 суток после начала локальной терапии установлена существенная связь между динамической характеристикой общей численности микроорганизмов и его глубиной (табл. 3).
Таблица 3. Значения коэффициентов корреляции связей между основными показателями,
характеризующими микробиологический статус пародонтального кармана,
и тяжестью течения хронического генерализованного пародонтита
через 30 суток после начала локальной терапии
Table 3. Correlation coefficients between the main indicators
characterizing the microbiological status of periodontal pocket
and the severity of chronic generalized periodontitis 30 days after the start of local therapy
|
Исследуемый показатель |
Контрольная группа |
Основная группа |
||||
|
1 |
2 |
3 |
1 |
2 |
3 |
|
|
Численность кокков |
0,55 |
1,44 |
1,98 |
-0,32 |
0,31 |
1,19 |
|
Численность неподвижных палочек |
0,45 |
0,36 |
0,77 |
-0,26 |
0,52 |
0,64 |
|
Численность подвижных палочек |
0,96 |
1,09 |
1,55 |
0,16 |
0,54 |
1,16 |
|
Численность извитых форм |
0,39 |
0,86 |
1,27 |
-0,18 |
-0,85 |
0,21 |
|
Глубина пародонтального кармана |
1,04 |
2,53 |
3,23 |
1,07 |
1,99 |
2,28 |
|
Нормообразующий показатель общего числа микроорганизмов через 30 суток после начала терапии, ∑² |
0,785 |
0,884 |
1,235 |
0,424 |
0,609 |
0,919 |
|
Дисперсионный показатель, α |
2,13 |
2,56 |
3,01 |
1,44 |
1,63 |
2,15 |
|
Доля дисперсии, % |
52,4 |
43,8 |
59,1 |
24,5 |
36,2 |
22,9 |
|
Прирост доли дисперсии, % |
57,6 |
56,2 |
40,9 |
75,5 |
63,8 |
77,1 |
Примечания: таблица составлена авторами;
1 — хронический генерализованный пародонтит легкой степени тяжести;
2 — хронический генерализованный пародонтит средней степени тяжести;
3 — хронический генерализованный пародонтит тяжелой степени тяжести.
Notes: compiled by the authors;
1 — chronic generalized periodontitis of mild severity;
2 — chronic generalized periodontitis of moderate severity;
3 — chronic generalized periodontitis of high severity.
Через 60 суток установлено, что чем глубже патологический карман, тем медленнее восстанавливается численность микроорганизмов. Следует отметить сильную отрицательную связь тяжести исследуемой патологии с числом неподвижных палочек, кокков и извитых форм в основной группе (табл. 4).
Таблица 4. Значения коэффициентов корреляции связей между основными показателями,
характеризующими микробиологический статус пародонтального кармана,
и тяжестью течения хронического генерализованного пародонтита
через 60 суток после начала локальной терапии
Table 4. Correlation coefficients between the main indicators
characterizing the microbiological status of periodontal pocket
and the severity of chronic generalized periodontitis 60 days after the start of local therapy
|
Исследуемый показатель |
Контрольная группа |
Основная группа |
||||
|
1 |
2 |
3 |
1 |
2 |
3 |
|
|
Численность кокков |
0,98 |
1,029 |
1,24 |
-0,64 |
-0,27 |
-0,98 |
|
Численность неподвижных палочек |
1,93 |
1,88 |
2,51 |
-0,28 |
-0,12 |
-0,92 |
|
Численность подвижных палочек |
1,22 |
2,65 |
2,03 |
0,18 |
-0,66 |
-0,09 |
|
Численность извитых форм |
0,39 |
0,86 |
1,27 |
-0,18 |
-0,85 |
0,21 |
|
Глубина пародонтального кармана |
1,35 |
1,99 |
3,14 |
0,56 |
1,67 |
2,05 |
|
Нормообразующий показатель общего числа микроорганизмов через 60 суток после начала терапии, ∑² |
0,512 |
1,339 |
1,761 |
0,737 |
0,554 |
0,323 |
|
Дисперсионный показатель, α |
1,64 |
1,83 |
2,77 |
0,27 |
0,59 |
1,76 |
|
Доля дисперсии, % |
73,5 |
54,2 |
77,6 |
33,8 |
45,3 |
19,4 |
|
Прирост доли дисперсии, % |
26,5 |
45,8 |
22,4 |
66,2 |
54,7 |
80,6 |
Примечания: таблица составлена авторами;
1 — хронический генерализованный пародонтит легкой степени тяжести;
2 — хронический генерализованный пародонтит средней степени тяжести;
3 — хронический генерализованный пародонтит тяжелой степени тяжести.
Notes: compiled by the authors;
1 — chronic generalized periodontitis of mild severity;
2 — chronic generalized periodontitis of moderate severity;
3 — chronic generalized periodontitis of high severity.
Дополнительные результаты исследования
Дополнительные результаты исследования не получены.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
При микробиологическом исследовании микрофлоры пародонтальных карманов у больных хроническим генерализованным пародонтитом различной степени тяжести установлено, что динамика индивидуальных значений общего числа микроорганизмов в пародонтальных карманах отличалась значительным разнообразием. По данным микробиологического исследования распределение общего числа микроорганизмов в пародонтальных карманах в основной и контрольной группах на 21-е сутки достигло наименьшей вариабельности при дисперсии нормообразующего показателя ∑² = 0,733 и 0,595 соответственно, через 60 суток численность микроорганизмов в контрольной группе восстанавливалась до исходных значений, а в основной группе оставалась ниже нормообразующего делителя, равного 1, при уменьшении общего числа выявленных форм пародонтопатогенов на 65,8 %.
Ограничения исследования
Не выявлены.
Интерпретация результатов исследования
Как показал обзор литературных данных по изучаемой проблеме, лечение хронического пародонтита может эффективно проводиться не только в результате системного антибактериального воздействия на пародонтопатогенную микрофлору полости рта [26][27], но и при локальной антибактериальной терапии [28]. Серьезным рывком в направлении совершенствования локальной антибактериальной терапии является разработка новых, инновационных форм доставки антибактериальных агентов внутрь пародонтальных тканей, в пародонтальный карман [29][30]. Одним из таких способов доставки стали микросферы (микрокорпускулы, микрогранулы, наносферы, твердые липидные микрочастицы), медленно высвобождающие действующее вещество в ткани, не растворимые в слюне и тканевой жидкости. Не менее важным представляется выбор самого антибактериального субагента — антибиотика [31]. Наиболее эффективными для локального применения остаются антибактериальные препараты из групп макролидов, азитромицинов и тетрациклинов: в ряде исследований показано, что введение антибиотика в пародонтальные карманы может обеспечить более высокие терапевтические концентрации по сравнению с системным его введением [32].
Имеющиеся данные свидетельствуют о том, что некоторые локально применяемые антибактериальные средства могут быть сопоставимы по противомикробной резистентности со специализированными вакцинами, по некоторым данным микросферы высокоэффективны при использовании у больных не только с локализованными, но и с генерализованными формами пародонтита. Данные средства и методы доставки лекарственных веществ в пародонтальные ткани способствуют улучшению не только микробиологических, но и клинических параметров, что является показанием к их использованию даже при тяжелых формах пародонтита.
В результате проведенного исследования отмечен рост дисперсионного показателя в контрольной группе на фоне прогрессирования патологического процесса в пародонте: в указанных пределах колебаний тяжести процесса очевидно существование пародонтальных карманов с резким подавлением численности кокковой флоры за счет статистически значимого прироста числа извитых форм, что может быть связано с изменением среды обитания микроорганизмов и уменьшения глубины карманов. Значительный рост дисперсии обнаружен в основной группе, где наибольшая корреляция обнаружена между глубиной пародонтального кармана и тяжестью хронического пародонтита: на фоне уменьшения доли показателя ∑² = 0,323, прирост доли дисперсии составил при ХГПТСТ 80,6 % (р < 0,05), что коррелировало с уменьшением глубины пародонтального кармана и имело сильную отрицательную связь тяжести исследуемой патологии с числом неподвижных палочек, кокков и извитых форм.
ЗАКЛЮЧЕНИЕ
Установленные корреляционные связи между основными показателями микробиологического статуса пародонтального кармана и тяжестью течения хронического генерализованного пародонтита в различные сроки после начала локальной терапии подтверждают положительную динамику проводимого лечения в основной группе, где больным проводились инсуффляции микросфер с миноциклина гидрохлоридом, что подтверждается изменением типологии микробного статуса пародонтальных карманов и количеством пародонтопатогенных микроорганизмов. Результаты проведенных исследований могут быть применены в практической стоматологии в рамках комплексного лечения больных с воспалительными заболеваниями пародонта. Микросферы с антибиотиком являются эффективным и действенным средством доставки лекарств, они эффективны при локальной терапии хронического пародонтита или в тех областях тканей пародонта, которые не реагируют на традиционную терапию, поэтому микросферы с миноциклина гидрохлоридом следует рассматривать в качестве вспомогательного средства к традиционной комплексной терапии пародонта для достижения высоких клинических результатов.
Список литературы
1. Kwon T, Lamster IB, Levin L. Current Concepts in the Management of Periodontitis. Int Dent J. 2021;71(6):462–476. https://doi.org/10.1111/idj.12630
2. Larsson L, Garaicoa-Pazmino C, Asa’ad F, Castilho RM. Understanding the role of endotoxin tolerance in chronic inflammatory conditions and periodontal disease. J Clin Periodontol. 2022;49(3):270–279. https://doi.org/10.1111/jcpe.13591
3. Tomasi C, Wennström JL. Locally delivered doxycycline as an adjunct to mechanical debridement at retreatment of periodontal pockets: outcome at furcation sites. J Periodontol. 2011;82(2):210–218. https://doi.org/10.1902/jop.2010.100308
4. Shiloah J, Patters MR, Dean JW 3rd, Bland P, Toledo G. The survival rate of Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis, and Bacteroides forsythus following 4 randomized treatment modalities. J Periodontol. 1997;68(8):720–728. https://doi.org/10.1902/jop.1997.68.8.720
5. Слажнева Е.С., Тихомирова Е.А., Атрушкевич В.Г. Пародонтопатогены: новый взгляд. Систематический обзор. Часть 2. Стоматология детского возраста и профилактика. 2020;20(2):160–167. https://doi.org/10.33925/1683-3031-2020-20-2-160-167
6. Wang W, Zheng C, Yang J, Li B. Intersection between macrophages and periodontal pathogens in periodontitis. J Leukoc Biol. 2021;110(3):577–583. https://doi.org/10.1002/JLB.4MR0421-756R
7. Григорян В.А., Перикова М.Г., Сирак С.В., Щетинин Е.В., Долгалев А.А., Бобрышев Д.В., Ремизова А.А., Дзгоева М.Г. Особенности клинического выбора антибактериальных средств терапии хронического генерализованного пародонтита по результатам микробиологического и молекулярно-генетического исследования. Медицинский вестник Северного Кавказа. 2019;14(4):649–653. https://doi.org/10.14300/mnnc.2019.14161
8. Jepsen K, Jepsen S. Antibiotics/antimicrobials: systemic and local administration in the therapy of mild to moderately advanced periodontitis. Periodontol 2000. 2016;71(1):82–112. https://doi.org/10.1111/prd.12121
9. Mehraliyeva SJ, Yusubova SR, Mammadova PB. Study of the antimicrobial action of nanogel used in the treatment of gingivitis. Theoretical & Applied Science. 2022;108(04):20–27. https://doi.org/10.15863/tas.2022.04.108.3
10. Tabenski L, Moder D, Cieplik F, Schenke F, Hiller KA, Buchalla W, Schmalz G, Christgau M. Antimicrobial photodynamic therapy vs. local minocycline in addition to non-surgical therapy of deep periodontal pockets: a controlled randomized clinical trial. Clin Oral Investig. 2017;21(7):2253–2264. https://doi.org/10.1007/s00784-016-2018-6
11. Calasans-Maia MD, Barboza Junior CAB, Soriano-Souza CA, Alves ATNN, Uzeda MJP, Martinez-Zelaya VR, Mavropoulos E, Rocha Leão MH, de Santana RB, Granjeiro JM, Rossi AM. Microspheres of alginate encapsulated minocycline-loaded nanocrystalline carbonated hydroxyapatite: therapeutic potential and effects on bone regeneration. Int J Nanomedicine. 2019;14:4559–4571. https://doi.org/10.2147/IJN.S201631
12. Gibson I, Momeni A, Filiaggi M. Minocycline-loaded calcium polyphosphate glass microspheres as a potential drug-delivery agent for the treatment of periodontitis. J Appl Biomater Funct Mater. 2019;17(3):2280800019863637. https://doi.org/10.1177/2280800019863637
13. Astuti SD, Mahmud AF, Putra AP, Setiawatie EM, Arifianto D. Effectiveness of bacterial biofilms photodynamic inactivation mediated by curcumin extract, nanodoxycycline and laser diode. Biomedical Photonics. 2020;9(4):4–14. https://doi.org/10.24931/2413–9432–2020-9–4–4–14
14. Grossi SG, Goodson JM, Gunsolley JC, Otomo-Corgel J, Bland PS, Doherty F, Comiskey J. Mechanical therapy with adjunctive minocycline microspheres reduces red-complex bacteria in smokers. J Periodontol. 2007;78(9):1741–1750. https://doi.org/10.1902/jop.2007.070118
15. Ilyes I, Rusu D, Rădulescu V, Vela O, Boariu MI, Roman A, Surlin P, Kardaras G, Boia S, Chinnici S, Jentsch HFR, Stratul SI. A Placebo-Controlled Trial to Evaluate Two Locally Delivered Antibiotic Gels (Piperacillin Plus Tazobactam vs. Doxycycline) in Stage II–-IV Periodontitis Patients. Medicina (Kaunas). 2023;59(2):303. https://doi.org/10.3390/medicina59020303
16. Zhang Z, Zheng Y, Bian X. Clinical effect of azithromycin as an adjunct to non-surgical treatment of chronic periodontitis: a meta-analysis of randomized controlled clinical trials. J Periodontal Res. 2016;51(3):275–283. https://doi.org/10.1111/jre.12319
17. Царев В.Н., Ушаков Р.В., Ипполитов Е.В., Подпорин М.С., Нуруев Н.Н. Экспериментальное исследование антимикробной и антибиопленочной активности комбинации ципрофлоксацина и тинидазола in vitro. Пародонтология. 2019;24(4):285–292. https://doi.org/10.33925/1683-3759-2019-24-4-285-292
18. Colombo AP, Bennet S, Cotton SL, Goodson JM, Kent R, Haffajee AD, Socransky SS, Hasturk H, Van Dyke TE, Dewhirst FE, Paster BJ. Impact of periodontal therapy on the subgingival microbiota of severe periodontitis: comparison between good responders and individuals with refractory periodontitis using the human oral microbe identification microarray. J Periodontol. 2012;83(10):1279–1287. https://doi.org/10.1902/jop.2012.110566
19. Макеева И.М., Даурова Ф.Ю., Бякова С.Ф., Ипполитов Е.В., Гостев М.С., Поликушина А.О., Шубин Е.А. Чувствительность микробных ассоциаций экссудата пародонтального кармана и одонтогенного очага к антибактериальным препаратам. Стоматология. 2016;95(3):26–30. https://doi.org/10.17116/stomat201695326-30
20. Жолдошев Ч.К., Куттубаева К.Б., Алымбаев Р.С., Суеркулов Э.С., Абдышев Т.К. Показатели микробиологического исследования при генерализованном хроническом пародонтите. Бюллетень науки и практики. 2021;7(10):231–235. https://doi.org/10.33619/2414-2948/71/25
21. Feres M, Haffajee AD, Allard K, Som S, Goodson JM, Socransky SS. Antibiotic resistance of subgingival species during and after antibiotic therapy. J Clin Periodontol. 2002;29(8):724–735. https://doi.org/10.1034/j.1600-051x.2002.290809.x
22. Леонтьева А.В., Потоцкая Л.А., Червинец Ю.В. Механизмы образования микробных биопленок в полости рта у здоровых людей и больных хроническим генерализованным пародонтитом. Пародонтология. 2023;28(3):208–217. https://doi.org/10.33925/1683-3759-2023-794
23. Оправин А.С., Галиева А.С., Давидович Н.В., Спиричева Э.П., Поливаная Е.А., Бажукова Т.А. Пародонтопатогенная микрофлора и гены антибиотикорезистентности у лиц с хроническим генерализованным пародонтитом. Пародонтология. 2023;28(1):39–47. https://doi.org/10.33925/1683-3759-2023-28-1-39-47
24. Mohammad CA, Ali KM, Al-Rawi RA, Gul SS. Effects of Curcumin and Tetracycline Gel on Experimental Induced Periodontitis as an Anti-Inflammatory, Osteogenesis Promoter and Enhanced Bone Density through Altered Iron Levels: Histopathological Study. Antibiotics (Basel). 2022;11(4):521. https://doi.org/10.3390/antibiotics11040521
25. Цепов Л.М., Николаев А.И., Петрова Е.В., Нестерова М.М. Патогенетическое обоснование клинического применения медикаментов в комплексной терапии при воспалительных заболеваниях пародонта (обзор литературы). Пародонтология. 2018;23(2):4–9. https://doi.org/10.25636/PMP.1.2018.2.1
26. Rams TE, Freedman IS, Chialastri SM, Slots J. Systemic ciprofloxacin treatment of multidrug-resistant Aggregatibacter actinomycetemcomitans in severe periodontitis. Diagn Microbiol Infect Dis. 2024;108(2):116162. https://doi.org/10.1016/j.diagmicrobio.2023.116162
27. Suzuki S, Yamada S. Epigenetics in susceptibility, progression, and diagnosis of periodontitis. Jpn Dent Sci Rev. 2022;58:183–192. https://doi.org/10.1016/j.jdsr.2022.06.001
28. Tonetti MS, Lang NP, Cortellini P, Suvan JE, Eickholz P, Fourmousis I, Topoll H, Vangsted T, Wallkamm B. Effects of a single topical doxycycline administration adjunctive to mechanical debridement in patients with persistent/recurrent periodontitis but acceptable oral hygiene during supportive periodontal therapy. J Clin Periodontol. 2012;39(5):475–482. https://doi.org/10.1111/j.1600-051X.2012.01864.x
29. Zheng J, Zhang Y, Zhang S. Sustained release of azithromycin from lipid liquid-crystalline nanoparticles laden in situ gel for the treatment of periodontitis: In vitro and efficacy study. J Biomater Appl. 2022;37(3):482–492. https://doi.org/10.1177/08853282221095395
30. Calderini A, Pantaleo G, Rossi A, Gazzolo D, Polizzi E. Adjunctive effect of chlorhexidine antiseptics in mechanical periodontal treatment: first results of a preliminary case series. Int J Dent Hyg. 2013;11(3):180–185. https://doi.org/10.1111/idh.12009
31. Morikawa S, Watanabe K, Otsuka R, Asoda S, Nakagawa T. Periodontal therapy for localized severe periodontitis in a patient receiving fixed orthodontic treatment: a case report. J Med Case Rep. 2023;17(1):19. https://doi.org/10.1186/s13256-023-03751-1
32. Rosini R, Nicchi S, Pizza M, Rappuoli R. Vaccines Against Antimicrobial Resistance. Front Immunol. 2020;11:1048. https://doi.org/10.3389/fimmu.2020.01048
Об авторах
З. К. ШамановаРоссия
Шаманова Зухра Казимовна - аспирант кафедры стоматологии общей практики
ул. им. Митрофана Седина, д. 4, г. Краснодар, 355063
О. Н. Рисованная
Россия
Рисованная Ольга Николаевна - доктор медицинских наук, доцент, профессор кафедры стоматологии факультета повышения квалификации и профессиональной переподготовки
специалистов
ул. им. Митрофана Седина, д. 4, г. Краснодар, 355063
В. Н. Ленев
Россия
Ленев Вадим Николаевич - кандидат медицинских наук, доцент кафедры стоматологии
ул. Мира, д. 310, г. Ставрополь, 355017
М. Г. Перикова
Россия
Перикова Мария Григорьевна - кандидат медицинских наук, доцент кафедры стоматологии
ул. Мира, д. 310, г. Ставрополь, 355017
О. В. Цымбалов
Россия
Цымбалов Олег Владимирович — доктор медицинских наук, профессор, профессор кафедры хирургической стоматологии и челюстно-лицевой хирургии
ул. им. Митрофана Седина, д. 4, г. Краснодар, 355063
Рецензия
Для цитирования:
Шаманова З.К., Рисованная О.Н., Ленев В.Н., Перикова М.Г., Цымбалов О.В. Микробиологический пейзаж пародонтальных карманов на фоне локальной антибактериальной терапии хронического генерализованного пародонтита: многоцентровое клиническое исследование. Кубанский научный медицинский вестник. 2024;31(2):55-68. https://doi.org/10.25207/1608-6228-2024-31-2-55-68
For citation:
Shamanova Z.K., Risovannaya O.N., Lenev V.N., Perikova M.G., Tsymbalov O.V. Microbial landscape of periodontal pockets against local antibacterial therapy of chronic generalized periodontitis: a multicenter clinical trial. Kuban Scientific Medical Bulletin. 2024;31(2):55-68. (In Russ.) https://doi.org/10.25207/1608-6228-2024-31-2-55-68








































