Перейти к:
Экспрессия гена стресс-индуцированного фосфопротеина 1 (STIP1) при аденомиозе: обсервационное исследование «случай — контроль»
https://doi.org/10.25207/1608-6228-2024-31-4-78-88
Аннотация
Введение. Несмотря на высокую распространенность и существенное влияние эндометриоза на качество жизни и репродуктивное здоровье женщин, до сих пор этиология и существенные моменты патогенеза этого заболевания остаются неопределенными. Современные исследования все больше внимания уделяют иммунным, гормональным и генетическим факторам, имеющим общую структуру и участвующим в общем метаболизме — так называемым однонуклеотидным полиморфизмам (single nucleotide polymorphism — SNP), среди которых выделяется стресс-индуцированный фосфопротеин 1 (stress induced phosphoprotein 1 — STIP1), принимающий участие в тканевом и клеточном метаболизме за счет сплайсинга транскрипции, фолдинга рибонуклеиновой кислоты (РНК). Роль данного белка, также известного как белок — организатор белков теплового шока, активно изучается при онкологических и гиперпролиферативных заболеваниях. Исследования, посвященные изучению роли гена STIP1 и его продукта в патогенезе аденомиоза, недостаточны, что и определяет актуальность данной статьи.
Цель исследования — оценить экспрессию гена стресс-индуцированного фосфопротеина 1 в эутопическом эндометрии и миометрии у женщин с изолированным аденомиозом, а также при сочетании с другими доброкачественными гиперпролиферативными заболеваниями органов репродуктивной системы.
Методы. Место проведения — клинико-диагностическое отделение федерального государственного бюджетного научного учреждения «Научно-исследовательский институт акушерства, гинекологии и репродуктологии имени Д. О. Отта». Дизайн — обсервационное исследование «случай — контроль» пациенток с верифицированными диагнозами «Диффузный аденомиоз», «Миома матки», «Наружный генитальный эндометриоз» (основная группа, n = 55). Основная группа (n = 43) разделялась на три подгруппы: пациентки с изолированным диффузным аденомиозом (АМ, n = 16), аденомиоз в сочетании с миомой матки (АМ + ММ, n = 16), аденомиоз в сочетании с наружным генитальным эндометриозом (АМ + НГЭ, n = 11)), группа сравнения — пациентки с миомой матки (n = 12) и контрольная группа (n = 17) — женщины репродуктивного возраста без гинекологических заболеваний. Период проведения исследования — с 01.11.2022 по 30.09.2023. Целевой показатель исследования — оценка уровня относительной экспрессии мРНК (mRNA) гена STIP1 (в единицах RQ (Relative Quantity)) в матке — железы аденомиоза, окружающий миометрий и эндометрий. Дополнительным показателем являлась гистологическая оценка состояния эндометрия. Статистический анализ полученных результатов, а именно относительный уровень экспрессии мРНК проведен методом ΔΔСt с использованием программы Expression Suit V1.0.3. (https://www.thermofisher.com/ru/ru/home/technical-resources/software-downloads/expressionsuite-software.html). Анализ данных выполнен с помощью программы GraphPad Prizm (Insight Partners, США). Различия между группами оценивали с применением однофакторного ANOVA (с последующими парными post-hoc сравнениями (тест Тьюки) значений в каждой группе. Статистически значимыми считали различия при p < 0.05.
Результаты. Зарегистрирован высокий уровень экспрессии гена STIP1 в миометрии пациенток с изолированным аденомиозом (повышение более чем в 3 раза по отношению к группе сравнения — пациентки с миомой матки). Кроме этого, отмечена более высокая экспрессия данного гена в миометрии женщин с аденомиозом, сочетающимся с миомой матки, по сравнению с пациентками с изолированной миомой матки (p < 0,01). Оценка экспрессии мРНК гена STIP1 в эутопическом эндометрии пациенток с аденомиозом и женщин группы контроля не выявила достоверных различий, однако в эндометрии у женщин с аденомиозом STIP1 оказался значимо ниже, чем в эндометрии как пациенток с миомой матки, так и женщин с аденомиозом в сочетании с наружным генитальным эндометриозом.
Заключение. Повышение экспрессии мРНК гена STIP1 в миометрии при аденомиозе подтверждает его роль в патогенезе данного заболевания. Дальнейшее уточнение роли экспрессии гена STIP1 и соответствующего белка позволит получить дополнительные результаты, оценить его специфичность и чувствительность в качестве диагностического маркера и определить новые подходы к лечению аденомиоза.
Ключевые слова
Для цитирования:
Шалина М.А., Малышева О.В., Ярмолинская М.И., Беганова А.К., Шалина Я.А. Экспрессия гена стресс-индуцированного фосфопротеина 1 (STIP1) при аденомиозе: обсервационное исследование «случай — контроль». Кубанский научный медицинский вестник. 2024;31(4):78-88. https://doi.org/10.25207/1608-6228-2024-31-4-78-88
For citation:
Shalina M.A., Malysheva O.V., Yarmolinskaya M.I., Beganova A.K., Shalina Ya.A. Stress-induced phosphoprotein 1 (STIP1) gene expression in adenomyosis: An observational case-control study. Kuban Scientific Medical Bulletin. 2024;31(4):78-88. (In Russ.) https://doi.org/10.25207/1608-6228-2024-31-4-78-88
ВВЕДЕНИЕ
Роль различных генетических и эпигенетических факторов, влияющих на изменения экспрессии отдельных генов, является предметом внимания многих исследователей при большинстве хронических заболеваний, тем более при такой мультифакториальной патологии с до сих пор не известной этиологией, как эндометриоз (и особенно внутренний генитальный эндометриоз — аденомиоз) [1–3]. Исследований по изучению экспрессии гена cтресс-индуцированного фосфопротеина 1 (stress induced phosphoprotein 1, STIP1) недостаточно, особенно с точки зрения ассоциации этого фактора с развитием различных типов аденомиоза [4][5]. Подобные исследования представляют не только теоретический, но и практический интерес.
Стресс-индуцированный фосфопротеин (STIP1, ген ID 10963; HPRD 05454) — это белок с массой 62,6 кДа, также известный как белок — организатор белков теплового шока (БТШ) (HOP, Hsp70/Hsp90-organizing protein) [6][7]. Он представляет собой ко-шаперон — полипептид, который координирует функции белков БТШ70 и БТШ90 (HSP70 и HSP90) и участвует в регуляции клеточного цикла, сплайсинга РНК, транскрипции, фолдинге белка и передаче сигналов. Роль STIP1 активно изучается при онкологических и гиперпролиферативных заболеваниях [8]. Ряд данных указывает на то, что STIP1 может стимулировать синтез ДНК и усиливать пролиферацию клеток [9]. Повышенная экспрессия STIP1 отмечается при некоторых злокачественных новообразованиях [10–14], среди гинекологической патологии он определен у пациенток с раком яичников и эндометрия, что позволило авторам предложить использование сочетанного определения маркеров CA125 и STIP1 в крови в качестве ранней диагностики этих злокачественных новообразований [15].
В настоящий момент изучением особенностей экспрессии гена STIP1 при наружном генитальном эндометриозе (НГЭ) и аденомиозе посвящено совсем мало исследований. Были представлены работы, в которых сообщалось о повышенном уровне STIP1 в сыворотке крови у женщин с НГЭ, аденомиозом и при сочетании НГЭ с аденомиозом, а также об экспрессии этого гена в эпителии и строме эктопического эндометрия [7]. В исследовании D. Chen et al. (2022) было показано присутствие белка STIP1 во внеклеточных везикулах крови и эктопического эндометрия у пациенток с аденомиозом [4]. Также были получены сведения об ассоциации аллеля G полиморфного варианта rs4980524 гена STIP1 с НГЭ, при этом отмечался более высокий уровень экспрессии STIP1 и матриксной металлопротеиназы 9 (MMP9) у носителей генотипа G/G [5].
В доступной научной литературе отсутствуют результаты исследований по изучению количественных параметров уровня экспрессии гена STIP1 в тканях матки (эндометрий, миометрий) у пациенток с аденомиозом. Оценка экспрессии данного гена в пораженных тканях могла бы привести к использованию этого параметра как потенциального биомаркера аденомиоза, а возможно, и как новой терапевтической мишени для лечения заболевания.
Цель исследования — оценить экспрессию гена STIP1 в эутопическом эндометрии и миометрии у женщин с изолированным аденомиозом и при сочетании с миомой матки и наружным генитальным эндометриозом.
МЕТОДЫ
Дизайн исследования
Исследование выполнено по принципам наблюдательного сравнительного контролируемого исследования по типу «случай — контроль». В работу включены 55 женщин репродуктивного возраста, обратившихся за медицинской помощью в лечебное учреждение с различными жалобами, характерными для аденомиоза, миомы матки, наружного генитального эндометриоза. Также 17 женщин без гинекологических заболеваний, которые в последующем были включены в контрольную группу обратившихся для клинико-лабораторного обследования, в том числе в связи с мужским фактором бесплодия.
Условия проведения исследования
Исследование проводилось на базе клинико-диагностического отделения федерального государственного бюджетного научного учреждения «Научно-исследовательский институт акушерства, гинекологии и репродуктологии имени Д. О. Отта» (ФГБНУ «НИИ АГИР им. Д. О. Отта»). Забор материала: амбулаторный прием или стационарное исследование в зависимости от вида операции — применялась пайпель-биопсия эндометрия (амбулаторно), лечебно-диагностическая лапароскопия и/или гистероскопия (мультифокальная биопсия с забором материала для генетического и морфологического исследования эктопического и эутопического эндометрия). Биоптат, предназначенный для анализа, помещали в консервант (IntactRNA, «Евроген», Россия) и хранили до проведения анализа при температуре –20 °С. Период проведения исследования — с 01.11.2022 по 30.09.2023.
Критерии соответствия
Критерии включения
Для пациенток всех групп: возраст от 18 до 46 лет, подписанное информированное согласие об участии в исследовании;
- для пациенток основной группы: пациентки с верифицированным диагнозом «Диффузный аденомиоз» (АМ) (в том числе: изолированный АМ, с АМ при сочетании с миомой матки, с АМ при сочетании с наружным генитальным эндометриозом I и II степени (классификация Американского общества репродуктивной медицины (пересмотренная) [16]);
- для пациенток группы сравнения: пациентки с верифицированным диагнозом «Миома матки» (ММ) изолированная без аденомиоза (локализация миоматозных узлов — интрамуральная и интрамурально-субсерозная) 3–6-го типов по классификации International Federation of Gynecology and Obstetrics (FIGO) [17];
- для пациенток контрольной группы: женщины с регулярным овуляторным менструальным циклом без гинекологической патологии.
Критерии невключения
Для пациенток всех групп: возраст младше 18 и старше 46 лет, беременность, декомпенсация или наличие тяжелой хронической соматической патологии, наличие онкологических новообразований, воспалительных заболеваний органов малого таза, прием гормональных препаратов за 3 месяца до исследования, оперативные вмешательства по поводу эндометриоза и других сопутствующих заболеваний.
Для пациенток основной группы: остальные формы аденомиоза, выделенные в настоящее время [18][19], кроме диффузного, НГЭ III–IV степени [16], наличие узлов 0, 1, 2, 7-го типов по классификации FIGO, наличие миоматозных узлов 0, 1, 2, 7-го типов по классификации FIGO [17].
Для пациенток группы сравнения: наличие миоматозных узлов 0, 1, 2, 7-го типов по классификации FIGO [17].
Критерии исключения
Для пациенток всех групп: отказ от участия в исследовании; изменение диагноза в процессе проведения исследования; беременность.
Описание критериев соответствия (диагностические критерии)
Постановка диагнозов «диффузный аденомиоз», «миома матки», «наружный генитальный эндометриоз» с последующим отбором пациенток для участия в исследовании осуществлялась на основании действующих клинических рекомендаций1,2. Диагнозы «диффузный аденомиоз» и «миома матки» также подтверждались по результатам комплексной ультразвуковой оценки органов малого таза, магнитно-резонансной томографии (МРТ) органов малого таза, лапароскопии и гистероскопии по разработанным и запатентованным критериям ФГБНУ «НИИ АГИР им. Д. О. Отта»2. Диагноз «наружный генитальный эндометриоз», а также степень его распространения устанавливались интраоперационно во время проведения лечебно-диагностической лапароскопии.
Подбор участников в группы
Изначально в исследование были включены 87 пациенток: основная группа (n = 53), группа сравнения (n = 12), контрольная (n = 23). В ходе дальнейшего отбора из основной группы исключили 10 женщин — несоответствие окончательного диагноза, и 6 из контрольной группы (1 — отказ от участия в исследовании, 2 — сменили место жительства, 3 — в связи с наступлением беременности). Таким образом, всего включены в исследование 72 женщины. После окончательного формирования выборки исследования основная группа была разделена на три подгруппы: женщины с изолированным диффузным аденомиозом (АМ, n = 16), с аденомиозом при сочетании с миомой матки (АМ + ММ, n = 16), с аденомиозом при сочетании с наружным генитальным эндометриозом (АМ + НГЭ, n = 11). Кроме того, была выделена группа сравнения — женщины с миомой матки без эндометриоза (n = 12) и контрольная группа (n = 17) — относительно здоровых женщин без гинекологических заболеваний.
Целевые показатели исследования
Основной показатель исследования
Определить уровень экспрессии мРНК гена STIP1 в миометрии, включающем железы аденомиоза и окружающий миометрий, а также в эндометрии. Показатели относительной экспрессии в работе приведены в единицах RQ (Relative Quantity). Данный параметр показывает, во сколько раз изменена экспрессия целевого гена относительно образца, для которого значение RQ равно 1. В качестве такого случайным образом с использованием программы Expression Suit был выбран образец эндометрия из группы контроля.
Дополнительные показатели исследования
Оценка морфологии гистологических препаратов: соответствие строения эндометрия дню менструального цикла, состояние желез, стромы и сосудистого компонента эндометрия, наличие/отсутствие признаков патологических изменений.
Методы измерения целевых показателей
Этапы подготовки биоматериалов для исследования экспрессии мРНК гена STIP1: гомогенизация, лизис биоматериала → выделение мРНК (набор Pure Link RNA Mini kit (Thermo Fisher Scientific, США)) → обратная транскрипция (набор High Capacity Reverse Transcription Kit (Thermo Fisher Scientific, США)) → ПЦР в режиме реального времени (РВ) (Real-Time PCR System 7500 (Applied Biosystems, США)) — расходные материалы ThermoFisher — TaqMan Gene Expression Assay Hs00428979_m1 для мРНК гена STIP1). Внутренней контроль — валидированный ген MRPL19 (TaqMan Gene Expression Assay Hs00608519_m1).
Морфологическое исследование биоптатов проведено по стандартной методике: эндометрий и/или миометрий → фиксация 10 % нейтральным формалином (рН 7,2) → гистологическая проводка (гистопроцессор Histo-Tek VP1, Япония) → заливка в парафиновые блоки → изготовление срезов (стандартная толщина 3–5 мкм) → классическая окраска гематоксилин-эозином → микроскопия — световой микроскоп Olympus СХ31 (Япония) — окуляр ×10, объективы ×10, ×20, ×40.
Переменные (предикторы, конфаундеры, модификаторы эффекта)
Искажающими факторами с возможным самостоятельным влиянием на результат исследования могли явиться сочетание пролиферативных заболеваний (миома матки, гиперплазия эндометрия, НГЭ) и предшествующие оперативные вмешательства по этому поводу (миомэктомия, цистэктомия по поводу эндометриоидных кист яичников, иссечение эндометриоидных инфильтратов при тяжелом НГЭ). Данные факторы были нивелированы на этапе формирования выборок за счет внесения их в критерии невключения.
Статистические процедуры
Принцип расчета размера выборки
Исследование наблюдательное. Размер выборки предварительно не рассчитывался.
Статистические методы
Статистический анализ полученных результатов, а именно относительный уровень экспрессии мРНК проведен методом ΔΔСt с использованием программы Expression Suit V1.0.3. (https://www.thermofisher.com/ru/ru/home/technical-resources/software-downloads/expressionsuite-software.html). Показатель относительной экспрессии (RQ, relative quantity) высчитывался относительно произвольно выбранного образца эндометрия из группы контроля. Статистический анализ данных был выполнен с помощью программы GraphPad Prizm (Insight Partners, США). Во всех исследованных группах значения RQ прошли тест на нормальность (критерий Колмогорова — Смирнова). Числовые данные в таблицах представлены в виде среднего значения и стандартного отклонения (M ± SD). Различия между группами оценивали с применением однофакторного ANOVA (с последующими парными post-hoc сравнениями (тест Тьюки) значений в каждой группе). Значимыми считали различия при p < 0.05.
РЕЗУЛЬТАТЫ
Формирование выборки (групп) исследования
Отобрано 87 женщин: основная группа (n = 53) — пациентки с верифицированным диагнозом «аденомиоз» (как с изолированным, так и в сочетании с ММ и НГЭ); группа сравнения (n = 12) — пациентки с диагнозом «миома матки» без эндометриоза; контрольная группа (n = 23) — относительно здоровые женщины без гинекологической патологии. На основании данных патогистологического исследования эндометрия из основной группы исключены: 6 пациенток с морфологией гиперплазии эндометрия без атипии, 4 — несоответствие критериям включения окончательной формы аденомиоза (очаговая и кистозная). У трех женщин контрольной группы наступила беременность, две поменяли место жительства и одна отказалась от дальнейшего участия в исследовании. Таким образом, в исследование вошли 72 женщины. Основная группа была разделена на три подгруппы: женщины с изолированным диффузным аденомиозом (АМ, n = 16), с аденомиозом при сочетании с миомой матки (АМ + ММ, n = 16), с аденомиозом при сочетании с НГЭ (АМ + НГЭ, n = 11). Блок-схема дизайна исследования представлена на рисунке 1.
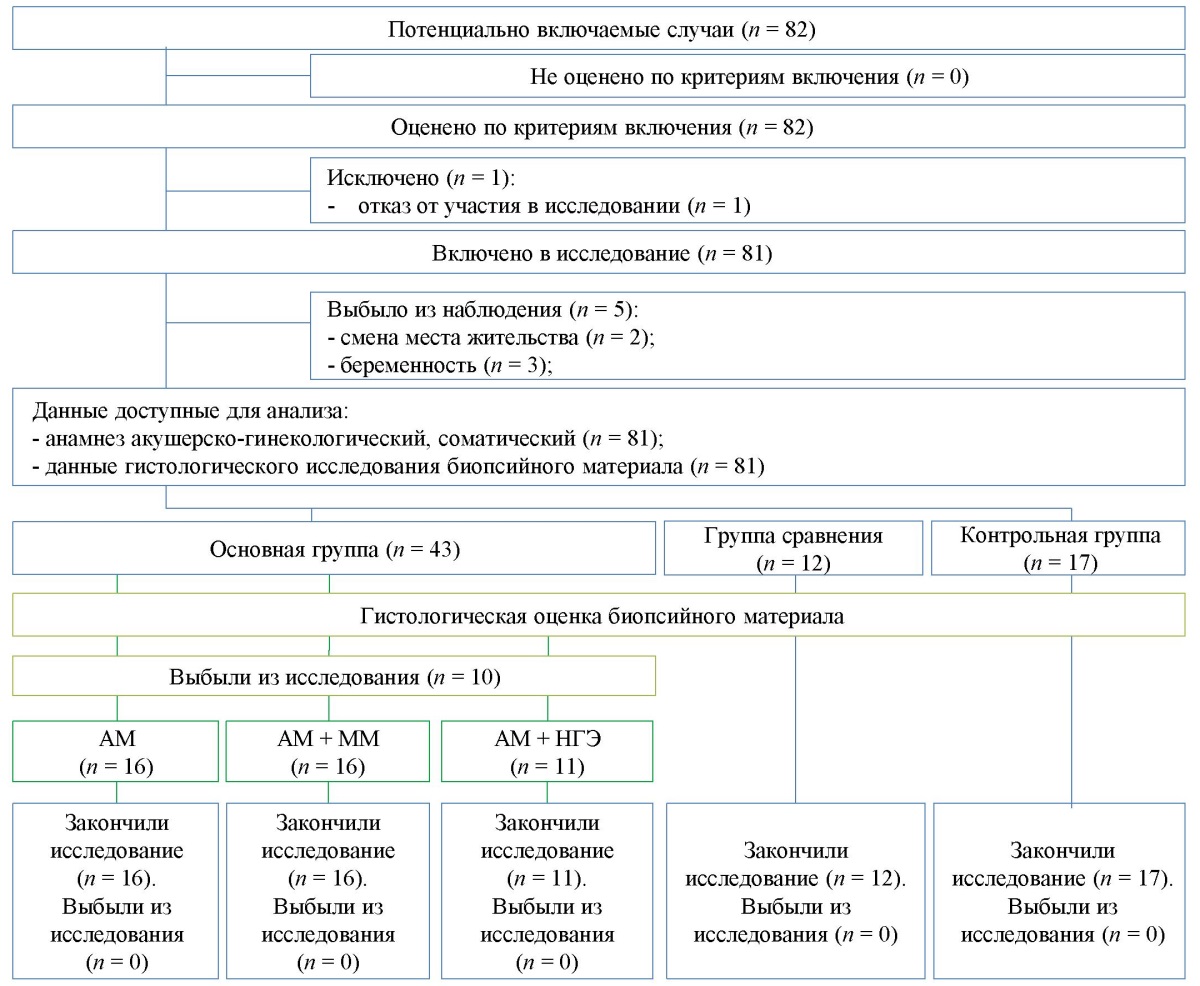
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами (согласно рекомендация, STROBE).
Сокращения: АМ — аденомиоз, ММ — миома матки;
НГЭ — наружный генитальный эндометриоз.
Fig. 1. Schematic diagram of the research design
Note: performed by the authors (according to STROBE recommendations).
Abbreviations: AM — adenomyosis, MM — uterine fibroids;
НГЭ — external genital endometriosis.
Характеристики выборки (групп) исследования
Пациенты, включенные в исследование, всех групп были сопоставимы по возрасту, индексу массы тела (ИМТ). Средний возраст 35,8 ± 5,6 года, средний ИМТ 22,2 ± 2,2 кг/м². При сравнении между группами достоверно не отличались (p > 0,05). Также мы не выявили значимых различий между группами по возрасту менархе, продолжительности менструальных выделений и другим показателям, представленным в таблице 1. Из основной группы (пациентки с изолированным аденомиозом и в сочетании с миомой матки или с НГЭ) клинические проявления оцениваемой патологии наблюдались у всех исследуемых. В основном наблюдались нарушения овариально-менструального цикла: аномальные маточные кровотечения по типу обильных менструальных кровотечений (49,7 %), межменструальные кровотечения (30,0 %), болевой синдром с дисменореей (94,0 %), диспареунией (45,0 %), хроническими тазовыми болями (28,0 %). Следует отметить частое сочетание указанных жалоб при обследовании пациенток.
Таблица 1. Средние значения (М ± SD) и доли (%) некоторых клинических показателей
пациенток в исследуемых группах
Table 1. Mean values (M ± SD) and proportions (%) of some clinical parameters
of the patients in the studied groups
|
Показатель |
Основная группа (n = 43) |
Группа сравнения (n = 12) |
Контрольная группа (n = 17) |
||
|
АМ (n = 16) |
АМ + ММ (n = 16) |
АМ + НГЭ (n = 11) |
|||
|
Возраст, лет; М ± SD |
34,5 ± 6,9 |
36,7 ± 6,8 |
34,8 ± 3,9 |
34,8 ± 3,9 |
36,7 ± 6,8 |
|
ИМТ, кг/м²; М ± SD |
22,4 ± 2,3 |
22,1 ± 2,0 |
22,0 ± 1,5 |
22,0 ± 1,5 |
22,1 ± 2,0 |
|
Возраст менархе, лет; М ± SD |
12,6 ± 1,1 |
12,6 ± 1,0 |
13,6 ± 0,9 |
13,6 ± 0,9 |
12,6 ± 1,0 |
|
Продолжительность менструальных выделений, дней; М ± SD |
6,0 ± 1,1 |
6,5 ± 0,8 |
6,0 ± 1,2 |
6,0 ± 1,2 |
6,5 ± 0,8 |
|
Длительность менструального цикла, дней; М ± SD |
28,5 ± 1,9 |
27,9 ± 1,7 |
27,9 ± 1,9 |
27,9 ± 1,9 |
27,9 ± 1,7 |
|
Регулярный менструальный цикл, % |
98 |
98 |
100 |
100 |
98 |
|
Олигоменорея, % |
2 |
0 |
0 |
2 |
0 |
Примечания: таблица составлена авторами;
статистически значимых различий между группами
не выявлено ни по одному из параметров (р > 0,05).
Сокращения: ИМТ — индекс массы тела; АМ — аденомиоз,
ММ — миома матки; НГЭ — наружный генитальный эндометриоз.
Notes: the table compiled by the authors; no statistically significant differences
between the groups were revealed in any of the parameters (p > 0.05).
Abbreviations: ИМТ — body mass index; AM — adenomyosis,
MM — uterine fibroids; НГЭ — external genital endometriosis.
При проведении лапароскопии у пациенток подгруппы АМ+НГЭ (n = 11) НГЭ I степени диагностирован у 4 (36,4 %) больных, НГЭ II степени — у 7 (63,6 %). Диагноз НГЭ у всех пациенток был установлен впервые, сочетание с экстрагенитальными формами заболевания не отмечено.
Основные результаты исследования
Уровень экспрессии мРНК гена STIP1 методом ОТ-РВ-ПЦР был проанализирован в эндометрии у всех женщин, а в миометрии — у пациенток основной группы (изолированный аденомиоз, сочетание АМ и ММ) и группы сравнения.
Экспрессия мРНК гена STIP1 в миометрии
При исследовании миометрия выявлено достоверное повышение экспрессии гена STIP1 в группе пациенток с аденомиозом более чем в 3 раза (1,84 ± 0,38, p < 0,001) по сравнению с этим показателем в группе с ММ. Также экспрессия гена STIP1 была достоверно увеличена в миометрии пациенток с АМ при сочетании с ММ (1,32 ± 0,56) по сравнению с пациентками с ММ (0,51 ± 0,26, p < 0,01). Не зарегистрировано зависимости уровня экспрессии гена STIP1 в миометрии от фазы менструального цикла (табл. 2, рис. 2).
Таблица 2. Относительный уровень экспрессии (RQ) гена STIP1 в миометрии
у пациенток обследованных групп
Table 2. Relative expression level (RQ) of STIP1 gene in myometrium
in patients of the studied groups
|
Группа пациенток |
Относительный уровень экспрессии STIP1 в миометрии (RQ) |
|
Основная группа (n = 43) |
|
|
АМ (n = 16) |
1,84 ± 0,38*** |
|
АМ + ММ (n = 16) |
1,32 ± 0,56*** |
|
АМ + НГЭ (n = 11) |
Исследование не проводилось |
|
Группа сравнения (n = 12) |
0,51 ± 0,26 |
|
Контрольная группа (n = 17) |
Исследование не проводилось |
Примечания: таблица составлена авторами;
*** — p < 0,001 по сравнению с миометрием пациенток с миомой матки (тест Тьюки);
по результату ANOVA при сравнении трех групп, р < 0,0001.
Сокращения: АМ — аденомиоз, ММ — миома матки;
НГЭ — наружный генитальный эндометриоз;
RQ (relative quantity) — относительное количество.
Notes: the table compiled by the authors;
*** — p < 0.001 compared with myometrium of patients with uterine fibroid (Tukey test);
according to ANOVA when comparing the three groups, p < 0.0001.
Abbreviations: AM — adenomyosis, MM — uterine fibroids;
НГЭ — external genital endometriosis; RQ — relative quantity.
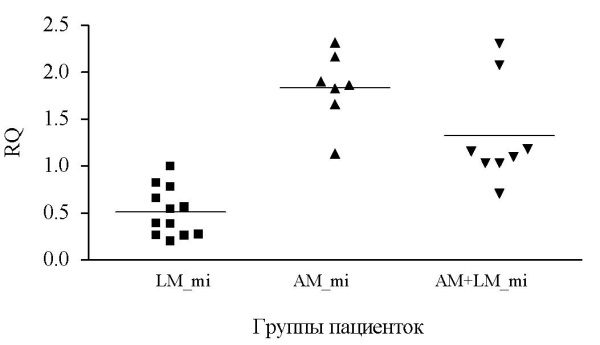
Рис. 2. Экспрессия гена STIP1 в миометрии у пациенток исследуемых групп
Примечания: рисунок выполнен авторами.
Сокращения: LM_mi — миометрий у пациенток с миомой матки;
АМ_mi — миометрий у пациенток с аденомиозом;
АМ+LM_mi — миометрий у пациенток с аденомиозом и миомой матки;
RQ (relative quantity) — относительное количество.
Fig. 2. STIP1 gene expression in the myometrium in patients of the studied groups
Notes: performed by the authors.
Abbreviations: AM_mi — myometrium in patients with adenomyosis;
AM+LM_mi — myometrium in patients with adenomyosis and uterine fibroids;
LM_mi — myometrium in patients with uterine fibroids;
RQ (relative quantity) — relative quantity.
Использование в качестве группы сравнения образцов миометрия от пациенток с ММ продиктовано сложностью сбора коллекции интактного миометрия здоровых женщин. Выполнение биопсии миометрия у пациенток, не страдающих гинекологическими заболеваниями, весьма нежелательно, так как происходящее при заборе материала повреждение переходной зоны может повлечь за собой негативные последствия для пациенток в будущем и этически неприемлемо. Кроме того, для получения достоверной информации, необходимо выполнение именно полифокальной биопсии миометрия (в области дна, трубных углов, по передней, задней стенкам матки и перешейка, всего в среднем 6 биоптатов), меньшее количество гистологических образцов является менее информативным и недостаточным для подтверждения диагноза [17]. Выполнение биопсии миометрия у пациенток с аденомиозом также связано с повреждением переходной зоны, которое может быть причиной дальнейшего прогрессирования патологического процесса. Биопсия миометрия с исследовательской целью может нанести ущерб здоровью пациенток и не может широко рекомендоваться к использованию. По указанным причинам следует отметить низкую частоту выполнения полифокальной биопсии миометрия в клинической практике.
Экспрессия гена STIP1 в эндометрии
Результаты данного исследования показали снижение (в среднем в 1,4 ± 0,1 раза) экспрессии мРНК гена STIP1 в эндометрии у женщин с установленным диагнозом «аденомиоз» по сравнению с пациентками с миомой матки без эндометриоза, а также с подгруппой АМ + НГЭ. При этом не было отмечено значимых различий в уровне экспрессии гена STIP1 при сравнении между всеми группами пациенток с АМ и контролем (табл. 3, рис. 3). Экспрессия гена STIP1 в эндометрии также существенно отличалась в зависимости от фазы менструального цикла.
Таблица 3. Относительный уровень экспрессии (RQ) гена STIP1 в эндометрии
у женщин обследуемых групп
Table 3. Relative expression level (RQ) of STIP1 gene in endometrium
in women of the studied groups
|
Группа пациенток |
Относительный уровень экспрессии STIP1 в миометрии (RQ) |
|
Основная группа (n = 43) |
|
|
АМ (n = 16) |
0,78 ± 0,46** |
|
АМ + ММ (n = 16) |
0,86 ± 0,39 |
|
АМ + НГЭ (n = 11) |
1,10 ± 0,42 |
|
Группа сравнения (n = 12) |
1,07 ± 0,62 |
|
Контрольная группа (n = 17) |
0,96 ± 0,50 |
Примечания: таблица составлена авторами;
** — р < 0,01 по сравнению с эндометрием пациенток
группы сравнения и АМ + НГЭ (тест Тьюки);
по результатам ANOVA при сравнении пяти групп p < 0,001.
Сокращения: АМ — аденомиоз, ММ — миома матки;
НГЭ — наружный генитальный эндометриоз;
RQ (relative quantity) — относительное количество.
Notes: the table compiled by the authors;
** — p < 0.01 compared with endometrium of patients
in the comparison group and AM + EGE (Tukey test);
according to ANOVA when comparing the three groups, p < 0.0001.
Abbreviations: AM — adenomyosis, MM — uterine fibroids;
НГЭ — external genital endometriosis (EGE); RQ — relative quantity.
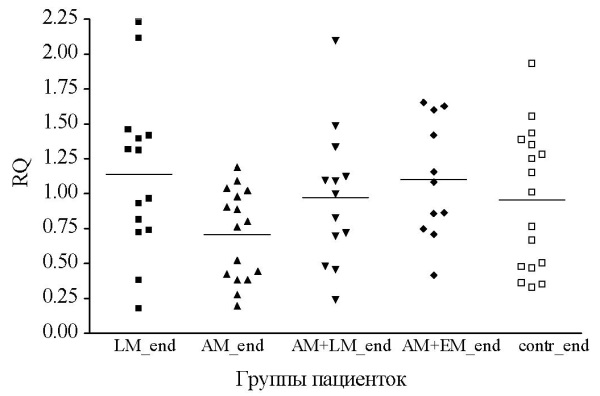
Рис. 3. Уровень экспрессии гена STIP1 в эндометрии пациенток исследуемых групп
Примечания: рисунок выполнен авторами.
Сокращения: LM_end — эндометрий пациенток группы сравнения;
АМ_end — эндометрий у пациенток с аденомиозом;
АМ+LM_end — эндометрий у пациенток с аденомиозом и миомой матки;
АМ+EM_end — эндометрий пациенток аденомиозом
и наружным генитальным эндометриозом;
contr_end — эндометрий женщин контрольной группы.
Fig. 3. STIP1 gene expression level in the endometrium of patients of the studied groups
Notes: performed by the authors.
Abbreviations: LM_end — endometrium of patients in the comparison group;
AM_end — endometrium of patients with adenomyosis;
AM+LM_end — endometrium in patients with adenomyosis and uterine fibroids;
AM+EM_end — endometrium of patients with adenomyosis
and external genital endometriosis;
contr_end — endometrium of women in the control group.
Дополнительные результаты исследования
Результаты оценки морфологии эндометрия: у большинства женщин было выявлено соответствие гистологической картины фазам менструального цикла, соответствующим времени забора материала: 39 (54,2 %) женщин — пролиферативная фаза (с 5 по 14 день), 33 (45,8 %) — секреторная (с 16 по 26 день МЦ). При сравнении показателей отдельных групп анализ биоптатов эндометрия проводился в соответствующие фазы МЦ с практически равным распределением по количеству женщин в группах, р > 0,05 (табл. 4).
Таблица 4. Абсолютное количество и доли распределения образцов эндометрия
в зависимости от фазы менструального цикла у пациенток исследуемых групп
Table 4. Absolute number and distribution of endometrial samples
depending on the menstrual cycle phase in patients of the studied groups
|
Группа таблицеФаза менструального цикла |
Основная группа (n = 43) |
Группа сравнения (n = 12) |
Контрольная группа (n = 17) |
|||||||
|
АМ (n = 16) |
АМ + ММ (n = 16) |
АМ + НГЭ (n = 11) |
||||||||
|
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% |
|
|
Пролиферативная фаза (с 5 по 14 день цикла) |
8 |
50 |
9 |
56,3 |
6 |
54,5 |
6 |
50 |
10 |
58,8 |
|
Секреторная фаза (с 16 по 26 день цикла) |
8 |
50 |
7 |
43,7 |
5 |
45,5 |
6 |
50 |
7 |
41,2 |
|
Уровень значимости |
р > 0,05** |
р > 0,05** |
р > 0,05* |
р > 0,05** |
р > 0,05** |
|||||
Примечания: таблица составлена авторами;
* — по точному критерию Фишера, ** — по критерию хи-квадрат с поправкой Йейтса.
Сокращения: АМ — аденомиоз, ММ — миома матки;
НГЭ — наружный генитальный эндометриоз.
Notes: the table compiled by the authors;
* — by Fisher’s exact test, ** — by Chi-square test with Yates correction.
Abbreviations: AM — adenomyosis, MM — uterine fibroids;
НГЭ — external genital endometriosis.
При оценке морфологии миометрия отмечается характерное строение очагов аденомиоза с сочетанием железистого эндометриоподобного эпителия и цитогенной стромы. Соотношение стромы и железистых элементов в очагах аденомиоза может быть различным. В зависимости от степени распространения аденомиоза в миометрии обнаруживаются единичные или множественные эндометриоидные гетеротопии. В данном исследовании имелись трудности при выполнении мультифокальной биопсии миометрия, в том числе по причине невозможности получения большого объема материала, что часто не позволяет по количеству и размерам эндометриоидных гетеротопий в миометрии говорить о распространении процесса.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
В результате проведенного исследования выявлено статистически значимое (по сравнению с показателем в группе с миомой матки) повышение уровня экспрессии гена STIP1 в миометрии пациенток с изолированным аденомиозом. Кроме этого, выявлено значимое увеличение экспрессии данного гена в миометрии пациенток с аденомиозом при сочетании с миомой матки по сравнению с пациентками только с миомой матки без эндометриоза. Эти данные подтверждают роль продуцируемого в миометрии белка STIP1 в патогенезе исследуемой патологии. В уровне экспрессии гена STIP1 в эндометрии при сравнении всех подгрупп пациенток основной и контрольной группы не выявлено статистически значимых отличий, поэтому в практической деятельности в качестве диагностического маркера развития аденомиоза и прогноза агрессивности течения заболевания данный показатель использовать нецелесообразно.
Ограничения исследования
Сравнительная доступность эндометрия сделала возможным проведение данного исследования во всех группах обследуемых женщин, в том числе и в контрольной, в то же время мы столкнулись с трудностями получения образцов миометрия у женщин контрольной группы, что было обсуждено ранее. Сложности с набором контрольной группы для оценки изменений миометрия при самых разных видах гинекологической патологии встречаются и у других исследователей. Так, в работе S. Qi et al. [20] в качестве контрольной группы объектом для исследований был эндометрий, а не миометрий. В другом исследовании [21] было сравнение миометрия при аденомиозе с миометрием группы сравнения, в которой проводилась плановая гистерэктомия. Показаниями к операции у этой группы явились: пролапс тазовых органов, аномальное маточное кровотечение (без указания истинных причин), доброкачественные опухоли яичников, цервикальная интраэпителиальная неоплазия. Безусловно, такая разнородная группа не может рассматриваться как адекватный контроль. По причине сложности набора групп сравнения исследователи часто включают в них пациенток с различными видами гинекологической патологии только на основании отсутствия у них аденомиоза. Возможно, в качестве контрольной группы можно использовать миометрий пациенток, у которых подозревался аденомиоз методами неинвазивной оценки, например по данным УЗИ, но при выполнении мультифокальной биопсии миометрия дианоз не подтвердился. Однако отсутствие эндометриоидных очагов в биоптате миометрия может быть связано с погрешностями при взятии материала, техникой проведения трепан-биопсии и не исключает их наличия в окружающем миометрии. С нашей точки зрения, группу сравнения могут составить пациентки без аденомиоза, но с другой гинекологической патологией. В данном исследовании такая группа сравнения была сформирована — это пациентки с миомой матки.
К ограничениям следует отнести и небольшие выборки оценки эндометрия и миометрия в зависимости от фазы менструального цикла. Возможно, взятие материала в определенные дни менструального цикла у всех пациентов унифицировало полученные данные и привело к увеличению выборок.
Интерпретация результатов исследования
Изучению роли STIP1 посвящено большое количество исследований в области биологии гиперпролиферативных и онкологических заболеваний [8]. Исследователи в основном изучают белок, продукт гена STIP1. Ряд данных указывает на то, что STIP1 может стимулировать синтез ДНК и усиливать пролиферацию клеток [9]. Уровень экспрессии STIP1 и его количество в сыворотке крови прямо коррелируют с опухолевой прогрессией, метастазированием, негативным прогнозом и рецидивированием при различных видах рака [11][12][22]. В то же время исследования, посвященные изучению STIP1 в патогенезе гиперпролиферативных заболеваний органов женской репродуктивной системы, в том числе аденомиоза, немногочисленны.
В доступных научных литературных источниках нет информации об исследованиях, посвященных количественной оценке экспрессии мРНК гена STIP1 в эндометрии или миометрии у пациенток с аденомиозом, что и определяет актуальность нашей работы, внося вклад в расширение представлений о патогенетических особенностях этой патологии, что может представлять не только теоретический, но и практический интерес для клиницистов в плане диагностики заболевания и даже распространенности и степени тяжести процесса.
Наше исследование показало диагностически значимое (более чем в 3 раза по сравнению с группой с пациенток миомой матки без эндометриоза) повышение экспрессии мРНК гена STIP1 в миометрии пациенток с изолированным аденомиозом. Также отмечался рост экспрессии данного показателя в миометрии женщин с АМ при сочетании с миомой матки (по сравнению с пациентками с миомой матки без эндометриоза) (p < 0,01). Вышеперечисленные результаты подтверждают роль белка STIP1 в патогенезе группы заболеваний, связанных в эндометриальной гетеротопией. Также выявленный статистически значимый рост экспрессии гена STIP1 в миометрии у пациенток с АМ и АМ + НГЭ может свидетельствовать о высокой пролиферативной активности, характерной для тканей с диффузным аденомиозом. По данным литературы [7], при аденомиозе белок STIP1 при иммуногистохимическом исследовании определяется в эпителиальных и стромальных клетках эктопического эндометрия. Полученные данные настоящего исследования также показали пониженную при аденомиозе экспрессию гена STIP1 (RQ 0,78 ± 0,46) в эутопическом эндометрии, при этом в миометрии без эндометриоза (группа сравнения) этот показатель был еще ниже (RQ 0,51 ± 0,50). В связи с этим можно предположить, что у больных аденомиозом гиперэкспрессия данного гена в миометрии (а также АМ + ММ и АМ + НГЭ) обеспечивается присутствием эктопического эндометрия и является характерной особенностью этой патологии. Эти результаты согласуются с данными других исследований, которые были получены при иммуногистохимической оценке белка STIP1 в эктопическом эндометрии [7][12].
Несмотря на ожидания, что оценка экспрессии гена STIP1 в эндометрии у пациенток с аденомиозом может быть использована в качестве прогностического маркера развития и прогрессирования этой патологии, данные предположения в настоящий момент не нашли подтверждения: отсутствовали значимые отличия в уровне экспрессии гена STIP1 в эндометрии при сравнении всех подгрупп пациенток с аденомиозом и контрольной группой. При этом особый интерес представляет обнаружение статистически значимых различий в экспрессии гена STIP1 в эндометрии между двумя подгруппами пациенток с изолированным аденомиозом и с аденомиозом при сочетании с НГЭ. В настоящее время принято считать, что эти формы заболевания различаются по локализации патологического процесса (так называемый «внутренний» и «наружный» аденомиоз), факторам риска (например, наличию внутриматочных вмешательств) и ряду других характеристик [19]. Весьма вероятно, что нам удалось выявить снижение экспрессии STIP1 как характерную особенность эутопического эндометрия при классическом диффузном аденомиозе («внутреннем» аденомиозе), однако это предположение нуждается в дополнительных доказательствах.
ЗАКЛЮЧЕНИЕ
Проведенное сравнительное наблюдательное исследование показало повышенную экспрессию мРНК гена STIP1 в миометрии пациенток с аденомиозом, что подтверждает роль этого белка в патогенезе данного заболевания. Гиперэкспрессия белка STIP1 в миометрии пациенток с аденомиозом, по-видимому, обусловлена присутствием очагов эктопического эндометрия с высокой пролиферативной активностью. Дальнейшее изучение экспрессии гена STIP1 при обследовании большего числа однородных групп позволит получить дополнительные результаты и определить новые подходы к лечению заболевания.
1. Эндометриоз. Клинические рекомендации. 2020. Available: https://disuria.ru/_ld/10/1002_kr20N80mz.pdf?ysclid=lz8r454ixm786495884
Миома матки. Клинические рекомендации. 2020. Available: https://disuria.ru/_ld/10/1034_kr20D25D26MZ.pdf?ysclid=lz8r540a87524721117
2. Патент на изобретение. RU 2764106. Нагорнева С. В., Шалина М. А., Ярмолинская М. И., Коган И. Ю., Цыпурдеева А. А., Нетреба Е. А., Прохорова В. С. Способ диагностики аденомиоза. Заявка № 2021101704 от 26.01.2021. Опубликовано 13.01.2022.
Патент на изобретение. RU 2787804 C1. Нагорнева С. В., Ярмолинская М. И., Шалина М. А. Способ дифференциальной диагностики узловой формы аденомиоза и миомы матки. Заявка № 2021125244 от 25.08.2021. Опубликовано 12.01.2023.
Список литературы
1. Малышева О.В., Ярмолинская М.И. Генетические детерминанты аденомиоза. Акушерство и гинекология. 2023;4:20–27. https://dx.doi.org/10.18565/aig.2023.52
2. Chen T, Xu Y, Xu X, Wang J, Qiu Z, Yu Y, Jiang X, Shao W, Bai D, Wang M, Mei S, Cheng T, Wu L, Gao S, Che X. Comprehensive transcriptional atlas of human adenomyosis deciphered by the integration of single-cell RNA-sequencing and spatial transcriptomics. Protein Cell. 2024;15(7):530–546. https://doi.org/10.1093/procel/pwae012
3. Адамян Л.В., Кузнецова М.В., Пивазян Л.Г., Давыдова Ю.Д., Трофимов Д.Ю. Генетические аспекты эндометриоза и аденомиоза: современный взгляд на проблему. Проблемы репродукции. 2023;29(4–2):14–22. https://doi.org/10.17116/repro20232904214
4. Chen D, Zhou L, Qiao H, Wang Y, Xiao Y, Fang L, Yang B, Wang Z. Comparative proteomics identify HSP90A, STIP1 and TAGLN-2 in serum extracellular vesicles as potential circulating biomarkers for human adenomyosis. Exp Ther Med. 2022;23(6):374. https://doi.org/10.3892/etm.2022.11301
5. Tsai CL, Lee YS, Chao A, Yen CF, Wang HS, Wang TH. Associations between a single nucleotide polymorphism of stress-induced phosphoprotein 1 and endometriosis/adenomyosis. Taiwan J Obstet Gynecol. 2018;57(2):270–275. https://doi.org/10.1016/j.tjog.2018.03.001
6. Baindur-Hudson S, Edkins AL, Blatch GL. Hsp70/Hsp90 organising protein (hop): beyond interactions with chaperones and prion proteins. Subcell Biochem. 2015;78:69–90. https://doi.org/10.1007/978-3-31911731-7_3
7. Wang HS, Tsai CL, Chang PY, Chao A, Wu RC, Chen SH, Wang CJ, Yen CF, Lee YS, Wang TH. Positive associations between upregulated levels of stress-induced phosphoprotein 1 and matrix metalloproteinase-9 in endometriosis/adenomyosis. PLoS One. 2018;13(1):e0190573. https://doi.org/10.1371/journal.pone.0190573
8. da Fonseca ACC, Matias D, Geraldo LHM, Leser FS, Pagnoncelli I, Garcia C, et al. The multiple functions of the co-chaperone stress inducible protein 1. Cytokine & Growth Factor Reviews. 2021;57:73–84. http://dx.doi.org/10.1016/j.cytogfr.2020.06.003
9. Chao A, Tsai CL, Wei PC, Hsueh S, Chao AS, Wang CJ, Tsai CN, Lee YS, Wang TH, Lai CH. Decreased expression of microRNA-199b increases protein levels of SET (protein phosphatase 2A inhibitor) in human choriocarcinoma. Cancer Lett. 2010;291(1):99–107. https://doi.org/10.1016/j.canlet.2009.10.005
10. Zhang S, Shao J, Su F. Prognostic significance of STIP1 expression in human cancer: A meta-analysis. Clin Chim Acta. 2018;486:168–176. https://doi.org/10.1016/j.cca.2018.07.037
11. Carta F, Demuro PP, Zanini C, Santona A, Castiglia D, D’Atri S, Ascierto PA, Napolitano M, Cossu A, Tadolini B, Turrini F, Manca A, Sini MC, Palmieri G, Rozzo AC; Italian Melanoma Intergroup. Analysis of candidate genes through a proteomics-based approach in primary cell lines from malignant melanomas and their metastases. Melanoma Res. 2005;15(4):235–244. https://doi.org/10.1097/00008390-200508000-00002
12. Sun W, Xing B, Sun Y, Du X, Lu M, Hao C, Lu Z, Mi W, Wu S, Wei H, Gao X, Zhu Y, Jiang Y, Qian X, He F. Proteome analysis of hepatocellular carcinoma by two-dimensional difference gel electrophoresis: novel protein markers in hepatocellular carcinoma tissues. Mol Cell Proteomics. 2007;6(10):1798–1808. https://doi.org/10.1074/mcp.M600449-MCP200
13. Erlich RB, Kahn SA, Lima FR, Muras AG, Martins RA, Linden R, Chiarini LB, Martins VR, Moura Neto V. STI1 promotes glioma proliferation through MAPK and PI3K pathways. Glia. 2007;55(16):16901698. https://doi.org/10.1002/glia.20579. PMID: 17886292.
14. Jing Y, Liang W, Liu J, Zhang L, Wei J, Zhu Y, Yang J, Ji K, Zhang Y, Huang Z. Stress-induced phosphoprotein 1 promotes pancreatic cancer progression through activation of the FAK/AKT/MMP signaling axis. Pathol Res Pract. 2019;215(11):152564. https://doi.org/10.1016/j.prp.2019.152564
15. Chao A, Liao MJ, Chen SH, Lee YS, Tsai CN, Lin CY, Tsai CL. JAK2-Mediated Phosphorylation of Stress-Induced Phosphoprotein-1 (STIP1) in Human Cells. Int J Mol Sci. 2022;23(5):2420. https://doi.org/10.3390/ijms23052420
16. Revised American Society for Reproductive Medicine classification of endometriosis: 1996. Fertil Steril. 1997;67(5):817–821. https://doi.org/10.1016/s0015-0282(97)81391-x
17. Munro MG, Critchley HO, Broder MS, Fraser IS; FIGO Working Group on Menstrual Disorders. FIGO classification system (PALM-COEIN) for causes of abnormal uterine bleeding in nongravid women of reproductive age. Int J Gynaecol Obstet. 2011;113(1):3–13. https://doi.org/10.1016/j.ijgo.2010.11.011
18. International working group of AAGL, ESGE, ESHRE and WES; Tomassetti C, Johnson NP, Petrozza J, Abrao MS, Einarsson JI, Horne AW, Lee TTM, Missmer S, Vermeulen N, Zondervan KT, Grimbizis G, De Wilde RL. An international terminology for endometriosis, 2021. J Minim Invasive Gynecol. 2021;28(11):1849–1859. https://doi.org/10.1016/j.jmig.2021.08.032
19. Ярмолинская М.И., Шалина М.А., Нагорнева С.В. Аденомиоз: Современные подходы к классификации. Журнал акушерства и женских болезней. 2023;72(1):97–108. http://dx.doi.org/10.17816/jowd121307
20. Qi S, Zhao X, Li M, Zhang X, Lu Z, Yang C, Zhang C, Zhang H, Zhang N. Aberrant expression of Notch1/numb/snail signaling, an epithelial mesenchymal transition related pathway, in adenomyosis. Reprod Biol Endocrinol. 2015;13:96. https://doi.org/10.1186/s12958-015-0084-2
21. Huang TS, Chen YJ, Chou TY, Chen CY, Li HY, Huang BS, Tsai HW, Lan HY, Chang CH, Twu NF, Yen MS, Wang PH, Chao KC, Lee CC, Yang MH. Oestrogen-induced angiogenesis promotes adenomyosis by activating the Slug-VEGF axis in endometrial epithelial cells. J Cell Mol Med. 2014;18(7):1358–1371. https://doi.org/10.1111/jcmm.12300
22. Zhang S, Shao J, Su F. Prognostic significance of STIP1 expression in human cancer: A meta-analysis. Clin Chim Acta. 2018;486:168–176.
Об авторах
М. А. ШалинаРоссия
Шалина Мария Александровна* — кандидат медицинских наук, старший научный сотрудник отдела гинекологии и эндокринологии
лн. Менделеевская, д. 3, г. Санкт-Петербург, 199034
О. В. Малышева
Россия
Малышева Ольга Викторовна — старший научный сотрудник лаборатории геномики
лн. Менделеевская, д. 3, г. Санкт-Петербург, 199034
М. И. Ярмолинская
Россия
Ярмолинская Мария Игоревна — доктор медицинских наук, профессор, профессор Российской Академии наук, руководитель отдела гинекологии и эндокринологии, руководитель центра «Диагностики и лечения эндометриоза»
лн. Менделеевская, д. 3, г. Санкт-Петербург, 199034
А. К. Беганова
Беганова Александра Камильевна — младший научный сотрудник отдела гинекологии и эндокринологии
лн. Менделеевская, д. 3, г. Санкт-Петербург, 199034
Я. А. Шалина
Россия
Шалина Яна Александровна — лаборант лаборатории молекулярной генетики и генной терапии
лн. Менделеевская, д. 3, г. Санкт-Петербург, 199034
Дополнительные файлы
Рецензия
Для цитирования:
Шалина М.А., Малышева О.В., Ярмолинская М.И., Беганова А.К., Шалина Я.А. Экспрессия гена стресс-индуцированного фосфопротеина 1 (STIP1) при аденомиозе: обсервационное исследование «случай — контроль». Кубанский научный медицинский вестник. 2024;31(4):78-88. https://doi.org/10.25207/1608-6228-2024-31-4-78-88
For citation:
Shalina M.A., Malysheva O.V., Yarmolinskaya M.I., Beganova A.K., Shalina Ya.A. Stress-induced phosphoprotein 1 (STIP1) gene expression in adenomyosis: An observational case-control study. Kuban Scientific Medical Bulletin. 2024;31(4):78-88. (In Russ.) https://doi.org/10.25207/1608-6228-2024-31-4-78-88








































