Перейти к:
Вакцинация при латентных формах папилломавирусной инфекции: экспериментальное рандомизированное проспективное открытое контролируемое исследование
https://doi.org/10.25207/1608-6228-2024-31-4-30-41
Аннотация
Введение. Вирус папилломы человека является одной из наиболее распространенных инфекций, передающихся половым путем, при этом бóльшая часть вирусов, находясь в организме хозяина, представляют собой транзиторное носительство, так называемые латентные формы папилломавирусной инфекции. Персистирование вируса папилломы человека высокого канцерогенного риска способно привести к развитию цервикальных интраэпителиальных неоплазий, а в последующем и рака шейки матки. До сих пор меры вторичной профилактики рака шейки матки при латентных формах папилломавирусной инфекции не разработаны, что и определило проведение данного исследования.
Цель исследования — повысить эффективность вторичной профилактики рака шейки матки путем совершенствования алгоритма менеджмента латентных форм папилломавирусной инфекции у женщин.
Методы. Проведено рандомизированное контролируемое исследование 152 пациенток с диагнозом «Латентная форма папилломавирусной инфекции». Обследование пациенток и анализ данных осуществлялись на клинических базах кафедры акушерства, гинекологии и перинатологии федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации в 2020–2024 гг. В исследование включали пациенток в возрасте от 18 до 35 лет. Пациентки методом «конвертов» были распределены на 2 группы: I группа (сравнения) (n = 74) — микробиологическая санация цервиковагинальной зоны (по показаниям) и наблюдение на протяжении 36 месяцев с ежегодным контролем вирусной нагрузки, кольпоскопией и онкоцитологией; II (основная) группа (n = 78) — микробиологическая санация цервиковагинальной зоны (по показаниям) и назначение квадривалентной рекомбинантной вакцины против вируса папилломы человека (6, 11, 16, 18-го типов) (внутримышечно 3 дозы: вторая и третья дозы вводились через 1 и 3 месяца после первой). У каждой пациентки анализировалась эффективность профилактической терапии по динамике показателей: кольпоскопия, цитологическое (окрашивание по Папаниколау), молекулярно-биологическое (полимеразная цепная реакция). Представленные показатели оценивались через 12, 24 и 36 месяцев. Статистический анализ результатов исследования проводили с помощью программ вариационной статистики IBM SPSS Statistics 26 Version (IBM, USA).
Результаты. Анализируя полученные данные, следует отметить, что вакцинация квадривалентной рекомбинантной вакциной против вирусов папилломы человека 6, 11, 16, 18-го типов на фоне коррекции дисбиотических вагинальных и цервикальных нарушений при латентных формах папилломавирусной инфекции у женщин позволила уменьшить (по сравнению с группой наблюдения) в 9,3 раза реализацию латентного персистирования вирусов в субклинические (25,7 % в I группе против 9,0 % во II группе) и клинические формы папилломавирусной инфекции (цервикальная интраэпителиальная неоплазия) — 12,1 % в I группе против 1,3 % во II группе, снизить персистенцию вируса папилломы человека и появление их новых генотипов, вирусную нагрузку высокоонкогенными типами вируса папилломы человека (в 1,9 раза — 3,2 ± 2,4 геномного эквивалента на миллилитр в I группе против 1,7 ± 2,1 геномного эквивалента на миллилитр во II группе).
Заключение. Проведенное исследование показало, что вакцинация против вируса папилломы человека связана со снижением риска реализации латентных форм папилломавирусной инфекции в клинические формы в виде цервикальных интраэпителиальных неоплазий, а соответственно и рака шейки матки, что представляется перспективным в плане вторичной профилактики этой патологии.
Ключевые слова
Для цитирования:
Боровиков И.О., Куценко И.И., Горринг Х.И. Вакцинация при латентных формах папилломавирусной инфекции: экспериментальное рандомизированное проспективное открытое контролируемое исследование. Кубанский научный медицинский вестник. 2024;31(4):30-41. https://doi.org/10.25207/1608-6228-2024-31-4-30-41
For citation:
Borovikov I.O., Kutsenko I.I., Gorring H.I. Vaccination in latent papillomavirus infections: An experimental randomized, prospective, open-label, controlled trial. Kuban Scientific Medical Bulletin. 2024;31(4):30-41. (In Russ.) https://doi.org/10.25207/1608-6228-2024-31-4-30-41
ВВЕДЕНИЕ
По данным мировой статистики, около 85 % женщин в течение жизни инфицируются вирусом папилломы человека (ВПЧ), при этом на репродуктивный период приходится от 5 до 40 %, а к 50 годам 85 % женщин инфицированы ВПЧ [1][2]. В настоящее время считается, что инфекция, вызванная вирусами папилломы человека (ВПЧ), является преходящей и может нивелироваться в течение нескольких лет после инфицирования, так называемая латентная форма папилломавирусной инфекции (ПВИ), трактующаяся как скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами [3][4]. В таком состоянии ВПЧ может оставаться много лет и обнаруживаться при случайной диагностике [4–6]. В то же время в 10–20 % случаев ведет к длительному персистированию папилломавируса, что может привести к прогрессированию заболевания с последующей возможностью малигнизации, в частности к раку шейки матки (РШМ), который в мире занимает четвертое место в структуре заболеваемости злокачественными опухолями среди женщин. В 2018 году в мире РШМ заболели 570 000, умерли 311 000 женщин. Стандартизованный показатель заболеваемости в мире равен 13 на 100 000 населения [7][8]. Несмотря на эффективность современных поливалентных профилактических вакцин против ВПЧ, вакцинация является в настоящее время мерой первичной профилактики и не применяется при уже существующей инфекции [9][10].
Также, учитывая, что на сегодня в большинстве регионов Российской Федерации существует ограниченный доступ к профилактической вакцинации (в основном из-за экономических проблем, связанных со стоимостью вакцин), разработка эффективных методов лечения, нацеленных на персистирующую инфекцию, остается настоятельной необходимостью [6][11–13]. В данном исследовании наряду с уточнением механизмов, способствующих персистированию ВПЧ-инфекции, обсуждаются возможности терапевтической вакцинации, направленной на усиление иммунного ответа хозяина против вирусной инфекции и препятствующей ее реализации в более серьезные (предраковые) формы.
Цель исследования — повышение эффективности вторичной профилактики рака шейки матки путем совершенствования алгоритма менеджмента латентных форм папилломавирусной инфекции у женщин.
МЕТОДЫ
Дизайн исследования
Проведено проспективное рандомизированное открытое контролируемое исследование (согласно рекомендациям CONSORT (Consolidated Standards Of Reporting Trials)) 152 пациенток, у которых в ходе скрининговых обследований методом полимеразной цепной реакции (ПЦР) были выявлены различные типы вируса папилломы человека.
Критерии соответствия
Критерии включения
Наличие латентной формы ПВИ, способность выполнять требования протокола, согласие на участие в исследовании.
Критерии не включения
Возраст до 18 и старше 35 лет; беременность или планирование беременности в период приема предлагаемых лекарственных средств (ЛС); тяжелая соматическая и гинекологическая патология; отказ от трехлетнего мониторинга. В выборочную совокупность также не были включены пациентки, инфицированные ВПЧ низкого канцерогенного риска и имеющие субклинические и клинические проявления ВПЧ-инфекции.
Критерии исключения
Гиперчувствительность к предлагаемым лекарственным препаратам; отказ от исследования.
Условия проведения исследования
Место проведения — клинические базы кафедры акушерства, гинекологии и перинатологии федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО КубГМУ Минздрава России): акушерско-гинекологическая клиника ФГБОУ ВО КубГМУ Минздрава России; женская консультация № 4 государственного бюджетного учреждения здравоохранения «Родильный дом города Краснодара» Министерства здравоохранения Краснодарского края (ГБУЗ Роддом г. Краснодара МЗ КК); женская консультация № 5 государственного бюджетного учреждения здравоохранения «Краевая клиническая больница № 2» Министерства здравоохранения Краснодарского края (ГБУЗ «ККБ № 2»), Краевой перинатальный центр государственного бюджетного учреждения здравоохранения «Детская краевая клиническая больница» Министерства здравоохранения Краснодарского края (ГБУЗ ДККБ).
Продолжительность исследования
01.03.2020 — 30.11.2023. Продолжительность наблюдения за каждым пациентом составила 36 месяцев.
Медицинские вмешательства
Пациенткам II группы запланирована к применению вакцинация квадривалентной рекомбинантной вакциной против ВПЧ (6, 11, 16, 18-го типов) — «Гардасил®» («Merck Sharp and Dome Idea, Inc.», Швейцария) (суспензия для внутримышечного введения, 0,5 мл/доза — 3 дозы: вторая и третья дозы вводились через 1 и 3 месяца после первой).
Исходы исследования
Основной исход исследования
Отсутствие субклинических и клинических проявлений ВПЧ-инфекции в течение 36-месячного мониторинга.
Дополнительные исходы исследования
Снижение детекции вируса папилломы человека и его вирусной нагрузки на протяжении 36 месяцев наблюдения.
Методы регистрации исходов
Обязательным условием было наличие медицинской документации (амбулаторная карта женской консультации), результатов проведенных исследований.
Исследование проводилось согласно клиническим рекомендациям «Воспалительные болезни шейки матки, влагалища и вульвы»1. Проведено общеклиническое; цитологическое исследование мазков с экзо- и эндоцервикса с интерпретацией результатов по классификации Папаниколау (Pap-test); ПЦР-РВ на ВПЧ высокого канцерогенного риска — количественное определение и дифференциация 12 генотипов ВПЧ ВКР (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) (анализатор iQ5Cycler (BioRAD, США), комплект тест-систем «АмплиСенс» ВПЧ ВКР скринтитр-FL» (ФГУН «ЦНИИ эпидемиологии» Роспотребнадзора); расширенная кольпоскопия; биопсия шейки матки — оценка по классификации Bethesda. Также была дана оценка вагинального и цервикального микробиоценоза (рН-метрия вагинального отделяемого — экспресс-тест FemExam — определение рН в диапазоне 3,0–7,0 (норма 3,8–4,4), система ПЦР-РВ («АмплиПрайм®», Россия). Количественное определение ДНК ВПЧ ВКР методом ПЦР РВ осуществлялось автоматически согласно кривой накопления флуоресценции: в соответствии со значениями проходило построение калибровочной прямой и расчет концентраций ДНК человека и ДНК ВПЧ с расчетом по формуле: Ig×200 000 = Ig (ВПЧ на 100 тыс. клеток). Оценка результатов: менее 3 Ig — малозначимая, от 3 до 5 Ig — клинически значимая и более 5 Ig — повышенная вирусная нагрузка.
Анализ результатов и оценка эффективности терапии — динамика показателей: кольпоскопии; ВПЧ-ПЦР-теста; данных цитологического (Pap-тест) исследования проводились в контрольные периоды наблюдения через 12, 24, 36 месяцев.
В работе соблюдались этические принципы, предъявляемые Хельсинкской декларацией2, правила Надлежащей клинической практики3, Правила клинической практики в Российской Федерации4.
Рандомизация
Пациентки с латентными формами ПВИ (n = 169) методом «конвертов» распределены на 2 группы (85 больных в I группе (в дальнейшем были исключены из исследования 11 женщин — отказ от наблюдения) и 84 больных во II группе (в дальнейшем были исключены из исследования 6 женщин — отказ от наблюдения). Окончательно I группа (n = 74) — наблюдение в течение 3 лет (36 месяцев) с контролем вирусной нагрузки (ВН), онкоцитологией (Pap-тест) и кольпоскопией; II группа (n = 78) — квадривалентная рекомбинантная вакцина против ВПЧ (6, 11, 16, 18-го типов) — «Гардасил®».
Обеспечение анонимности данных
Об эксперименте, распределении в группы и проводимой терапии были информированы сами авторы исследования. Кроме них каждая пациентка, принимающая участие в исследовании, была информирована о проводимом лично ей обследовании и терапии.
Статистические процедуры
Принципы расчета размера выборки
Выборочная совокупность составила 184 пациентки с латентными формами папилломавирусной инфекции, отобранных на клинических базах кафедры акушерства, гинекологии и перинатологии КубГМУ при прохождении профилактического обследования, в связи с чем размер выборки предварительно не рассчитывался.
Статистические методы
На основании оценки нормальности распределение выполняли путем анализа распределений количественных показателей — критерия Колмогорова — Смирнова с последующим применением параметрических или непараметрических методов. В случае соответствия распределения выборки нормальному закону распределения первичных данных применяли описательную статистику в виде среднего арифметического и стандартного отклонения — М ± SD, а сравнительный анализ проводили с помощью параметрических методов (t-критерий Стьюдента). Если распределения выборок не соответствовали нормальному закону распределения первичных данных, то применяли описательную статистику в виде медианы и первого (Q1 — 25 %) и третьего (Q3 — 75 %) квартилей — Ме (Q1; Q3), а сравнительный анализ проводили с помощью непараметрических методов (U-критерий Манна — Уитни, критерий Краскела — Уоллиса). В случае анализа качественных показателей в виде долей (процентов) применяли четырехпольные или многопольные таблицы сопряженности (хи-квадрат Пирсона). Уровень статистической значимости p ≤ 0,05 считали статистически значимым. Статистическая обработка полученных данных проводилась с помощью программного пакета Excel 2019 (Microsoft, США). Полученные цифровые данные были обработаны методами математической статистики с использованием компьютерной программы IBM SPSS Statistics 26 Version (IBM, США).
РЕЗУЛЬТАТЫ
Формирование выборки (групп) исследования
Генеральной совокупностью данного исследования являются пациентки с латентными формами папилломавирусной инфекции, проходящие обследование на клинических базах кафедры акушерства, гинекологии и перинатологии ФГБОУ ВО КубГМУ Минздрава России. К исследованию изначально были привлечены 184 пациентки, у которых в ходе скрининговых обследований методом ПЦР были выявлены различные типы вируса папилломы человека. В последующем при отборе из данного исследования были исключены 15 женщин (основные причины — несоответствие критериям: возраст — 2; наличие сопутствующей патологии — 4; отказ от участия в исследовании — 9). В результате методом «конвертов» были отобраны в 2 группы 169 пациенток с латентными формами ПВИ: I группа (сравнения) (n = 85) — наблюдение в течение 3 лет (36 месяцев) с контролем вирусной нагрузки (ВН), онкоцитологией (Pap-тест) и кольпоскопией; II (основная) группа (n = 84) — которым введена квадривалентная рекомбинантная вакцина против ВПЧ (6, 11, 16, 18-го типов) — «Гардасил®» 3 дозы: вторая и третья дозы вводились через 1 и 3 месяца после первой («Merck Sharp and Dome Idea, Inc.», Швейцария). В дальнейшем были исключены из исследования 17 женщин — отказ от наблюдения. Таким образом, в окончательный анализ результатов вошли I группа — 74 женщины и II (основная) группа — 78 женщин (рис. 1).
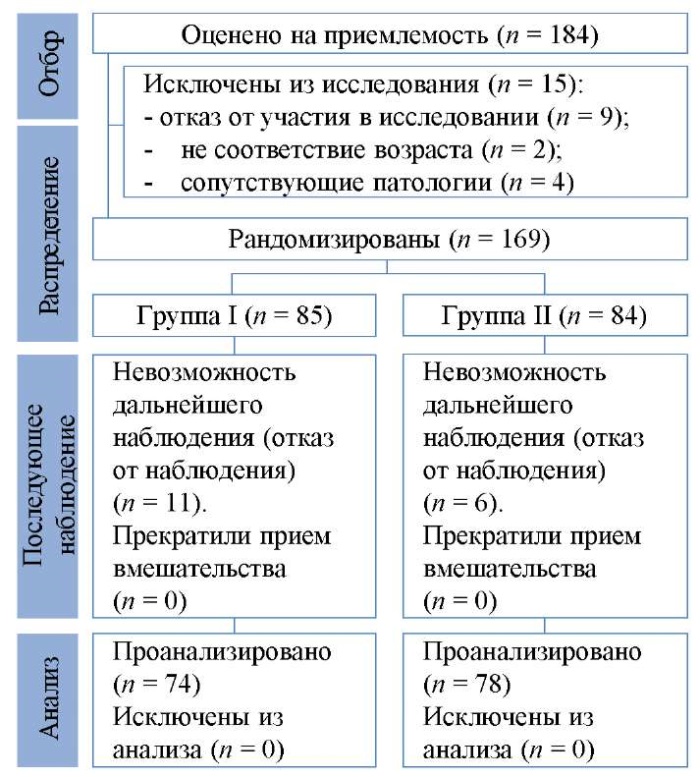
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами (согласно рекомендациям CONSORT).
Fig. 1. Schematic diagram of the research design
Note: performed by the authors (according to CONSORT recommendations).
Характеристика выборки (групп) исследования
В исследовании участвовали пациентки с латентными формами ПВИ. Возраст 18–34 года (средний возраст 26,2 ± 7,2 года: в I группе — 26,1 ± 7,0, во II — 26,3 ± 7,5). Средний возраст полового дебюта в основной группе — 17,1 ± 5,5 года, в контрольной — 16,5 ± 6,5 года; интервал от возраста менархе до сексуального дебюта — 3,9 ± 3,5 года в I группе и 3,8 ± 3,0 во II (табл. 1).
Клиническая картина у женщин с латентными формами ПВИ в большинстве случаев или отсутствовала, или была представлена симптомами, характерными для неспецифического вульвовагинита (44,6 % в I и 43,6 % во II группе) и цервицита (48,6 % в I и 48,7 % во II группе). При этом клинические проявления в I и II группах были сопоставимы (табл. 1).
Таблица 1. Медианные значения и доля основных социальных факторов
и клинических проявлений в исследуемых группах
Table 1. Median values and proportion of the main social factors
and clinical manifestations in the groups
|
Группы (n = 152) Параметры |
I группа (n = 74) |
II группа (n = 78) |
Вероятность уровня значимости p 1–2 |
||
|
Социальные факторы |
|||||
|
M |
±SD |
M |
±SD |
p 1–2 |
|
|
Возраст (лет) |
26,1 |
7,0 |
26,3 |
7,5 |
>0,05 |
|
ИМТ (кг/м²) |
25,8 |
4,4 |
25,5 |
5,4 |
>0,05 |
|
Возраст полового дебюта (лет) |
17,1 |
5,5 |
16,8 |
6,5 |
>0,05 |
|
Интервал от возраста менархе до сексуального дебюта (лет) |
3,9 |
3,5 |
3,8 |
3,0 |
>0,05 |
|
n |
% |
n |
% |
p 1–2 |
|
|
Курение (n; %) |
12 |
16,2 |
14 |
17,9 |
>0,05 |
|
Субъективные клинические проявления (жалобы) |
|||||
|
n |
% |
n |
% |
p 1–2 |
|
|
Зуд |
9 |
12,2 |
10 |
12,8 |
>0,05 |
|
Дизурические расстройства |
4 |
5,4 |
4 |
5,1 |
>0,05 |
|
Диспареуния |
6 |
8,1 |
7 |
9,0 |
>0,05 |
|
Объективные клинические проявления (патологический процесс) |
|||||
|
n |
% |
n |
% |
p 1–2 |
|
|
Обильные бели |
13 |
17,6 |
14 |
17,9 |
>0,05 |
|
Вульвовагинит |
33 |
44,6 |
34 |
43,6 |
>0,05 |
|
Цервицит |
36 |
48,6 |
38 |
48,7 |
>0,05 |
Примечание: таблица составлена авторами. Сокращение: ИМТ — индекс массы тела.
Note: compiled by the authors. Abbreviation: ИМТ — body mass index.
Основные результаты исследования
Результаты расширенной кольпоскопии показали отсутствие признаков цервикальной интраэпителиальной неоплазии у всего исследуемого контингента женщин, при этом у почти половины пациенток (77/152; 48,7 %) определена картина воспаления в цервикальном канале. Результаты были подтверждены цервикальной цитологией — NILM (negative for intraepithelial lesion or malignancy) — интраэпителиальные поражения и злокачественные процессы отсутствуют у всех пациенток.
В исследовании применялась тест система «АмплиСенс» ВПЧ ВКР для детекции ВПЧ высокого канцерогенного риска (ВКР), в связи с чем критерием включения было обнаружение именно этих типов вируса. Основными представителями ВПЧ при латентных формах были типы 16 (81/152; 53,3 ± 0,65 % — 52,6 % в I и 51,3 % во II группе) и 18 (31/152; 20,4 ± 0,2 % — 20,5 % в I и 20,3 % во II группе), также достаточно часто выявлялись 31 (17/152; 11,2 %), 51 (15/152; 9,9 %) и 52 (14/152; 9,2 %) типы (рис. 2).
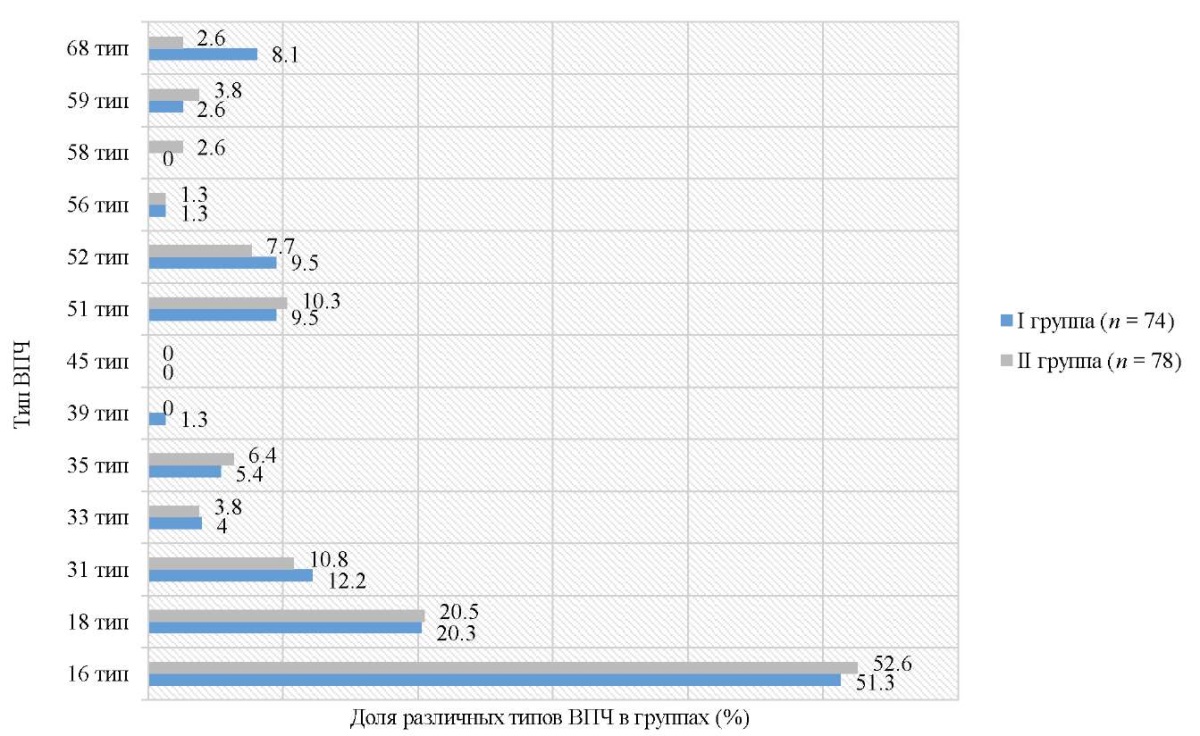
Рис. 2. Доля встречаемости различных типов вируса папилломы человека
в исследуемых группах
Примечание: рисунок выполнен авторами. Сокращение: ВПЧ — вирус папилломы человека.
Fig. 2. Incidence of different types of human papilloma virus in the study groups
Note: performed by the authors. Abbreviation: ВПЧ — human papilloma virus.
Несколько типов ВПЧ определено у 33,5 % (51/152; 20,5 % (35,1 % (26/74) в I и 32,0 % (25/78) во II группе) пациенток с латентными формами ПВИ. Различия между двумя группами по распространенности того или иного типа ВПЧ были недостоверны (p > 0,05), исключая 68 тип ВПЧ, который хоть и недостоверно (χ² = 1,892; p > 0,05), но был в 3 раза выше в I группе (8,1 % против 2,6 %).
То есть в настоящее время на фоне доминирования, как и в прежние годы, 16 и 18 типов ВПЧ активизируются и другие высокоонкогенные типы вирусов, такие как 31, 51 и 52. А достаточно частое сочетание нескольких типов ВПЧ ВКР может утяжелять клиническую картину и ускорить реализацию неопластических процессов в эпителиальных клетках цервикальной зоны.
У всех женщин исследуемой группы определена клинически значимая (более 3 Ig) концентрация ДНК ВПЧ — так называемая вирусная нагрузка (ВН), при этом повышенная (более 5 Ig) ВН определена у 21,05 ± 1,2 % (32/152) женщин: 20,3 % (15/74) в I группе и 21,8 % (17/78) во II группе.
Оценка цервико-вагинального микробиоценоза у пациенток с латентными формами ПВИ выявила превышение среднестатистических показателей нарушений микробиоты, представленных в основном условно-патогенной аэробной и анаэробной микрофлорой — 48,7 % (74/152), что потребовало у данных женщин проведения микробиологической санации в зависимости от этиологии возбудителя.
Исследование влагалищных мазков у пациенток с латентными формами ПВИ показало неоднозначные результаты: лейкоцитарная воспалительная реакция (количество лейкоцитов более 10 в поле зрения), зарегистрирована у 22,3 % (34/152) женщин (21,6 % (16/74) в I и 23,1 % (18/78) во II группе; p > 0,05); у 17,1 % (26/152) (17,6 % (13/74) в I и 15,4 % (12/78) во II группе; p > 0,05) количество лейкоцитов в вагинальном мазке было менее 4 (рис. 3).
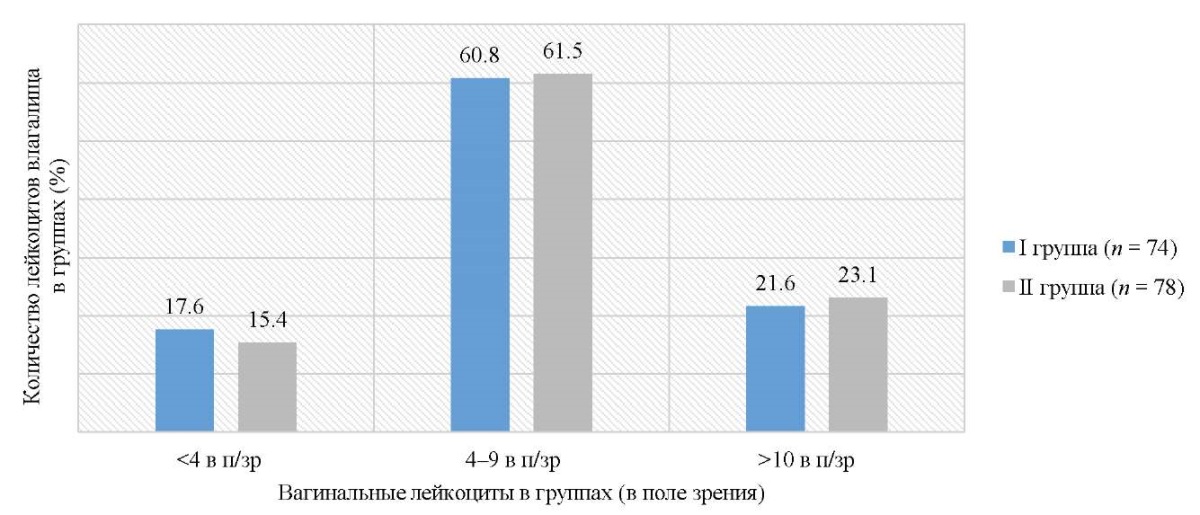
Рис. 3. Лейкоцитарная реакция вагинального содержимого у пациенток исследуемых групп
Примечание: рисунок выполнен авторами. Сокращение: п/зр — в поле зрения
Fig. 3. Leukocytic reaction of vaginal contents in patients of the studied groups
Note: performed by the authors. Abbreviation: п/зр — field of view.
Клеточный состав вагинальных мазков у наших пациенток выглядел таким образом: количество лейкоцитов (КЛ) в среднем составило 7,1 ± 3,3, количество эпителиальных клеток (КЭК) — 8,4 ± 3,5; соответственно, сумма клеток (СК) составила 15,5 ± 3,4; цитологический коэффициент (ЦК) также был в пределах нормы — 1,1 ± 0,2. При это оценка признаков дисбиоза (Hay/Ison) показала 2-ю (промежуточную) степень у 13,8 % (21/152) пациенток (12,2 % (9/74) в I и 15,4 % (12/78) во II группе; p > 0,05), 3-ю (бактериальный вагиноз) — у 35,5 % (54/152) (35,1 % (26/74) в I и 35,9 % (28/78) во II группе; p > 0,05) и 4-ю (анаэробный вагиноз) — у 18,4 % (28/152) (21,6 % (16/74) в I и 15,4 % (12/78) во II группе; p > 0,05). Соотношение кокковых и палочковидных форм бактерий у женщин с латентными формами ПВИ составило 1:2,8 (1:2,9 в I и 1:2,8 во II группе) — снижение палочковой микрофлоры с активацией бациллярных бактерий.
Среднее значение pH при латентных формах ПВИ было 4,24 ± 1,6 (4,28 ± 1,6 в I и 4,21 ± 1,6 во II группе; p > 0,05) (рис. 4). При этом повышенные (более 4,4; границы нормы 3,8–4,4) значения pH зарегистрированы у 38,8 % (59/152) (35,1 % (26/74) в I и 42,3 % (33/78) во II группе; p > 0,05) пациенток. Измененные значения pH подтверждают наличие дисбиотических (чаще всего обусловленных анаэробной условно-патогенной микрофлорой) локальных изменений, что может создавать предпосылки для длительного персистирования ВПЧ, а в некоторых случаях и прогрессирования ВПЧ-ассоциированных неопластических процессов.
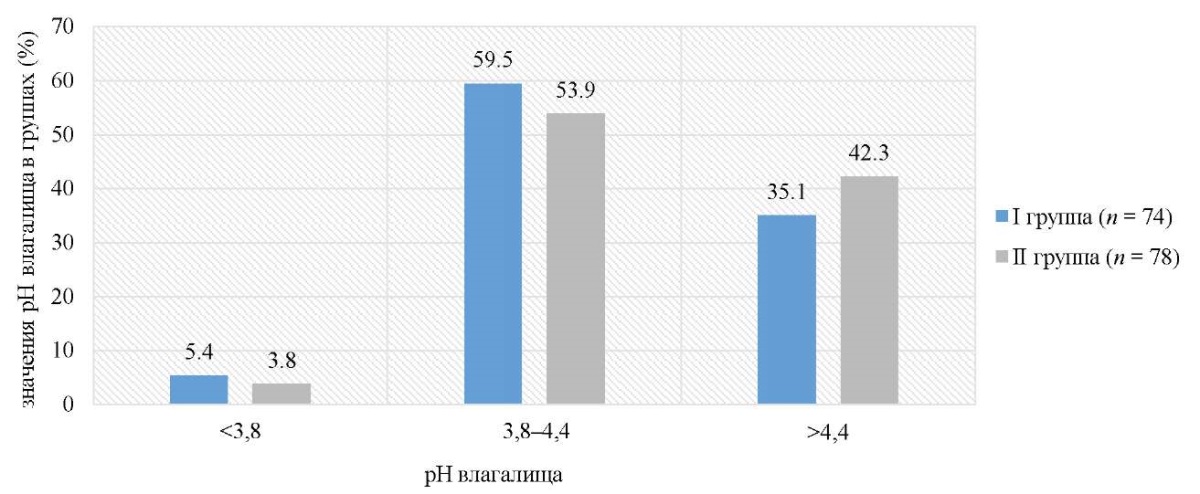
Рис. 4. Распределение значений pH вагинальной жидкости у пациенток исследуемых групп
Примечание: рисунок выполнен авторами.
Fig. 4. Distribution of vaginal fluid pH values in patients of the studied groups
Note: performed by the authors.
Интерпретация результатов исследования цервикального микробиоценоза методом ПЦР-РВ (система «АмплиПрайм® Флороценоз-Бактериальный вагиноз», Россия) показала наличие бактериального вагиноза со сниженным количеством лактобактерий и преобладанием Gardnerella vaginalis (41,9 % в I и 46,1 % во II группе; p > 0,05) и Atopobium vaginae (36,5 % в I и 39,7 % во II группе; p > 0,05) у 40,1 % (61/152) (табл. 2).
Таблица 2. Доли основных типов микроорганизмов цервикального микробиоценоза
в исследуемых группах (n (%); ГЭ/мл — М ± SD)
Table 2. Proportions of the main types of microorganisms of the cervical microbiocenosis
in the studied groups (n (%); geq/ml — M ± SD)
|
Группы таблицеМикроорганизм |
n (%) |
ГЭ/мл — М ± SD |
Вероятность уровня значимости p 1–2 |
||
|
I группа (n = 74) |
II группа (n = 78) |
I группа (n = 74) |
II группа (n = 78) |
||
|
Lactobacillus sp. |
71 (95,9 %) |
73 (93,6 %) |
6,5 ± 1,3 |
6,3 ± 1,35 |
˃0,05 |
|
Gardnerella vaginalis |
31 (41,9 %) |
36 (46,1 %) |
2,7 ± 1,1 |
2,8 ± 1,1 |
˃0,05 |
|
Atopobium vag. |
27 (36,5 %) |
31 (39,7 %) |
3,4 ± 2,3 |
3,35 ± 1,9 |
˃0,05 |
|
Bacteria |
19 (25,7 %) |
22 (28,2 %) |
3,6 ± 1,8 |
3,8 ± 2,0 |
˃0,05 |
Примечание: таблица составлена авторами.
Сокращение: ГЭ/мл — геномных эквивалентов на миллилитр.
Note: compiled by the authors. Abbreviation: ГЭ/мл — genomic equivalents per millilitre.
Обратило на себя внимание достаточно высокое количество у наших пациенток вирусов простого герпеса (HPV I–II типов) — 53,3 % (81/152) (48,6 % (36/74) в I и 57,7 % (45/78) во II группе; p > 0,05) и цитомегаловирусов (CMV) — 34,9 % (53/152) (37,8 % (28/74) в I и 32,0 % (25/78) во II группе; p > 0,05).
Особенности патогенеза персистирующей папилломавирусной инфекции явились обоснованием для проведения лечебно-профилактической вакцинации квадривалентной рекомбинантной вакциной против ВПЧ 6, 11, 16, 18-го типов. Причиной выбора данного метода явилось плейотропное воздействие вакцины на различные звенья локального иммунитета, что дает возможность защиты эпителиоцитов от ВПЧ, снижения вирусной нагрузки до малоопределяемых значений и, соответственно, отсутствия дальнейшего прогрессирования процесса.
При мониторинге пациенток в течение 36 месяцев выявлена следующая динамика: проведение кольпоскопического и цитологического контроля в I группе через 12 месяцев выявило 10,8 % (8/74) случаев субклинической формы ПВИ (не видимые невооруженным глазом и бессимптомные, выявляемые только при кольпоскопии и/или цитологическом или гистологическом исследовании плоские кондиломы; малые формы (различные поражения метапластического эпителия с единичными койлоцитами); кондиломатозный цервицит) и 4,0 % (3/74) женщин с ASC-US (atypical squamous cells of undetermined significance), проявления в виде цервикальной интраэпителиальной неоплазии легкой степени (CIN I) на данном сроке были диагностированы у 2,7 % (2/74) пациенток (рис. 5). При дальнейшем наблюдении (последующие 24 месяца) в I группе выявлено 25,7 % (19/74) женщин с субклиническими формами ПВИ, CIN I диагностированы у 12,1 % (9/74) и ASC-US у 13,5 (10/74) пациенток (рис. 5).
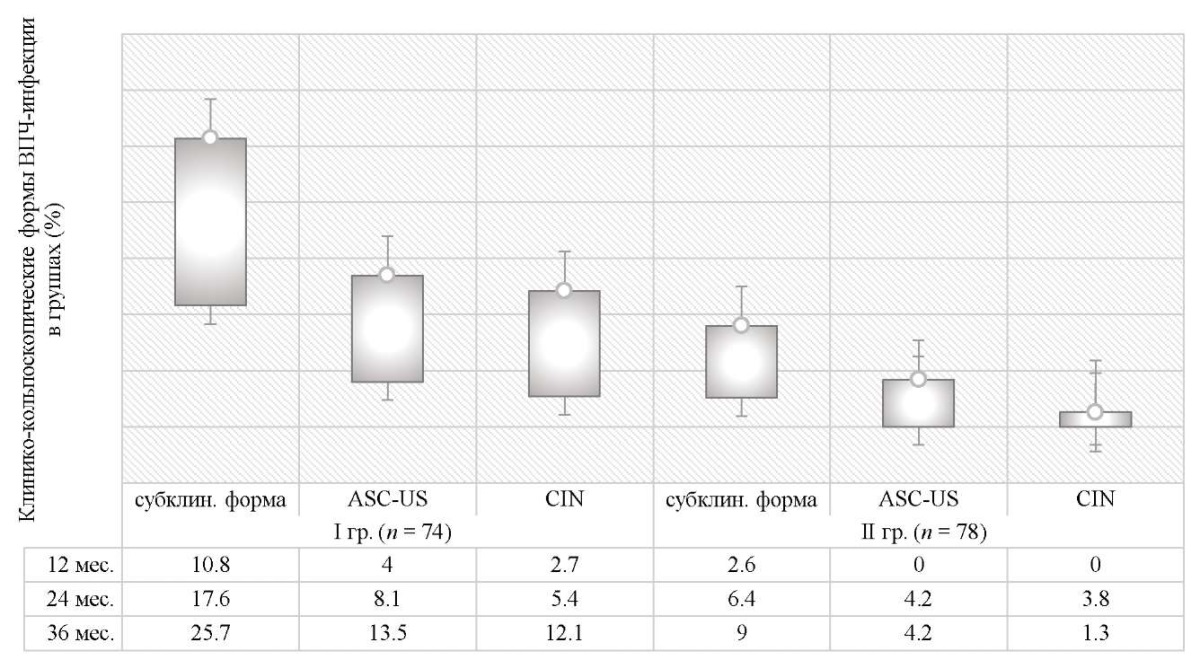
Рис. 5. Динамика кольпоскопических изменений в исследуемых группах
в процессе трехгодичного мониторинга
Примечание: рисунок выполнен авторами.
Сокращения: CIN — цервикальная интраэпителиальная неоплазия легкой степени;
ASC-US — atypical squamous cells of undetermined significance;
ВПЧ — вирус папилломы человека; гр. — группа; субклин. — субклиническая.
Fig. 5. Dynamics of colposcopic changes in the studied groups
during the three-year observation period
Note: performed by the authors.
Abbreviations: CIN — mild cervical intraepithelial neoplasia;
ASC-US — atypical squamous cells of undetermined significance;
ВПЧ — human papillomavirus; гр. — group; субклин. — subclinical.
Во II группе детекция CIN I наблюдалось у 3,8 % (3/78) пациенток через 24 месяца наблюдения, при этом после проведенной микробиологической санации к трехгодичному сроку мониторинга цервикальная неоплазия была выявлена только у одной женщины (1,3 %); субклинические формы за весь срок мониторинга диагностированы у 9,0 % (7/78), ASC-US — у 4,2 % (3/78) женщин.
Дополнительные результаты исследования
При мониторинге в течение 36 месяцев положительный статус персистенции диагностированных при рандомизации ВПЧ ВКР зафиксирован у 91,7 % (68/74) пациенток I и у 43,6 (31/79) — II группы (χ² = 16,396; p < 0,01). При этом у части женщин обеих групп (12,0 % — I и 5,2 % — II) наблюдалось инфицирование новыми генотипами ВПЧ, при этом у пациенток I группы в большинстве случаев обнаружены ВПЧ 16 и 18 типов — 8,1 % (6/74), наиболее часто ответственные за развитие неопластических процессов в шейке матки (табл. 3).
Таблица 3. Изменение структуры встречаемости различных типов вируса папилломы человека
в исследуемых группах в процессе трехгодичного мониторинга
Table 3. Changes in the incidence of different types of human papilloma virus
in the studied groups during the three-year observation period
|
Типы ВПЧ |
I группа (n = 74) |
II группа (n = 78) |
Вероятность уровня значимости p 1–2 |
||
|
n |
% |
n |
% |
||
|
Персистирование ВПЧ |
|||||
|
16 |
29 |
39,2 |
15 |
19,2 |
<0,05 |
|
18 |
12 |
16,2 |
8 |
10,2 |
˃0,05 |
|
31 |
6 |
8,1 |
2 |
2,6 |
˃0,05 |
|
33 |
2 |
2,7 |
1 |
1,3 |
˃0,05 |
|
35 |
1 |
1,3 |
0 |
0,0 |
˃0,05 |
|
39 |
0 |
0,0 |
2 |
2,6 |
˃0,05 |
|
45 |
5 |
6,8 |
0 |
0,0 |
˃0,05 |
|
51 |
4 |
5,4 |
3 |
3,8 |
˃0,05 |
|
52 |
1 |
1,3 |
0 |
0,0 |
˃0,05 |
|
56 |
0 |
0,0 |
2 |
2,6 |
˃0,05 |
|
58 |
1 |
1,3 |
1 |
1,3 |
˃0,05 |
|
59 |
3 |
4,0 |
0 |
0,0 |
˃0,05 |
|
68 |
4 |
5,4 |
0 |
0,0 |
˃0,05 |
|
Всего |
68 |
91,7 |
31 |
43,6 |
<0,05 |
|
Новые генотипы ВПЧ |
|||||
|
16 |
4 |
5,4 |
0 |
0,0 |
˃0,05 |
|
18 |
2 |
2,7 |
0 |
0,0 |
˃0,05 |
|
31 |
1 |
1,3 |
2 |
2,6 |
˃0,05 |
|
33 |
0 |
0,0 |
1 |
1,3 |
˃0,05 |
|
35 |
1 |
1,3 |
0 |
0,0 |
˃0,05 |
|
39 |
0 |
0,0 |
0 |
0,0 |
˃0,05 |
|
45 |
0 |
0,0 |
0 |
0,0 |
˃0,05 |
|
51 |
0 |
0,0 |
0 |
0,0 |
˃0,05 |
|
52 |
0 |
0,0 |
0 |
0,0 |
˃0,05 |
|
56 |
1 |
1,3 |
0 |
0,0 |
˃0,05 |
|
58 |
0 |
0,0 |
0 |
0,0 |
˃0,05 |
|
59 |
0 |
0,0 |
1 |
1,3 |
˃0,05 |
|
68 |
0 |
0,0 |
0 |
0,0 |
˃0,05 |
|
Всего |
9 |
12,0 |
3 |
5,2 |
˃0,05 |
Примечание: таблица составлена авторами. Сокращение: ВПЧ — вирус папилломы человека.
Note: compiled by the authors. Abbreviation: ВПЧ — human papillomavirus.
Средняя вирусная нагрузка ВПЧ ВКР в I группе (пассивное наблюдение женщин с латентными формами ПВИ) через 36 месяцев мониторинга составила 3,2 ± 2,4 ГЭ/мл, при этом клинически значимая (более 3 Ig) зарегистрирована у 75,7 % (56/74) пациенток. В то же время во II группе (вакцинированные против ВПЧ) средняя ВН была 1,7 ± 2,1 ГЭ/мл, то есть в 1,9 раза ниже, а клинически значимая ВН была у 44,9 % (35/78) женщин (рис. 6).
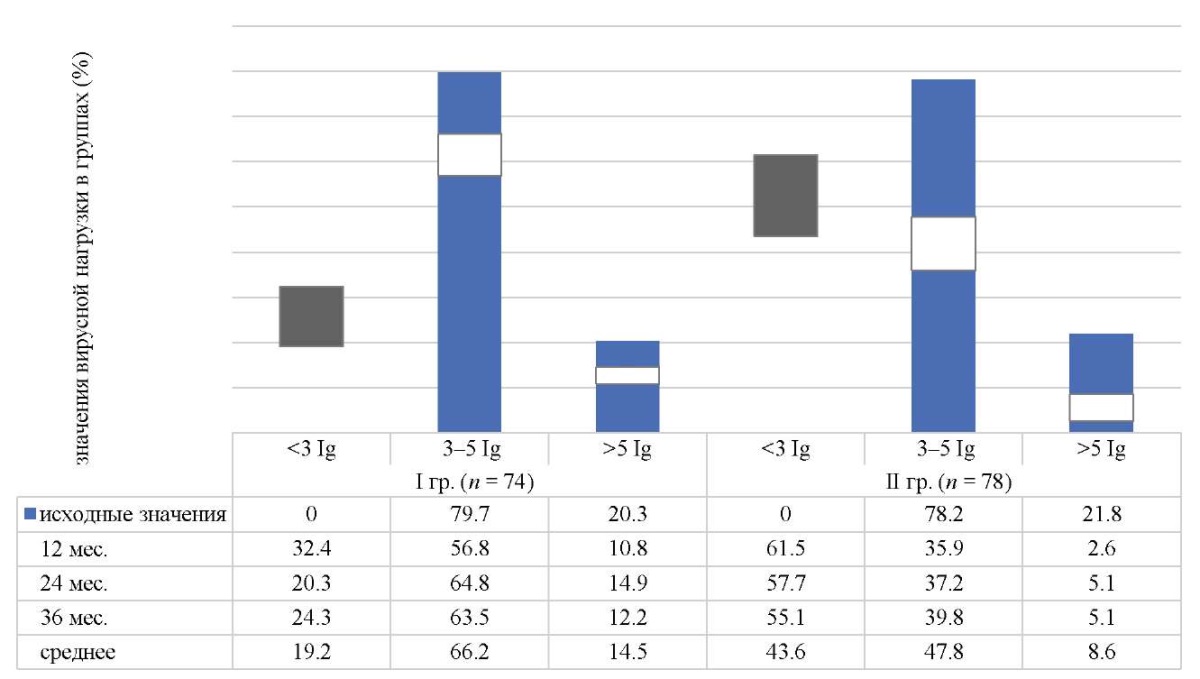
Рис. 6. Динамика изменений общей вирусной нагрузки вируса папилломы человека
в исследуемых группах в процессе трехгодичного мониторинга
Примечание: рисунок выполнен авторами. Сокращение гр. — группа.
Fig. 6. Dynamics of changes in the total human papilloma virus viral load
in the studied groups during the three-year observation period
Note: performed by the authors. Abbreviation: гр. — group.
Хотя в настоящее время вирусная нагрузка и не является диагностически «ценным» критерием, разница, по нашему мнению, подчеркивает различия между группами. Поэтому у нас возникла гипотеза, что вакцинопрофилактика, опосредованно уменьшая вирусную нагрузку папилломавирусов высокого онкогенного риска, способствует подавлению фосфорилирования кодируемых вирусом белков в пораженных ВПЧ клетках, воздействуя на цитохром Р450 с ростом синтеза 2-гидроксиэстрогенов и снижением, соответственно, количества 16-гидроксиэстриола, что ведет к нормализации их соотношений в эпителии слизистых урогенитальной зоны и тем самым блокирует атипичную пролиферацию клеток. Но данная гипотеза требует проведения дальнейших исследований.
Нежелательные явления
Существенных нежелательных явлений, вынуждающих пациенток выйти из исследования, при применении квадривалентной вакцины против ВПЧ не было выявлено. У 2/78 (2,6 %) пациенток была выявлена умеренная гиперемия и зуд в месте инъекции, исчезнувшие в течение суток без дополнительного вмешательства.
ОБСУЖДЕНИЕ
Ограничения исследования
В исследовании приведены статистические данные, собранные на основании наблюдения 152 пациенток на протяжении 36 месяцев мониторинга. Для углубленного анализа необходимо провести дальнейшее исследование с увеличением объема группы и срока мониторинга.
Обобщаемость/экстраполяция
Результаты этого исследования могут распространяться и на другие виды или экспериментальные условия исследований. В частности, вакцинация против ВПЧ в эксперименте может проводиться пациенткам с субклиническими формами папилломавирусной инфекции, а также после адьювантной терапии женщин с цервикальными интраэпителиальными неоплазиями I и даже II стадии.
Резюме основного результата исследования
На основании проведенного исследования был сделан ряд выводов: латентные формы папилломавирусной инфекции более часто, чем в популяции, сопровождаются нарушениями микробиоценоза цервико-вагинальной зоны; наблюдение пациенток с латентными формами ПВИ должно включать проведение кольпоскопии, микробиологического и цитологического исследования, при этом оценка вирусной нагрузки ВПЧ ВКР в большинстве случаев не имеет клинического значения; необходимым условием ведения пациенток с латентными формами ПВИ является микробиологическая санация цервико-вагинальной зоны; результаты настоящего исследования показывают, что вторичная профилактика рака шейки матки путем вакцинирования против ВПЧ пациенток с латентными формами ПВИ снижает количество субклинических и клинических форм данной инфекции и уменьшает персистенцию ВПЧ.
Обсуждение основного результата исследования
В настоящее время профилактические вакцины против ВПЧ считаются наиболее успешной мерой мирового здравоохранения для связанных с ВПЧ-инфицированием заболеваний, в том числе с онкологической направленностью, особенно это касается рака шейки матки [2][14][15]. Действие всех вакцин против ВПЧ основано на способности ВПЧ-подобных частиц, входящих в них, к выработке нейтрализующих L1-специфических антител, блокирующих проникновение вируса в эпителиоциты [16][17].
По последним рекомендациям Консультативного комитета по практике иммунизации (ACIP), вакцинация против ВПЧ предназначена для женщин и мужчин в возрасте от 9 до 26 лет [18][19]. При этом сейчас вакцинация не рекомендуется тому контингенту людей, которые ранее были ВПЧ-инфицированы, что ограничивает наши терапевтические воздействия и, соответственно, подвергает значительную часть населения риску заболеваний, связанных с этими вирусами [20–22]. До сих пор ни одна вакцина против ВПЧ не была лицензирована для терапевтического использования, что предполагает возможность ее исследования в качестве лечения пациенток, уже подвергшихся инфицированию ВПЧ, то есть латентными формами этой инфекции. Обоснованность эффективности данной «профилактической» терапии, по нашему мнению, может быть связана с перекрестной защитой по отношению к нескольким типам ВПЧ, стимуляцией вакциной клеточного иммунитета с изменением T-helper направленности иммунного ответа, а также с тем, что при нормализации микробиоценоза уменьшается воспалительная реакция в цервикальной зоне, что увеличивает эффективность терапевтического воздействия вакцины, предотвращая аутоинокуляцию через воспаленные анатомические участки. Учитывая, что в крупных клинических исследованиях эффективность вакцины против ВПЧ для вторичной профилактики у пациентов с латентной инфекцией не изучалась, данный факт требует дополнительных исследований.
В данном клиническом рандомизированном исследовании как раз и было отражено влияние вакцины против ВПЧ на эффективность профилактического лечения пациенток с латентными формами папилломавирусной инфекции при наблюдении женщин в течение 36 месяцев. Было показано, что у пациенток, которым применяли квадривалентную рекомбинантную вакцину против ВПЧ (II группа), диагностировано в 2,8 раза меньшее количество субклинических форм ПВИ (25,7 % в I против 9,0 % во II группе), и в 9,3 раза цервикальных интраэпителиальных неоплазий (CIN I): 12,1 % в I против 1,3 % во II группе. Также отмечается значимое уменьшение (в 2,1 раза) персистенции ВПЧ во II группе, вирусной нагрузки ВПЧ ВКР (в 1,9 раза) — 3,2 ± 2,4 ГЭ/мл в I против 1,7 ± 2,1 ГЭ/мл во II группе.
ЗАКЛЮЧЕНИЕ
Настоящее исследование показывает, что вакцинация против ВПЧ у пациенток с латентными формами ПВИ способствует снижению риска возникновения клинических форм заболевания, тем самым, возможно, предотвращая возникновение в дальнейшем такой патологии, как рак шейки матки. Таким образом, своевременная санация цервико-вагинальной зоны с нормализацией микробиоценоза на фоне вторичной профилактической вакцинации против ВПЧ может способствовать развитию новой эры в терапии этой патологии. Дальнейшие исследования будут направлены на привлечение большего количества участников и увеличение длительности наблюдения, а также на расширение показаний к вакцинации против ВПЧ путем возможного привлечения пациенток с клиническими формами ПВИ — CIN I и CIN II после адъювантной терапии.
1. ООО «Российское общество акушеров-гинекологов (РОАГ)». Воспалительные болезни шейки матки, влагалища и вульвы. Клинические рекомендации. Available: https://www.elevit.ru/sites/g/files/vrxlpx38816/files/2022-10/Воспалительные%20болезни%20шейки%20матки%2C.pdf
2. Хельсинкская декларация Всемирной медицинской ассоциации «Этические принципы проведения медицинских исследований с участием человека в качестве субъекта» (принята на 18-й Генеральной Ассамблее ВМА, Хельсинки, Финляндия, июнь 1964 г.); изменения внесены на 64-й Генеральной Ассамблее ВМА, Форталеза, Бразилия, октябрь 2013 г. Available: https://dgkbsv.mos.ru/_upload/upload_17_05_2022_02_38_17x06282e0692d289x.pdf
3. Совет Евразийской экономической комиссии. Решение от 03.11.2016 № 79 «Об утверждении Правил надлежащей клинической практики Евразийского экономического союза».
4. Министерство здравоохранения Российской Федерации. Приказ от 01.04.2016 г. № 200н «Об утверждении правил надлежащей клинической практики».
Список литературы
1. Венедиктова М.Г., Саранцев А.Н., Морозова К.В., Оруджова К.Ф. Современный взгляд на комплексную терапию дисплазии шейки матки в условиях инфицирования вирусом папилломы человека. РМЖ. Мать и дитя. 2019;2(3):237–242. https://doi.org/10.32364/2618-8430-2019-2-3-237-242
2. Доброхотова Ю.Э., Боровкова Е.И. Вакцинация от вируса папилломы человека: доказательная база эффективности и безопасности. Гинекология. 2021;23(2):125–130. DOI: https://doi.org/10.26442/20795696.2021.2.200742
3. Назарова Н.М., Павлович С.В., Аттоева Д.И. ВПЧ-ассоциированные заболевания у женщин и мужчин: принципы диагностики, лечения, профилактики. Медицинский совет. 2019;7:82–86. https://doi.org/10.21518/2079-701X-2019-7-82-86
4. Arbyn M, Weiderpass E, Bruni L, de Sanjosé S, Saraiya M, Ferlay J, Bray F. Estimates of incidence and mortality of cervical cancer in 2018: a worldwide analysis. Lancet Glob Health. 2020;8(2):e191–e203. https://doi.org/10.1016/S2214-109X(19)30482-6
5. Виноградова О.П., Епифанова О.В., Андреева Н.А. Цитокиновый профиль при цервикальной интраэпителиальной неоплазии II степени у женщин с папилломавирусной инфекцией. Российский вестник акушера-гинеколога. 2020;20(5):21–25. https://doi.org/10.17116/rosakush20202005121
6. Shanmugasundaram S, You J. Targeting Persistent Human Papillomavirus Infection. Viruses. 2017;9(8):229. https://doi.org/10.3390/v9080229
7. Malagón T, MacCosham A, Burchell AN, El-Zein M, Tellier PP, Coutlée F, Franco EL; HITCH Study Group. Proportion of Incident Genital Human Papillomavirus Detections not Attributable to Transmission and Potentially Attributable to Latent Infections: Implications for Cervical Cancer Screening. Clin Infect Dis. 2022;75(3):365–371. https://doi.org/10.1093/cid/ciab985
8. Зароченцева Н.В., Джиджихия Л.К., Набиева В.Н. Эффективность вакцинации против ВПЧ в профилактике рецидивов цервикальных интраэпителиальных неоплазий после эксцизионных методов лечения. Вопросы гинекологии, акушерства и перинатологии. 2021;20(4):38–44. https://doi.org/10.20953/1726-1678-2021-4-38-44
9. Bogani G, Raspagliesi F, Sopracordevole F, Ciavattini A, Ghelardi A, Simoncini T, Petrillo M, Plotti F, Lopez S, Casarin J, Serati M, Pinelli C, Valenti G, Bergamini A, Gardella B, Dell’Acqua A, Monti E, Vercellini P, D’ippolito G, Aguzzoli L, Mandato VD, Carunchio P, Carlifante G, Gianella L, Scaffa C, Falcone F, Ferla S, Borghi C, Ditto A, Malzoni M, Giannini A, Salerno MG, Liberale V, Contino B, Donfrancesco C, Desiato M, Perrone AM, Dondi G, De Iaco P, Leone Roberti Maggiore U, Signorelli M, Chiappa V, Ferrero S, Sarpietro G, Matarazzo MG, Cianci A, Bocio S, Ruisi S, Guerrisi R, Brusadelli C, Mosca L, Tinelli R, De Vincenzo R, Zannoni GF, Ferrandina G, Dessole S, Angioli R, Greggi S, Spinillo A, Ghezzi F, Colacurci N, Fischetti M, Carlea A, Zullo F, Muzii L, Scambia G, Benedetti Panici P, Di Donato V. Assessing the Long-Term Role of Vaccination against HPV after Loop Electrosurgical Excision Procedure (LEEP): A Propensity-Score Matched Comparison. Vaccines (Basel). 2020;8(4):717. https://doi.org/10.3390/vaccines8040717
10. Athanasiou A, Bowden S, Paraskevaidi M, Fotopoulou C, MartinHirsch P, Paraskevaidis E, Kyrgiou M. HPV vaccination and cancer prevention. Best Pract Res Clin Obstet Gynaecol. 2020;65:109–124. https://doi.org/10.1016/j.bpobgyn.2020.02.009
11. Karena ZV, Faldu PS. A Cross-Sectional Study on Knowledge, Attitude, and Practices Related to Cervical Cancer Screening Among the Nursing Staff in a Tertiary Care Hospital in the Western Region of India. Cureus. 2024;16(1):e51566. https://doi.org/10.7759/cureus.51566
12. Karimi-Zarchi M, Allahqoli L, Nehmati A, Kashi AM, Taghipour-Zahir S, Alkatout I. Can the prophylactic quadrivalent HPV vaccine be used as a therapeutic agent in women with CIN? A randomized trial. BMC Public Health. 2020;20(1):274. https://doi.org/10.1186/s12889-020-8371-z
13. Palmer T, Wallace L, Pollock KG, Cuschieri K, Robertson C, Kavanagh K, Cruickshank M. Prevalence of cervical disease at age 20 after immunisation with bivalent HPV vaccine at age 12-13 in Scotland: retrospective population study. BMJ. 2019;365:l1161. https://doi.org/10.1136/bmj.l1161
14. Zurek Munk-Madsen M, Toft L, Kube T, Richter R, Ostergaard L, Søgaard OS, Tolstrup M, Kaufmann AM. Cellular immunogenicity of human papillomavirus vaccines Cervarix and Gardasil in adults with HIV infection. Hum Vaccin Immunother. 2018;14(4):909–916. https://doi.org/10.1080/21645515.2017.1407896
15. Di Donato V, Caruso G, Petrillo M, Kontopantelis E, Palaia I, Perniola G, Plotti F, Angioli R, Muzii L, Benedetti Panici P, Bogani G. Adjuvant HPV Vaccination to Prevent Recurrent Cervical Dysplasia after Surgical Treatment: A Meta-Analysis. Vaccines (Basel). 2021;9(5):410. https://doi.org/10.3390/vaccines9050410
16. Petrillo M, Dessole M, Tinacci E, Saderi L, Muresu N, Capobianco G, Cossu A, Dessole S, Sotgiu G, Piana A. Efficacy of HPV Vaccination in Women Receiving LEEP for Cervical Dysplasia: A Single Institution’s Experience. Vaccines (Basel). 2020;8(1):45. https://doi.org/10.3390/vaccines8010045
17. Mariz FC, Bender N, Anantharaman D, Basu P, Bhatla N, Pillai MR, Prabhu PR, Sankaranarayanan R, Eriksson T, Pawlita M, Prager K, Sehr P, Waterboer T, Müller M, Lehtinen M. Peak neutralizing and cross-neutralizing antibody levels to human papillomavirus types 6/16/18/31/33/45/52/58 induced by bivalent and quadrivalent HPV vaccines. NPJ Vaccines. 2020 Feb 14;5(1):14. https://doi.org/10.1038/s41541-020-0165-x. PMID: 32128255; PMCID: PMC7021830.
18. Meites E, Szilagyi PG, Chesson HW, Unger ER, Romero JR, Markowitz LE. Human Papillomavirus Vaccination for Adults: Updated Recommendations of the Advisory Committee on Immunization Practices. MMWR Morb Mortal Wkly Rep. 2019;68(32):698–702. https://doi.org/10.15585/mmwr.mm6832a3
19. de Martel C, Georges D, Bray F, Ferlay J, Clifford GM. Global burden of cancer attributable to infections in 2018: a worldwide incidence analysis. Lancet Glob Health. 2020;8(2):e180–e190. https://doi.org/10.1016/S2214-109X(19)30488-7
20. Bogani G, Raspagliesi F, di Donato V, Brusadelli C, Guerrisi R, Pinelli C, Casarin J, Ghezzi F, Del Fabro A, Ditto A, Simoncini T, Ciavattini A, Sopracordevole F. Spotlight on the role of human papillomavirus vaccines. Gynecol Oncol. 2021;160(1):346–350. https://doi.org/10.1016/j.ygyno.2020.08.034
21. Di Donato V, Caruso G, Bogani G, Cavallari EN, Palaia G, Perniola G, Ralli M, Sorrenti S, Romeo U, Pernazza A, Pierangeli A, Clementi I, Mingoli A, Cassoni A, Tanzi F, Cuccu I, Recine N, Mancino P, de Vincentiis M, Valentini V, d’Ettorre G, Della Rocca C, Mastroianni CM, Antonelli G, Polimeni A, Muzii L, Palaia I. HPV Vaccination after Primary Treatment of HPV-Related Disease across Different Organ Sites: A Multidisciplinary Comprehensive Review and MetaAnalysis. Vaccines (Basel). 2022;10(2):239. https://doi.org/10.3390/vaccines10020239
22. Antonsson A, Forslund O, Ekberg H, Sterner G, Hansson BG. The ubiquity and impressive genomic diversity of human skin papillomaviruses suggest a commensalic nature of these viruses. J Virol. 2000;74(24):11636–11641. https://doi.org/10.1128/jvi.74.24.1163611641.2000
Об авторах
И. О. БоровиковРоссия
Боровиков Игорь Олегович — доктор медицинских наук, доцент, профессор кафедры акушерства, гинекологии и перинатологии
ул. им. Митрофана Седина, д. 4, г. Краснодар, 350063
И. И. Куценко
Россия
Куценко Ирина Игоревна — доктор медицинских наук, профессор, заведующая кафедрой акушерства, гинекологии и перинатологии
ул. им. Митрофана Седина, д. 4, г. Краснодар, 350063
Х. И. Горринг
Россия
Горринг Хава Израиловна — аспирант кафедры акушерства, гинекологии и перинатологии
ул. им. Митрофана Седина, д. 4, г. Краснодар, 350063
Дополнительные файлы
Рецензия
Для цитирования:
Боровиков И.О., Куценко И.И., Горринг Х.И. Вакцинация при латентных формах папилломавирусной инфекции: экспериментальное рандомизированное проспективное открытое контролируемое исследование. Кубанский научный медицинский вестник. 2024;31(4):30-41. https://doi.org/10.25207/1608-6228-2024-31-4-30-41
For citation:
Borovikov I.O., Kutsenko I.I., Gorring H.I. Vaccination in latent papillomavirus infections: An experimental randomized, prospective, open-label, controlled trial. Kuban Scientific Medical Bulletin. 2024;31(4):30-41. (In Russ.) https://doi.org/10.25207/1608-6228-2024-31-4-30-41
JATS XML








































