Перейти к:
Пузырная жидкость как источник биомаркеров стероидной резистентности у больных жизнеугрожающими буллезными дерматозами: наблюдательное когортное контролируемое исследование
https://doi.org/10.25207/1608-6228-2025-32-4-62-81
Аннотация
Введение. Буллезные дерматозы представляют собой тяжелые жизнеугрожающие антитело-индуцированные орган-специфические мультифакториальные заболевания, в основе которых лежит генетическая предрасположенность. Системные глюкокортикостероиды являются первой линией терапии множества буллезных дерматозов. Небольшая, но существенная часть таких больных рефрактерна к проводимой базовой терапии системными глюкокортикостероидами. Механизмы стероидной резистентности изучались на уровне рецепторов, генов в сыворотке больных, однако на уровне пузырной жидкости локально в области формирования пузыря данный механизм не исследовался.
Цель исследования: оценить цитокиновый (интерлейкин-10, -15, -4, фактор некроза опухоли альфа), хемокиновый (хемотаксический белок эозинофилов, интерлейкин-8) профили и уровень гранулизина у больных буллезными дерматозами в сыворотке и пузырной жидкости, а также их возможную взаимосвязь со стероидной резистентностью.
Методы. В наблюдательное когортное контролируемое исследование вошло 67 больных буллезными дерматозами, госпитализированных в период с января 2020 по декабрь 2023 г. в клинику кожных и венерических болезней им. В.А. Рахманова университетской клинической больницы № 2 федерального государственного бюджетного образовательного учреждения высшего образования «Первый Московский государственный медицинский университет им. И.М. Сеченова» Министерства здравоохранения Российской Федерации (Сеченовский Университет) и в отделение аллергологии и иммунологии государственного бюджетного учреждения здравоохранения города Москвы «Городская клиническая больница № 24 Департамента здравоохранения города Москвы». В зависимости от установленного диагноза пациенты были разделены на три группы. В первую входили пациенты с акантолитической пузырчаткой (n = 43), во вторую — с буллезным пемфигоидом (n = 11) и третью — с синдромом Стивенса — Джонсона и токсическим эпидермальным некролизом (n = 13). Группу контроля составили 43 здоровых донора, биологический материал от которых был получен из Центра крови федерального государственного бюджетного образовательного учреждения высшего образования «Первый Московский государственный медицинский университет им. И.М. Сеченова» Министерства здравоохранения Российской Федерации (Сеченовский Университет). После проведения 3‑недельного курса системных глюкокортикостероидов в группах пациентов с буллезными дерматозами была проведена стратификация на стероид-резистентные и стероид-чувствительные подгруппы соответственно: с акантолитической пузырчаткой 18/25 человек; с буллезным пемфигоидом 3/8; с синдромом Стивенса — Джонсона и токсическим эпидермальным некролизом 1/12. Статистический анализ данных результатов анализов стероид-резистентных и стероид-чувствительных пациентов с синдромом Стивенса — Джонсона и токсическим эпидермальным некролизом не осуществлялся ввиду незначительного количества пациентов. Основные показатели исследования: интерлейкины -10, -15, -4, фактор некроза опухоли альфа, хемотаксический белок эозинофилов, интерлейкин-8 и уровень гранулизина в сыворотке крови и пузырной жидкости больных в зависимости от наличия или отсутствия стероидной резистентности. Статистическая обработка данных проводилась с использованием пакетов программ Statistica 10.01 (StatSoft, США), Microsoft Excel 2010 (Microsoft, США) и IBM SPSS 24.0 (IBM, США). Различия считались статистически значимыми при p < 0,05.
Результаты. У больных акантолитической пузырчаткой, буллезным пемфигоидом Левера, а также синдромом Стивенса — Джонсона и токсическим эпидермальным некролизом в сыворотке крови концентрация фактора некроза опухоли-α, интерлейкина-10, гранулизина, а также хемокинов — интерлейкина-8 и эозинофильного белка была статистически значимо выше по сравнению с группой контроля (p < 0,001). У больных пузырчаткой значимо более низкий уровень фактора некроза опухоли-α, а именно — в пузырной жидкости, в отличие от сыворотки, коррелировал со стероидной резистентностью (p < 0,05), поскольку снижение уровня ключевого хемоаттрактанта нейтрофилов может свидетельствовать о нарушении рекрутинга иммунных клеток в очаг поражения, что делает его потенциальным биомаркером рефрактерного течения заболевания. В то время как в пузырной жидкости у стероидрезистентных пациентов с буллезным пемфигоидом отмечался статистически значимо высокий уровень интерлейкинов -4, -8, -15, а также гранулизина по сравнению со стероид-чувствительными больными (p < 0,05). Это подчеркивает различия в профилях воспалительных маркеров, связанных с нечувствительностью больных к гормональной терапии. Интересно, что по сравнению с группой пузырчатки большинство пациентов с буллезным пемфигоидом адекватно отвечали на терапию (8/11) системными глюкокортикостероидами. У пациентов с синдромом Стивенса — Джонсона и токсическим эпидермальным некролизом в пузырной жидкости уровень гранулизина (медиана: 12105 нг/мл) был статистически значимо выше по сравнению с пузырчаткой (медиана: 10842 нг/мл; p = 0,024) и буллезным пемфигоидом (медиана: 10 335 нг/мл; p = 0,048). Полученные данные говорят о том, что анализ данного биомаркера в пузырной жидкости может быть применен для диагностики и дифференциальной диагностики буллезных дерматозов.
Заключение. В проводимом исследовании были идентифицированы потенциальные предикторы ответа на терапию системными глюкокортикостероидами в пузырной жидкости у больных пузырчаткой и буллезным пемфигоидом. В перспективе анализ пузырной жидкости может быть использован комплементарно гистологическому методу в качестве экспресс-диагностики, дифференциальной диагностики тяжелых буллезных дерматозов, мониторинга ответа на терапию в режиме реального времени, а также прогноза тяжести течения данных заболеваний. Кроме того, это поможет своевременно назначать адъювантную терапию рефрактерным к системным стероидам пациентам с целью минимизации риска развития осложнений и побочных эффектов.
Ключевые слова
Для цитирования:
Олисова О.Ю., Лепехова А.А., Духанин А.С., Теплюк Н.П., Шимановский Н.Л., Юдин А.А. Пузырная жидкость как источник биомаркеров стероидной резистентности у больных жизнеугрожающими буллезными дерматозами: наблюдательное когортное контролируемое исследование. Кубанский научный медицинский вестник. 2025;32(4):62-81. https://doi.org/10.25207/1608-6228-2025-32-4-62-81
For citation:
Olisova O.Yu., Lepekhova A.A., Dukhanin A.S., Teplyuk N.P., Shimanovsky N.L., Yudin A.A. Blister fluid as a source of steroid resistance biomarkers in patients with life-threatening bullous dermatoses: An observational cohort controlled study. Kuban Scientific Medical Bulletin. 2025;32(4):62-81. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-4-62-81
Введение
Буллезные дерматозы (БД) представляют собой тяжелые жизнеугрожающие антитело-индуцированные орган-специфические мультифакториальные заболевания, в основе которых лежит генетическая предрасположенность [1]. Известно также, что различные эпигенетические факторы могут индуцировать формирование аутоантител против адгезивных компонентов в коже и слизистых оболочках при акантолитической пузырчатке (АП) [2] и буллезном пемфигоиде (БП) [3], с одной стороны, а с другой — в основе формирования тяжелых аллергических реакций, например, синдрома Стивенса — Джонсона (ССД) и токсического эпидермального некролиза (ТЭН) лежит СD8+ (cluster designation) Т-клеточная цитотоксичность, приводящая к тотальной отслойке эпидермиса [4].
Системные глюкокортикостероиды (СГК) представляют собой первую линию терапии АП, БП и ССД/ТЭН. Часть больных БД может не отвечать должным образом на данную терапию. В научной литературе появился термин «стероидная резистентность» (СР). Механизмы СР исследовались на уровне α- и β-изоформ глюкокортикоидных рецепторов (ГР), а также на уровне полиморфизмов генов при пузырчатке и БП [5][6].
Пузырная жидкость (ПЖ) у больных БД имеет важное значение для их диагностики и дифференциальной диагностики. Она содержит в себе большое количество потенциальных биомаркеров тяжелого и рефрактерного течения данных заболеваний, а также отражает целый комплекс биологических процессов, происходящих в организме. В состав пузырной жидкости входят экзосомальные протеины, белки, мРНК, клетки и т. д. E. H. Kowalski et al. (2019) в метаанализе продемонстрировали, что цитокиновый и хемокиновый профили ПЖ при разных БД различались. Так, при БП в ПЖ уровень IL-5 (interleukin), IL-6, CCL26 (C–C motif chemokine ligand 26) и TNF-α (tumor necrosis factor) был статистически значимо выше по сравнению с сывороткой, тогда как при АП наблюдался статистически значимо более высокий уровень IL-10, IL-17, CCL17 и CXCL8 (C–X-C motif chemokine ligand 8) в ПЖ по сравнению с сывороткой (p < 0,001) соответственно [7]. Следует отметить, что каждый из этих цитокинов и хемокинов играет свою определенную роль в патогенезе пузырных дерматозов. Следует отметить, что высокий уровень IL-17 коррелировал с тяжелым течением БП [3][8]. W. H. Chung et al. (2008) в своем исследовании показали, что введение гранулизина в кожу мышей приводило к появлению у них высыпаний, характерных для ССД/ТЭН [9]. Ряд других исследований продемонстрировал, что высокий уровень гранулизина в ПЖ и сыворотке коррелировал с более тяжелым течением ССД/ТЭН. Однако диагностическая ценность гранулизина при ССД/ТЭН остается неясной, поскольку сообщалось также о его повышенном уровне при некоторых других тяжелых дерматозах [10]. Высокий уровень TNF-α как в сыворотке, так и ПЖ коррелировал с тяжестью ССД/ТЭН [11].
I. Viard-Leveugle et al. (2013) предположили, что высокий уровень TNF-α в ПЖ достигается за счет активированных Т-клеток, что приводит к увеличению экспрессии и активности индуцируемой кератиноцитами синтетазы оксида азота, которая усиливает экспрессию Fas-лиганда, приводя к гибели этих клеток и формированию субэпидермального пузыря [12].
Однако следует отметить, что механизмы СР на уровне формирования пузыря не исследовались. Кроме того, не оценивалось влияние цитокинов IL-15, IL-10, IL-4, TNF-α, хемокинов CCL11 и CXCL8, а также гранулизина в пузырной жидкости на возможное формирование СР у больных БД.
Цель исследования: оценить цитокиновый (интерлейкин-10, -15, -4, фактор некроза опухоли альфа), хемокиновый (хемотаксический белок эозинофилов, интерлейкин 8) профили и уровень гранулизина у больных буллезными дерматозами в сыворотке и пузырной жидкости, а также их возможную взаимосвязь со стероидной резистентностью.
МЕТОДЫ
Дизайн исследования
Наблюдательное когортное контролируемое исследование проведено с участием 67 больных буллезными дерматозами со стероидной резистентностью, проходивших лечение в стационаре в специализированном дерматологическом отделении. В группу контроля вошли 43 условно здоровых добровольца (доноры крови).
Условия проведения исследования
Забор биологических материалов для анализов, лечение и наблюдение осуществлялись у пациентов с диагнозом АП и БП, госпитализированных в период с января 2020 по декабрь 2023 г. в клинику кожных и венерических болезней им. В. А. Рахманова университетской клинической больницы № 2 федерального государственного бюджетного образовательного учреждения высшего образования «Первый Московский государственный медицинский университет им. И. М. Сеченова» Министерства здравоохранения Российской Федерации (ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России (Сеченовский Университет)); пациентов с ССД/ТЭН, госпитализированных в тот же период в отделение аллергологии и иммунологии государственного бюджетного учреждения здравоохранения города Москвы «Городская клиническая больница № 24 Департамента здравоохранения города Москвы» (ГБУЗ «ГКБ № 24 ДЗМ»). Забор крови у здоровых доноров проводился в Центре крови ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России (Сеченовский Университет) в период январь — февраль 2020 г. Лабораторные исследования крови и пузырной жидкости выполнялись на кафедре молекулярной фармакологии и радиобиологии имени академика П. В. Сергеева медико-биологического факультета федерального государственного автономного образовательного учреждения высшего образования «Российский национальный исследовательский медицинский университет имени Н. И. Пирогова» Министерства здравоохранения Российской Федерации (ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России (Пироговский Университет)). Анализ полученных результатов исследования выполнялся на кафедре кожных и венерических болезней имени В. А. Рахманова ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России (Сеченовский Университет).
Критерии соответствия
Критерии включения
Для экспериментальных групп: пациенты в возрасте ≥ 18 лет, независимо от пола; впервые выявленный или ранее установленный диагноз АП, БП или ССД/ТЭН; соответствие больных критериям стероидной резистентности, разработанных D. F. Murrell et al. (2008) [13]; наличие свежих пузырей (длительностью 1–3 дня) на коже, позволяющих получить пузырную жидкость для анализа уровней биомаркеров; подписанное пациентом добровольное информированное согласие на участие в исследовании (забор биоматериалов) и использование анамнестических данных.
Для группы контроля: здоровые добровольцы в возрасте ≥ 18 лет, независимо от пола; отсутствие диагностированных хронических или острых заболеваний, включая аутоиммунные патологии, онкологические, сердечно-сосудистые (гипертоническая болезнь, ишемическая болезнь сердца и т. д.), хронические заболевания печени (цирроз, гепатит) и почек (хроническая почечная недостаточность), а также различные инфекции (острые респираторные вирусные инфекции, вирус иммунодефицита человека, грипп, гепатиты B, C, туберкулез); отсутствие приема системных и топических антибиотиков, противовирусных, иммуномодулирующих и иммуносупрессивных препаратов, а также вакцин за месяц до забора крови; подписанное добровольцем добровольное информированное согласие на участие в исследовании (забор биоматериалов) и использование анамнестических данных.
Критерии невключения
Для экспериментальных групп: несоответствие диагнозу. Например, выявление ошибочного диагноза после включения пациента в исследование при повторной гистологической и иммуногистохимической верификации, исключающей АП, БП и ССД/ТЭН; отсутствие возможности получения биоматериала: больные, у которых невозможно было получить сыворотку крови или пузырную жидкость для анализа (например, из-за отсутствия пузырей или недостаточного объема биоматериала); отказ пациента предоставить письменное добровольное информированное согласие на участие в исследовании, забор биоматериалов и использование клинических данных; беременность и лактация.
Для группы контроля: беременность и лактация.
Критерии исключения
Добровольный отказ пациента или здорового добровольца от дальнейшего участия в исследовании по любой причине после первоначального включения; невозможность получения достаточного объема сыворотки крови или пузырной жидкости (для экспериментальной группы) для анализа биомаркеров после включения (например, из-за технических трудностей при заборе или недостаточного объема пузырей); начало приема иммуномодуляторов, иммуносупрессоров, антибиотиков, противовирусных препаратов или вакцин в период исследования; развитие интеркуррентных состояний: появление новых и обострение хронических заболеваний во время исследования, которые могут повлиять на уровень биомаркеров (например: инфекции, онкологические заболевания, острые сердечно-сосудистые заболевания).
Описание критериев соответствия (диагностические критерии)
Диагноз выставлялся согласно клиническим рекомендациям по лечению АП (L10.0*), БП (L12.0*), ССД/ТЭН (L51.1/L51.2*)1, а также данных анамнеза, клинической картины, результатов реакции прямой иммунофлюоресценции, гистологического и иммуногистохимического методов исследования (табл. 1).
Подбор участников в группы
В зависимости от установленного диагноза включенные в исследование пациенты (n = 67), соответствующие критериям включения, были разделены на три группы. В первую входили пациенты с АП (n = 43), во вторую — с БП (n = 11), в третью — с ССД/ТЭН (n = 13). И группа контроля — 43 здоровых донора. В зависимости от результатов 3-недельной терапии СГК и характеристики состояния высыпаний (появление новых, увеличение старых, отсутствие заживления уже существующих элементов) в каждой группе исследования с использованием критериев консенсуса D. F. Murrell et al. (2008) [13] была проведена стратификация на стероид-резистентных (СР+) и стероид-чувствительных (СР-) пациентов. Таким образом, сформированы следующие подгруппы: АП/СР+ (n = 18) — пациенты с АП и СР; АП/СР- (n = 25) — пациенты с АП без СР; БП/СР+ (n = 3) — пациенты с БП и СР; БП/СР- (n = 8) — пациенты с БП без СР; ССД/ТЭН/СР+ (n = 1) — пациенты с ССД/ТЭН и СР; ССД/ТЭН/СР- (n = 12) — пациенты с ССД/ТЭН без СР.
Все больные АП получали начальную дозу СГК 80–100 мг/сут с последующим медленным снижением на 1/3 от максимальной начальной дозы до 60–70 мг/сут, затем через 3 недели дозу препарата снижали до 50–60 мг/сут и через неделю до 40 мг/сут, затем каждую неделю — по 10 мг до 20 мг/сут, которую больные получали в течение месяца. После чего еженедельно дозировка преднизолона снижалась на ¼ таблетки с постепенным увеличением кратности снижения. Больным БП назначалось 40–60 мг СГК в сутки. Дозировку снижали медленно по 10 мг/неделю до достижения 20 мг/сутки, которую больные получали в течение месяца, после чего доза СГК снижалась на ¼ таблетки с еженедельным увеличением кратности снижения препарата. Больные ССД/ТЭН получали пульс-терапию метилпреднизолоном в дозе 1000 мг/внутривенно 1 раз в день в течение трех дней2.
Целевые показатели исследования
Основной показатель исследования
Основным показателем исследования было выявление различий по уровням IL-4, IL-10, IL-15, TNF-α, CXCL8, CCL11 и гранулизина в сыворотке и пузырной жидкости больных в зависимости от наличия или отсутствия СР.
Дополнительные показатели исследования
Дополнительные показатели не предусмотрены.
Методы измерения целевых показателей
Забор крови и пузырной жидкости у больных производился в активную стадию заболевания (до начала лечения) и в период ремиссии на фоне снижения малых доз СГК (20 мг/день) (примерно через 3–4 недели от начала лечения). Образцы пузырной жидкости (0,2–0,5 мл) и сыворотки (5 мл) забирали с помощью стерильного шприца; образцы помещались в эппендорфы, после чего переносились в ультранизкотемпературную морозильную камеру при температуре –80 °C для хранения. Разморозка образцов осуществлялась непосредственно перед исследованием биологического материала в автоматизированной системе оттаивания ThawSTAR CFT2 (Astero Bio, США).
Концентрации цитокинов TNF-α (пг/мл), IL-4 (пг/мл), IL-15 (пг/мл), IL-10 (пг/мл), гранулизина (нг/мл), а также хемокинов CXCL8 (пг/мл), CCL11 (пг/мл) в сыворотке крови и пузырной жидкости у больных АП, БП и ССД/ТЭН определялись с использованием двух методов. Цитокины TNF-α, IL-4, IL-15, IL-10 и хемокины CXCL8, CCL11 количественно оценивались методом Cytometric Bead Array (CBA, BD Biosciences, США) с применением набора BD CBA Human Inflammatory Cytokines Kit (Thermo Fisher Scientific Inc., США) согласно инструкции производителя, обеспечивающего чувствительность в диапазоне от 2 до 5000 пг/мл. Уровень гранулизина в пузырной жидкости измерялся с помощью иммуноферментного анализа (ELISA, Human Granulysin ELISA Kit (R&D Systems, США) с чувствительностью от 15 до 4000 нг/мл, в соответствии с протоколом производителя.
Цитокины анализировали с использованием системы анализа, состоящей из наборов и панелей для иммуноанализа Millipore MILLIPLEX Human Cytokine Panel I Premixed 7 Plex [HCYTOMAG60K07] (MILLIPLEX, США). Затем образцы инкубировали с гранулами, покрытыми антителами при температуре 4 °C. Далее их инкубировали вместе с меченными биотином антителами, направленными на цитокины человека, с последующей их инкубацией со стрептавидином и фикоэритрином.
Анализ образцов сыворотки крови и пузырной жидкости для определения концентрации цитокинов TNF-α, IL-4, IL-15, IL-10 и хемокинов (CXCL8, CCL11) методом CBA проводился на приборе Luminex 200 (Luminex Corporation, США) с использованием программного обеспечения xPONENT® 3.1 (Luminex Corporation, США). Образцы обрабатывались в соответствии с протоколом набора BD CBA Human Inflammatory Cytokines Kit с двухкратным повтором для каждого образца.
Флуоресцентные сингалы от образцов сыворотки крови и пузырной жидкости, проанализированных методом CBA, регистрировались при длине волны возбуждения 635 нм и эмиссии 660 нм с последующей обработкой результатов в программном обеспечении для количественного определения концентраций биомаркеров в диапазоне от 2 до 5000 пг/мл. Для перевода единиц флуоресценции в концентрации (пг/мл) использовали стандартные кривые концентраций рекомбинантных цитокинов человека. Для преобразования интенсивности флуоресценции в концентрации биомаркеров (TNF-α, IL-4, IL-15, IL-10, CCL11, CXCL8, гранулизин) в диапазоне 2–5000 пг/мл использовались калибровочные кривые, построенные на основе рекомбинантных цитокинов человека, входящих в состав набора BD CBA Human Inflammatory Cytokines Kit (кат. № 551811). Далее калибровочные кривые генерировались с использованием 8-точечной стандартной серии разведений (2–5000 пг/мл), а данные обрабатывались в программном обеспечении xPONENT® 3.1 (Luminex Corporation, США) с применением логистической регрессии для интерполяции концентраций. Для воспроизводимости результатов все измерения выполнялись в двух повторностях с коэффициентом вариации <10 %.
В пузырной жидкости, полученной от пациентов, уровни TNF-α, IL-4, IL-15, IL-10, гранулизина, а также хемокинов CXCL8, CCL11 измеряли методом ИФА с использованием антител, распознающих эпитопы в зависимости от молекулярного веса этих цитокинов и хемокинов. Пластины были покрыты 2 мг/мл m-антителами RB-1 (MBL International Corporation, США) в стерильном фосфатно-буферном солевом растворе в течение ночи при комнатной температуре. На планшетах неспецифические сайты блокировали 1 % бычьим сывороточным альбумином в промывочном буфере (PBS, содержащий 0,1 % Tween-20) в течение часа при комнатной температуре (22–25 °C). При этом между каждой реакцией выполнялись этапы промывания: образцы или стандарты промывались в блокирующем буфере в течение 2 часов, 1 мг/мл биотинилированного моноклонального антитела RC-8 (распознающего эпитопы гранулизина) в блокирующем буфере в течение 1 часа и 2 мг/мл стрептавидина, конъюгированного с пероксидазой хрена (R&D System, США) — в промывочном буфере. Наконец планшеты инкубировали с раствором субстрата, содержащим H2O2 и тетраметилбензидин (R&D System, США), в течение 5–10 минут с инкубацией при 37 °C в темноте. Затем с помощью микропланшет-ридера Multiskan FC (Thermo scientific, США) определяли оптическую плотность каждой лунки (620 нм). Каждый образец пузырной жидкости и сыворотки больных АП, БП и ССД/ТЭН анализировали в трех технических повторах (тройные лунки на планшете) с использованием набора Human Granulysin ELISA Kit (R&D Systems, США, кат. № DY313).
Наличие СР у больных АП оценивалась с помощью консенсуса D. F. Murrell et al. (2008) [13] и характеризовалась отсутствием ответа на терапию СГК и появлением новых высыпаний, увеличением старых, а также отсутствием заживления уже существующих элементов, несмотря на 3-недельное лечение больных СГК в дозе 1,5 мг/кг/день и/или адъювантной терапией (метотрексат, азатиоприн и т. д.). Для пациентов с БП и ССД/ТЭН критерии были адаптированы с учетом клинических особенностей: СР устанавливалась при отсутствии регресса новых высыпаний, стабилизации эрозий или снижения активности заболевания (при оценке индексов BPDAI [14] и BSA [15]) спустя 3–4 недели от начала терапии СГК в дозе ≥0,5 мг/кг/день. Больные, достигшие частичной или полной ремиссии на монотерапии СГК в указанные сроки, классифицировались как стероид-чувствительные.
Переменные (предикторы, конфаундеры, модификаторы эффекта)
Искажающим фактором, способным самостоятельно влиять на результат исследования, мог быть прием дополнительных иммуносупрессивных препаратов, а также наличие других аутоиммунных и воспалительных заболеваний у больных буллезными дерматозами. Данные факторы были нивелированы на этапе формирования выборок за счет внесения их в состав критериев исключения.
Статистические процедуры
Принципы расчета размера выборки
Расчет размера выборки не проводился. В исследования включались все соответствующие критериям включения пациенты в связи с редкостью исследуемых дерматозов.
Статистические методы
Статистическая обработка данных проводилась с использованием пакетов прикладных программ Statistica 10.01 (StatSoft, США), Microsoft Excel 2010 (Microsoft, США) и IBM SPSS 24.0 (IBM, США).
Оценка нормальности распределения проводилась с помощью теста Шапиро — Уилка. При нормальном распределении данных рассчитывались средние значения (Mean) и стандартное отклонение (SD). Если дисперсии равны, то разница средних оценивалась с 95 % доверительным интервалом (ДИ) с использованием statsmodels; для проверки значимости различий применялся t-критерий Стьюдента; размер эффекта определялся с помощью индекса Коэна (d) с 95 % ДИ; для выборок n < 20 использовалась поправка Ходжеса. Если дисперсии не равны (гетероскедастичность), то использовался t-критерий Уэлча с поправкой на неравные дисперсии; размер эффекта оценивался через дельту Гласса (аналог индекса Коэна); 95 % ДИ для эффекта рассчитывался методом бутстрепа (5000 повторов). При отсутствии норамльности распределения данных: данные представлялись в виде медианы и квартилей Ме [Q1; Q3]; разница между группами оценивалась через разницу медиан по Ходжесу — Леману с 95 % ДИ (бутстреп, 5000 повторов); для проверки значимости использовался U-критерий Манна — Уитни. Для сравнения частот при анализе категориальных данных использовался точный критерий Фишера.
Результаты
Формирование выборки исследования
Согласно протоколу исследования первоначально общая когорта включала 80 больных БД. Обязательным критерием было наличие свежих пузырей на коже. Больные, у которых такие пузыри отсутствовали, в исследование включены не были (исключено 13 больных). В окончательный анализ вошли 67 больных. Группы сформированы из когорты пациентов, постоянно проживающих в г. Москве и Московской области, обратившихся за медицинской помощью самостоятельно или направленных из кожно-венерологических диспансеров (КВД), а также направленных другими специалистами дерматологического профиля коммерческих и бюджетных дерматологических и других медицинских учреждений для госпитализации в клинику кожных и венерических болезней им. В. А. Рахманова университетской клинической больницы № 2 ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России (Сеченовский Университет) и в отделение аллергологии и иммунологии ГБУЗ «ГКБ № 24 ДЗМ». В зависимости от установленного диагноза пациенты были разделены на три группы. В первую входили пациенты с АП (n = 43), во вторую — с БП (n = 11), в третью — с ССД/ТЭН (n = 13). Группу контроля составили 43 здоровых донора. После проведения 3-недельного курса СГК в каждой группе пациентов была проведена стратификация на стероид-резистентные (СР+) и стероид-чувствительные (СР-) подгруппы. По результатам анализа сформированы следующие подгруппы: АП/СР+ (n = 18) — пациенты с АП и СР; АП/СР– (n = 25) — пациенты с АП без СР; БП/СР+ (n = 3) — пациенты с БП и СР; БП/СР– (n = 8) — пациенты с БП без СР; ССД/ТЭН/СР+ (n = 1) — пациенты с ССД/ТЭН и СР; ССД/ТЭН/СР– (n = 12) — пациенты с ССД/ТЭН без СР. Пациенты подгрупп ССД/ТЭН/СР+ и ССД/ТЭН/СР– в окончательный статистический анализ не вошли ввиду незначительного количества пациентов (рис. 1).
Характеристики выборки (групп) исследования
Средний возраст больных АП был 54,4 ± 13,0 года; БП — 55,4 ± 17,2 года; ССД/ТЭН — 45,15 ± 20,5 года; средний возраст больных контрольной группы составил 51,0 ± 2,0 года. В группу АП входили 10 мужчин и 33 женщины; БП — 4 мужчины и 7 женщин; ССД/ТЭН — 3 мужчин и 10 женщин. Согласно критерию Краскела — Уоллиса и тесту Фишера можно заключить, что группы АП, БП и здоровые доноры по полу и возрасту были сопоставимы (p > 0,05; α = 0,05). Однако пациенты из группы ССД/ТЭН были несколько младше. По степени тяжести группы были не сопоставимы из-за различий распределения категорий (табл. 2). Тяжелая степень статистически значимо чаще встречалась среди больных БП и ССД/ТЭН по сравнению с АП (p = 0,001) (табл. 2).
Основные результаты исследования
Уровни цитокинов (TNF-α, IL-10, IL-15, IL-4) и хемокинов (CCL11 и CXCL8), а также гранулизина в сыворотке крови больных АП, БП, ССД/ТЭН были статистически значимо выше по сравнению с группой контроля (p < 0,001), за исключением IL-15, который у больных АП не продемонстрировал значимых различий (p = 0,09). Кроме того, уровень IL-4 был ниже во всех группах больных по сравнению со здоровыми донорами (p < 0,001) (табл. 3–5). Тенденция к более высокому уровню IL-4 и IL-15 в группе здоровых доноров (p < 0,05) могла быть связана с наличием каких-либо скрытых сопутствующих заболеваний в группе контроля, что может явиться ограничением проводимого исследования (табл. 4, 5).
При сравнении уровней биомаркеров в сыворотке между группами АП, БП, ССД/ТЭН с использованием критерия Краскела — Уоллиса значимых различий выявлено не было (p > 0,05), за исключением гранулизина, который был статистически значимо выше у больных ССД/ТЭН по сравнению с АП и БП (p < 0,001) (табл. 3–5).
В ходе статистического сравнения уровней хемокинов (CCL1, CXCL8) и цитокинов (IL-4, IL-10, TNF-α, IL-15) в сыворотке между группами больных АП, БП, ССД/ТЭН с использованием критерия Краскела — Уоллиса не было выявлено статистически значимых различий. Однако была обнаружена пограничная статистическая тенденция к межгрупповым различиям (p = 0,09) по уровню IL-15 в сыворотке, не достигшая уровня значимости в пост-хок анализе.
Для гранулизина тест Краскела — Уоллиса показал статистически значимые различия между группами. Так, был проведен пост-хок тест Данна для попарных сравнений с поправкой Холма, который подтвердил статистически значимые различия в уровне гранулизина в сыворотке между ССД/ТЭН и АП, а также между ССД/ТЭН и БП (p < 0,001), тогда как различия между АП и БП не достигли значимых различий (p = 0,39) (табл. 6).
В пузырной жидкости значимые различия выявлены только для гранулизина у больных ССД/ТЭН, где его уровень был выше по сравнению с БП и АП (p < 0,05), что подтверждает его патогенетическую роль в развитии данного заболевания. Абсолютная разница составила –2132,0 пг/мл [95 % ДИ: –9671,0…–627,0], что обосновывает включение гранулизина в алгоритмы диагностики ССД/ТЭН (табл. 7). При оценке остальных биомаркеров (TNF-α, IL-15, IL-4, IL-10, CCL11, CXCL8) не было обнаружено статистически значимых различий между группами (p > 0,05) (табл. 7).
При анализе хемокинового профиля сыворотки стероид-резистентных больных АП уровень CCL11 был статистически значимо выше по сравнению со стероид-чувствительными пациентами (p <0,001) (табл. 8). Однако в пузырной жидкости отмечался статистически значимо высокий уровень хемокина CXCL8 у стероид-чувствительных больных по сравнению со стероид-резистентными (p < 0,05) (табл. 9). По другим показателям значимых различий обнаружено не было.
Среди больных АП легкой степени преобладали стероид-чувствительные пациенты (83,4 %), тогда как стероид-резистентные составили 16,6 %. В группе средней степени количество адекватно отвечавших на терапию СГК пациентов (56 %) было несколько выше по сравнению со стероид-резистентными (44 %), тогда как среди больных с тяжелой формой заболевания с долей 83,3 % (5 из 6) преобладали больные с плохим ответом на проводимое лечение (табл. 10).
Следует отметить, что закономерность по наличию СР наблюдалась только у больных АП. Полученные данные могут быть связаны с некоторыми ограничениями исследования. Так, в связи с небольшой выборкой стероид-резистентных больных БП и ТЭН и ввиду редкости данных дерматозов статистический анализ в группе БП был ограничен и невозможен в группе ТЭН. СР наблюдалась у трех больных БП, восемь пациентов адекватно отвечали на терапию высокими дозами СГК. Нельзя не отметить, что в группе ССД/ТЭН неадекватный ответ на терапию наблюдался только у одного больного ТЭН. Остальные 12 пациентов хорошо отвечали на системную гормональную терапию. Однако при анализе показателей цитокинового, хемокинового профилей и уровня гранулизина у больных БП с помощью критерия Манна — Уитни для малых выборок надежность статистически значимых различий оценивалась с помощью доверительных интервалов, мер центральной тенденции и описательной статистики.
У рефрактерных к терапии СГК больных БП отмечалась тенденция к более высокому уровню ТNF-α в сыворотке по сравнению со стероид-чувствительными пациентами (p = 0,049). По остальным цитокинам (IL-15, IL-4, IL-10) подобной тенденции между стероид-резистентными и стероид-чувствительными больными не выявлено. Аналогичная картина наблюдалась в сыворотке больных БП и при оценке хемокинового профиля. Уровни СCL11 у пациентов с хорошим и плохим ответом на терапию были сопоставимы. Однако уровень CXCL8 демонстрировал тенденцию к более высокой концентрации у стероид-резистентных пациентов по сравнению со стероид-чувствительными. Тем не менее малый объем выборки больных исключал получение статистически значимых результатов (табл. 11).
В пузырной жидкости у больных БП с наличием СР наблюдалась тенденция к более высокой концентрации IL-15, гранулизина, CXCL8 и IL-4 по сравнению с пациентами, адекватно отвечавшими на терапию СГК, причем для некоторых из этих биомаркеров была достигнута статистическая значимость (p = 0,0317; p = 0,0485; p = 0,0121; p = 0,0241 соответственно) (табл. 12). Напротив, при оценке уровней TNF-α, IL-10 и CCL11 у стероид-резистентных и стероид-чувствительных больных значимых различий не выявлено (табл. 12).
У стероид-чувствительных пациентов с АП и БП выявлены характерные особенности цитокинового и хемокинового профилей, отражающие иммунный ответ. В группе АП среди пациентов с легкой степенью заболевания преобладали стероид-чувствительные больные — 83,4 % (10 из 12 больных), со средней — 56 % (14 из 25 пациентов), с тяжелой — 16,7 % (1 из 6) (табл. 10). В сыворотке АП уровни TNF-α (24,1 ± 8,6 пг/мл), CCL11, гранулизина, IL-15, IL-4, IL-10 и CXCL8 (57,0 пг/мл) не различались между стероид-чувствительными и резистентными пациентами (p > 0,05, табл. 8). В пузырной жидкости стероид-чувствительных больных АП уровень CXCL8 был значимо выше (157,8 ± 22,4 пг/мл против 141,0 ± 25,8 пг/мл, p < 0,05, табл. 9) по сравнению со стероид-резистентными. В группе пациентов с БП преобладали пациенты, адекватно отвечавшие на терапию СГК (8 из 11), демонстрируя сниженный уровень TNF-α в сыворотке (22 пг/мл против 38 пг/мл, p = 0,0485) и меньшие концентрации IL-15, гранулизина, CXCL8 и IL-4 в пузырной жидкости (p < 0,05, табл. 11, 12). Полученные нами данные подчеркивают различия в воспалительных маркерах, связанных с чувствительностью к глюкокортикоидам.
Дополнительные результаты исследования
В ходе выполнения исследования не запланированы и не получены.
Таблица 1. Диагностические показатели у больных буллезными дерматозами
Table 1. Diagnostic parameters in patients with bullous dermatoses
|
Диагностические критерии |
Акантолитическая пузырчатка |
Буллезный пемфигоид |
Синдром Стивенса — Джонсона и токсический эпидермальный некролиз |
|
Клинические |
Характерные пузыри и эрозии, склонные к периферическому росту, локализующиеся на коже и слизистых оболочках, с положительным феноменом Никольского |
Напряженные пузыри, воспалительные эритематозные пятна и уртикарные элементы на коже без вовлечения слизистых оболочек |
Субэпидермальные пузыри, а также положительные феномены Никольского и «носков и перчаток», обширная отслойка эпидермиса |
|
Гистологические и иммуногистохимические |
Акантолиз и внутриэпидермальный пузырь |
Субэпидермальный пузырь (иногда с эозинофильным инфильтратом) |
Некроз и/или апоптоз кератиноцитов, вакуолярная дегенерация базального слоя, приводящая к субэпидермальному расщеплению, минимальный воспалительный инфильтрат в дерме, состоящий преимущественно их CD8+ клеток |
|
Иммунологические* |
Отложение IgG и C3 компонента комплемента в клетках шиповатого или зернистого слоев эпидермиса. Выявление антител IgG к десмоглеинам 1 и 3 методом ИФА |
Положительная реакция прямой иммунофлюоресценции с линейным отложением IgG и C3 компонента комплемента вдоль базальной мембраны. Положительная ИФА с выявлением IgG к антигенам BP180 и BP230 |
Отсутствие фиксации IgG в шиповатом слое эпидермиса и/или базальной мембраны |
Примечания: таблица составлена авторами; * иммунологические критерии определены на основании результатов анализа реакции прямой иммунофлюоресценции и иммуноферментного анализа. Сокращения: ИФА — иммуноферментный анализ; Ig (immunoglobulin) — иммуноглобулин; CD (cluster of differentiation) — кластер дифференцировки, дифференцировочный антиген; С3 — бета-1-C-глобулин; BP (Bullous Pemphigoid) — антитела к антигену буллезного пемфигоида.
Notes: the table was compiled by the authors; * immunologic criteria were determined based on the results of direct immunofluorescence reaction and enzyme-linked immunosorbent assay. Abbreviations: ИФА — enzyme-linked immunosorbent assay; Ig — immunoglobulin; CD — cluster of differentiation, differentiation antigen; C3 — beta-1-C-globulin; BP — antibodies to bullous pemphigoid antigen.
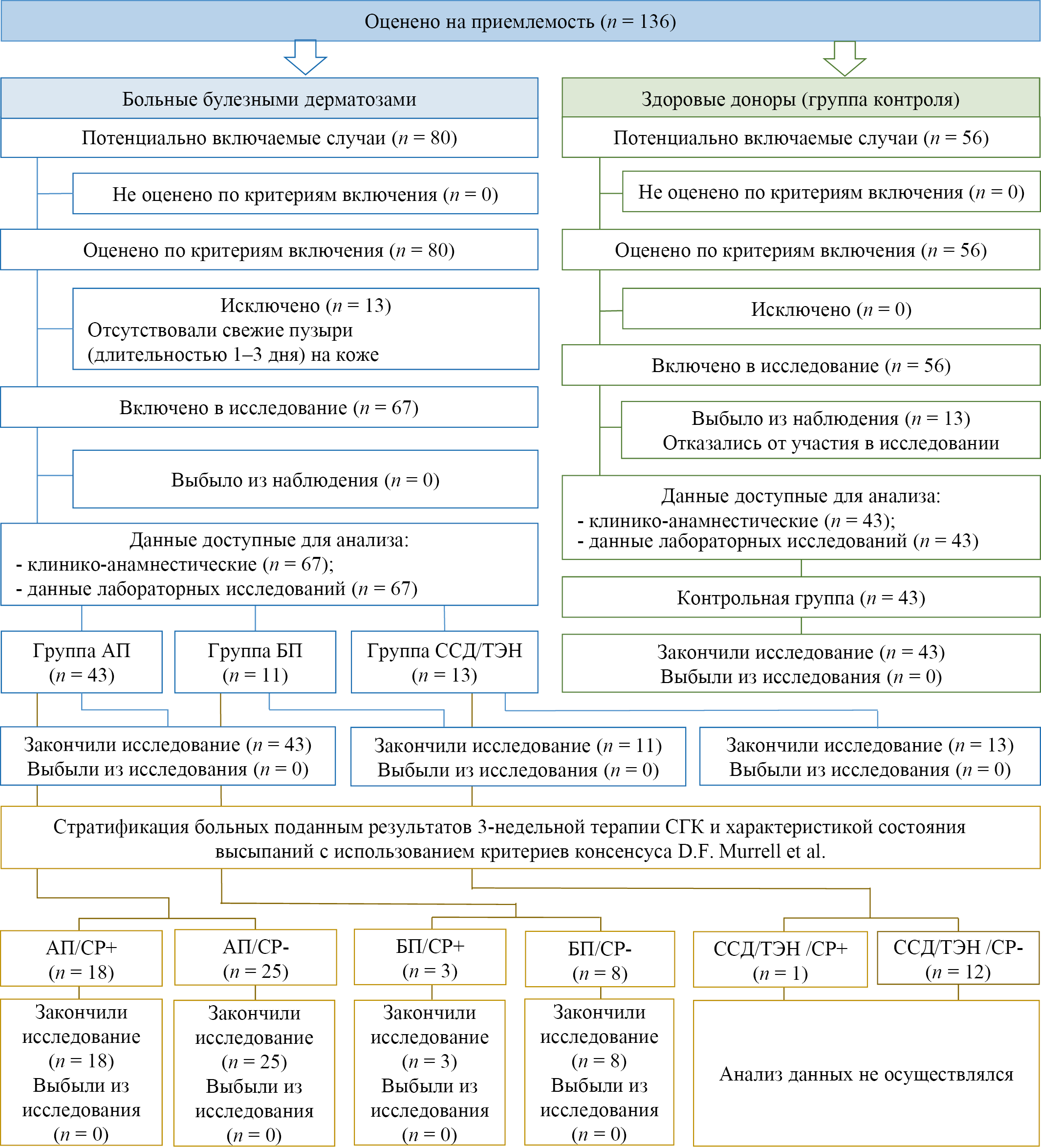
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами (согласно рекомендациям STROBE). Сокращения: АП — акантолитическая пузырчатка; БП — буллезный пемфигоид; ССД — синдром Стивенса — Джонсона; ТЭН — токсический эпидермальный некролиз; СГК — системные глюкокортикостероиды; СР+ — стероид-резистентные; СР– — стероид-чувствительные.
Fig. 1. Block diagram of the study design
Note: the block diagram was created by the authors (as per STROBE recommendations). Abbreviations: АП — pemphigus vulgaris; БП — bullous pemphigoid; ССД — Stevens — Johnson syndrome; ТЭН — toxic epidermal necrolysis; СГК — systemic glucocorticosteroids; СР+ — steroid-resistant; СР– — steroid-sensitive.
Таблица 2. Характеристики больных буллезными дерматозами и контрольной группы по возрасту, полу и степени тяжести заболевания
Table 2. Characteristics of bullous dermatoses patients and controls by age, sex, and disease severity
|
Группа
Показатель |
АП (n = 43) |
БП (n = 11) |
ССД/ТЭН (n = 13) |
Контрольная группа (n = 43) |
Уровень значимости p |
|
Средний возраст, лет, |
54,4 ± 13,0 |
55,4 ± 17,2 |
45,15 ± 20,5 |
51,0 ± 2,0 |
0,073** |
|
Пол (мужской/женский); абс. |
10/33 |
4/7 |
3/10 |
19/24 |
0,177* |
|
Степень тяжести заболевания, %, |
|||||
|
Легкая |
28 |
0 |
23 |
- |
0,110*** |
|
Средняя |
58 |
36 |
31 |
0,130*** |
|
|
Тяжелая |
14 |
64 |
46 |
0,001*** |
|
Примечания: таблица составлена авторами; * по критерию хи-квадрат, ** анализ ANOVA; *** по критерию Фишера. Сокращения: АП — акантолитическая пузырчатка; БП — буллезный пемфигоид; ССД — синдром Стивенса — Джонсона; ТЭН — токсический эпидермальный некролиз.
Notes: the block diagram was created by the authors (as per STROBE recommendations); * by Chi-square test, ** ANOVA analysis; *** by Fisher’s criterion. Abbreviations: АП — pemphigus vulgaris; БП — bullous pemphigoid; ССД — Stevens — Johnson syndrome; ТЭН — toxic epidermal necrolysis.
Таблица 3. Количественные показатели Ме [Q1; Q3] хемокинового и цитокинового профилей, а также гранулизина в сыворотке у больных акантолитической пузырчаткой и здоровых доноров
Table 3. Quantitative Me [Q1; Q3] values of chemokine and cytokine profiles, as well as granulysin in serum from pemphigus vulgaris disease patients and healthy donors
|
Показатель |
АП (n = 43) |
Контрольная группа (n = 43) |
Разность |
Уровень значимости p |
Размер эффекта (95 % ДИ) |
|
IL-4 (пг/мл) |
8,0 [ 6,0; 10,0] |
15,0 [ 11,5; 20,0] |
-7,0 [ -10,0; -5,0] |
<0,001 |
- |
|
IL-10 (пг/мл) |
50,0 [ 43,0; 65,0] |
2,9 [ 1,95; 3,7] |
47,3 [ 43,2; 53,2] |
<0,001 |
- |
|
IL-15 (пг/мл) |
11,0 [ 8,0; 15,0] |
13,0 [ 10,0; 19,5] |
-2,0 [ -5,0; 0,0] |
0,090 |
- |
|
TNF-α (пг/мл) |
25,0 [ 19,0; 31,5] |
7,0 [ 4,4; 9,15] |
17,9 [ 14,6; 22,0] |
<0,001 |
- |
|
CCL11 (пг/мл) |
76,0 [ 65,5; 83,0] |
50,3 [ 41,3; 59,3] |
25,7 [ 19,78; 31,62] |
<0,001 |
1,86 [ 1,35; 2,38] |
|
CXCL8 (пг/мл) |
53,0 [ 48,0; 59,5] |
28,0 [ 23,0; 38,0] |
24 [ 19,0; 28,0] |
<0,001 |
- |
|
Гранулизин (нг/мл) |
5575 [ 5156; 6355] |
1088 [ 933; 1343] |
4521 [ 4240; 4836] |
<0,001 |
- |
Примечание: таблица составлена авторами. Сокращения: АП — акантолитическая пузырчатка; IL (interleukin) — интерлейкин; TNF (tumor necrosis factor) — фактор некроза опухоли; CCL (C–C motif chemokine ligand) — хемокиновый лиганд с мотивом C–C; CXCL (C–X-C motif chemokine ligand) — хемокиновый лиганд с мотивом C–X-C; ДИ — доверительный интервал.
Note: the table was compiled by the authors. Abbreviations: АП — pemphigus vulgaris; IL — interleukin; TNF — tumor necrosis factor; CCL — chemokine ligand with C–C motif; CXCL — chemokine ligand with C–X-C motif; ДИ — confidence interval.
Таблица 4. Количественные показатели Ме [Q1; Q3] хемокинового и цитокинового профилей, а также гранулизина в сыворотке у больных буллезным пемфигоидом и здоровых доноров
Table 4. Quantitative Me [Q1; Q3] values of chemokine and cytokine profiles, as well as granulysin in serum from bullous pemphigoid patients and healthy donors
|
Показатель |
БП (n = 11) |
Контрольная группа (n = 43) |
Разность |
Уровень значимости p |
Размер эффекта (95 % ДИ) |
|
IL-4 (пг/мл) |
8,0 [ 5,5; 10,5] |
15,0 [ 11,5; 20,0] |
-7,0 [ 11,0; -4,0] |
<0,001 |
- |
|
IL-10 (пг/мл) |
60,0 [ 48,5; 72,5] |
2,9 [ 1,95; 3,7] |
57,9 [ 47,5; 68,3] |
<0,001 |
* |
|
IL-15 (пг/мл) |
7,0 [ 5,0; 12,0] |
13,0 [ 10,0; 19,5] |
-6,0 [ -9,0; -3,0] |
<0,01 |
- |
|
TNF-α (пг/мл) |
28,0 [ 18,0; 37,0] |
7,0 [ 4,4; 9,15] |
20,2 [ 10,6; 29,6] |
<0,001 |
- |
|
CCL11 (пг/мл) |
77,0 [ 73,5; 84,5] |
50,3 [ 41,3; 59,3] |
26,3 [ 17,4; 35,4] |
<0,001 |
1,95 [ 1,18; 2,73] |
|
CXCL8 (пг/мл) |
58,0 [ 57,0; 66,5] |
28,0 [ 23,0; 38,0] |
30,8 [ 23,8; 37,9] |
<0,001 |
2,92 [ 2,04; 3,80] |
|
Гранулизин (нг/мл) |
5393 [ 4659; 5995] |
1088 [ 933; 1343] |
4264 [ 3670; 4858] |
<0,001 |
* |
Примечания: таблица составлена авторами; * при большом различии показателей групп и/или низкого SD контроля размер эффекта не рассчитывается, так как получаемые значения кратно превосходят интерпретируемые пороги. Сокращения: БП — буллезный пемфигоид; IL (interleukin) — интерлейкин; TNF (tumor necrosis factor) — фактор некроза опухоли; CCL (C–C motif chemokine ligand) — хемокиновый лиганд с мотивом C–C; CXCL (C–X-C motif chemokine ligand) — хемокиновый лиганд с мотивом C–X-C; ДИ — доверительный интервал.
Notes: the table was compiled by the authors; * no effect size is calculated for large group differences and/or low SD of controls because the resulting values are multiples of the interpretable thresholds. Abbreviations: БП — bullous pemphigoid; IL — interleukin; TNF — tumor necrosis factor; CCL — chemokine ligand with C–C motif; CXCL — chemokine ligand with C–X-C motif; ДИ — confidence interval.
Таблица 5. Количественные показатели Ме [Q1; Q3] хемокинового и цитокинового профилей, а также гранулизина в сыворотке у больных с синдромом Стивенса — Джонсона и токсическим эпидермальным некролизом и здоровых доноров
Table 5. Quantitative Me [Q1; Q3] values of chemokine and cytokine profiles, as well as granulysin in serum from patients with Stevens — Johnson syndrome and toxic epidermal necrolysis and healthy donors
|
Показатель |
ССД/ТЭН (n = 13) |
Контрольная группа (n = 43) |
Разность |
Уровень значимости p |
Размер эффекта (95 % ДИ) |
|
IL-4 (пг/мл) |
9,0 [ 6,0; 11,0] |
15,0 [ 11,5; 20,0] |
-7,0 [ -10,0; -4,0] |
<0,001 |
- |
|
IL-10 (пг/мл) |
45,0 [ 24,0; 74,0] |
2,9 [ 1,95; 3,7] |
44,5 [ 26,2; 62,8] |
<0,001 |
* |
|
IL-15 (пг/мл) |
9,0 [ 6,0; 13,0] |
13,0 [ 10,0; 19,5] |
-4,0 [ -8,0; -1,0] |
<0,01 |
- |
|
TNF-α (пг/мл) |
24,0 [ 17,0; 39,0] |
7,0 [ 4,4; 9,2] |
17,9 [ 11,0; 33,6] |
<0,001 |
- |
|
CCL11 (пг/мл) |
79,0 [ 64,0; 103,0] |
50,3 [ 41,3; 59,3] |
29,9 [ 12,2; 47,6] |
<0,01 |
2,20 [ 1,07; 3,69] |
|
CXCL8 (пг/мл) |
52,0 [ 45,0; 57,0] |
28,0 [ 23,0; 38,0] |
20,7 [ 14,3; 27,1] |
<0,001 |
2,03 [ 1,29; 2,77] |
|
Гранулизин (нг/мл) |
8765 [ 7896; 11237] |
1088 [ 933; 1343] |
8570 [ 7476; 9663] |
<0,001 |
* |
Примечания: таблица составлена авторами; * при большом различии показателей групп и/или низкого SD контроля размер эффекта не рассчитывается, так как получаемые значения кратно превосходят интерпретируемые пороги. Сокращения: ССД — синдром Стивенса — Джонсона; ТЭН — токсический эпидермальный некролиз; IL (interleukin) — интерлейкин; TNF (tumor necrosis factor) — фактор некроза опухоли; CCL (C–C motif chemokine ligand) — хемокиновый лиганд с мотивом C–C; CXCL (C–X-C motif chemokine ligand) — хемокиновый лиганд с мотивом C–X-C; ДИ — доверительный интервал.
Notes: the table was compiled by the authors; * no effect size is calculated for large group differences and/or low SD of controls because the resulting values are multiples of the interpretable thresholds. Abbreviations: ССД — Stevens — Johnson syndrome; ТЭН — toxic epidermal necrolysis; IL — interleukin; TNF — tumor necrosis factor; CCL — chemokine ligand with C–C motif; CXCL — chemokine ligand with C–X-C motif; ДИ — confidence interval.
Таблица 6. Результаты пост-хок теста Данна с поправкой Холма для попарного сравнения уровней гранулизина в сыворотке у больных буллезными дерматозами
Table 6. Results of the Dunn’s post-hoc test with the Holm correction for pairwise comparison of serum granulysin levels in patients with bullous dermatoses
|
Группы |
Разность медиан (95 % ДИ) |
Уровень значимости p |
|
АП (n = 43) против БП (n = 11) |
182 [ -280; 908] |
0,390 |
|
АП (n = 43) против ССД/ТЭН (n = 13) |
-3190 [ -5349; -2556] |
<0,001 |
|
БП (n = 11) против ССД/ТЭН (n = 13) |
-3372 [ -5844; -2979] |
<0,001 |
Примечание: таблица составлена авторами. Сокращения: АП — акантолитическая пузырчатка; БП — буллезный пемфигоид; ССД — синдром Стивенса — Джонсона; ТЭН — токсический эпидермальный некролиз; ДИ — доверительный интервал.
Note: the table was compiled by the authors. Abbreviations: АП — pemphigus vulgaris; БП — bullous pemphigoid; ССД — Stevens — Johnson syndrome; ТЭН — toxic epidermal necrolysis; ДИ — confidence interval.
Таблица 7. Количественные показатели Ме [Q1; Q3] уровня цитокинов, хемокинов и гранулизина у больных буллезными дерматозами в пузырной жидкости с попарными сравнениями
Table 7. Quantitative Me [Q1; Q3] values of chemokine and cytokine profiles, as well as granulysin in patients with bullous dermatoses in blister fluid with pairwise comparisons
|
Показатель |
АП (n = 43) |
БП (n = 11) |
ССД/ТЭН (n = 13) |
Уровень значимости p |
|
IL-4 (пг/мл) |
15,0 [ 13,0; 20,0] |
21,0 [ 10,0; 31,0] |
12,0 [ 7,0; 18,0] |
0,1451 |
|
IL-10 (пг/мл) |
106,0 [ 88,5; 154,5] |
122,0 [ 98,0; 132,5] |
106,0 [ 78,0; 131,0] |
0,6931 |
|
IL-15 (пг/мл) |
22,0 [ 14,5; 27,5] |
22,0 [ 11,5; 28,5] |
18,0 [ 12,0; 24,0] |
0,5461 |
|
TNF-α (пг/мл) |
58,0 [ 46,5; 74,5] |
54,0 [ 51,5; 61,5] |
63,0 [ 44,0; 78,0] |
0,9751 |
|
CCL11 (пг/мл) |
173,0 [ 147,5; 187,5] |
172,0 [147,0; 179,0] |
167,0 [144,0; 210,0] |
0,7921 |
|
CXCL8 (пг/мл) |
150,0 [ 132,0; 162,5] |
166,0 [ 150,5; 181,5] |
150,0 [ 142,0; 167,0] |
0,1351 |
|
Гранулизин (нг/мл) |
10842 [ 9415; 13209] |
10335 [ 9617; 10748] |
12105 [ 10987; 20765] |
0,0502 |
Примечание: таблица составлена авторами; 1p (Краскела — Уоллиса) отражает общую значимость различий между группами; 2p при попарном сравнении групп с использованием пост-хок теста Данна с поправкой Холма: рАП-БП = 0,366; рАП-ССД/ТЭН = 0,063; рБП-ССД/ТЭН = 0,049. Сокращения: АП — акантолитическая пузырчатка; БП — буллезный пемфигоид; ССД — синдром Стивенса — Джонсона; ТЭН — токсический эпидермальный некролиз; IL (interleukin) — интерлейкин; TNF (tumor necrosis factor) — фактор некроза опухоли; CCL (C–C motif chemokine ligand) — хемокиновый лиганд с мотивом C–C; CXCL (C–X-C motif chemokine ligand) — хемокиновый лиганд с мотивом C–X-C; ДИ — доверительный интервал.
Note: the table was compiled by the authors; 1p (Kraskell — Wallis) reflects the overall significance of differences between groups; 2p when groups were compared in pairs using the Dunn’s post-hoc test with the Holm correction: рАП-БП = 0.366; рАП-ССД/ТЭН = 0.063; рБП-ССД/ТЭН = 0.049. Abbreviations: АП — pemphigus vulgaris; БП — bullous pemphigoid; ССД — Stevens — Johnson syndrome; ТЭН — toxic epidermal necrolysis; IL — interleukin; TNF — tumor necrosis factor; CCL — chemokine ligand with C–C motif; CXCL — chemokine ligand with C–X-C motif; ДИ — confidence interval.
Таблица 8. Количественные показатели Ме [Q1; Q3] и Mean ± SD уровня цитокинов, хемокинов и гранулизина в сыворотке у больных акантолитической пузырчаткой в зависимости от наличия/отсутствия стероидной резистентности
Table 8. Quantitative Me [Q1; Q3] and Mean ± SD values of serum levels of cytokines, chemokines, and granulysin in pemphigus vulgaris patients depending on the presence/absence of steroid resistance
|
Показатель |
АП/СР+ (n = 18) |
АП/СР- (n = 25) |
Разность (95 % ДИ) |
Уровень значимости p |
Размер эффекта (95 % ДИ) |
|
IL-4 (пг/мл) |
8,0 [ 6,0; 9,75] |
8,0 [ 6,0; 10,0] |
0,0 [ -2,0; 2,0] |
0,930 |
- |
|
IL-10 (пг/мл) |
46,5 [ 43,0; 57,25] |
54,0 [ 46,0; 67,0] |
-6,0 [ -14,0, 2,0] |
0,130 |
- |
|
IL-15 (пг/мл) |
12,0 [ 8,25; 17,25] |
11,0 [ 7,0; 15,0] |
1,0 [ -2,0; 5,0] |
0,530 |
- |
|
ТNF-α (пг/мл) |
25,8 ± 7,6 |
24,1 ± 8,6 |
1,7 [ -3,27; 6,72] |
0,490 |
0,21 [ -0,41; 0,83] |
|
CCL11 (пг/мл) |
76 |
48 |
28,0 |
<0,001 |
0,59 |
|
CXCL8 (пг/мл) |
51,0 [ 44,25; 57,25] |
57,0 [ 50,0; 61,0] |
-6,0 [ -11,0; 1,0] |
0,110 |
- |
|
Гранулизин (нг/мл) |
5698 ± 1192 |
5783 ± 1050 |
-85 [ -779; 608] |
0,810 |
-0,08 [ -0,69; 0,54] |
Примечание: таблица составлена авторами. Сокращения: АП — акантолитическая пузырчатка; СР — стероидная резистентность; IL (interleukin) — интерлейкин; TNF (tumor necrosis factor) — фактор некроза опухоли; CCL (C–C motif chemokine ligand) — хемокиновый лиганд с мотивом C–C; CXCL (C–X-C motif chemokine ligand) — хемокиновый лиганд с мотивом C–X-C; ДИ — доверительный интервал.
Note: the table was compiled by the author. Abbreviations: АП — pemphigus vulgaris; СР — steroid resistance; IL — interleukin; TNF — tumor necrosis factor; CCL — chemokine ligand with C–C motif; CXCL — chemokine ligand with C–X-C motif; ДИ — confidence interval
Таблица 9. Количественные показатели Ме [Q1; Q3] и Mean ± SD уровня цитокинов, хемокинов и гранулизина в пузырной жидкости у больных акантолитической пузырчаткой в зависимости от наличия/отсутствия стероидной резистентности
Table 9. Quantitative Me [Q1; Q3] and Mean ± SD values of cytokine, chemokine, and granulysin levels in blister fluid of pemphigus vulgaris patients depending on the presence/absence of steroid resistance
|
Показатель |
АП/СР+ (n = 18) |
АП/СР- (n = 25) |
Разность (95 % ДИ) |
Уровень значимости p |
Размер эффекта (95 % ДИ) |
|
IL-4 (пг/мл) |
16,5 [ 15,0; 20,75] |
14,0 [ 12,0; 19,0] |
3,0 [ 0,0; 6,0] |
0,070 |
- |
|
IL-10 (пг/мл) |
100,0 [ 91,5; 151,5] |
108,0 [ 87,0; 156,0] |
0,5 [ -19,5; 21,0] |
0,999 |
- |
|
IL-15 (пг/мл) |
21,5 [ 14,25; 26,0] |
22,0 [ 16,0; 28,0] |
0,0 [ -7,0; 7.0] |
0,971 |
- |
|
TNF-a (пг/мл) |
55,5 [ 43,5; 65,75] |
67,0 [ 50,0; 79,0] |
-8,0 [ -20,0; 4,0] |
0,181 |
- |
|
CCL11 (пг/мл) |
162,4 ± 35,7 |
177,6 ± 28,0 |
-15,2 [ 35,0; 4,6] |
0,130 |
-0,47 [ -1,10; 0,15] |
|
CXCL8 (пг/мл) |
141,0 ± 25,8 |
157,8 ± 22,4 |
-16,8 [ -31,8; –1,96] |
< 0,05 |
-0,70 [ -1,33; –0,06] |
|
Гранулизин (нг/мл) |
11164 ± 3663 |
11216 ± 3388 |
-53 [ -2228; 2123] |
0,960 |
-0,02 [ -0,63; 0,60] |
Примечание: таблица составлена авторами. Сокращения: АП — акантолитическая пузырчатка; СР — стероидная резистентность; IL (interleukin) — интерлейкин; TNF (tumor necrosis factor) — фактор некроза опухоли; CCL (C–C motif chemokine ligand) — хемокиновый лиганд с мотивом C–C; CXCL (C–X-C motif chemokine ligand) — хемокиновый лиганд с мотивом C–X-C; ДИ — доверительный интервал.
Note: the table was compiled by the author. Abbreviations: АП — pemphigus vulgaris; СР — steroid resistance; IL — interleukin; TNF — tumor necrosis factor; CCL — chemokine ligand with C–C motif; CXCL — chemokine ligand with C–X-C motif; ДИ — confidence interval.
Таблица 10. Распределение больных с диагнозом «акантолитическая пузырчатка» в зависимости от наличия стероидной резистентности и степени тяжести
Table 10. Distribution of patients diagnosed with pemphigus vulgaris according to the presence of steroid resistance and severity level
|
Степень тяжести |
Стероид-резистентные абс./ % |
Стероид-чувствительные абс./ % |
Общее количество больных (n) |
|
Легкая |
2 (16,6 %) |
10 (83,4 %) |
12 |
|
Средняя |
11 (44 %) |
14 (56 %) |
25 |
|
Тяжелая |
5 (83,3 %) |
1 (16,7 %) |
6 |
Примечание: таблица составлена авторами.
Note: the table was compiled by the author.
Таблица 11. Количественные показатели Ме [Q1; Q3] уровня цитокинов, хемокинов и уровня гранулизина в сыворотке у больных буллезным пемфигоидом в зависимости от наличия/отсутствия стероидной резистентности
Table 11. Quantitative Me [Q1; Q3] values of cytokine, chemokine, and granulysin levels in serum from patients with bullous pemphigoid depending on the presence/absence of steroid resistance
|
Показатель |
БП/СР+ (n = 3) |
БП/СР- (n = 8) |
Разность (95 % ДИ) |
Уровень значимости p |
|
IL-4 (пг/мл) |
8 [ 8; 12] |
7,5 [ 5; 10,25] |
3,0 [ -2,00; 9,00] |
0,473 |
|
IL-10 (пг/мл) |
70 [ 69; 78,5] |
50,5 [ 46,25; 63,75] |
20,5 [ 1,5; 37,0] |
0,133 |
|
IL-15 (пг/мл) |
5 [ 4,5; 7,5] |
9,5 [ 6,5; 12,25] |
-2,5 [ -8,0; 2,50] |
0,304 |
|
ТNF-α (пг/мл) |
38 [ 37; 39] |
22 [ 15,25; 28,5] |
16,0 [ 8,0; 24,5] |
0,049 |
|
CCL11 (пг/мл) |
77 [ 74,5; 86] |
78,50 [ 70,00; 83,25] |
3,5 [ -10,0; 20,0] |
0,838 |
|
CXCL8 (пг/мл) |
73 [ 66; 77] |
57,5 [ 56,25; 58,5] |
15,0 [ 1,0; 24,0] |
0,081 |
|
Гранулизин (нг/мл) |
6424 [ 5488; 6704,5] |
5153,5 [ 4707,5; 5636,0] |
934,5 [ -698,0; 2071,0] |
0,279 |
Примечания: таблица составлена авторами; p-value — рассчитано по критерию Манна — Уитни. Сокращения: БП — буллезный пемфигоид; СР — стероидная резистентность; IL (interleukin) — интерлейкин; TNF (tumor necrosis factor) — фактор некроза опухоли; CCL (C–C motif chemokine ligand) — хемокиновый лиганд с мотивом C–C; CXCL (C–X-C motif chemokine ligand) — хемокиновый лиганд с мотивом C–X-C; ДИ — доверительный интервал.
Notes: the table was compiled by the author; p-value is calculated by Mann — Whitney criterion. Abbreviations: БП — bullous pemphigoid; СР — steroid resistance; IL — interleukin; TNF — tumor necrosis factor; CCL — chemokine ligand with C–C motif; CXCL — chemokine ligand with C–X-C motif; ДИ — confidence interval.
Таблица 12. Количественные показатели Ме [Q1; Q3] уровня цитокинов, хемокинов и уровня гранулизина в пузырной жидкости у больных буллезным пемфигоидом в зависимости от наличия/отсутствия стероидной резистентности
Table 12. Quantitative Me [Q1; Q3] values of cytokine, chemokine, and granulysin levels in blister fluid of bullous pemphigoid patients depending on the presence/absence of steroid resistance
|
Показатель |
БП/СР+ (n = 3) |
БП/СР- (n = 8) |
Разность (95 % ДИ) |
Уровень |
|
IL-4 (пг/мл) |
35 [ 33; 36] |
13,00 [ 9,75; 23,25] |
21,0 [ 7,0; 27,0] |
0,024 |
|
IL-10 (пг/мл) |
130,0 [ 129,5; 134,5] |
108,00 [ 90,75; 125,25] |
26,0 [ 2,0; 51,0] |
0,133 |
|
IL-15 (пг/мл) |
32,0 [ 29,5; 33,5] |
13,5 [ 10,0; 22,75] |
18,0 [ 5,0; 23,5] |
0,032 |
|
ТNF-α (пг/мл) |
58 [ 55; 69.5] |
53,5 [ 50,5; 57,5] |
4,5 [ -4,5; 28.0] |
0,497 |
|
CCL11 (пг/мл) |
183 [ 168; 184] |
164,00 [ 139,25; 175,75] |
11,5 [ -12,5; 44,0] |
0,194 |
|
CXCL8 (пг/мл) |
186,0 [ 185,5; 187,5] |
154,5 [ 148,75; 166,5] |
32,5 [ 18,5; 40,5] |
0,012 |
|
Гранулизин (нг/мл) |
13 450 [ 11 905; 14 231,5] |
9899,5 [ 9533,75; 10 351,5] |
3550,5 [ 347,5; 5187,0] |
0,049 |
Примечания: таблица составлена авторами; p — рассчитано по критерию Манна — Уитни. Сокращения: БП — буллезный пемфигоид; СР — стероидная резистентность; IL (interleukin) — интерлейкин; TNF (tumor necrosis factor) — фактор некроза опухоли; CCL (C–C motif chemokine ligand) — хемокиновый лиганд с мотивом C–C; CXCL (C–X-C motif chemokine ligand) — хемокиновый лиганд с мотивом C–X-C; ДИ — доверительный интервал.
Notes: the table was compiled by the author; p is calculated by Mann — Whitney criterion. Abbreviations: БП — bullous pemphigoid; СР — steroid resistance; IL — interleukin; TNF — tumor necrosis factor; CCL — chemokine ligand with C–C motif; CXCL — chemokine ligand with C–X-C motif; ДИ — confidence interval.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Из проводимого исследования следует сделать вывод, что уровень большинства цитокинов (ТNF-α, IL-10) и хемокинов (CCL11, CXCL8), а также гранулизина у БД был статистически значимо выше по сравнению со здоровыми донорами (p < 0,001). Уровень хемокинов ТNF-α, IL-15, IL-4, IL-10, а также хемокинов CCL11, CXCL8 и гранулизина отличался от такового в пузырной жидкости у стероид-резистентных и стероид-чувствительных больных БД. Так, у больных АП, которые адекватно отвечали на терапию СГК в пузырной жидкости, наблюдался статистически значимо высокий уровень хемокина CXCL8, (p = 0,0391), тогда как в сыворотке у этих больных, наоборот, на достоверно высоком уровне по сравнению с остальными цитокинами и хемокинами находился CCL11 (p < 0,001). При БП пузырная жидкость показала наиболее высокий уровень IL-15, IL-4, гранулизина а также CXCL8 у стероид-резистентных пациентов (p < 0,0485). Это косвенно подтверждает роль Th2- и NK-клеток в развитии СР. У больных ССД/ТЭН статистически значимых результатов выявлено не было. Это связано с тем, что такие пациенты обычно адекватно отвечают на терапию СГК и высокая смертность у этих больных все-таки связана с тяжестью течения ССД/ТЭН.
Ограничения исследования
В связи с редкостью представляемых дерматозов в исследование удалось рекрутировать относительно небольшое количество больных, что могло послужить причиной возникновения систематической ошибки отбора (selection bias). Таким образом, в перспективе для устранения потенциальных ошибок необходимо проведение мультицентровых исследований на большой выборке больных (от 1000 человек и более) с целью подтверждения полученных нами результатов. Малый размер выборки для ССД/ТЭН (n = 13), обусловленной крайней редкостью данного заболевания согласно эпидемиологическим данным, мог снизить мощность анализа, что представляет собой потенциальное ограничение исследования.
Интерпретация результатов исследования
Стероидная резистентность при БД, в особенности при пузырчатке, представляет большую проблему, поскольку это может приводить развитию серьезных осложнений, вызванных как самим заболеванием, так и высокими дозами СГК.
Хемокины представляют собой небольшие белки, которые играют ключевую роль в регуляции миграции и активации иммунных клеток. Они могут способствовать воспалению и аутоиммунным процессам, включая БД. Хемокины могут привлекать макрофаги и T-лимфоциты в очаг воспаления, тем самым усиливая аутоиммунный процесс [16]. Помимо всего прочего СГК могут оказывать влияние на изменение экспрессии рецепторов к хемокинам на поверхности клеток, что может приводить к развитию СР [17]. Некоторые хемокины могут активировать сигнальные пути, которые противодействуют основным механизмам СГК, а также могут изменять микроокружение тканей, приводя к снижению противовоспалительного эффекта стероидов [14]. Например, хемокин CXCL8, известный как интерлейкин-8 (IL-8), играет важную роль в воспалительных процессах и привлечении нейтрофилов к месту воспаления. Он способствует миграции нейтрофилов и других иммунных клеток к очагу воспаления. В исследованиях было показано, что при АП это может усиливать местный воспалительный ответ и приводить к повреждению тканей [16]. Кроме того, отмечено, что CXCL8 способствовал активации Th17-иммунного ответа, который отвечает за формирование акантолиза и клеточную адгезию при АП. Было также продемонстрировано, что достоверно высокий уровень CXCL8 в сыворотке коррелировал с более тяжелым течением множества дерматологических заболеваний [18–20].
Согласно данным литературы, хемокин CCL11 может усиливать иммунный ответ при БД. По данным исследований высокий уровень CCL11 достоверно чаще встречался в сыворотке у больных БП с распространенными высыпаниями. CCL11 также участвует в рекрутинге эозинофилов в место воспаления посредством связывания с рецептором CCR3 (C–C chemokine receptor), экспрессируемом на их поверхности [21].
В данной работе при оценке хемокинового профиля у стероид-чувствительных больных АП статистически значимо высокий уровень хемокина CXCL8 наблюдался в пузырной жидкости по сравнению со стероид-резистентными. Такая разница по уровню хемокинов в сыворотке и пузырной жидкости может указывать на то, что в блистерной жидкости они вырабатываются клетками локально непосредственно в месте формирования пузыря и не связаны с системным кровотоком [22][23]. Кроме того, снижение уровня ключевого хемоаттрактанта нейтрофилов может указывать на нарушение рекрутинга иммунных клеток в очаг поражения, что делает CXCL8 потенциальным биомаркером рефрактерного течения заболевания. В сыворотке цитокины и хемокины также могут связываться с рецепторами клеток, что проявляется их более низким уровнем в ней по сравнению с пузырной жидкостью. Кроме того, это связано с активацией местного иммунного ответа, приводя к увеличению уровня определенных цитокинов в пузырной жидкости, тогда как в сыворотке он может оставаться нормальным или изменяться незначительно. Таким образом, различия в концентрациях цитокинов и хемокинов в сыворотке и пузырной жидкости отражают сложные взаимодействия между местными и системными иммунными ответами, что требует дальнейшего исследования [7].
Известно, что и определенные цитокины могут влиять на формирование аутоантител при БД. Их можно классифицировать на цитокины Th1 (T helper cells) типа (IL-2, IL-12, IL-18, IFN-γ (IFN-γ)), Th2 типа (IL-4, IL-5, IL-6, IL-10, IL-13), Th17 типа (IL-17, IL-22, IL-23), Treg (regulatory T cells) типа (IL-10, трансформирующий фактор роста — TGF-β (transforming growth factor)) и провоспалительные цитокины (IL-1, IL-8, TNF-α) [20]. Предыдущие исследования указывали на высокий уровень IL-4, IL-6 и IL-10 в сыворотке, что подтверждает роль пути Th2 в патогенезе АП [24]. R. S. Chriguer et al. (2012) при исследовании цитокинового профиля больных АП обнаружили более высокий уровень IL-6 и TNF-α, секретируемых мононуклеарными клетками крови, у больных АП по сравнению с группой контроля даже после стимуляции клеток конкавалином-A и дексаметазоном (p < 0,001), что косвенно может свидетельствовать о их роли в развитии СР [25].
Повышенный уровень IL-10 у больных БП (60,0 пг/мл) по сравнению с АП (50,0 пг/мл, p = 0,225) отражает компенсаторную иммуносупрессию и может служить предиктором хорошего ответа на глюкокортикоиды.
Что касается тяжелых буллезных аллергических реакций, в частности ССД/ТЭН, то в исследовании O. Correia et al. (2002) уровень IL-6, IL-10 (p < 0,018) и ТNF-α (p = 0,028) в пузырной жидкости больных ТЭН был статистически значимо выше по сравнению с сывороткой [26].
Следует отметить, что в проводимом исследовании наблюдались ограничения в виде малой выборки больных БП. Тем не менее наблюдались некие тенденции в различии по хемокиновому профилю. У пациентов с БП, не поддающихся лечению СГК, наблюдался повышенный уровень TNF-α в сыворотке по сравнению с теми, кто адекватно отвечал на терапию стероидами. Эти результаты согласуются с предыдущими исследованиями, которые выявили более тяжелое течение АП и БП у больных с достоверно высоким уровнем TNF-α как в сыворотке крови, так и в пузырной жидкости [20]. Однако в пузырной жидкости цитокиновый и хемокиновый состав в зависимости от наличия или отсутствия СР у больных БП также отличался от такого в сыворотке. Так, у стероид-резистентных больных БП в пузырной жидкости отмечалась склонность к более высокому уровню IL-15, гранулизина, CXCL8 и IL-4. Полученные данные косвенно подтверждают роль влияния Th2-клеток на развитие СР. Однако для подтверждения тенденций необходимо проведение исследования на более крупной и релевантной выборке пациентов.
Как известно, IL-4 стимулирует B-клетки к продукции IgE и других классов антител, которые затем атакуют структурные белки кожи, а также способствует миграции и активации эозинофилов и других воспалительных клеток. Кроме того, IL-4 также принимает участие в дифференцировке Т-клеток в Th2-клетки, которые играют важную роль в формировании аллергических реакций и воспалительных процессов. Это говорит о том, что данный механизм усиливает воспалительные реакции, приводя к рефрактерному течению заболевания и посредством влияния на уровень гранулизина (ГР) [27]. Например, E. Goleva et al. (2008) продемонстрировали, что комбинация IL-2/IL-4 ингибировала ядерную транслокацию α-изоформы ГР в Т-клетках человека, и этот эффект устранялся с помощью IFN-γ посредством ингибирования активации p38 MAPK (mitogen-activated protein kinases) [27].
IL-15 также, согласно исследованиям, менял экспрессию ГР на лимфоцитах. Авторами было продемонстрировано, что СГК в сочетании с IL-15 в культурах клеток CD56+, полученных из периферической крови, индуцировали повышенную экспансию клеток CD56+CD3-, проявляя высокую цитолитическую активность и высокую продукцию IFN-γ, приводя к активации экспрессии рецепторов, включая NKp30 (natural killer), NKp44, NKp46, 2B4, NKG2D (natural killer group) и DNAM-1 (DNAX Accessory Molecule). Более того, СГК защищали NK-клетки от гибели, вызванной IL-15 [28][29].
Гранулизин, представляющий собой антимикробный пептид, играет одну из ключевых ролей в патогенезе ТЭН. Он вырабатывается NK-клетками и индуцирует диссеминированную гибель кератиноцитов, приводя к отслойке эпидермиса, что подтверждает его цитотоксическое действие. Кроме того, он может привлекать другие иммунные клетки к месту воспаления, а также обладает антимикробным действием, защищая кожу от вторичных бактериальных инфекций [30]. Это подтверждается исследованием Y. Yang et al. (2017), показавшим вариабельность уровня sTRAIL (soluble TNF-related apoptosis-inducing ligand), IFN-γ, TNF-α, FasL (Fas ligand) и гранулизина в сыворотке и пузырной жидкости у больных ССД/ТЭН [31, 32]. В ходе проводимого нами анализа уровня гранулизина в пузырной жидкости у пациентов с АП, БП и ССД/ТЭН было обнаружено его статистически значимое повышение у больных с ССД/ТЭН (p < 0,05) (табл. 6). Эти результаты позволяют рассматривать гранулизин как потенциальный дифференциально-диагностический биомаркер для различных буллезных дерматозов. Кроме того, гранулизин также можно рассматривать в качестве маркера ранней диагностики ССД/ТЭН [33].
Помимо всего прочего, механизмы СР исследовались и на уровне генных механизмов, в частности ассоциаций с различными полиморфизмами гена NR3C1 (nuclear receptor subfamily 3, group C, member 1), кодирующего экспрессию β-изоформы ГР — доминантного ингибитора классической α-изоформы ГР, которая непосредственно связывается с гормоном. Этот механизм был представлен у больных бронхиальной астмой, ревматоидным артритом, анемией Даймонда Блекфена и красной волчанкой [34][35]. Так, при оценке полиморфизмов гена NR3C1 S. Y. Fang et al. (2017) показали, что полиморфизмы rs11745958 C/T (OR: 8.95) и rs17209237 A/G (OR: 4.07) ассоциировались с высоким риском развития рефрактерного течения АП, в то время как rs33388 A/T (OR: 0,45) и rs7701443 A/G (OR: 0,51), наоборот, были связаны с хорошим ответом на терапию СГК [6].
Таким образом, пузырная жидкость является источником потенциальных биомаркеров тяжести и рефрактерного течения БД, которая может быть использована комплементарно гистологическому методу исследования для отражения клинически значимых данных в режиме реального времени, включая прогнозирование СР, тяжести течения и исхода этих тяжелых заболеваний.
Заключение
В проведенном исследовании были идентифицированы потенциальные предикторы ответа на терапию СГК в пузырной жидкости у больных пузырчаткой. Кроме того, уровень показателей у всех пациентов был выше в пузырной жидкости по сравнению с сывороткой, что говорит о том, что она позволяет более точно и прицельно оценить уровень воспаления локально, непосредственно в месте формирования пузыря. Таким образом, можно сделать вывод, что ее анализ в перспективе может быть использован комплементарно гистологическому методу в качестве экспресс-диагностики, дифференциальной диагностики тяжелых БД, мониторинга ответа на терапию в режиме реального времени, а также прогноза тяжести течения данных заболеваний. Кроме того, это поможет своевременно назначать адъювантную терапию рефрактерным к СГК больным с целью минимизации риска развития осложнений и побочных эффектов.
1 Общероссийская общественная организация «Российское общество дерматовенерологов и косметологов». Клинические рекомендации. Пузырчатка. 2020.
Общероссийская общественная организация «Российское общество дерматовенерологов и косметологов». Клинические рекомендации. Буллезный пемфигоид. 2020.
Российское общество дерматовенерологов и косметологов. Федеральные клинические рекомендации по ведению больных синдромом Стивенса — Джонсона/токсическим эпидермальным некролизом. 2015.
* Классы заболеваний представлены по Международной классификации болезней 10-го пересмотра.
2 Общероссийская общественная организация «Российское общество дерматовенерологов и косметологов». Клинические рекомендации. Пузырчатка. 2020.
Общероссийская общественная организация «Российское общество дерматовенерологов и косметологов». Клинические рекомендации. Буллезный пемфигоид. 2020.
Российское общество дерматовенерологов и косметологов. Федеральные клинические рекомендации по ведению больных синдромом Стивенса — Джонсона/токсическим эпидермальным некролизом. 2015.
Список литературы
1. Beek NV, Zillikens D, Schmidt E. Bullous Autoimmune Dermatoses–Clinical Features, Diagnostic Evaluation, and Treatment Options. Dtsch Arztebl Int. 2021;118(24):413–420. https://doi.org/10.3238/arztebl.m2021.0136
2. Kowalska-Kępczyńska A, Mleczko M, Domerecka W, Krasowska D, Donica H. Assessment of Immune Cell Activation in Pemphigus. Cells. 2022;11(12):1912. https://doi.org/10.3390/cells11121912
3. Pratasava V, Sahni VN, Suresh A, Huang S, Are A, Hsu S, Motaparthi K. Bullous Pemphigoid and Other Pemphigoid Dermatoses. Medicina (Kaunas). 2021;57(10):1061. https://doi.org/10.3390/medicina57101061
4. Huang X, Ao S, Xu R, Gao X, Qi S, Liang Y, Feng P, Xue R, Ren Y, Han J, Li F, Chu C, Wang F. Sensory neuroimmune signaling in the pathogenesis of Stevens-Johnson syndrome and toxic epidermal necrolysis. J Allergy Clin Immunol. 2025;155(2):533–546. https://doi.org/10.1016/j.jaci.2024.10.015
5. Тлиш М.М., Шавилова М.Е., Сычева Н.Л., Псавок Ф.А. Топические глюкокортикостероиды: от высокой клинической эффективности к проблеме бесконтрольного применения (обзор клинических случаев). Медицинский совет. 2023;17(6):186–192. https://doi.org/10.21518/ms2023-043.
6. Fang SY, Li CL, Liu XS, Chen F, Hua H. Correlation between polymorphisms of the NR3C1 gene and glucocorticoid effectiveness in patients with pemphigus vulgaris. Sci Rep. 2017;7(1):11890. https://doi.org/10.1038/s41598-017-12255-0
7. Kowalski EH, Kneibner D, Kridin K, Amber KT. Serum and blister fluid levels of cytokines and chemokines in pemphigus and bullous pemphigoid. Autoimmun Rev. 2019;18(5):526–534. https://doi.org/10.1016/j.autrev.2019.03.009
8. Huang R, Hu L, Jiang F. Study of cytokine-induced immunity in bullous pemphigoid: recent developments. Ann Med. 2023;55(2):2280991. https://doi.org/10.1080/07853890.2023.2280991
9. Chung WH, Hung SI, Yang JY, Su SC, Huang SP, Wei CY, Chin SW, Chiou CC, Chu SC, Ho HC, Yang CH, Lu CF, Wu JY, Liao YD, Chen YT. Granulysin is a key mediator for disseminated keratinocyte death in Stevens-Johnson syndrome and toxic epidermal necrolysis. Nat Med. 2008;14(12):1343–1350. https://doi.org/10.1038/nm.1884 10. Saito Y, Abe R. New insights into the diagnosis and management of Stevens-Johnson syndrome and toxic epidermal necrolysis. Curr Opin Allergy Clin Immunol. 2023;23(4):271–278. https://doi.org/10.1097/ACI.0000000000000914
10. Olsson-Brown A, Yip V, Ogiji ED, Jolly C, Ressel L, Sharma A, Bergfeld W, Liu X, Khirwadkar N, Bellon T, Dickinson A, Ahmed S, Langton A, Watson R, Pirmohamed M, Carr DF. TNF-α‒Mediated Keratinocyte Expression and Release of Matrix Metalloproteinase 9: Putative Mechanism of Pathogenesis in Stevens‒Johnson Syndrome/Toxic Epidermal Necrolysis. J Invest Dermatol. 2023;143(6):1023–1030.e7
11. Viard-Leveugle I, Gaide O, Jankovic D, Feldmeyer L, Kerl K, Pickard C, Roques S, Friedmann PS, Contassot E, French LE. TNF-α and IFN-γ are potential inducers of Fas-mediated keratinocyte apoptosis through activation of inducible nitric oxide synthase in toxic epidermal necrolysis. J Invest Dermatol. 2013;133(2):489–498. https://doi.org/10.1038/jid.2012.330
12. Murrell DF, Dick S, Ahmed AR, Amagai M, Barnadas MA, Borradori L, Bystryn JC, Cianchini G, Diaz L, Fivenson D, Hall R, Harman KE, Hashimoto T, Hertl M, Hunzelmann N, Iranzo P, Joly P, Jonkman MF, Kitajima Y, Korman NJ, Martin LK, Mimouni D, Pandya AG, Payne AS, Rubenstein D, Shimizu H, Sinha AA, Sirois D, Zillikens D, Werth VP. Consensus statement on definitions of disease, end points, and therapeutic response for pemphigus. J Am Acad Dermatol. 2008;58(6):1043–1046. https://doi.org/10.1016/j.jaad.2008.01.012
13. Masmoudi W, Vaillant M, Vassileva S, Patsatsi A, Quereux G, Moltrasio C, Abasq C, Prost-Squarcioni C, Kottler D, Kiritsi D, Litrowski N, Plantin P, Friedrichsen L, Zebrowska A, Duvert-Lehembre S, Hofmann S, Ferranti V, Jouen F, Joly P, Hebert V; EADV Autoimmune Bullous Skin Disease Task Force. International validation of the Bullous Pemphigoid Disease Area Index severity score and calculation of cut-off values for defining mild, moderate and severe types of bullous pemphigoid. Br J Dermatol. 2021;184(6):1106–1112. https://doi.org/10.1111/bjd.19611
14. Dobry AS, Himed S, Waters M, Kaffenberger BH. Scoring Assessments in Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis. Front Med (Lausanne). 2022;9:883121. https://doi.org/10.3389/fmed.2022.883121
15. Timoteo RP, da Silva MV, Miguel CB, Silva DA, Catarino JD, Rodrigues Junior V, Sales-Campos H, Freire Oliveira CJ. Th1/Th17-Related Cytokines and Chemokines and Their Implications in the Pathogenesis of Pemphigus Vulgaris. Mediators Inflamm. 2017;2017:7151285. https://doi.org/10.1155/2017/7151285
16. Mitsui G, Hirano T, Niwano Y, Mitsui K, Ohara O, Yanagihara S, Kato M. Effect of a topical steroid on gene expressions for chemokines in mice with contact hypersensitivity. Int Immunopharmacol. 2004;4(1):57–69. https://doi.org/10.1016/j.intimp.2003.10.005
17. Koduri MA, Prasad D, Upadhyaya S, Jaffet J, Shanbhag SS, Basu S, Singh V. Differential expression of tear film cytokines in Stevens-Johnson syndrome patients and comparative review of literature. Sci Rep. 2021;11(1):18433. https://doi.org/10.1038/s41598-021-97575-y
18. Liu T, Li J, Deng Z, Chen M, Sha K, Xiao W, Xie H, Zhao Z. Increased serum levels of CCL3, CXCL8, CXCL9, and CXCL10 in rosacea patients and their correlation with disease severity. J Dermatol. 2022;49(5):525– 533. https://doi.org/10.1111/1346-8138.16329
19. Morais KL, Miyamoto D, Orfali RL, Maruta CW, Santi CG, Sotto MN, da Silva LFF, Branco ACCC, Sato MN, Aoki V. Increased expression of in situ IL-31RA and circulating CXCL8 and CCL2 in pemphigus herpetiformis suggests participation of the IL-31 family in the pathogenesis of the disease. J Eur Acad Dermatol Venereol. 2020;34(12):2890–2897. https://doi.org/10.1111/jdv.16730
20. Jordan TJM, Chen J, Li N, Burette S, Wan L, Chen L, Culton DA, Geng S, Googe P, Thomas NE, Diaz LA, Liu Z. The Eotaxin-1/CCR3 Axis and Matrix Metalloproteinase-9 Are Critical in Anti-NC16A IgE-Induced Bullous Pemphigoid. J Immunol. 2023;211(8):1216–1223. https://doi.org/10.4049/jimmunol.2300080
21. Nassif A, Moslehi H, Le Gouvello S, Bagot M, Lyonnet L, Michel L, Boumsell L, Bensussan A, Roujeau JC. Evaluation of the potential role of cytokines in toxic epidermal necrolysis. J Invest Dermatol. 2004;123(5):850–855. https://doi.org/10.1111/j.0022-202X.2004.23439.x
22. de Araujo E, Dessirier V, Laprée G, Valeyrie-Allanore L, Ortonne N, Stathopoulos EN, Bagot M, Bensussan A, Mockenhaupt M, Roujeau JC, Tsapis A. Death ligand TRAIL, secreted by CD1a+ and CD14+ cells in blister fluids, is involved in killing keratinocytes in toxic epidermal necrolysis. Exp Dermatol. 2011;20(2):107–112. https://doi.org/10.1111/j.1600-0625.2010.01176.x
23. Lee SH, Hong WJ, Kim SC. Analysis of Serum Cytokine Profile in Pemphigus. Ann Dermatol. 2017;29(4):438–445. https://doi.org/10.5021/ad.2017.29.4.438
24. Chriguer RS, Roselino AM, de Castro M. Glucocorticoid sensitivity and proinflammatory cytokines pattern in pemphigus. J Clin Immunol. 2012;32(4):786–793. https://doi.org/10.1007/s10875-012-9679-y
25. Correia O, Delgado L, Barbosa IL, Campilho F, Fleming-Torrinha J. Increased interleukin 10, tumor necrosis factor alpha, and interleukin 6 levels in blister fluid of toxic epidermal necrolysis. J Am Acad Dermatol. 2002;47(1):58–62. https://doi.org/10.1067/mjd.2002.120473
26. Goleva E, Li LB, Leung DY. IFN-gamma reverses IL-2- and IL-4-mediated T-cell steroid resistance. Am J Respir Cell Mol Biol. 2009;40(2):223– 230. https://doi.org/10.1165/rcmb.2007-0327OC
27. Moustaki A, Argyropoulos KV, Baxevanis CN, Papamichail M, Perez SA. Effect of the simultaneous administration of glucocorticoids and IL-15 on human NK cell phenotype, proliferation and function. Cancer Immunol Immunother. 2011;60(12):1683–1695. https://doi.org/10.1007/s00262-011-1067-6
28. Hejazi M, Zhang C, Bennstein SB, Balz V, Reusing SB, Quadflieg M, Hoerster K, Heinrichs S, Hanenberg H, Oberbeck S, Nitsche M, Cramer S, Pfeifer R, Oberoi P, Rühl H, Oldenburg J, Brossart P, Horn PA, Babor F, Wels WS, Fischer JC, Möker N, Uhrberg M. CD33 Delineates Two Functionally Distinct NK Cell Populations Divergent in Cytokine Production and Antibody-Mediated Cellular Cytotoxicity. Front Immunol. 2022;12:798087. https://doi.org/10.3389/fimmu.2021.798087
29. Chen CB, Kuo KL, Wang CW, Lu CW, Chung-Yee Hui R, Lu KL, Chang WC, Chen WT, Yun F, Teng YC, Lee HE, Lin JY, Ho HC, Chi MH, Yu-Wei Lin Y, Chang CJ, Lin Y Jr, Ku CL, Hung SI, Chang YC, Chung WH; Taiwan Severe Cutaneous Adverse Reaction Consortium. Detecting Lesional Granulysin Levels for Rapid Diagnosis of Cytotoxic T lymphocyte-Mediated Bullous Skin Disorders. J Allergy Clin Immunol Pract. 2021;9(3):1327–1337.e3. https://doi.org/10.1016/j.jaip.2020.09.048
30. Yang Y, Li F, Du J, Shen Y, Lin J, Zhu X, Luo X, Liang J, Xu J. Variable levels of apoptotic signal-associated cytokines in the disease course of patients with Stevens-Johnson syndrome and toxic epidermal necrolysis. Australas J Dermatol. 2017;58(3):e61–e67. https://doi.org/10.1111/ajd.12462
31. Wang F, Ye Y, Luo ZY, Gao Q, Luo DQ, Zhang X. Diverse expression of TNF-α and CCL27 in serum and blister of Stevens-Johnson syndrome/ toxic epidermal necrolysis. Clin Transl Allergy. 2018;8:12. https://doi.org/10.1186/s13601-018-0199-6
32. Le TVT, Nguyen DQ, Tran ND, Tu Trinh HK. Association of singlenucleotide NR3C1 gene polymorphisms with glucocorticosteroid responsiveness in patients with pemphigus vulgaris. Dermatol Reports. 2021;14(2):9190. https://doi.org/10.4081/dr.2021.9190
33. Motavalli R, Majidi T, Pourlak T, Abediazar S, Shoja MM, Zununi Vahed S, Etemadi J. The clinical significance of the glucocorticoid receptors: Genetics and epigenetics. J Steroid Biochem Mol Biol. 2021;213:105952. https://doi.org/10.1016/j.jsbmb.2021.105952
34. Başar Kılıç Ş, Taheri S, Mehmetbeyoğlu Duman E, Öksüm Solak E, Yılmaz Şükranlı Z, Rassoulzadegan M, Borlu M. Psoriatic skin transcript phenotype: androgen/estrogen and cortisone/cortisol imbalance with increasing DNA damage response. Mol Biol Rep. 2024;51(1):933. https://doi.org/10.1007/s11033-024-09782-1
Об авторах
О. Ю. ОлисоваОлисова Ольга Юрьевна - доктор медицинских наук, профессор, член-корреспондент Российской академии наук, заведующая кафедрой кафедры кожных и венерических болезней имени В.А. Рахманова; директор клиники лечебно-диагностического отделения № 2 (с функциями приемного отделения) клиники кожных и венерических болезней им. В.А. Рахманова университетской клинической больницы № 2,
ул. Трубецкая, д. 8 стр. 2, г. Москва, 119048
А. А. Лепехова
Россия
Лепехова Анфиса Александровна - кандидат медицинских наук, доцент кафедры кожных и венерических болезней имени В.А. Рахманова, специалист лечебно-диагностического отделения № 2 (с функциями приемного
отделения) клиники кожных и венерических болезней им. В.А. Рахманова университетской клинической больницы № 2,
ул. Трубецкая, д. 8 стр. 2, г. Москва, 119048
А. С. Духанин
Россия
Духанин Александр Сергеевич - доктор медицинских наук, профессор, профессор кафедры молекулярной фармакологии и радиобиологии им. академика П.В. Сергеева медико-биологического факультета,
ул. Островитянова, д. 1, стр. 6, г. Москва, 117513
Н. П. Теплюк
Россия
Теплюк Наталия Павловна - доктор медицинских наук, профессор кафедры кожных и венерических болезней имени
В.А. Рахманова, специалист лечебно-диагностического отделения № 2 (с функциями приемного отделения) клиники
кожных и венерических болезней им. В.А. Рахманова университетской клинической больницы № 2,
ул. Трубецкая, д. 8 стр. 2, г. Москва, 119048
Н. Л. Шимановский
Россия
Шимановский Николай Львович - доктор медицинских наук, профессор, член-корреспондент Российской академии наук, заведующий кафедрой молекулярной фармакологии и радиобиологии имени академика П.В. Сергеева медико-биологического факультета; заведующий научно-исследовательской лабораторией молекулярной фармакологии научно-исследовательского института трансляционной медицины,
ул. Островитянова, д. 1, стр. 6, г. Москва, 117513
А. А. Юдин
Россия
Юдин Александр Александрович - кандидат медицинских наук, доцент кафедры иммунологии медико-биологического факультета, ул. Островитянова, д. 1, стр. 6, г. Москва, 117513;
заведующий отделением аллергологии и иммунологии государственного бюджетного учреждения здравоохранения города Москвы «Городская клиническая больница № 24 Департамента здравоохранения города Москвы», ул. Писцовая, д. 10, г. Москва, 127015;
врач-пульмонолог, ул. Староволынская, д. 10, г. Москва, 121352
Дополнительные файлы
Рецензия
Для цитирования:
Олисова О.Ю., Лепехова А.А., Духанин А.С., Теплюк Н.П., Шимановский Н.Л., Юдин А.А. Пузырная жидкость как источник биомаркеров стероидной резистентности у больных жизнеугрожающими буллезными дерматозами: наблюдательное когортное контролируемое исследование. Кубанский научный медицинский вестник. 2025;32(4):62-81. https://doi.org/10.25207/1608-6228-2025-32-4-62-81
For citation:
Olisova O.Yu., Lepekhova A.A., Dukhanin A.S., Teplyuk N.P., Shimanovsky N.L., Yudin A.A. Blister fluid as a source of steroid resistance biomarkers in patients with life-threatening bullous dermatoses: An observational cohort controlled study. Kuban Scientific Medical Bulletin. 2025;32(4):62-81. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-4-62-81
JATS XML








































