Перейти к:
Применение спектроскопии комбинационного рассеяния для оценки состояния костной ткани при пародонтите: нерандомизированное клинико-лабораторное исследование
https://doi.org/10.25207/1608-6228-2025-32-5-64-73
Аннотация
Введение. Оценка состояния костной ткани челюстей при определении стоматологического статуса пациента, определение объема костных структур является, несомненно, актуальным направлением и связана с необходимостью принятия решения о возможности дентальной имплантации, проведении зубосохраняющих регенеративных вмешательств, при пародонтитах, периодонтитах, выборе послеоперационной тактики и определении прогнозов. Статья посвящена изучению спектральных изменений костной ткани при пародонтите, выявленных с помощью метода Рамановской спектроскопии как метода диагностики, успешно применяемого в последние годы для решения различных биомедицинских задач.
Цель исследования: оценка спектральных изменений костной ткани альвеолярной части нижней челюсти при пародонтите.
Методы. Проведено нерандомизированное клинико-лабораторное исследование у 45 пациентов в возрасте от 45 до 60 лет на базе федерального государственного бюджетного образовательного учреждения высшего образования «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации и стоматологической клиники «Центр восстановительной стоматологии» общества с ограниченной ответственностью «Академия стоматологии». В группу сравнения (1-ю группу) включали 17 образцов костной ткани, полученных у пациентов во время хирургических вмешательств по поводу патологии периапикальных тканей с диагнозом по МКБ-10 — К04.5, К04.8 в области зубов с нормальным пародонтом. Для исследуемой основной группы 28 образцов костной ткани альвеолярной части нижней челюсти были получены у пациентов во время манипуляций по поводу хронического локализованного пародонтита с диагнозом по МКБ-10 — К05.30 в области зубов с патологией пародонта (2-я группа). Для оценки костных биоптатов использовали метод рамановской спектроскопии. Для статистического анализа использовались спектры после разделения (деконволюции) линии, проводимой в программной среде MagicPlotPro (Magicplot Systems, LLC, Россия). Анализ полученных данных произведен в программной среде IBMSPSS Statistics (IBM, США) методом линейного дискриминантного анализа (LDA) и в сравнительном LDA-анализе групп.
Результаты. При пародонтите наблюдаются спектральные изменения костной ткани, связанные с изменением относительной интенсивности линий комбинационного рассеяния. При линейном дискриминантном анализе (LDA) основные спектральные изменения наблюдаются как и для спектров комбинационного рассеяния костной ткани на линиях 850 см-1 (бензольное кольцо пролина), 956 см-1 (v1 P–O симметричное валентное (PO43-), 1069 см-1 (C–O плоскостное валентное (СO32-v1)), 1172 см-1 (тирозин, фенилаланин, C-H связь (белок)), 1315 см-1 (амид III (α спираль)), 1385–1441 см-1 (ножничные колебания CH2 и изгибные колебания CH3 в липидах и белках), 1555 см-1 (амид II N–H), 1665 см-1 (амид I), 1745 см-1 (фосфолипиды), которые соответствуют минеральной и органической составляющей.
Заключение. Проведенные клинико-лабораторные исследования по оценке костной ткани при пародонтите показали спектральные различия со здоровой костной тканью, которые проявляются на линиях комбинационного рассеяния, соответствующих минерало-органической структуре костной ткани. Следовательно, рамановская спектроскопия представляется перспективным методом для анализа состояния костной ткани при пародонтите. В дальнейшем полученные данные могут послужить основой для оптимизации подходов к лечению пародонтита.
Ключевые слова
Для цитирования:
Бажутова И.В., Тимченко П.Е., Тимченко Е.В., Трунин Д.А., Глубоков Д.Г., Хамадеева А.М. Применение спектроскопии комбинационного рассеяния для оценки состояния костной ткани при пародонтите: нерандомизированное клинико-лабораторное исследование. Кубанский научный медицинский вестник. 2025;32(5):64-73. https://doi.org/10.25207/1608-6228-2025-32-5-64-73
For citation:
Bazhutova I.V., Timchenko P.E., Timchenko E.V., Trunin D.A., Glubokov D.G., Khamadeeva А.M. Raman spectroscopy for assessing bone tissue in periodontitis: A nonrandomized clinical and laboratory study. Kuban Scientific Medical Bulletin. 2025;32(5):64-73. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-5-64-73
ВВЕДЕНИЕ
Состояние костной ткани челюстей является ключевым моментом при определении стоматологического статуса пациента, принятии решения о возможности дентальной имплантации, проведении зубосохраняющих регенеративных вмешательств при пародонтитах [1][2] и периодонтитах, выборе послеоперационной тактики и определении прогнозов. Кроме как из-за локализованных проблем челюстно-лицевой области цитоархитектоника и характер ремоделирования костной ткани меняются при постменопаузальном остеопорозе, болезни Педжета, опухолевых метастазах, ревматоидном артрите [3–8] и пародонтите (распространенность которого составляет более 90 % взрослого населения Российской Федерации) [9][10]. Системные нарушения перестройки костной ткани являются противопоказанием для восстановления жевательной функции с использованием дентальных имплантатов [11][12]. Стоит отметить, что восстановление и ремоделирование костей челюстей могут протекать более активно, чем в осевых костях скелета [13].
Диагностика состояния костной ткани челюстей является важнейшей проблемой современной стоматологии, причем широко распространенные существующие рентгенологические методы [14][15] не всегда позволяют оценить состояние и относительный состав костной ткани челюстей [16][17]. При хроническом генерализованном пародонтите одной из основных проблем является поздняя обращаемость пациентов за специализированной помощью, так как ранние стадии часто протекают бессимптомно, хотя при своевременном выявлении сохраняется возможность перевести заболевание в состояние стойкой ремиссии и практически остановить развитие патологического процесса на той стадии, на которой было начато лечение [18].
Наряду с общепринятыми методами диагностики (рентгеновская, компьютерная томография и прочие) в последние годы все активнее применяются в области изучения тканей челюстно-лицевой области и оптические методы исследования [10][19–22].
В настоящей работе проведено изучение спектральных изменений костной ткани при пародонтите, проведенное с помощью Рамановской спектроскопии, успешно применяемой в последние годы для решения различных биомедицинских задач [20, 21]. Все более широкое применение в стоматологии метод получает в том числе из-за возможности его использования и при неинвазивных подходах, для исследования одного и того же участка тканей многократно, в динамике для объективной оценки влияния разных терапевтических методик [22–25].
Цель исследования — оценка спектральных изменений костной ткани альвеолярной части нижней челюсти при пародонтите.
МЕТОДЫ
Дизайн исследования
Дизайн работы построен в виде нерандомизированного клинико-лабораторного исследования, проведенного на 45 образцах костной ткани альвеолярной части нижней челюсти пациентов, обратившихся в стоматологическую клинику для удаления зуба по ортодонтическим показаниям.
Критерии соответствия
В исследование включались образцы костной ткани, полученные у пациентов перед основным хирургическим вмешательством.
Критерии включения для пациентов
Возраст от 45 до 60 лет с признаками состояния, удовлетворяющего критериям диагноза «хронический локализованный пародонтит» (код по МКБ-10 — К05.30), и патологией периапикальных тканей (коды по МКБ-10 — К04.5, К04.8), при наличии добровольного информированного согласия на участие в исследовании. Обязательным условием являлось наличие соседних зубов в зоне получения образцов, участки адентии не использовали.
Критерии невключения для пациентов
Критериями невключения являлись генерализованный пародонтит, наличие соматических заболеваний в стадии декомпенсации, онкологические заболевания, отягощенный аллергологический анамнез, аутоиммунные заболевания, остеопороз, беременность, лактация.
Критерии исключения для пациентов
Отказ от дальнейшего участия в исследовании, отказ от выполнения врачебных рекомендаций.
Условия проведения
Клиническая часть исследования проводилась на базе кафедры стоматологии института последипломного образования федерального государственного бюджетного образовательного учреждения высшего образования «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО СамГМУ Минздрава России) и стоматологической клиники «Центр восстановительной стоматологии» общества с ограниченной ответственностью «Академия стоматологии» (г. Самара).
Экспериментальные исследования с использованием Рамановской спектроскопии были проведены на базе межвузовской научно-исследовательской лаборатории «Тканевая инженерия» и на кафедре лазерных и биотехнических систем федерального государственного автономного образовательного учреждения высшего образования «Самарский национальный исследовательский университет имени академика С. П. Королева».
Продолжительность исследования
Период проведения исследования: с ноября 2021 по сентябрь 2022 года.
Описание медицинского вмешательства
Образцы костной ткани получали с помощью физиодиспенсера Traus (TRAUS, Южная Корея) при скорости 200 об/мин трепаном с внутренним диаметром 3 мм под охлаждением 0,9 % раствором NaCl до основного хирургического вмешательства. Затем образцы тщательно промывали в физиологическом растворе, присваивали номер, упаковывали в индивидуальные пакеты и передавали в лабораторию на спектральный анализ. У каждого пациента забор материала осуществлялся однократно.
Исходы исследования
Основной исход исследования
Конечной точкой исследования считали получение и исследование спектров комбинационного рассеяния (КР), а также LD-анализ итоговых данных для оценки состояния костной ткани при пародонтите для диагностики при решении различных биомедицинских задач.
Дополнительные исходы исследования
Дополнительные исходы не предусмотрены.
Анализ в подгруппах
В группу сравнения (1‑ю группу) включили 17 образцов костной ткани, полученных у пациентов во время хирургических вмешательств по поводу патологии периапикальных тканей (коды по МКБ-10 — К04.5, К04.8) в области зубов с нормальным пародонтом. Для исследуемой группы 28 образцов костной ткани альвеолярной части нижней челюсти было получено у пациентов во время манипуляций по поводу хронического локализованного пародонтита (код по МКБ-10 — К05.30) в области зубов с патологией пародонта (2‑я группа).
Методы регистрации исходов
В качестве основного метода оценки костной ткани в норме и при пародонтите был использован метод рамановской спектроскопии. Для реализации метода применялся стенд (рис. 1), состоящий из пробника RPB-785 (f = 7,5 мм), лазера LuxxMaster LML-785.0RB-04 (LuxxMaster, Великобритания), мощность до 500 мВт, длина волны 784,7 ± 0,05 нм, и высокоразрешающего цифрового спектрометра ANDOR Shamrock sr-303i (Andor Technology, Великобритания), спектральное разрешение 0,15 нм, с охлаждаемой камерой «DV420A-OE» (диапазон 200–1200 нм) [19]. Были сняты 3 спектра в различных точках костной ткани для каждого образца, всего 135 спектров. Спектры сохранялись в виде таблицы (в нм длина волны излучения и его интенсивность в относительных цифровых единицах).
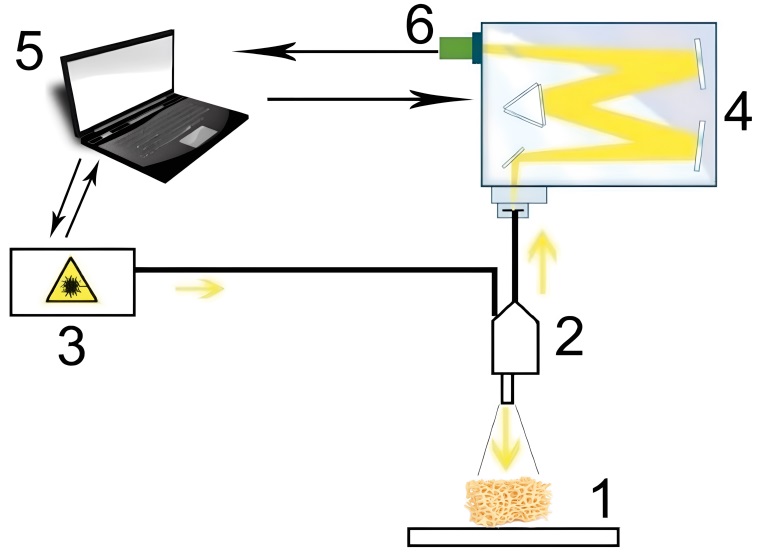
Рис. 1. Экспериментальный стенд: 1 — исследуемый объект; 2 — рамановский пробник RPB 785; 3 — лазерный модуль LuxxMaster LML-785.0RB-04; 4 — спектрометр Shamrock sr-303i; 5 — компьютер; 6 — охлаждаемая камера DV420A-OE
Примечание: рисунок выполнен авторами.
Fig. 1. Experimental setup: 1 — test object; 2 — RPB 785 Raman probe; 3 — LuxxMaster LML-785.0RB-04 laser module; 4 — Shamrock sr-303i spectrometer; 5 — computer; 6 — DV420A-OE cooled chamber
Note: The figure was created by the authors.
Обработка полученных спектров КР была выполнена в программе Wolfram Mathematica 12.2 (Wolfram Research, США). При обработке результатов, у исследуемых спектров осуществлялся перевод единиц измерения из нм в рамановский сдвиг в см⁻¹ (по отношению к длине волны лазера), далее очищали от шумов фильтром Maximum Likelihood Estimation Savitzky-Golay filter (MLE-SG), определяли на выбранном интервале 380–1780 cm⁻¹ при помощи итерационного алгоритма аппроксимирующую линию (полином пятой степени) автофлуоресцентной составляющей, а затем вычитали эту составляющую, в результате получали выделенный рамановский спектр [19]. Интерпретация полос в рамановском спектре на i-м диапазоне для костной ткани осуществлялась по данным Tarnowski et al. (2002); Ager et al. (2006) [26][27].
Статистический анализ
Принципы расчета размера выборки
Размер выборки предварительно не рассчитывался.
Методы статистического анализа данных
Для статистического анализа использовались спектры после разделения (деконволюции) линии, проводимой в программной среде MagicPlotPro (Magicplot Systems, LLC, Россия). Анализ полученных данных произведен в программной среде IBMSPSS Statistics (IBM, США) методом линейного дискриминантного анализа (LDA). Анализ взаимосвязи групп исследуемых объектов проводился в сравнительном LDA-анализе групп материалов здорового участка костной ткани и с парадонтитом.
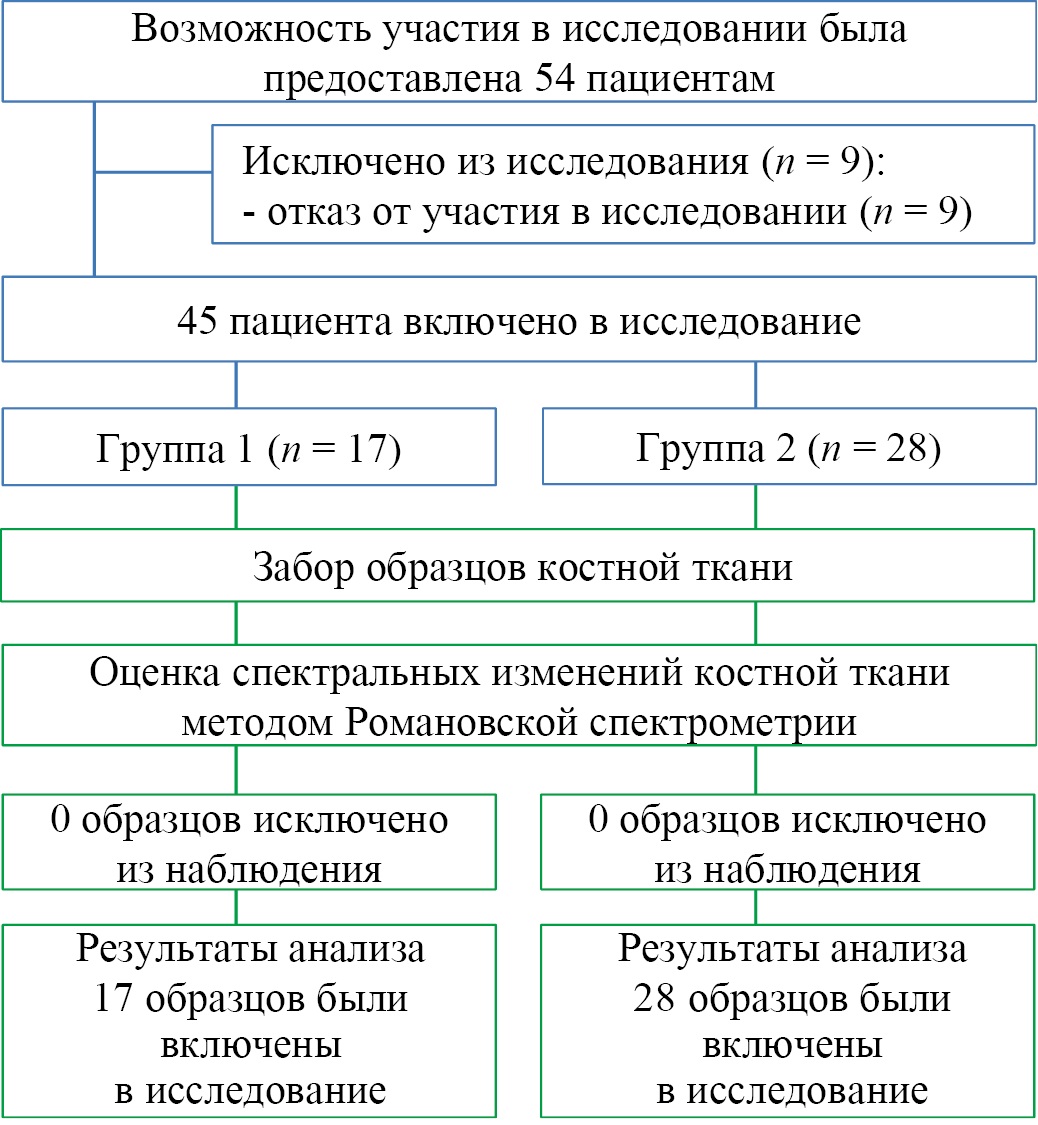
Рис. 2. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами (согласно рекомендациям CONSORT).
Fig. 2. The block diagram of the study design
Note: Performed by the authors (according to CONSORT recommendations).
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
Формирование выборки проведено в соответствии с критериями включения и невключения. Для проведения исследования были сформированы 2 группы. В группу сравнения (1‑ю группу) включили 17 пациентов, у которых были отобраны образцы костной ткани во время хирургических вмешательств по поводу патологии периапикальных тканей (код по МКБ-10 — К04.5, К04.8) в области зубов с нормальным пародонтом. Для исследуемой группы у 28 пациентов отобраны образцы костной ткани альвеолярной части нижней челюсти во время манипуляций по поводу хронического локализованного пародонтита (код по МКБ-10 — К05.30) в области зубов с патологией пародонта (2‑я группа).
Группы формировались из пациентов обоего пола в возрасте до 45 и старше 60 лет. Средние значения половозрастного состава групп различаются несущественно (52,4 и 52,9 года для групп 1 и 2) (табл. 1). Выборки с учетом количества образцов являются репрезентативными.
Таблица 1. Половая и возрастная характеристика пациентов в сравниваемых группах
Table 1. Sex and age characteristics of patients in the compared groups
|
Показатель |
Группа 1 (n = 17) |
Группа 2 (n = 28) |
Уровень значимости, р |
|
Пол (женский/мужской), % |
52,9/47,1 |
50/50 |
0,85 |
|
Возраст (М ± SD), лет |
52,4 ± 4,5 |
52,9 ± 5,1 |
0,56 |
Примечание: таблица составлена авторами.
Note: The table was compiled by the authors.
Основные результаты исследования
Усредненные спектры комбинационного рассеяния костной ткани челюсти человека в норме и при пародонтите представлены на рисунке 3 (с каждого исследуемого образца костной ткани было снято по 3 спектра в различных его зонах, после чего строился усредненный спектр по каждому исследуемому образцу, а затем общий усредненный спектр комбинационного рассеяния строился по всем усредненным образцам в пределах каждой исследуемой группы, всего было изучено 135 спектров). Первичные спектры проходили фильтрацию шумов и вычитание автофлуоресцентной составляющей (итерационным алгоритмом подбиралась линия в виде полинома 5–10‑й степени, аппроксимирующая автофлуоресцентную составляющую), а также преобразование в систему координат рамановского сдвига (по отношению к исходной длине волны лазера 785 нм).
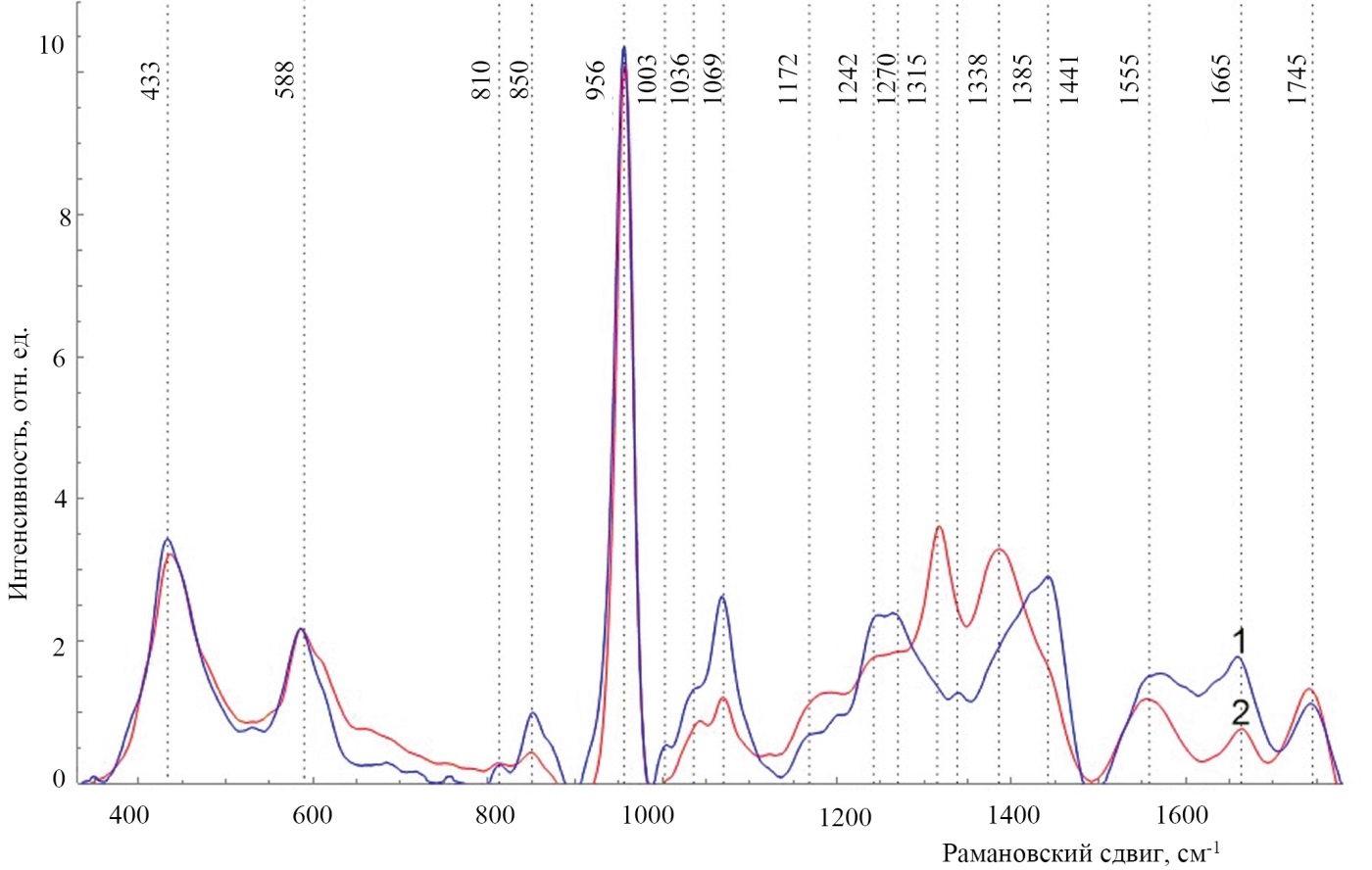
Рис. 3. Усредненные спектры комбинационного рассеяния костной ткани в норме (1) и при пародонтите (2)
Примечание: рисунок выполнен авторами.
Fig. 3. Average Raman scattering spectra of bone tissue in normal conditions (1) and in periodontitis (2)
Note: The figure was created by the authors.
Из рисунка хорошо видно, что при пародонтите наблюдаются спектральные изменения костной ткани, связанные с изменением относительной интенсивности линий комбинационного рассеяния, соответствующих минеральной составляющей, 956 см⁻¹ (v1 P–O симметричное валентное (PO4³⁻, 1069 см⁻¹ (C–O плоскостное валентное (СO3²⁻v1)), а также органической составляющей костной ткани 850 см⁻¹ (бензольное кольцо пролина), 1172 см⁻¹ (тирозин, фенилаланин, C-H связь (белок)), 1242–1270 см⁻¹ (амид III), 1315 см⁻¹ (амид III (α спираль)), 1385–1441 см⁻¹ (ножничные колебания CH2 и изгибные колебания CH3 в липидах и белках), 1555 см⁻¹ (амид II N–H), 1665 см⁻¹ (амид I), 1745 см⁻¹ (фосфолипиды).
Данные спектральные изменения связаны с резорбцией костной ткани при пародонтите (линии гидроксиапатита 956 см⁻¹ (v1 P–O симметричное валентное (PO4³⁻ и его замещение 1069 см⁻¹ (C–O плоскостное валентное (СO3²⁻v1)), что свидетельствует о замещении водно-минерального обмена в костной ткани (интенсивное замещение гидроксид-иона OH⁻ в структуре апатита ионами СO3²), а также разрушении органической матрицы (амидные линии 1242–1270 см⁻¹ (Amide III), 1315 см⁻¹ (амид III (α-спираль)), 1555 см⁻¹ (амид II N–H), 1665 см⁻¹ (амид I), линии пролина 850 см⁻¹ (бензольное кольцо пролина)).
Заметный сдвиг комбинационного рассеяния органической составляющей при пародонтите на линиях 1315 и 1385 см⁻¹ обусловлен разрушением органической матрицы при пародонтите [28–30]. Разрушение органической матрицы (каркаса) ведет к невозможности удержания и утрате минеральной составляющей.
Спектральный контур на рисунке 3 имеет ряд линий комбинационного рассеяния с высоким коэффициентом взаимного перекрытия, так что определить количество, положения и ширину этих линий в перекрытом состоянии затруднительно.
Поэтому для повышения информативности и точности полученных спектров КР был произведен нелинейный регрессионный анализ спектров, состоящий в их разложении на отдельные спектральные линии. Данное разложение проводилось с ограничением ряда параметров (амплитуда линии не отрицательная, ширина ограничена минимальной шириной, обусловленной шириной линии лазера, и максимальной, дабы не получать физически невозможные линии при математическом подборе) и использования шаблона с положением заранее известных сильных линий. При моделировании спектрального контура у линий, используемых как шаблон, фиксировались положение x0 и полуширина линии (HWHM) dx. При моделировании подбиралась лишь интенсивность линии в диапазоне от 0 до значения локального максимума спектра в области x0. HWHM ограничивалось в диапазоне от 1 до 16 см⁻¹. Это позволяло добиться высокой стабильности результатов при моделировании контура и учитывать все сдвиги линий КР. Критериальной переменной являлась амплитуда линий a, которая зависит от значений независимых регрессоров dx и x0, определяющих начальные условия анализа.
Среднее значение скорректированного коэффициента детерминации спектра от исходного в области 380–1780 см⁻¹ для всех 135 спектров составило adjR2 = 0,9989. Подобранная линия комбинационного рассеяния не выходит за границы спектрального контура.
На рисунке 4 представлен результат разложения спектрального контура в диапазоне 380–1780 см⁻¹ на сумму распределений линий Гаусса (для используемого спектрометра с разрешением ~1,2 см⁻¹ и биообъектов является оптимальной формой линии).
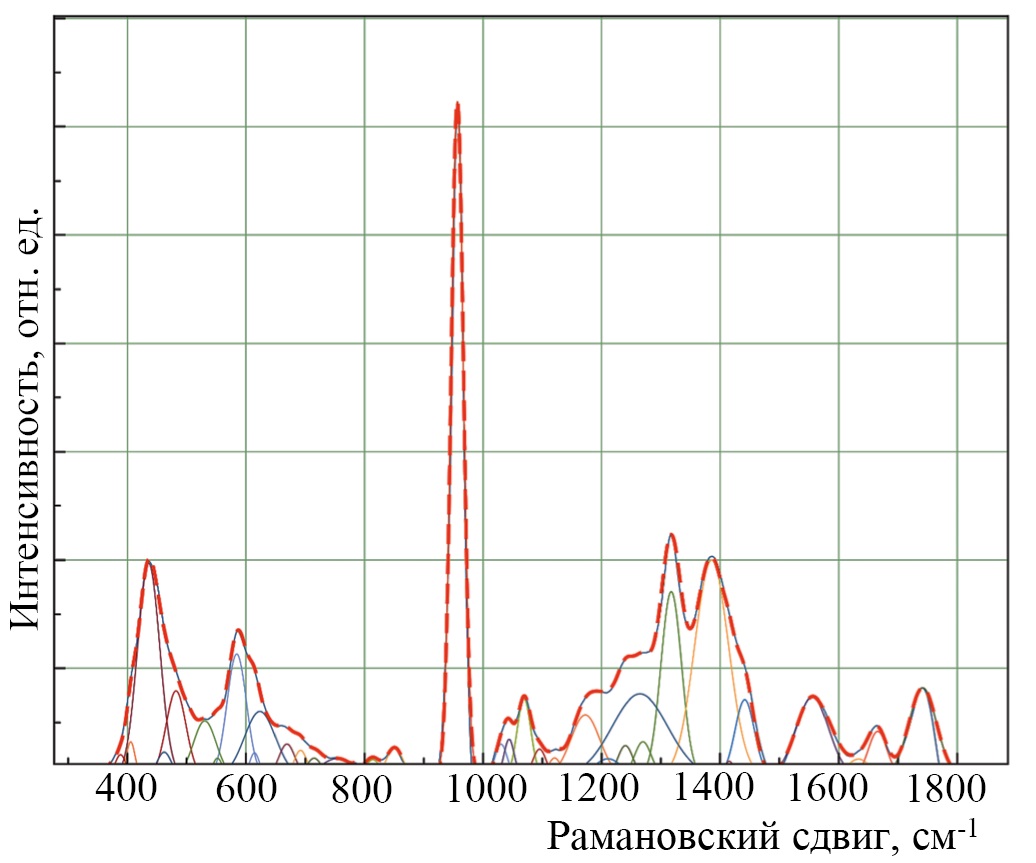
Рис. 4. Разложение спектрального контура образцов костной ткани челюсти человека
Примечание: рисунок выполнен авторами. Сокращение: КР — комбинационное рассеяние.
Fig. 4. Decomposition of the spectral contour of jawbone samples
Note: The figure was created by the authors. Abbreviation: КР — Raman scattering.
В программной среде Wolfram Mathematica 12.2 с применением методов машинного обучения на основе автоматического многоитерационного моделирования установлен окончательный состав спектральных линий КР, использовались данные первичных неусредненных спектров (135 спектров). Апробация метода проведена с учетом анализа литературных данных [28][31–33].
Относительная количественная оценка компонентного состава образцов костной ткани из обеих исследуемых групп проведена с использованием нормированных амплитуд разделенных линий комбинационного рассеяния.
Для дальнейшего анализа полученных после разделения спектральных линий исследуемых образцов был применен метод линейного дискриминантного анализа (ЛДА — linear discriminant analysis, LDA) в программной среде IBM SPSS Statistics. Сопоставлялись группы образцов костной ткани челюсти человека в норме и ткани челюсти человека при пародонтите. В качестве основной переменной задействована дискриминантная функция LD-1 (описывает 100 % дисперсию), другие LD переменные оказались не задействованы.
На рисунке 5 показаны результаты сравнения LDA двух групп образцов. Группа 1 принадлежит образцам костной ткани челюсти человека в норме, группа 2 — костной ткани челюсти человека при пародонтите.
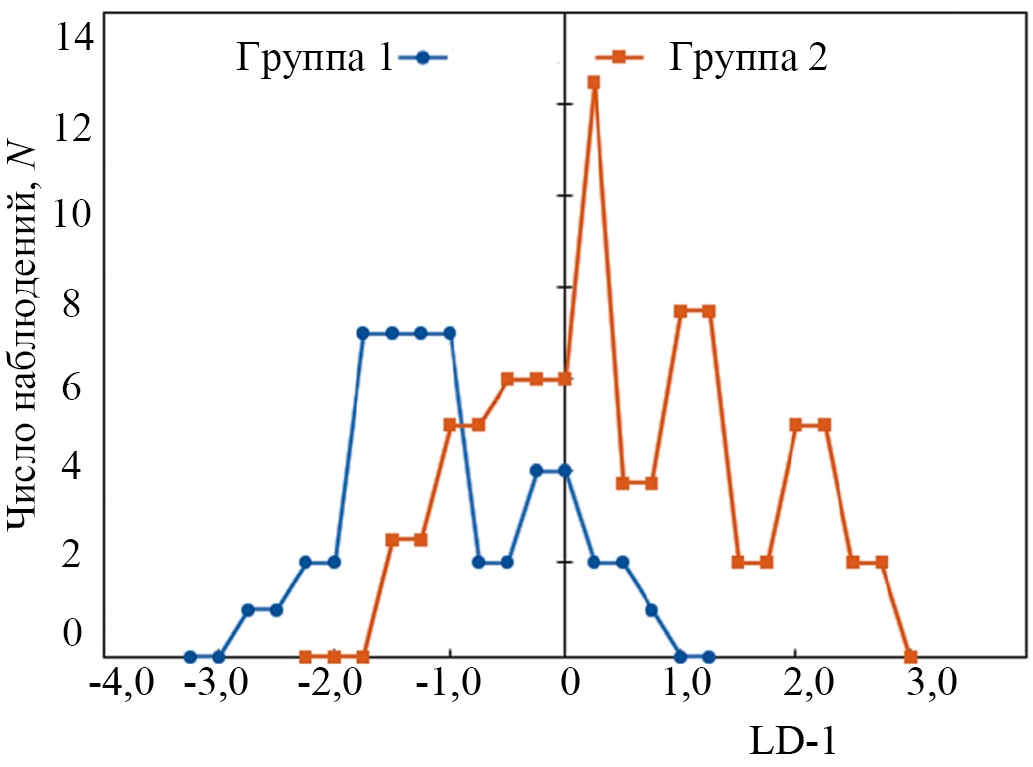
Рис. 5. График значений линейной дискриминантной функции исследуемых групп
Примечание: рисунок выполнен авторами. Сокращение: LD — линейная дискриминантная функция.
Fig. 5. Value graph of the linear discriminant function for the groups under study
Note: The figure was created by the authors. Abbreviation: LD — linear discriminant function.
В основном положительные значения LD-1 характеризуют спектры комбинационного рассеяния костной ткани челюсти человека в норме, отрицательные значения характеризуют спектры комбинационного рассеяния костной ткани челюсти человека при пародонтите. Области групп имеют значительное пересечение в диапазоне LD-1 = {-1,75; 0,75}. Площади групп имеют также пересечения.
Чем выше по модулю значение LD-1 переменной, тем в большей степени она определяет разницу в дискриминационной модели между костной тканью челюсти человека в норме и при пародонтите.
Для относительной количественной оценки компонентного состава костной ткани челюсти человека в норме и при пародонтите использовались отношения интенсивности линий комбинационного рассеяния к интенсивности линии фосфолипидов.
Из рисунка 5 видно, что наибольшие значения LD-1 наблюдаются на линиях комбинационного рассеяния, соответствующих органической составляющей костной ткани. Данные спектральные изменения также свидетельствуют об изменении синтеза коллагена в структуре костной ткани при пародонтите.
Далее были проанализированы различные комбинации параметров и выделено 10 линий комбинационного рассеяния.
На рисунке 6 показаны значения релевантных коэффициентов матрицы факторной структуры, имеющие физический смысл корреляции между переменными в модели и дискриминирующей функцией.
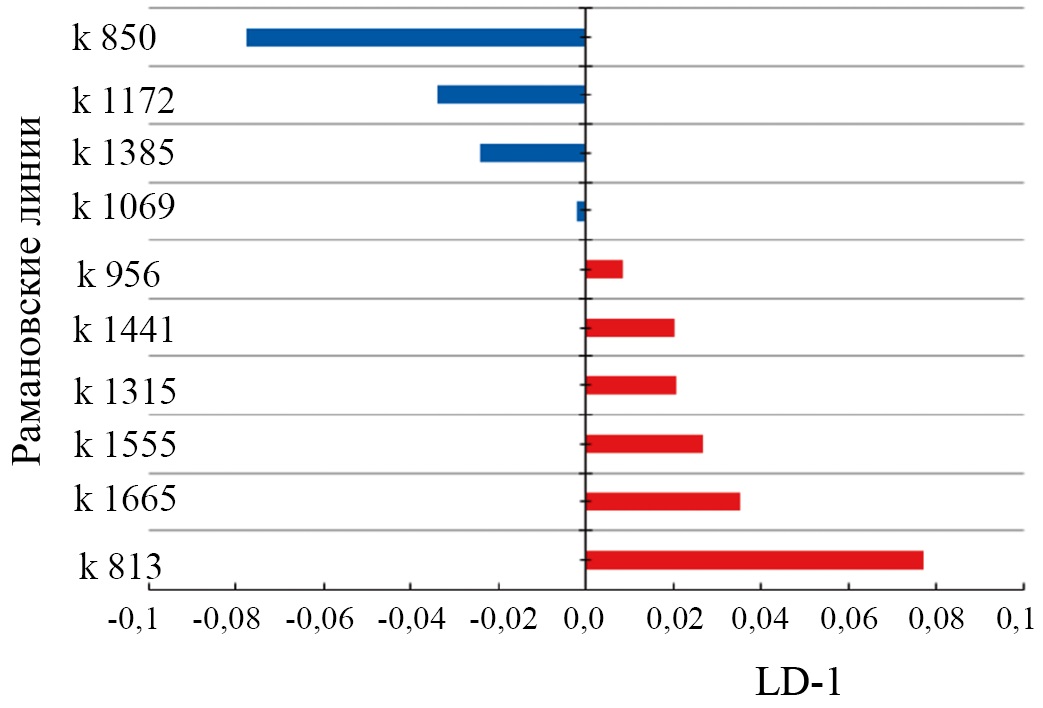
Рис. 6. Значения коэффициентов факторной структуры
Примечание: рисунок выполнен авторами. Сокращение: LD — линейная дискриминантная функция.
Fig. 6. Values of factor structure coefficients
Note: The figure was created by the authors. Abbreviation: LD — linear discriminant function.
По данному графику видно, что основные спектральные изменения наблюдаются как и для спектров комбинационного рассеяния костной ткани на линиях 850 см⁻¹ (бензольное кольцо пролина), 956 см⁻¹ (v1 P–O симметричное валентное (PO4³⁻), 1069 см⁻¹ (C–O плоскостное валентное (СO3²⁻v1)), 1172 см⁻¹ (тирозин, фенилаланин, C-H-связь (белок)), 1315 см⁻¹ (амид III (α-спираль)), 1385–1441 см⁻¹ (ножничные колебания CH2 и изгибные колебания CH3 в липидах и белках), 1555 см⁻¹ (амид II N–H), 1665 см⁻¹ (амид I), 1745 см⁻¹ (фосфолипиды), которые соответствуют минеральной и органической составляющей. Чем выше по модулю значение LD-1 для переменной, тем в большей степени она определяет разницу в дискриминационной модели между группами образцов.
Дополнительные результаты исследования
В процессе планирования исследования получение дополнительных результатов не ожидалось, и они не были достигнуты в ходе его реализации.
Нежелательные явления
Не зарегистрированы.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Спектральный анализ костной ткани зубов при пародонтите позволил установить характерные критерии. Обнаружено, что заболевание пародонтитом вызывает отличительные спектральные отклонения в структуре органического матрикса, а также перемены в спектрах комбинационного рассеяния (КР) минеральной фазы. Эти изменения прямо связаны с резорбцией костной ткани при пародонтите.
Выявленные спектральные сдвиги обусловлены процессом резорбции костной ткани и разрушением органического матрикса. Заметное смещение линий КР органической составляющей на линиях 1315 и 1385 см⁻¹ у пациентов с пародонтитом указывает на разрушение органической матрицы. Спектральные аномалии, возникающие из-за повреждения поперечных связей в органическом матриксе, приводят к изменениям в минеральном составе.
Применение дискриминантного анализа позволило определить критерии для выявления изменений в костной ткани при пародонтите. Это особенно ценно при сложной дифференциальной диагностике очагов деструкции альвеолярных отростков челюстей, позволяя дифференцировать от других патологических состояний.
Обсуждение основного результата исследования
Установлены изменения спектров комбинационного рассеяния костной ткани при пародонтите. Данные спектральные изменения обусловлены резорбцией костной ткани и разрушением органической матрицы. Разрушение органической матрицы (каркаса) при пародонтите ведет к невозможности удержания и утрате минеральной составляющей [34][35].
При этом выявленные в настоящей работе спектральные изменения не проявляются при других распространенных стоматологических заболеваниях, например при кариесе зубов. Так, в работе О. А. Магсумовой и соавт. [36] показано, что при кариесе снижается только концентрация ионов (РО4)³⁻.
В работах других авторов диагностика пародонтита осуществляется по изменению цемента зубов. Показано [37–39], что основным структурным изменением при пародонтите является цемент зубов. Неправильное формирование цемента приводит к развитию пародонтальных карманов. Это связано с тем, что структура цемента является основным элементом восприимчивости к микробной инвазии и образованию пародонтальных карманов [37].
Ранее авторами установлено, что спектральные изменения зубов при пародонтите имеют схожий характер со спектральными изменениями, возникающими при остеопорозе [19]. При пародонтите нарушается водно-минеральный обмен в тканях зубов (интенсивное замещение гидроксид-иона OH⁻ в структуре апатита ионами СO3²⁻) и синтез коллагена. Подобные спектральные изменения наблюдаются и при пародонтите в костной ткани.
Таким образом, при пародонтите происходят спектральные сдвиги комбинационного рассеяния, схожие с изменениями в органическом матриксе, возникающие при механической нагрузке, а также при остеопорозе, которые обусловлены разрывом поперечных связей в органическом матриксе.
Ограничения исследования
Не выявлены.
ЗАКЛЮЧЕНИЕ
Проведенные клинико-лабораторные исследования по оценке костной ткани при пародонтите показали спектральные различия со здоровой костной тканью, которые проявляются на линиях комбинационного рассеяния, соответствующих минерало-органической структуре костной ткани. Установлено, что данные спектральные изменения в костной ткани при пародонтите связаны с резорбцией костной ткани и вызваны замещением гидроксид-иона OH в структуре апатита ионами СO3²⁻, а также нарушением структуры органического матрикса кости, о чем свидетельствует изменение линий КР амидных структур, а также пролина. Таким образом, метод спектроскопии КР может быть использован для оценки костной ткани при пародонтите. Полученные результаты можно будет использовать для коррекции лечения данного заболевания.
Список литературы
1. Шукпаров А.Б., Шомуродов К.Э., Мирхусанова Р.С. Принципы направленной костной регенерации: критические предоперационные факторы и критерии успеха. Интегративная стоматология и челюстно‑лицевая хирургия. 2022;1(1):10–13.
2. Putra RH, Yoda N, Iikubo M, Kataoka Y, Yamauchi K, Koyama S, Cooray U, Astuti ER, Takahashi T, Sasaki K. Influence of bone condition on implant placement accuracy with computer-guided surgery. Int J Implant Dent. 2020;6(1):62. https://doi.org/10.1186/s40729-02000249-z
3. Rak D, Kulloli AM, Shetty SK, Tripathy S, Mathur A, Mehta V, Cicciù M, Minervini G. Correlation between rheumatoid arthritis and chronic periodontitis: a systematic review and meta-analysis. Minerva Dent Oral Sci. 2024;73(5):294–302. https://doi.org/10.23736/S27246329.23.04891-X
4. Yu B, Wang CY. Osteoporosis and periodontal diseases — An update on their association and mechanistic links. Periodontol 2000. 2022;89(1):99–113. https://doi.org/10.1111/prd.12422
5. Lu EM. The role of vitamin D in periodontal health and disease. J Periodontal Res. 2023;58(2):213–224. https://doi.org/10.1111/jre.13083
6. Herrera D, Sanz M, Shapira L, Brotons C, Chapple I, Frese T, Graziani F, Hobbs FDR, Huck O, Hummers E, Jepsen S, Kravtchenko O, Madianos P, Molina A, Ungan M, Vilaseca J, Windak A, Vinker S. Periodontal diseases and cardiovascular diseases, diabetes, and respiratory diseases: Summary of the consensus report by the European Federation of Periodontology and WONCA Europe. Eur J Gen Pract. 2024;30(1):2320120. https://doi.org/10.1080/13814788.2024.2320120
7. Jawed STM, Tul Kubra Jawed K. Understanding the Link Between Hormonal Changes and Gingival Health in Women: A Review. Cureus. 2025;17(6):e85270. https://doi.org/10.7759/cureus.85270
8. Villoria GEM, Fischer RG, Tinoco EMB, Meyle J, Loos BG. Periodontal disease: A systemic condition. Periodontol 2000. 2024;96(1):7–19. https://doi.org/10.1111/prd.12616
9. Слажнева Е.С., Атрушкевич В.Г., Орехова Л.Ю., Лобода Е.С. Распространенность заболеваний пародонта у пациентов c различным индексом массы тела. Пародонтология. 2022;27(3):202–208. https://doi.org/10.33925/1683-3759-2022-27-3-202-208
10. Гимранова И.А., Хакимова Л.Р., Акмалова Г.М., Газизуллина Г.Р. Современные методы диагностики заболеваний пародонта: возможности и перспективы (обзор литературы). Клиническая лабораторная диагностика. 2023;68(9):570–577. https://doi.org/10.51620/0869-2084-2023-68-9-570-577
11. Тунева Н.А., Богачева Н.В., Тунева Ю.О. Проблемы дентальной имплантации. Вятский медицинский вестник. 2019:2(62):86–93.
12. Lemos CAA, de Oliveira AS, Faé DS, Oliveira HFFE, Del Rei Daltro Rosa CD, Bento VAA, Verri FR, Pellizzer EP. Do dental implants placed in patients with osteoporosis have higher risks of failure and marginal bone loss compared to those in healthy patients? A systematic review with meta-analysis. Clin Oral Investig. 2023;27(6):2483–2493. https://doi.org/10.1007/s00784-023-05005-2
13. Музыкин М.И., Иорданишвили А.К., Лосев Ф.Ф., Григорьев С.Г. Репаративный потенциал костной ткани и влияющие на него факторы. Стоматология. 2024;103(2):41–49. https://doi.org/10.17116/stomat202410302141
14. Oliveira MR, Gonçalves A, Gabrielli MAC, de Andrade CR, Scardueli CR, Pereira Filho VA. The correlation of different methods for the assessment of bone quality in vivo: an observational study. Int J Oral Maxillofac Surg. 2022;51(3):388–397. https://doi.org/10.1016/j.ijom.2021.05.019
15. Hasiuk P, Korobeinikova Y, Vorobets A, Korobeinikov L, Dzetsiukh T, Rosolovska S, Gurando V. Comparative assessment of the state of bone resorption in patients with chronic generalized periodontitis according to orthopantomogram and cone-beam computed tomography. Pol Merkur Lekarski. 2021;49(292):286–289
16. Baimuratova M, Shertayeva A, Madraimov N, Erkebay R, Diusebayev E. Diseases of periodontal tissues: modern challenges of the time. Georgian Med News. 2023;(336):126–131.
17. Янушевич О.О., Гасанова З.Т., Вавилова Т.П., Рунова Г.С. Состояние альвеолярной костной ткани в зависимости от витальности пульпы зуба по показателям слюны пациентов с пародонтитом средней степени. Эндодонтия Today. 2021;19(4):278–284. https://doi.org/10.36377/1683-2981-2021-19-4-278-284 Y
18. Сабирова А.И. Модифицируемые факторы риска развития и прогрессирования заболеваний тканей пародонта. Acta Biomedica Scientifica. 2022;7(5-2):182–192. https://doi.org/10.29413/ABS.2022-7.5-2.19
19. Timchenko EV, Timchenko PE, Pisareva EV, Vlasov MY, Volova LT, Frolov OO, Fedorova YV, Tikhomirova GP, Romanova DA, Daniel MA. Spectral analysis of rat bone tissue during long antiorthostostatic hanging and at introduction of allogen hydroxyapatitis. Optics and Spectroscopy. 2020;128(7):989–997. https://doi.org/10.1134/S0030400X20070243
20. Тихонова В.В., Саушкина А.С. Обзор возможностей применения рамановской спектроскопии в процессно-аналитической технологии (PAT). Вопросы биологической, медицинской и фармацевтической химии. 2020;23(10):35–39. https://doi.org/10.29296/25877313-2020-10-05
21. Chauhan S, Sharma S. Applications of Raman spectroscopy in the analysis of biological evidence. Forensic Sci Med Pathol. 2024;20(3):1066–1090. https://doi.org/10.1007/s12024-023-00660-z
22. Легких А.В., Мандра Ю.В., Киселева Д.В. Метод рамановской спектроскопии как средство оценки морфологии микрорельефа поверхности зуба, а также степени минерализации твердых тканей зубов. Вестник уральского государственного медицинского университета. 2015;2–3(29–30):214–215
23. Otel I. Overall Review on Recent Applications of Raman Spectroscopy Technique in Dentistry. Quantum Beam Science. 2023;7(1):5. http://dx.doi.org/10.3390/qubs7010005
24. Prikule DV, Kukushkin VI, Mitronin AV, Prikuls VF. Studying the Degree of Tooth Enamel Mineralization through Raman Spectroscopy in Various Spectral Ranges. Biophysica. 2021;1(3):269–278. http://dx.doi.org/10.3390/biophysica1030020
25. Shrivastava PK, Kumar A, Aggarwal Y, Kumar A, Agrawal A, Rai A. Diagnostic accuracy of Vibrational spectroscopy in the diagnosis of oral potentially malignant and malignant disorders: A systematic review and meta-analysis. J Cancer Res Ther. 2023;19(2):151–158. http://dx.doi.org/10.4103/jcrt.jcrt_2275_21
26. Tarnowski CP, Ignelzi MA Jr, Morris MD. Mineralization of developing mouse calvaria as revealed by Raman microspectroscopy. J Bone Miner Res. 2002;17(6):1118–1126. http://dx.doi.org/10.1359/jbmr.2002.17.6.1118
27. Ager JW 3rd, Nalla RK, Balooch G, Kim G, Pugach M, Habelitz S, Marshall GW, Kinney JH, Ritchie RO. On the increasing fragility of human teeth with age: a deep-UV resonance Raman study. J Bone Miner Res. 2006;21(12):1879–1887. http://dx.doi.org/10.1359/jbmr.060816
28. Carden A, Rajachar RM, Morris MD, Kohn DH. Ultrastructural changes accompanying the mechanical deformation of bone tissue: a Raman imaging study. Calcif Tissue Int. 2003;72(2):166–175. http://dx.doi.org/10.1007/s00223-002-1039-0
29. Голощапов Д.Л., Кашкаров В.М., Ипполитов Ю.А., Ипполитов И.Ю., Vongsvivut J., Середин П.В. Визуализация молекулярнохимического взаимодействия материала, биокомпозита и ткани зуба на основе синхротронной ИК-микроспектроскопии. Вестник Российского государственного медицинского университета. 2019;(4):75–82. http://dx.doi.org/10.24075/vrgmu.2019.047
30. Timchenko EV, Timchenko PE, Volova LT, Ponomareva YV, Taskina LA. Raman spectroscopy of the organic and mineral structure of bone grafts. Quantum Electronics. 2014;44(7):696–699. http://dx.doi.org/10.1070/qe2014v044n07abeh015546
31. Movasaghi Z, Rehman S, Rehman IU. Raman Spectroscopy of Biological Tissues. Applied Spectroscopy Reviews. 2007;42(5):493–541. http://dx.doi.org/10.1080/05704920701551530
32. Bi X, Lin L, Chen Z, Ye J. Artificial Intelligence for Surface-Enhanced Raman Spectroscopy. Small Methods. 2024;8(1):e2301243. http://dx.doi.org/10.1002/smtd.202301243
33. Li L, Yu M, Li X, Ma X, Zhu L, Zhang T. A deep learning method for multi-task intelligent detection of oral cancer based on optical fiber Raman spectroscopy. Anal Methods. 2024;16(11):1659–1673. http://dx.doi.org/10.1039/d3ay02250a
34. Huang X, Xie M, Xie Y, Mei F, Lu X, Li X, Chen L. The roles of osteocytes in alveolar bone destruction in periodontitis. J Transl Med. 2020;18(1):479. http://dx.doi.org/10.1186/s12967-020-02664-7
35. Ушаков Р.В., Герасимова Т.П. Механизмы тканевой деструкции при пародонтите. Стоматология. 2017;96(4):63–66. https://doi.org/10.17116/stomat201796463-66
36. Магсумова О.А., Полканова В.А., Тимченко Е.В., Волова Л.Т. Рамановская спектроскопия и ее применение в стоматологии. Стоматология. 2021;100(4):137–142. https://doi.org/10.17116/stomat202110004
37. Paknejad M, Khorsand A, Yaghobee S, Motahhari P, Etebarian A, Bayani M, Mehrfard A. Cementogenesis in Patients with Localized Aggressive Periodontitis. J Dent (Tehran). 2015;12(5):347–351.
38. Armitage GC, Cullinan MP. Comparison of the clinical features of chronic and aggressive periodontitis. Periodontol 2000. 2010;53:12–27. https://doi.org/10.1111/j.1600-0757.2010.00353.x
39. Mahajan AC, Kolte AP, Kolte RA, Agrawal AA. Dimensional Evaluation of Root Resorption Areas in Differing Severity of Chronic Periodontitis: A Scanning Electron Microscopic Study. Contemp Clin Dent. 2017;8(3):433–438. https://doi.org/10.4103/ccd.ccd_512_17
Об авторах
И. В. БажутоваРоссия
Бажутова Ирина Владимировна — кандидат медицинских наук, доцент кафедры стоматологии института последипломного образования
ул. Чапаевская, д. 89, г. Самара, 443099
П. Е. Тимченко
Россия
Тимченко Павел Евгеньевич — кандидат физико-математических наук, доцент кафедры лазерных и биотехнических систем
ш. Московское, д. 34, г. Самара, 443086
Е. В. Тимченко
Россия
Тимченко Елена Владимировна — кандидат физико-математических наук, доцент, доцент кафедры лазерных и биотехнических систем
ш. Московское, д. 34, г. Самара, 443086
Д. А. Трунин
Россия
Трунин Дмитрий Александрович — доктор медицинских наук, профессор, заведующий кафедрой стоматологии института последипломного образования
ул. Чапаевская, д. 89, г. Самара, 443099
Д. Г. Глубоков
Россия
Глубоков Дмитрий Геннадьевич — заведующий отделением патологической анатомии
ул. Мирная, д. 169, г. Самара, 443035
А. М. Хамадеева
Россия
Хамадеева Альфия Минвалиевна — доктор медицинских наук, профессор, профессор кафедры стоматологии института последипломного образования
ул. Чапаевская, д. 89, г. Самара, 443099
Дополнительные файлы
Рецензия
Для цитирования:
Бажутова И.В., Тимченко П.Е., Тимченко Е.В., Трунин Д.А., Глубоков Д.Г., Хамадеева А.М. Применение спектроскопии комбинационного рассеяния для оценки состояния костной ткани при пародонтите: нерандомизированное клинико-лабораторное исследование. Кубанский научный медицинский вестник. 2025;32(5):64-73. https://doi.org/10.25207/1608-6228-2025-32-5-64-73
For citation:
Bazhutova I.V., Timchenko P.E., Timchenko E.V., Trunin D.A., Glubokov D.G., Khamadeeva А.M. Raman spectroscopy for assessing bone tissue in periodontitis: A nonrandomized clinical and laboratory study. Kuban Scientific Medical Bulletin. 2025;32(5):64-73. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-5-64-73








































