Перейти к:
Значимость цитокинового профиля при ренальных осложнениях у детей в период пандемии COVID-19: обсервационное когортное ретроспективное клиническое исследование
https://doi.org/10.25207/1608-6228-2025-32-1-29-38
Аннотация
Введение. Коронавирус-2 тяжелого острого респираторного синдрома (SARS-CoV-2) является новой проблемой здравоохранения во всем мире. Он потенциально поражает все органы, включая почки. Ренальная патология чаще встречалась у детей младшего возраста и у лиц с сопутствующими заболеваниями. Отмечается развитие острой почечной недостаточности у некоторых больных с патологией мочевыделительной системы, спровоцированной COVID-19, к периоду выписки из стационара.
Цель исследования — изучить важные аспекты цитокинового профиля в сыворотке крови и в моче у детей возрастной группы 9–14 лет с острым пиелонефритом, развившимся на фоне COVID-19 и без него.
Методы. Обсервационное когортное ретроспективное клиническое исследование 28 детей с острым пиелонефритом проведено из числа пациентов отделения нефрологии государственного бюджетного учреждения здравоохранения «Самаркандский областной детский многопрофильный медицинский центр» Министерства здравоохранения Республики Узбекистан. Группу контроля составили 14 здоровых детей, проходивших профилактический медицинский осмотр согласно возрасту и/или в порядке самообращения в поликлинике данного учреждения. Лабораторные исследования биологического материала выполнялись на базе клинико-диагностической лаборатории учреждения, где проходили лечение и наблюдение дети, а также лаборатории международного многопрофильного медицинского центра «INNOVA EXPERT» (г. Самарканд) и в центральной научно-исследовательской лаборатории Института иммунологии и геномики человека и в лаборатории клиники «Gunchamed» (г. Ташкент). Отбор участников в исследование проводился с января 2021 по декабрь 2022 года. Дети с острым пиелонефритом включались в исследование в порядке госпитализации в лечебное учреждение и в зависимости от наличия в анамнезе COVID-19 разделены на две группы: 1-я группа (n = 14) — с острым пиелонефритом без наличия в анамнезе COVID-19, 2-я группа (n = 14) — больных на фоне COVID-19, период реконвалесценции после перенесенного COVID-19 от 3 недель до 3 месяцев. Основной исход исследования: оценка цитокинового профиля (интерлейкин-4, интерлейкин-6, фактор некроза опухоли-α и интерферон-γ) сыворотки крови и мочи. Дополнительный исход: оценка ренальной функции почек по принципу исследования состояния проксимальных и дистальных тубул. Статистическую обработку результатов лабораторных исследований осуществляли с помощью программ Excel (Microsoft Office, 2016, США) и StatPlus версия 7 (AnalystSoft Inc., США). Различия считались статистически значимыми при р < 0,05.
Результаты. Установлено статистически значимое повышение концентрации интерлейкина-6, интерлейкина-4, фактора некроза опухоли-α и интерферона-γ в моче. У больных 1-й группы показатели фактора некроза опухоли-α были выше в 4,9 раза, а интерферона-γ — в 11,0 раза по сравнению с показателями контрольной группы, тогда как у детей 2-й группы данные показатели превышали в 8,8 и в 14,8 раза показатели здоровых детей соответственно. При этом превышение интерлейкина-4 в моче составило 4,7 раза для группы 1 и 5,6 раза для группы 2. Результаты анализа указывают на значительную роль интерлейкина-6 как агрессивного фактора в развитии тубулоинтерстициального поражения, его уровень в моче был повышен в 37,9 раза у детей 1-й группы и в 47,1 раза у пациентов 2-й группы по сравнению с данными показателями у здоровых детей. Значительное увеличение уровня интерлейкина-6 при менее выраженных поражениях тубулоинтерстициальной ткани и повышение его значений по мере возрастания тубулоинтерстициального поражения указывает на повышенную экскрецию цитокина с мочой при повреждении канальцевых функций из-за наличия вируса SARS-CoV-2, который приводит к повреждению проксимальных тубул.
Заключение. С целью контроля течения латентных поражений тубулярных функций (скрининг-исследование) у больных, перенесших COVID-19, необходимо изучить уровень цитокинов (интерлейкина-6, интерферона-γ, фактора некроза опухоли-α, интерлейкина-4) в моче, на основании чего можно определить степень пролиферативных изменений в тубулоинтерстициальной ткани почек и сформировать группы риска больных по хронизации процесса.
Для цитирования:
Ахмеджанова Н.И. Значимость цитокинового профиля при ренальных осложнениях у детей в период пандемии COVID-19: обсервационное когортное ретроспективное клиническое исследование. Кубанский научный медицинский вестник. 2025;32(1):29-38. https://doi.org/10.25207/1608-6228-2025-32-1-29-38
For citation:
Axmedjanova N.I. Significance of cytokine profile in renal complications in children during the COVID-19 pandemic: An observational cohort retrospective clinical study. Kuban Scientific Medical Bulletin. 2025;32(1):29-38. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-1-29-38
ВВЕДЕНИЕ
В развитии ренальной патологии на фоне COVID- 19 у детей имеют значение поражение не только канальцевого аппарата, но и клубочков и всех сосудов ренальной интерстициальной ткани. Этот феномен вызывает деструктивный процесс мозгового слоя, переходящий в интерстициальный фиброз с вовлечением в воспалительный процесс всего нефрона.
Из-за малого количества явных клинических симптомов и нередко неточной трактовки показателей мочевого синдрома и биохимических индикаторов крови острая почечная дисфункция после перенесенного COVID-19 в дебютный раз устанавливается в период значительного нарушения ренальных функций почек, и зачастую даже непоправимого [1–5]. Для изучения особенностей формирования изменений почечной структуры после перенесенного COVID-19 конструируются нетрадиционные методы диагностики [6]. Установление патогенеза изменений является трудноразрешимой проблемой, в частности в связи с необходимостью применения неинвазивного метода диагностики [7][8].
D. J. Stewart et al. указывают на необходимость контроля цитокинового профиля почек у всех больных детей с COVID-19, одномоментно предотвращая такие факторы, утяжеляющие ренальные нарушения, как применение нефротоксичных средств и гиповолемия [9].
Особенности цитокинов в различных периодах тубулоинтерстициальной патологии изучили D. Morozov et al. (2016) [4]. Моноциты, макрофаги и Т-клетки синтезируют хемокины и цитокины, тем самым стимулируя пролиферативные процессы в ренальных клетках, вещества активации фибробластов, ТФН-ß, фактор роста фибробластов, инсулиноподобный, эпидермальный факторы роста, интерферон-γ, ФНО-α, макрофагальный колониестимулирующий фактор и интерлейкины [10].
В ходе эксперимента на крысах Y. Renata et al. (2013) показали, что цитокин агрессии ФНО-α синтезируется эпителиальными клетками тубул и данная патология значимо повышает экспрессию гена внутрипочечного ФНО-α. Повышение уровня ФНО-α в моче достоверно коррелировало с альбуминурией, a использование на крысах эналаприла приводило к снижению экспрессии гена этого цитокина, экскреции его с мочой и снижало уровень альбуминурии [11–15].
Стимуляция выделения этими клетками агрессивных цитокинов и факторов роста, установленная в ряде исследований [16], является ключевым моментом поражения тубулярных клеток, появления тубулоинтерстициальных нарушений и определяет значимую важность их как местных медиаторов. Таким образом, методика определения цитокинов в моче — это наиболее точный метод диагностики тубулоинтерстициальных повреждений почек (ТИПП), а в сыворотке — он используется только в сложных диагностических ситуациях.
Цель исследования — определить и оценить особенности цитокинового профиля в сыворотке крови и в моче у детей возрастной группы 9–14 лет с острым пиелонефритом, развившимся на фоне COVID-19 и без него.
МЕТОДЫ
Дизайн исследования
Обсервационное когортное ретроспективное клиническое исследование 28 детей, госпитализированных в медицинское учреждение с диагнозом «острый пиелонефрит» в возрасте 9–14 лет, с и без верифицированного диагноза COVID-19 в анамнезе (по данным медицинской карты ребенка). Также в исследование включены лабораторные показатели анализов крови и мочи 14 здоровых детей, полученные при прохождении профилактического медицинского осмотра.
Условия проведения исследования
Госпитализация, лечение и наблюдение пациентов с острым пиелонефритом проведены в период с января 2021 по декабрь 2022 года в отделении нефрологии государственного бюджетного учреждения здравоохранения «Самаркандский областной детский многопрофильный медицинский центр» Министерства здравоохранения Республики Узбекистан. Профилактический медицинский осмотр согласно возрасту и/или в порядке самообращения условно здоровых детей осуществлялся в поликлинике данного учреждения в январе—феврале 2021 года. Лабораторные исследования биологического материала выполнены на базе клинико-диагностической лаборатории государственного бюджетного учреждения здравоохранения «Самаркандский областной детский многопрофильный медицинский центр» Министерства здравоохранения Республики Узбекистан, лаборатории международного многопрофильного медицинского центра «INNOVA EXPERT» (г. Самарканд), в центральной научно-исследовательской лаборатории Института иммунологии и геномики человека и в лаборатории клиники «Gunchamed» (г. Ташкент).
Критерии соответствия
Критерии включения
Для всех исследуемых групп возраст пациентов от 9 до 14 лет — наличие от законных представителей пациентов письменного информированного согласия на участие в исследование. Для детей контрольной группы — отсутствие в анамнезе по данным медицинской карты ребенка COVID-19. Для пациентов опытных групп — диагноз «острый пиелонефрит» вне зависимости от наличия COVID-19 в анамнезе.
Критерии невключения
Острые или хронические заболевания в активной фазе, не связанные с изучаемой патологией (например, декомпенсированная стадия гепатобилиарной системы, кардио-васкулярная патология, болезни кровеносной системы и прочее); психические заболевания.
Критерии исключения
Отказ родителей от дальнейшего мониторинга.
Описание критериев соответствия (диагностические критерии)
Согласно клинико-лабораторной диагностике, обоснованной клиническими рекомендациями, выбор детей для исследования содержал постановку диагноза «острый пиелонефрит»1. Результаты субъективного и объективного обследования пациента, клинико-лабораторные показатели (общий анализ мочи, проба Нечипоренко, бакпосев мочи с выявлением возбудителя, определение лейкоцитов в моче) являлись диагностическими критериями при делении детей на группы. Симптомами острого пиелонефрита (ОП) у детей в изучаемых группах было сочетание лихорадки фебрильного характера (в сочетании интоксикацией) с поражением ритма мочеиспускания (императивные позывы, паллакиурия, редкие микции), эквивалентами болезненного мочеиспускания. Использовали ИФА-диагностику сыворотки крови для подтверждения COVID-19 в анамнезе исследуемых больных c ОП, где обнаруживали высокую концентрацию IgG (г/л), которая обосновывала наличие данной патологии в анамнезе и переход COVID-19 в фазу ремиссии [17].
Подбор участников в группы
Дети с острым пиелонефритом включались в исследования в порядке госпитализации в лечебное учреждение и в зависимости от наличия в анамнезе COVID-19 разделены на две группы: 1-я группа (n = 14) — с острым пиелонефритом без наличия в анамнезе COVID-19, 2-я группа (n = 14) — больных на фоне COVID-19. Контрольную (3 группу) исследования составили условно здоровые дети (n = 14).
Целевые показатели исследования
Основной показатель исследования
Исследовать цитокиновый профиль сыворотки крови и мочи на основании изучения интерлейкина-6 (ИЛ-6) (пг/мл), интерлейкина-4 (ИЛ-4) (пг/мл), интерферон-γ (ИНФ-γ) (пг/мл), фактора некроза опухоли α (ФНО-α) (пг/мл), которые, по литературным источникам, являлись наиболее значимыми показателями для лабораторной оценки статуса больных с ОП, имевших в анамнезе COVID-19.
Дополнительные показатели исследования
Рассмотреть ренальные функции почек по принципу исследования состояния проксимальных и дистальных тубул. Функцию проксимальных тубул оценивали по количеству суточной протеинурии (мг/сут) и осмотического концентрирования мочи (усл. ед.). Целесообразные функции дистальных тубул определяли по объему выделения титруемых кислот (ммоль/24) и аммиака в моче (ммоль/24), которые, по литературным источникам [17][20], являлись наиболее значимыми показателями для лабораторной оценки тубулярных функций почек у пациентов с ОП.
Методы измерения целевых показателей
Выполнен анализ показателей мочевого синдрома: (протеинурия (мг/сут), лейкоцитурия (кл. в п. з.), бактериурия (КОЕ/мл)); накопительные пробы по Нечипоренко (кл/мл); посев мочи на микрофлору (>100 000 КОЕ/мл). Для анализа тубулярных функций почек применяли методы, определяющие состояние проксимальных тубул (суточной протеинурии (мг/л)); дистальных тубул (осмотическое концентрирование мочи (проба Зимницкого) (усл. ед.)), уровень титрационных кислот (ммоль/24) и аммиака в моче (ммоль/24).
Кровь собирали из локтевой вены в утренние часы, натощак, в пластиковые вакуумные пробирки в объеме 5 мл. Отделение сыворотки осуществили путем центрифугирования пробирок при 3000 об/мин на протяжении 15 минут. Хранение сыворотки до реализации исследования (не более 3 месяцев) проводилось при температуре –20 °C. Сбор стандартов мочи по 15 мл каждый осуществляли на обобщенном режиме на протяжении суток из суммарного количества суточного диуреза. Стандарты мочи держали при –20 ºС до окончания анализа.
Цитокиновый профиль сыворотки крови и мочи определялся на основании использования диагностических наборов коммерческих тестов: систем ИЛ-6 (пг/мл), ИЛ-4 (пг/мл), ИНФ-γ (пг/мл), ФНО-α (пг/мл) (ЗАО «Вектор-Бест», Россия) [15]. Для изучения концентрации данных цитокинов в моче использовали методику «sandwich» — твердофазного иммуноферментного анализа (ИФА) (ELISA-enzym-linked immunosorbent assay) [2], основанную на качественном и количественном анализе изучаемого антигена путем его послойного связывания со специфичными к нему антителами. Моноклональные антитела, специфичные к исследуемому антигену, фиксированы на поверхности лунок 96-луночного планшета. При добавлении к ним изучаемых образцов или стандартов исследуемый антиген связывался иммобилизованными антителами. После удаления не связавшихся протеинов в лунки добавлялись поликлональные антитела. После этого их излишек отмывался и в лунки добавлялся раствор хромогенного субстрата (TMB (3,3´,5,5´-тетраметилбензидин)), который, прореагировав с энзимом, давал характерное окрашивание. В процессе ферментативной реакции изменяется интенсивность окраски лунок, и это измеряют на спектрофотометре для планшетов.
Переменные (предикторы, конфаундеры, модификаторы эффекта)
Фальсифицирующими аспектами, влияющими на количество изучаемых маркеров в сыворотке или плазме крови, преимущественно считаются заболевания соматического профиля (ревматическая лихорадка), органические дисфункции соединительной ткани. Эти параметры были уравнены в период организации выборок отнесением их в группу критериев невключения. Также непосредственным подтверждением дефицита явного воздействия органических дисфункций соединительнотканной системы является недостаточный уровень типичных периферических индикаторов нарушения соединительной ткани (маркеры ревмопробы).
Статистические процедуры
Принципы расчета размера выборки
Расчет размера выборки не проводился. Группы больных детей формировались по наличию поступивших в стационар больных детей с острым пиелонефритом в возрастном диапазоне 9–14 лет.
Статистические методы
Оценка соответствия распределения числовых значений целевых показателей и других количественных параметров в группах больных и здоровых детей нормальному закону распределения проводили с помощью критерия Колмогорова — Смирнова. Статистическую значимость различия полученных числовых результатов для отдельных групп оценивали с помощью или параметрического критерия Стьюдента (для двух выборок), или Фишера (при сравнении трех выборок) с вычислением средних показателей (М) и среднеквадратического отклонения (SD) в виде М ± SD. При статистическом анализе качественных параметров (сравнение долей) применялся критерий хи-квадрат. Различия считались статистически значимыми при р < 0,05. Проведение расчетов осуществляли с помощью программ: Excel (Microsoft Office, 2016, США) и StatPlus версия 7 (AnalystSoft Inc., США).
РЕЗУЛЬТАТЫ
Формирование выборки исследования
Включение пациентов с острым пиелонефритом в исследование осуществлялось согласно критериям включения и невключения при поступлении в стационар, до начала проведения лечения. При наличии в анамнезе COVID-19 у пациента с ОП (на основании анализа медицинской карты ребенка) его включали в основную группу (группа 2, n = 14). Параллельно была набрана группа сравнения (группа 1, n = 14), которую составили пациенты с ОП, не имевшие в анамнезе COVID-19. Период реконвалесценции после перенесенного COVID-19 у пациентов 2-й группы составил от 3 недель до 3 месяцев. Контрольную группу (группа 3, n = 14) составили условно здоровые дети. Исключение участников исследования, как и отказа от участия в исследовании, не было (рис. 1).
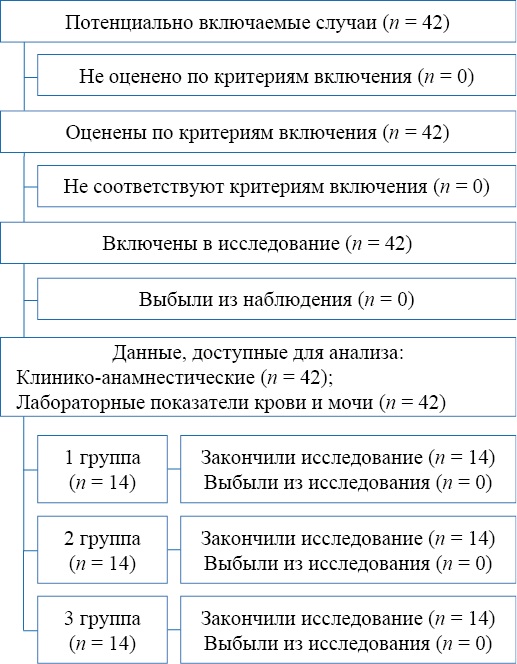
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена автором (согласно рекомендациям STROBE).
Fig. 1. Schematic diagram of the research design
Note: performed by the author (according to STROBE recommendations).
Характеристики выборки (групп) исследования
Исследуемые дети были сопоставимы по полу и возрасту: во 2-й группе мальчиков насчитывалось 8 (57,1 %), девочек 6 (42,9 %); в 1-й группе число мальчиков составило 7 (50,0 %) и девочек 7 (50,0 %); в группе контроля мальчиков было 6 (42,9 %), девочек 8 (57,1 %). По критерию хи-квадрат (анализ произвольных таблиц сопряженности) доли в группах сравнения были статистически одинаковыми (р = 0,571) (табл. 1). В 1-й группе средний возраст (М ± SD) был равен 11,3 ± 1,9 года; во 2-й группе — 12,6 ± 1,4 года; в группе контроля — 11,7 ± 1,8 года. Однофакторный дисперсионный анализ по критерию Фишера не выявил статистически значимого различия в группах по возрасту (р = 0,297) (табл. 1). Статистический анализ по росту, весу, индексу массы тела (ИМТ), доли мест проживания (село или город) детей в группах также не показал статистически значимого различия в значениях в сравниваемых группах больных и здоровых детей и представлен в таблице 1.
Таблица 1. Средние значения величин демографических и физиологических параметров (М ± SD) или доли (%) в сравниваемых группах больных и здоровых детей
Table 1. Mean values of demographic and physiological parameters (M ± SD) or proportions (%) in the compared groups of patients and healthy children
|
Наименование параметра |
Группа 1 (n = 14) |
Группа 2 (n = 14) |
Группа 3 (n = 14) |
Уровень значимости (p) |
|
Возраст, лет |
11,3 ± 1,9 |
12,6 ± 1,4 |
11,7 ± 1,8 |
0,297 |
|
Рост, см |
143,3 ± 8,7 |
140,3 ± 13,3 |
139,4 ± 12,8 |
0,688 |
|
Вес, кг |
35,0 ± 7,4 |
33,7 ± 8,7 |
34,4 ± 8,3 |
0,167 |
|
ИМТ, кг/м² |
16,9 ± 2,0 |
16,9 ± 2,0 |
17,5 ± 1,8 |
0,687 |
|
Женщин, n/ % |
7/50,0 |
6/42,9 |
8/57,1 |
0,571 |
|
Сельские жители, n/ % |
10/71,4 |
11/78,6 |
9/64,3 |
0,700 |
Примечание: таблица составлена автором. Сокращение: ИМТ — индекс массы тела.
Note: compiled by the author. Abbreviation: ИМТ — body mass index.
По всем вышеуказанным показателям все три группы были сопоставимы для сравнения, так как не выявлено статистически значимых различий в значениях показателей.
Проводили сравнение значений некоторых показателей, таких как содержание общего белка, температура при поступлении в лечебное учреждение, содержание лейкоцитов, скорость оседания эритроцитов (СОЭ) и скорость клубочковой фильтрации (СКФ) только среди групп больных детей. Анализ проводили с помощью параметрического критерия Стьюдента для двух независимых выборок. Средние значения общего белка для детей в группах 1 и 2 статистически значимо не отличались (р > 0,05) (табл. 2). Температура при поступлении в стационар была во второй группе значимо больше, 39,1 ± 0,6 °C, чем в первой группе, 38,0 ± 0,3 °C (табл. 2). Содержание лейкоцитов, средние значения СОЭ и СКФ в сравниваемых группах больных статистически значимо различались между собой (табл. 2).
Таблица 2. Средние значения некоторых параметров (M ± SD) в сравниваемых группах больных детей
Table 2. Mean values of certain parameters (M ± SD) in the compared groups of pediatric patients
|
Наименование параметра |
Группа 1 (n = 14) |
Группа 2 (n = 14) |
Уровень значимости (p) |
|
Общий белок, мг/мл |
55,3 ± 3,1 |
56,2 ± 3,9 |
0,492 |
|
Температура, °C |
38,0 ± 0,3 |
39,1 ± 0,6 |
0,003 |
|
Лейкоциты, 10⁹/л |
12,6 ± 2,8 |
22,6 ± 4,3 |
<0,001 |
|
СОЭ, мм/ч |
24,1 ± 5,8 |
37,8 ± 5,7 |
<0,001 |
|
СКФ, мл/мин/1,73 мІ |
84,1 ± 15,2 |
63,8 ± 6,0 |
<0,001 |
Примечание: таблица составлена автором. Сокращения: СОЭ — скорость оседания эритроцитов, СКФ — скорость клубочковой фильтрации.
Note: compiled by the author. Abbreviations: Abbreviations: СОЭ — erythrocyte sedimentation rate, СКФ — glomerular filtration rate.
Основные результаты исследования
Показатели цитокинового профиля сыворотки крови оценивались в острый период болезни при поступлении больных детей в стационар. Исследование цитокинового профиля сыворотки крови показало, что при наличии COVID-19 в анамнезе отмечено значительное повышение провоспалительных медиаторов. Такой медиатор, как ИЛ-6, повышался до 18,3 ± 4,6 пг/мл у детей 1-й группы и до 93,7 ± 13,8 пг/мл у детей 2-й группы, тогда как у здоровых детей данный показатель был равен 3,4 ± 0,9 пг/мл (р < 0,001 по критерию Фишера при однофакторном дисперсионном анализе). Концентрация ФНО-α в крови была повышенной для группы 1 до значений 64,3 ± 10,1 пг/мл и для группы 2 до значений 85,1 ± 12,6 пг/мл, хотя для группы здоровых детей концентрация была равна 10,7 ± 3,1 пг/мл (р < 0,001 по критерию Фишера при однофакторном дисперсионном анализе). Уровень ИНФ-γ у больных 1-й группы составил 135,5 ± 13,6 пг/мл, а у детей 2-й группы 194,1 ± 18,4 пг/мл, тогда как у здоровых детей данный показатель не превышал 13,3 ± 3,0 пг/мл (р < 0,001 по критерию Фишера при однофакторном дисперсионном анализе). Отмечено также повышение ИЛ-4 до 29,4 ± 7,2 пг/мл, а у пациентов 2-й группы его уровень достигал 47,4 ± 8,2 пг/мл, тогда как у здоровых детей данный показатель составлял 6,2 ± 1,7 пг/мл (р < 0,001 по критерию Фишера при однофакторном дисперсионном анализе) (табл. 3). Повышение провоспалительных цитокинов приводит к разрушению подоцитов, апоптозу и даже гломерулярному фиброзу.
Таблица 3. Средние значения (М ± SD) концентрации цитокинов в сыворотке крови больных и здоровых детей в сравниваемых группах
Table 3. Mean values (М ± SD) of cytokine concentrations in the serum of patients and healthy children in the compared groups
|
Наименование параметра |
Группа 1 (n = 14) |
Группа 2 (n = 14) |
Группа 3 (n = 14) |
Уровень значимости (p) |
|
ИЛ-4 в крови, пг/мл |
29,4 ± 7,2 |
47,4 ± 8,2 |
6,2 ± 1,7 |
<0,001 |
|
ИЛ-6 в крови, пг/мл |
18,3 ± 4,6 |
93,7 ± 13,8 |
3,4 ± 0,9 |
<0,001 |
|
ФНО-α в крови, пг/мл |
64,3 ± 10,1 |
85,1 ± 12,6 |
10,7 ± 3,1 |
<0,001 |
|
ИНФ-γ в крови, пг/мл |
135,5 ± 13,6 |
194,1 ± 18,4 |
13,3 ± 3,0 |
<0,001 |
Примечание: таблица составлена автором. Сокращения: ИЛ — интерлейкин, ФНО — фактор некроза опухоли, ИНФ — интерферон.
Note: compiled by the author. Abbreviations: ИЛ — interleukin, ФНО — tumor necrosis factor, ИНФ — interferon.
Если привести уровни содержания цитокинов в крови в виде нормированных показателей, у которых за единицу принимаем уровень концентрации отдельных цитокинов в крови здоровых детей, то получим наглядное представление, во сколько раз концентрации цитокинов в крови больных превышают концентрацию аналогичных цитокинов в сыворотке крови здоровых детей (рис. 2).
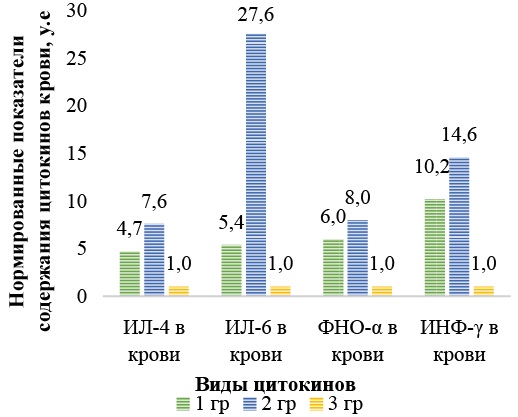
Рис. 2. Нормированные показатели уровней цитокинов в крови в группах больных и здоровых детей
Примечание: рисунок выполнен автором. Сокращения: ИЛ — интерлейкин; ФНО — фактор некроза опухоли; ИНФ — интерферон.
Fig. 2. Normalized levels of cytokines in blood in groups of patients and healthy children
Note: performed by the author. Abbreviations: ИЛ — interleukin, ФНО — tumor necrosis factor, ИНФ — interferon.
Определено статистически значимое повышение уровня противовоспалительного ИЛ-4 в сыворотке крови у больных 1-й группы в 4,7 раза (29,4 ± 7,2 пг/мл, р < 0,001) по сравнению со значениями у здоровых детей (6,2 ± 1,7 пг/мл, р < 0,001). Этот факт сочетался с увеличением уровня концентрации ФНО-α и ИНФ-γ в сыворотке крови детей группы 1 (соответственно в 6,0 и 10,2 раза), тогда как у здоровых детей данные показатели составляли 10,7 ± 3,1 и 13,3 ± 3,0 пг/мл соответственно.
У больных группы 2 уровень ИЛ-4 в сыворотке крови был повышен в 7,6 раза по сравнению с контрольной группой, а концентрация ФНО-α в 8,0 раза и концентрация ИНФ-γ в 14,6 раза. Во всех случаях сравнения р < 0,001. Средние значения ИЛ-6 у детей 1-й группы были превышены в 5,4 раза (р < 0,001) по сравнению с контрольной группой. Самые высокие уровни ИЛ-6 в крови были зарегистрированы у детей 2-й группы, где данный параметр был повышен в 27,6 раза (р < 0,001) (рис. 2). Проводили сравнение только между значениями концентрации цитокинов в крови для групп 1 и 2 с помощью критерия Стьюдента для независимых выборок. По всем четырем целевым показателям различия статистически значимы на уровне р < 0,001. Определено, что нарушение цитокинового профиля сыворотки крови было более выражено у больных, имевших в анамнезе COVID-19, что связано с развитием более выраженного иммунного нарушения, на фоне которого формируется острая почечная патология, возникающая из-за повышения проницаемости сосудов, потери жидкости, внутрибрюшной гипертензии, гиповолемии и последующего шока.
У пациентов с острым течением пиелонефрита концентрация изучаемых цитокинов в моче представлена в таблице 4.
Таблица 4. Средние значения (М ± SD) концентрации цитокинов в моче больных и здоровых детей в сравниваемых группах
Table 4. Mean values (М ± SD) of cytokine concentrations in the urine of patients and healthy children in the compared groups
|
Наименование параметра |
Группа 1 (n = 14) |
Группа 2 (n = 14) |
Группа 3 (n = 14) |
Уровень значимости (p) |
|
ИЛ-4 в моче, пг/мл |
32,7 ± 7,2 |
38,3 ± 7,9 |
6,9 ± 3,4 |
<0,001 |
|
ИЛ-6 в моче, пг/мл |
113,6 ± 15,0 |
141,4 ± 9,6 |
3,0 ± 1,1 |
<0,001 |
|
ФНО-α в моче, пг/мл |
49,1 ± 9,2 |
88,5 ± 14,4 |
10,1 ± 3,9 |
<0,001 |
|
ИНФ-γ в моче, пг/мл |
151,1 ± 12,3 |
203,0 ± 23,6 |
13,7 ± 4,3 |
<0,001 |
Примечание: таблица составлена автором. Сокращения: ИЛ — интерлейкин, ФНО — фактор некроза опухоли, ИНФ — интерферон.
Note: compiled by the author. Abbreviations: ИЛ — interleukin, ФНО — tumor necrosis factor, ИНФ — interferon.
Как свидетельствуют полученные данные, острый процесс сочетался со значимо повышенной концентрацией ИЛ-6, ФНО-α, ИНФ-γ, ИЛ-4 в моче. Цитокин ИЛ-6 в моче повышался до 113,6 ± 15,0 пг/мл у детей 1-й группы и до 141,4 ± 9,6 пг/мл у детей 2-й группы, тогда как у здоровых детей данный показатель был равен 3,0 ± 1,1 пг/мл (р < 0,001 по критерию Фишера при однофакторном дисперсионном анализе). У больных 1-й группы показатели ФНО-α составляли 49,1 ± 9,2 пг/мл, а у детей 2-й группы данный параметр был равен 88,5 ± 14,4 пг/мл, тогда как у здоровых детей этот показатель в моче не превышал 10,1 ± 3,9 пг/мл (р < 0,001 по критерию Фишера при однофакторном дисперсионном анализе). ИНФ-γ у детей с ОП без наличия в анамнезе COVID-19 концентрация была 151,1 ± 12,3 пг/мл, а у детей 2-й группы данный показатель был повышен до 203,0 ± 23,6 пг/мл, что указывает на значимое повышение изучаемого параметра у детей, переболевших COVID-19, по сравнению с больными ОП без наличия COVID-19 в анамнезе, тогда как у здоровых детей изучаемый параметр был равен 13,7 ± 4,3 пг/мл (р < 0,001 по критерию Фишера при однофакторном дисперсионном анализе). ИЛ-4 у детей 1-й группы повышен до 32,7 ± 7,2 пг/мл, а у больных 2-й группы уровень данного показателя повысился до 38,3 ± 7,9 пг/мл, тогда как у здоровых детей он не превышал 6,9 ± 3,4 пг/мл (р < 0,001 по критерию Фишера при однофакторном дисперсионном анализе). Если привести уровни содержания цитокинов в моче в виде нормированных показателей, у которых за единицу примем уровень концентрации отдельных цитокинов в моче здоровых детей, то получим наглядное представление, во сколько раз концентрации цитокинов в моче больных превышают концентрацию аналогичных цитокинов в моче здоровых детей (рис. 3).
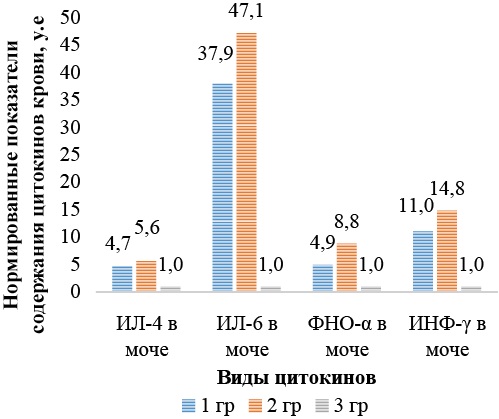
Рис. 3. Нормированные показатели уровней цитокинов в моче в группах больных и здоровых детей
Примечание: рисунок выполнен автором. Сокращения: ИЛ — интерлейкин, ФНО — фактор некроза опухоли, ИНФ — интерферон.
Fig. 3. Normalized levels of cytokines in urine in groups of patients and healthy children
Note: performed by the author. Abbreviations: ИЛ — interleukin, ФНО — tumor necrosis factor, ИНФ — interferon
У больных 1-й группы показатели концентрации ФНО-α в моче повысились в 4,9 раза, а ИНФ-γ в 11,0 раза по сравнению с показателями контрольной группы (р < 0,001), тогда как у детей 2-й группы данные показатели превышали в 14,8 раза (р < 0,001) и составили 88,5 ± 14,4 и 203,0 ± 23,6 пг/мл соответственно. При этом у детей группы 1 превышение концентрации в моче ИЛ-4 составило 4,7 раза (32,7 ± 7,2 пг/мл, р < 0,001), тогда как у детей группы 2 изучаемый показатель превышал уровень здоровых детей в 5,6 раза (р < 0,001). Так, концентрация ИЛ-6 в моче для группы 1 превышает в 37,9 раза, а в группе 2 в 47,1 раза. Проводили сравнение только между значениями концентрации цитокинов в моче для групп 1 и 2 с помощью критерия Стьюдента для независимых выборок. По всем четырем целевым показателям различия статистически значимы на уровне р < 0,001.
Дополнительные результаты исследования
Изучено состояние «мочевого синдрома» у детей с острым пиелонефритом и установлено более значимое изменение всех лабораторных параметров у детей, перенесших COVID-19. При исследовании мочевого синдрома определили лейкоцитурию, которая составила по пробе Ничепоренко у детей 1-й группы 4500 ± 178 клеток в 1 мл мочи и у пациентов 2-й группы 7140 ± 165 клеток в 1 мл, тогда как у здоровых детей данный показатель не превышал 1900 ± 55 клеток в 1 мл мочи (р < 0,001 по критерию Фишера при однофакторном дисперсионном анализе). Определен сравнительно высокий уровень микрогематурии у больных 2-й группы, 2300 ± 135 эритроцитов в мл мочи, тогда как у детей 1 группы этот показатель составил 1250 ± 120 эритроцитов в мл, у здоровых же этот параметр не превышал 980 ± 50 эритроцитов в мл мочи (р < 0,001 по критерию Фишера при однофакторном дисперсионном анализе).
Нарушения функции дистального (ацидо- и аммониогенез) и проксимального (протеинурия) канальцев выявлялись у 100 % детей с ОП. Отмечено в обеих группах значимое снижение реабсорбционной функции проксимальных тубул (оценивали по уровню протеинурии), но более выраженное отмечено у пациентов с ОП на фоне COVID-19. Так, у детей 1-й группы протеинурия составила 387,0 ± 5,3 мг/сут, а у детей 2-й группы 709,0 ± 22,8 мг/сут, тогда как у здоровых детей данный показатель был равен 50,8 ± 9,8 мг/сут (р < 0,001 по критерию Фишера при однофакторном дисперсионном анализе).
Обращает внимание более выраженное повреждение функции осмотического концентрирования мочи в результате воспаления дистальных канальцев у больных 2-й группы. Так, у больных 1-й группы относительный удельный вес мочи составил 1011,62 ± 3,72 усл. ед. (р < 0,05), а у детей 2-й группы 1003,55 ± 5,78 усл. ед. (р < 0,001), тогда как у здоровых данный показатель был равен 1020,31 ± 4,33 усл. ед.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Анализ результатов исследования показал, что в сыворотке крови и в моче концентрации изучаемых цитокинов у пациентов с ОП с наличием COVID-19 в анамнезе имели наиболее высокое значение не только по ИНФ-γ, ФНО-α, но и по ИЛ-6, ИЛ-4, что мы связываем с наличием иммунопатологического механизма развития ОП на фоне COVID-19, что было обусловлено патологическим воздействием токсинов коронавирусной инфекции.
Результаты анализа цитокинового профиля мочи указывают на значительную роль ИЛ-6 как агрессивного фактора в развитии тубулоинтерстициального поражения, его уровень в моче был увеличен в 37,9 раза у пациентов группы сравнения и в 47,1 раза у детей основной группы по сравнению с параметрами у здоровых детей (контрольной группы 3). Интерпретация настоящего наблюдения установила, что в моче больных основной группы количество цитокинов имело более значимые величины нежели их уровень в крови. При этом такая же тенденция определена при изучении величин ФНО-α, что мы связываем с наличием иммунопатологического механизма развития воспалительного процесса в проксимальных канальцах, где и продуцируются цитокины воспаления при ОП, развившегося на фоне COVID-19, что было обусловлено патологическим воздействием токсинов коронавирусной инфекции на тубулярные клетки.
Ограничения исследования
Результаты настоящего исследования были получены на небольших выборках пациентов. Для дальнейшего развития выполненной работы необходимо проведение исследования с бóльшим объемом выборки, большей продолжительностью и возможным разделением основной группы на подгруппы в зависимости от длительности и активности COVID-19.
Интерпретация результатов исследования
Результаты исследования цитокинового профиля указывают на то, что весомое количество случаев с ренальными осложнениями в период пандемии COVID-19 объясняется нефротропностью токсинов коронавирусной инфекции [18–20]. Несмотря на особенности проявления острого пиелонефрита, интенсивная патология сопровождалась увеличением изучаемых провоспалительных цитокинов (ИНФ-γ, ФНО-α) в моче, инициировавших (активировавших) антивоспалительную деятельность увеличением уровня ИЛ-4. Завышенная концентрация изучаемых цитокинов в моче на фоне обнаруженной дисфункции тубулярного аппарата и искажения мочевого осадка воспалительного характера доказывает развитие местного воспалительного очага в тубулоинтерстиции [13][14]. Более значимый уровень ИЛ-6 при менее выраженных поражениях тубулоинтерстициальной ткани и снижение его параметров по мере возрастания тубулоинтерстициального поражения указывают на повышенную экскрецию цитокина с мочoй при повреждении канальцевых функций из-за наличия вируса SARS-CoV-2, который приводит к повреждению проксимальных тубул [20–22].
Определена корреляционная взаимосвязь цитокина ФНО-α в моче с уровнем лейкоцитурии и с С-реактивным белком в крови, что указывает на его патогенетическое участие в воспалительном процессе в проксимальных канальцах, взаимосвязанное с неспецифическими признаками системного воспаления, местными проявлениями активности процесса [22–26].
Обратная взаимосвязь, выявленная между ИНФ-γ в моче с эритроцитурией в фазе ремиссии, доказывает наличие связи между тубулярными функциями и цитокинами [15].
Сильная взаимосвязь концентрации ФНО-α в моче с лейкоцитозом говорит об обособленной дисфункции пассажа мочи, а отмеченная сильная взаимосвязь между мочевым уровнем ФНО-α с рН мочи указывает на то, что эти процессы являются доклиническими и тесно связаны с парциально нарушенными тубулярными функциями, что доказывает присутствие локального патологического процесса в тубулоинтерстициальной ткани [16][17].
Сильная обратная корреляционная связь отмечена между противовоспалительным цитокином ИЛ-4 в сыворотке крови и экскрецией титруемых кислот и аммиака с мочой, что доказывает наличие тесной связи между тубулярными функциями и цитокинами в крови [16][22–24].
ЗАКЛЮЧЕНИЕ
Так как для больных, имевших в анамнезе COVID-19, характерно более выраженное иммунное нарушение, вероятность формирования у таких больных острой почечной патологии, возникающей из-за повышения проницаемости сосудов, потери жидкости, внутрибрюшной гипертензии, гиповолемии и последующего шока, наиболее высока по сравнению с детьми, не имеющими в анамнезе COVID-19. Для ранней диагностики степени пролиферативных изменений в тубулоинтерстициальной ткани почек и организации групп риска больных по хронизации процесса необходим мониторинг течения латентных поражений тубулярных функций (скрининг-исследование) у больных, перенесших COVID-19, путем изучения количества цитокинов (ИЛ-6, ИНФ-γ, ФНО-α, ИЛ-4) в сыворотке крови и в моче. Рекомендуется у пациентов с легочными признаками COVID-19 в активную фазу болезни длительный мониторинг цитокинового профиля сыворотки крови и мочи с целью раннего выявления латентной ренальной патологии у детей с изолированным мочевым синдромом.
1. Союз педиатров России; Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии. Инфекция мочевыводящих путей у детей. Клинические рекомендации. 2021. Available: https://diseases.medelement.com/disease/инфекция-мочевыводящих-путей-у-детей-кр-рф-2021/17052
Список литературы
1. Aroca-Martínez G, Avendaño-Echavez L, Garcia C, Ripoll D, Dianda D, Cadena-Bonfanti A, Musso CG. Renal tubular dysfunction in COVID-19 patients. Ir J Med Sci. 2023;192(2):923–927. https://doi.org/10.1007/s11845-022-02993-0
2. Ахмеджанова Н.И., Ахмеджанов И.А., Исмаилова З.А., Гаппарова Г.Н. Клинико-лабораторная оценка ренальных осложнений у детей в период пандемии COVID-19. Doktor axborotnomasi. 2023;2(110):13–16. https://doi.org/10.38095/2181-466X-20231102-13-16
3. Киселева А.В., Лескова А.В., Скворцов В.В. Патология почек у пациентов с COVID-19. Лечащий Врач. 2022;9(25):19–23. https://doi.org/10.51793/OS.2022.25.9.003
4. Morozov D, Morozova O, Budnik I, Pervouchine D, Pimenova E, Zakharova N. Urinary cytokines as markers of latent inflammation in children with chronic pyelonephritis and anorectal malformations. J Pediatr Urol. 2016;12(3):153.e1–6. https://doi.org/10.1016/j.jpurol.2016.01.013
5. Laudanski K, Okeke T, Hajj J, Siddiq K, Rader DJ, Wu J, Susztak K. Longitudinal urinary biomarkers of immunological activation in covid-19 patients without clinically apparent kidney disease versus acute and chronic failure. Sci Rep. 2021;11(1):19675. https://doi.org/10.1038/s41598-021-99102-5
6. Robbins-Juarez SY, Qian L, King KL, Stevens JS, Husain SA, Radhakrishnan J, Mohan S. Outcomes for Patients With COVID-19 and Acute Kidney Injury: A Systematic Review and Meta-Analysis. Kidney Int Rep. 2020;5(8):1149–1160. https://doi.org/10.1016/j.ekir.2020.06.013. PMID: 32775814; PMCID: PMC7314696
7. Ronco C, Reis T. Kidney involvement in COVID-19 and rationale for extracorporeal therapies. Nat Rev Nephrol. 2020;16(6):308–310. https://doi.org/10.1038/s41581-020-0284-7
8. Shaikh N, Hoberman A, Keren R, Gotman N, Docimo SG, Mathews R, Bhatnagar S, Ivanova A, Mattoo TK, Moxey-Mims M, Carpenter MA, Pohl HG, Greenfield S. Recurrent Urinary Tract Infections in Children With Bladder and Bowel Dysfunction. Pediatrics. 2016;137(1):e20152982. https://doi.org/10.1542/peds.2015-2982
9. Stewart DJ, Hartley JC, Johnson M, Marks SD, du Pré P, Stojanovic J. Renal dysfunction in hospitalised children with COVID-19. Lancet Child Adolesc Health. 2020;4(8):e28–e29. https://doi.org/10.1016/S2352-4642(20)30178-4
10. Kang SH, Kim SW, Kim AY, Cho KH, Park JW, Do JY. Association between Chronic Kidney Disease or Acute Kidney Injury and Clinical Outcomes in COVID-19 Patients. J Korean Med Sci. 2020;35(50):e434. https://doi.org/10.3346/jkms.2020.35.e434
11. Renata Y, Jassar H, Katz R, Hochberg A, Nir RR, Klein-Kremer A. Urinary concentration of cytokines in children with acute pyelonephritis. Eur J Pediatr. 2013;172(6):769–774. https://doi.org/10.1007/s00431-012-1914-2
12. Shen Q, Wang M, Che R, Li Q, Zhou J, Wang F, Shen Y, Ding J, Huang S, Yap HK, Warady BA, Xu H, Zhang A; Chinese Society of Pediatric Nephrology and Chinese Medical Doctor Association of Pediatric Nephrology. Consensus recommendations for the care of children receiving chronic dialysis in association with the COVID-19 epidemic. Pediatr Nephrol. 2020;35(7):1351–1357. https://doi.org/10.1007/s00467-020-04555-x
13. Su H, Yang M, Wan C, Yi LX, Tang F, Zhu HY, Yi F, Yang HC, Fogo AB, Nie X, Zhang C. Renal histopathological analysis of 26 postmortem findings of patients with COVID-19 in China. Kidney Int. 2020;98(1):219–227. https://doi.org/10.1016/j.kint.2020.04.003
14. Raina R, Chakraborty R, Mawby I, Agarwal N, Sethi S, Forbes M. Critical analysis of acute kidney injury in pediatric COVID-19 patients in the intensive care unit. Pediatr Nephrol. 2021;36(9):2627–2638. https://doi.org/10.1007/s00467-021-05084-x
15. Tantisattamo E, Dafoe DC, Reddy UG, Ichii H, Rhee CM, Streja E, Landman J, Kalantar-Zadeh K. Current Management of Patients With Acquired Solitary Kidney. Kidney Int Rep. 2019;4(9):1205–1218. https://doi.org/10.1016/j.ekir.2019.07.001
16. Tramma D, Hatzistylianou M, Gerasimou G, Lafazanis V. Interleukin-6 and interleukin-8 levels in the urine of children with renal scarring. Pediatr Nephrol. 2012;27(9):1525–1530. https://doi.org/10.1007/s00467012-2156-2
17. Fragkou PC, De Angelis G, Menchinelli G, Can F, Garcia F, Morfin-Sherpa F, Dimopoulou D, Mack E, de Salazar A, Grossi A, Lytras T, Skevaki C. ESCMID COVID-19 guidelines: diagnostic testing for SARS-CoV-2. Clin Microbiol Infect. 2022;28(6):812–822. https://doi.org/10.1016/j.cmi.2022.02.011
18. Андрусев А.М., Томилина Н.А., Перегудова Н.Г., Шинкарев М.Б. Заместительная терапия терминальной хронической почечной недостаточности в Российской Федерации 2014–2018 гг. Отчет по данным Общероссийского Регистра заместительной почечной терапии Российского диализного общества. Нефрология и диализ. 2020;22(1):1–71. https://doi.org/10.28996/2618-9801-2020-1suppl-1-71
19. Tsai JD, Lin CC, Yang SS. Diagnosis of pediatric urinary tract infections. Urological Science. 2016;27(3):131–134. http://dx.doi.org/10.1016/j.urols.2016.10.001
20. van Veldhuisen DJ, Ruilope LM, Maisel AS, Damman K. Biomarkers of renal injury and function: diagnostic, prognostic and therapeutic implications in heart failure. Eur Heart J. 2016;37(33):2577–2585. https://doi.org/10.1093/eurheartj/ehv588
21. Joyce E, Glasner P, Ranganathan S, Swiatecka-Urban A. Tubulointerstitial nephritis: diagnosis, treatment, and monitoring. Pediatr Nephrol. 2017;32(4):577–587. https://doi.org/10.1007/s00467-016-3394-5
22. Кравченко А.Я., Концевая А.В., Будневский А.В., Черник Т.А. Новая коронавирусная инфекция (COVID-19) и патология почек. Профилактическая медицина. 2022;25(3):92–97. https://doi.org/10.17116/profmed20222503192
23. Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, Wang B, Xiang H, Cheng Z, Xiong Y, Zhao Y, Li Y, Wang X, Peng Z. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA. 2020;323(11):1061–1069. https://doi.org/10.1001/jama.2020.1585
24. Widiasta A, Sribudiani Y, Nugrahapraja H, Hilmanto D, Sekarwana N, Rachmadi D. Potential role of ACE2-related microRNAs in COVID-19-associated nephropathy. Noncoding RNA Res. 2020;5(4):153–166. https://doi.org/10.1016/j.ncrna.2020.09.001
25. Xiao G, Hu H, Wu F, Sha T, Zeng Z, Huang Q, Li H, Han J, Song W, Chen Z, Cai S. [Acute kidney injury in patients hospitalized with COVID-19 in Wuhan, China: a single-center retrospective observational study]. Nan Fang Yi Ke Da Xue Xue Bao. 2021;41(2):157–163. https://doi.org/10.12122/j.issn.1673-4254.2021.02.01
26. Xu Y, Li X, Zhu B, Liang H, Fang C, Gong Y, Guo Q, Sun X, Zhao D, Shen J, Zhang H, Liu H, Xia H, Tang J, Zhang K, Gong S. Characteristics of pediatric SARS-CoV-2 infection and potential evidence for persistent fecal viral shedding. Nat Med. 2020;26(4):502–505. https://doi.org/10.1038/s41591-020-0817-4
Об авторе
Н. И. АхмеджановаУзбекистан
Ахмеджанова Наргиза Исмаиловна — доктор медицинских наук, доцент, заведующая кафедрой педиатрии 2
ул. Амира Темура, д. 18, г. Самарканд, 100400
Дополнительные файлы
Рецензия
Для цитирования:
Ахмеджанова Н.И. Значимость цитокинового профиля при ренальных осложнениях у детей в период пандемии COVID-19: обсервационное когортное ретроспективное клиническое исследование. Кубанский научный медицинский вестник. 2025;32(1):29-38. https://doi.org/10.25207/1608-6228-2025-32-1-29-38
For citation:
Axmedjanova N.I. Significance of cytokine profile in renal complications in children during the COVID-19 pandemic: An observational cohort retrospective clinical study. Kuban Scientific Medical Bulletin. 2025;32(1):29-38. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-1-29-38








































