Перейти к:
Опыт лечения абсцессов подвздошно-поясничной мышцы в условиях ургентного многопрофильного стационара: когортное ретроспективное исследование
https://doi.org/10.25207/1608-6228-2025-32-3-74-93
Аннотация
Введение. Илиопсоас-абсцесс является редкой патологией, исследования, посвященные данной теме, в России немногочисленны. В литературе описываются единичные наблюдения, что ограничивает статистический анализ данных. Летальность при илиопсоас-абсцессе составляет 12–15 % и не имеет тенденции к снижению. Диагноз устанавливается на основании лучевых методов визуализации в сочетании с клинико-лабораторными данными, направленными на выявление признаков воспалительной реакции, оценку органной дисфункции и тяжести состояния. Лечение включает в себя антибактериальную терапию, дренирование абсцесса, терапию сепсиса и коррекцию органной дисфункции, при этом единые клинические рекомендации по диагностике и лечению отсутствуют. Анализ накопленных данных об этой патологии и изучение факторов, влияющих на течение заболевания и прогноз, позволят в дальнейшем наметить пути улучшения результатов лечения. Цель исследования — провести ретроспективный анализ структуры пациентов с илиопсоас-абсцессами, поступивших в многопрофильный стационар за восьмилетний период, а также осуществить оценку результатов диагностики и лечения данной категории больных. Методы. Проведено когортное ретроспективное исследование на базе государственного бюджетного учреждения «Санкт-Петербургский научно-исследовательский институт скорой помощи имени И. И. Джанелидзе» 116 пациентов с илиопсоас-абсцессами, госпитализированных в период с 01.01.2015 по 31.12.2022, на основании анализа данных медицинских карт. Основными показателями исследования были определение частоты встречаемости и структуры пациентов с илиопсоас-абсцессами, их распределение по полу, возрасту, наличию фоновой патологии, этиологии, исходной тяжести состояния. Проведена оценка диагностической значимости отдельных клинических симптомов, лабораторных показателей и методов визуализации у пациентов с илиопсоас-абсцессами. Основным исходом исследования стало определение факторов, влияющих на прогноз заболевания, согласно предположению, что на летальность при илиопсоас-абсцессах в большей степени влияют такие факторы, как индивидуальная реактивность организма и наличие коморбидных состояний. Дополнительно определена общая частота развития осложнений послеоперационного периода. Статистический анализ проводился с использованием программы jamovi ver. 2.4.8.0 (Intel, США). Оценка степени влияния отдельных факторов при сравнении номинальных данных проводилась при помощи критерия χ² Пирсона, в качестве количественной меры эффекта использовался показатель отношения шансов и рассчитывались границы 95 % доверительного интервала. Различия между группами считались статистически значимыми при p < 0,05. Результаты. Медиана по возрасту составила 59,5 (45–69) года. Среди пациентов 65 (56,0 %) мужчин и 51 (44,0 %) женщина. Первичный илиопсоас-абсцесс диагностирован у 15 (12,9 %), вторичный у 101 (87,1 %) больного. В проведенном исследовании наиболее частым источником илиопсоас-абсцессов (58,6 %, 68/116) явились гнойно-воспалительные заболевания позвоночника. Типичная клиническая картина псоас-абсцесса отмечена только у 27,6 % (32/116) пациентов. Заболевание сопровождалось синдромом системной воспалительной реакции у 63,8 % (74/116) больных, тяжелым сепсисом у 43,1 % (50/116), септическим шоком у 2,6 % (3/116) больных. Наиболее часто используемым методом визуализации абсцесса, позволяющим установить диагноз, была спиральная компьютерная томография (69,8 %, 81/116). В 61,3 % (54 из 88 положительных посевов) случаев возбудителем инфекции был Staphylococcus aureus, доля MRSA (methicillin-resistant Staphylococcus aureus) составила 9,3 % (5/54). На втором месте по частоте встречаемости были Klebsiella pneumoniae и Escherichia coli. При первичных и остеогенных абсцессах в 70,9 % (56/79) случаев выделена грамположительная флора. При абсцессах кишечного происхождения в 83,3 % (5/6) случаев была выявлена грамотрицательная флора, в 50 % (3/6) получена полимикробная флора. Всем пациентам с илиопсоас-абсцессами проводилась антибактериальная терапия и дренирование абсцесса. Соответствие эмпирической антибактериальной терапии посевам наблюдалось в 64,8 % (57/88) случаев. В 93,1 % (108/116) случаев выполнялось открытое хирургическое вмешательство, в остальных — малоинвазивное дренирование под ультразвуковой навигацией. Летальный исход наступил у 14,7 % (17/116) больных. Статистически значимыми факторами, влияющими на летальный исход, были сопутствующие заболевания центральной нервной системы, сердечно-сосудистой и дыхательной систем, наличие у больного тяжелого сепсиса, множественных очагов инфекции, острой белковой недостаточности, тромбоцитопении, тяжелое исходное состояние. Заключение. Илиопсоас-абсцесс представляет собой диагностическую трудность для врача. Лечение требует мультидисциплинарного подхода, выявления и санации всех очагов инфекции, мониторинга и коррекции органной дисфункции, белковой недостаточности, лечения сопутствующей патологии. Индекс коморбидности Charlson, шкалы SOFA (Sequential Organ Failure Assessment Score), APACHE II (Acute Physiology and Chronic Health Evaluation II), SAPS (Original Simplified Acute Physiology Score), уровень С-реактивного белка могут использоваться для оценки риска развития летального исхода.
Для цитирования:
Шумейко А.А., Батыршин И.М., Демко А.Е., Насер Н.Р. Опыт лечения абсцессов подвздошно-поясничной мышцы в условиях ургентного многопрофильного стационара: когортное ретроспективное исследование. Кубанский научный медицинский вестник. 2025;32(3):74-93. https://doi.org/10.25207/1608-6228-2025-32-3-74-93
For citation:
Shumeyko A.A., Batyrshin I.M., Demko A.E., Naser N.R. Experience in iliopsoas abscess treatment at a multi-specialty emergency inpatient care facility: A cohort retrospective study. Kuban Scientific Medical Bulletin. 2025;32(3):74-93. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-3-74-93
ВВЕДЕНИЕ
Илиопсоас-абсцесс (ИПА) — это скопление гноя в пределах подвздошно-поясничного пространства, представляющего собой костно-фасциальный футляр, идущий от полости груди до нижней конечности, образованный желобом между телами и поперечными отростками поясничных позвонков, подвздошной ямкой и подвздошно-поясничной фасцией, которая отделяет его от забрюшинного пространства. Данный отдел содержит подвздошно-поясничную мышцу, поясничное сплетение, ветви поясничных и подвздошных сосудов, клетчаточные пространства и мелкие лимфатические узлы. Через межпозвоночные отверстия по ходу спинномозговых нервов он сообщается с позвоночным каналом, по ходу поясничных артерий — со срединным отделом забрюшинного пространства, содержащего брюшную аорту и нижнюю полую вену (так называемое средостение живота по Н. И. Пирогову), по ходу мелких сосудов и нервов — с клетчаточными пространствами соседних областей1.
Илиопсоас-абсцесс является редкой патологией. В литературе, как правило, описываются единичные наблюдения либо представлена небольшая выборка пациентов, что ограничивает статистический анализ данных. Отмечается тенденция к увеличению заболеваемости ИПА. В 1980-е гг. заболеваемость составляла 0,4 на 100 000 населения в год. Многоцентровое ретроспективное когортное исследование, проведенное за 2010–2012 гг., выявило заболеваемость 1,21 на 100 000 населения в год [1].
ИПА может быть, как самостоятельным заболеванием (первичный абсцесс подвздошно-поясничной мышцы), так и осложнением инфекционно-воспалительного заболевания соседнего органа, например почки, толстой кишки, позвоночника, тазобедренного сустава (вторичный илиопсоас-абсцесс). Согласно ранее проведенным исследованиям более 80 % первичных ИПА приходится на возраст до 20 лет. Этиопатогенез первичных абсцессов имеет сходство с пиомиозитами других локализаций. Выделяют следующие патогенетические факторы первичного илиопсоита: наличие источника бактериемии или отдаленного очага инфекции; повреждение мышцы (травматическое, ишемическое); факторы риска, способствующие снижению иммунитета. Провести разграничение между первичными и вторичными абсцессами не всегда можно однозначно, поскольку, согласно действующим классификациям, каждый узкий специалист, обнаруживая рядом гнойный очаг, именно «свою» патологию будет считать вторичной. Учитывая топографо-анатомические особенности, близость жизненно важных структур, особенности патогенеза, потенциальные риски при прогрессировании заболевания, илиопсоас-абсцесс традиционно классифицируют отдельно от инфекционных миозитов других локализаций [2].
Классическая клиническая картина илиопсоас-абсцесса включает в себя триаду симптомов: лихорадка; болевой синдром; нарушение функции мышцы, проявляющееся хромотой или сгибательной контрактурой бедра. Полная триада симптомов встречается менее чем в 30 % случаев, что затрудняет своевременную диагностику и лечение [3]. Диагноз обычно устанавливается на основании лучевых методов визуализации (ультразвукового исследования (УЗИ), спиральной компьютерной томографии (СКТ), магнитно-резонансной томографии (МРТ) [4]. Лабораторная диагностика направлена на выявление признаков воспалительной реакции, оценку органной дисфункции и тяжести состояния. Микробиологические исследования крови, содержимого абсцесса, потенциальных источников инфекции используют для установления возбудителя инфекции и определения его чувствительности к антибиотикам. Первичный очаг при вторичных абсцессах часто выявляют при диагностике самого абсцесса.
Лечение включает в себя антибактериальную терапию, дренирование абсцесса, терапию сепсиса и коррекцию органной дисфункции, при вторичных ИПА — лечение основного заболевания. Единые клинические рекомендации по диагностике и лечению илиопсоас-абсцессов отсутствуют.
Данные по летальности разнятся в исследованиях, что обусловлено объемом и структурой выборки в каждом случае, разброс составляет от 2,3 % [3] до 44 % [5][6]. В большинстве исследований летальность при ИПА 12–15 % [1][7–12] и не имеет тенденции к снижению.
Анализ накопленных данных об этой патологии и изучение факторов, влияющих на течение заболевания и прогноз, позволят в дальнейшем наметить пути улучшения результатов лечения.
Цель исследования — провести ретроспективный анализ структуры пациентов с илиопсоас-абсцессами, поступивших в многопрофильный стационар за восьмилетний период, а также осуществить оценку результатов диагностики и лечения данной категории больных.
МЕТОДЫ
Дизайн исследования
Проведено когортное ретроспективное исследование 116 пациентов с абсцессами подвздошно-поясничной мышцы на основе анализа данных медицинских карт.
Условия проведения исследования
Исследование проведено на базе государственного бюджетного учреждения «Санкт-Петербургский научно-исследовательский институт скорой помощи имени И. И. Джанелидзе» (ГБУ СПб НИИ СП им. И. И. Джанелидзе), представляющего собой круглосуточный многопрофильный стационар на 934 койки, оказывающий экстренную и плановую хирургическую помощь взрослому населению. В исследование включены пациенты, госпитализированные в ГБУ СПб НИИ СП им. И. И. Джанелидзе в период с 1 января 2015 года по 31 декабря 2022 года и прооперированные по поводу абсцесса подвздошно-поясничной мышцы. Продолжительность периода наблюдения за каждым пациентом составляла 1 год после операции.
Критерии соответствия
Критерии включения
В исследование включены все пациенты, прооперированные по поводу абсцесса подвздошно-поясничной мышцы, госпитализированные в ГБУ СПб НИИ СП им. И. И. Джанелидзе в течение указанного периода времени. Возраст на момент операции составлял 18 лет и старше.
Критерии невключения
Пациенты с илиопсоитом без локализованного жидкостного скопления и с абсцессами малого объема, получавшие только консервативное лечение, в исследование не включены.
Критерии исключения
Добровольный отказ пациента от продолжения стационарного лечения и/или этапного хирургического лечения (если оно требовалось).
Описание критериев соответствия (диагностические критерии)
Диагноз ИПА устанавливался на основании клинико-лабораторных данных в сочетании с методами визуализации (УЗИ, СКТ, МРТ) и подтверждался интраоперационно.
Подбор участников в группы
Не предусмотрен. Первичный поиск проводился с использованием медицинской информационной системы (МИС) «Ариадна» («Решение», Россия). Отбор данных проводился сплошным методом.
На первом этапе исследования проводился анализ всей выборки. На втором этапе, в зависимости от наличия или отсутствия предполагаемых факторов риска неблагоприятного исхода, пациенты делились на 2 группы и определялся исход заболевания (выжил/умер) в каждой группе с последующим сравнением групп и определением статистической значимости выявленных различий. Для определения влияния факторов, измеренных количественно, проводилось сравнение данных показателей в группе выживших и умерших пациентов.
Целевые показатели исследования
Основной показатель исследования
Основными показателями исследования были определение частоты встречаемости и структуры пациентов с илиопсоас-абсцессами, их распределение по полу, возрасту, наличию фоновой патологии, этиологии, исходной тяжести состояния. Проведена оценка диагностической значимости отдельных клинических симптомов, лабораторных показателей и методов визуализации у пациентов с ИПА.
Основными исходами исследования стали: определение общей частоты развития осложнений послеоперационного периода, факторов, влияющих на прогноз заболевания, согласно предположению, что на летальность при ИПА в большей степени влияют индивидуальная реактивность организма и наличие коморбидных состояний.
Дополнительные показатели исследования
Не предусмотрены.
Методы измерения целевых показателей
Тяжесть сопутствующей патологии оценивали по индексу коморбидности Charlson и по отдельным нозологическим группам, при этом учитывались только те заболевания, которые на момент госпитализации имели клинические проявления и/или потенциально могли повлиять на течение основного заболевания и прогноз. Индекс коморбидности Charlson представляет собой балльную систему оценки наличия определенных сопутствующих заболеваний, влияющих на прогноз, а также учитывает возраст пациентов [13].
Среди лабораторных показателей оценивались уровень гемоглобина (г/л), лейкоцитов (10⁹/л), тромбоцитов (10⁹/л), СОЭ (мм/ч), общего белка (г/л). Пациентам с подозрением на сепсис дополнительно определялись уровень С-реактивного белка (мг/л) и/или прокальцитонина (нг/мл) [14].
Бактериологические исследования проводили по общепринятой схеме [15]: посев на плотные питательные среды с последующим выделением чистой культуры и идентификацией микроорганизмов. Окрашивание по Граму проводили с помощью аппарата для автоматического окрашивания мазков по Граму «PREVI color GRAM» (bioMérieux SA, Франция). Для выделения возбудителя из крови использовалась автоматизированная система длительного мониторинга (система посева крови с непрерывным контролем) BacT/ALERT 3D (bioMérieux, Франция), посев крови осуществлялся во флаконы со стандартизированными средами, содержащими активированный уголь для поглощения антибиотиков (BacT/ALERT FA).
Определение вида возбудителя и его антибиотикочувствительности проводилось автоматизированным способом на аппарате «Vitek 2» (bioMérieux, Франция). Полученные при микробиологическом исследовании от пациентов возбудители были изучены на чувствительность к ряду антибактериальных препаратов по стандартам CLSI (Clinical and Laboratory Standards Institute).
Для оценки проявлений синдрома системной воспалительной реакции (ССВР, SIRS) и диагностики сепсиса использовались «Клинические рекомендации по диагностике и лечению тяжелого сепсиса и септического шока в лечебно-профилактических организациях Санкт-Петербурга»2.
Органная дисфункция оценивалась по шкале SOFA (Sepsis-related (Sequential) Organ Failure Assessments Score) от 0 до 24 баллов, 0 баллов соответствует отсутствию органной недостаточности, SOFA более 4 баллов, как правило, является показанием для перевода пациента в отделение интенсивной терапии и реанимации.
Общая тяжесть состояния пациентов до операции оценивалась в баллах по шкалам APACHE II (Acute Physiology and Chronic Health Evaluation II) и SAPS (Original Simplified Acute Physiology Score). APACHE II состоит из трех блоков: 1) оценка острых физиологических изменений; 2) оценка возраста; 3) оценка хронических заболеваний. Сумма баллов 15 и более соответствует тяжелому состоянию [16]. По шкале SAPS оцениваются острые физиологические состояния и возраст пациента, баллы соответствуют риску летального исхода, более 9 баллов соответствует высокому риску [17].
Ультразвуковое исследование (УЗИ) проводили на аппаратах «Vivid E9» (GE HealthCare, США) и «Mindray M7» (Mindray, Китай). Спиральную компьютерную томографию (СКТ) проводили с помощью аппарата «GE Revolution CT 256» (General Electric, США), магнитно-резонансную томографию (МРТ) на аппарате «GE Optima MR450w 1,5T» (General Electric, США).
Частота послеоперационных осложнений оценивалась по нозологиям с использованием определений стандартов EPCO (European Perioperative Clinical Outcome), а также проводилась градация степени тяжести осложнений по Clavien — Dindo [18].
Переменные (предикторы, конфаундеры, модификаторы эффекта)
При проведении исследования анализировались общепринятые потенциальные предикторы тяжелого течения и неблагоприятного исхода инфекционных хирургических заболеваний: время от появления симптомов заболевания до операции, объем илиопсоас-абсцесса, наличие иммунодефицитных состояний. Самостоятельного влияния данных факторов на предоперационную тяжесть состояния и исход выявлено не было.
Одной из задач исследования было определение предикторов неблагоприятного течения илиопсоас-абсцессов, которые могут использоваться для стратификации пациентов по группам с целью оптимизации лечебно-диагностической тактики у пациентов разных групп, а также для последующих исследований.
Затрудняющими моментами (конфаундерами) для сравнения результатов исследований, проведенных разными авторами, являются отсутствие клинических рекомендаций по диагностике и лечению илиопсоас-абсцессов, разница в методах сбора данных и проведения статистического анализа, использование в литературе разных подходов к определению сепсиса. В настоящем исследовании использованы определения сепсиса, общепринятые в период, за который проводился сбор данных («Сепсис-2»). С 2024 года используются новые определения («Сепсис-3»).
Статистические процедуры
Принципы расчета размера выборки
Размер выборки предварительно не рассчитывался.
Статистические методы
Материалы исследования были подвергнуты статистической обработке с использованием преимущественно методов непараметрического анализа. Накопление и систематизация исходной информации осуществлялись в электронных таблицах Microsoft Office Excel 2021 (Microsoft, США). Статистический анализ проводился с использованием программы jamovi ver. 2.4.8.0 (Intel, США), представляющей собой графический интерфейс для языка программирования R. Номинальные данные описывались с указанием абсолютных значений и процентных долей. Количественные показатели оценивались на предмет соответствия нормальному распределению с использованием критерия Шапиро — Уилка (при объеме выборки менее 50) и критерия Колмогорова — Смирнова (при объеме выборки более 50). Для количественных показателей, имеющих нормальное распределение, указывалось среднее арифметическое величин и стандартное отклонение М ± SD; количественные показатели, распределение которых отличалось от нормального, описывались при помощи значений медианы (Me) и нижнего и верхнего квартилей [ Q1; Q3]. Оценка степени влияния отдельных факторов при сравнении номинальных данных проводилась при помощи критерия χ² Пирсона. В случае анализа четырехпольных таблиц при ожидаемом явлении хотя бы в одной ячейке менее 10 нами рассчитывался критерий χ² с поправкой на непрерывность Йейтса; когда число ожидаемых наблюдений было менее 5, использовался точный критерий Фишера; в качестве количественной меры эффекта использовался показатель отношения шансов (ОШ) и рассчитывались границы 95 % доверительного интервала (95 % ДИ). Для сравнения количественных данных в нормально распределенных совокупностях рассчитывался t-критерий Стьюдента; в случаях отсутствия признаков нормального распределения данных использовался U-критерий Манна — Уитни. Различия между группами считались статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
Формирование и характеристика выборки (групп) исследования
В исследование включены 116 пациентов, из которых 65 (56,0 %) мужчин и 51 (44,0 %) женщина. Блок-схема дизайна исследования представлена на рисунке 1. Среди отобранных больных 56 (48,3 %) госпитализированы в ГБУ СПБ НИИ СП им. И. И. Джанелидзе каретой скорой медицинской или неотложной помощи, 51 (44,0 %) был переведен из других лечебных учреждений, 9 (7,8 %) госпитализированы в ГБУ СПБ НИИ СП им. И. И. Джанелидзе по поводу другого заболевания, течение которого осложнилось ИПА.
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами (согласно рекомендациям STROBE). Сокращения: APACHE II (Acute Physiology and Chronic Health Evaluation II) — Шкала оценки острых физиологических расстройств и хронических нарушений состояний II; SAPS (Original Simplified Acute Physiology Score) — Оригинальная упрощенная шкала оценки физиологических расстройств; SIRS (Systemic Inflammatory Response Syndrome) — синдром системного воспалительного ответа.
Fig. 1. Block diagram of the study design
Note: the block diagram was created by the authors (as per STROBE recommendations). Abbreviations: APACHE II — Acute Physiology and Chronic Health Evaluation II; SAPS — original Simplified Acute Physiology Score; SIRS — Systemic Inflammatory Response Syndrome.
Левосторонний ИПА встречался у 44,0 % (51/116) больных, правосторонний у 37,1 % (43/116), двустороннее поражение наблюдалось у 19,0 % (22/116) больных.
Таким образом, у 116 пациентов было прооперировано 138 абсцессов (73 слева, 65 справа) объемом от 5 до 2000 мл, медиана по объему 50 мл с интерквартильным размахом от 20 до 150 мл. По классификации В. П. Брюханова верхний илиопсоит с расположением абсцесса в большой поясничной мышце наблюдался в 57,2 % (79/138) случаев, нижний илиопсоит с локализацией в подвздошной мышце — в 11,6 % (16/138) случаев, и тотальный с поражением обоих брюшек m. iliopsoas — в 31,2 % (43/138) случаев.
Основные результаты исследования
Демографические показатели и сопутствующая патология
Медиана и интерквартильный размах возраста пациентов с ИПА на момент операции составили 59,5 (45–69) года, минимальный возраст 24 года, максимальный 86 лет. Распределение пациентов по возрасту, согласно возрастной периодизации ВОЗ [19], и полу представлено на рисунке 2. В данном исследовании среди пациентов моложе 60 лет преобладали мужчины — 74,1 % (43/58) против 25,9 % (15/58), в группе старше 60 лет женщины — 62,1 % (36/58) против 37,9 % (22/58) (при использовании критерия χ² Пирсона p < 0,001). Тяжесть сопутствующей патологии оценивали по индексу коморбидности Charlson, медиана которого составила 3,5 (2–6) балла, более подробно данные представлены в таблице 1.
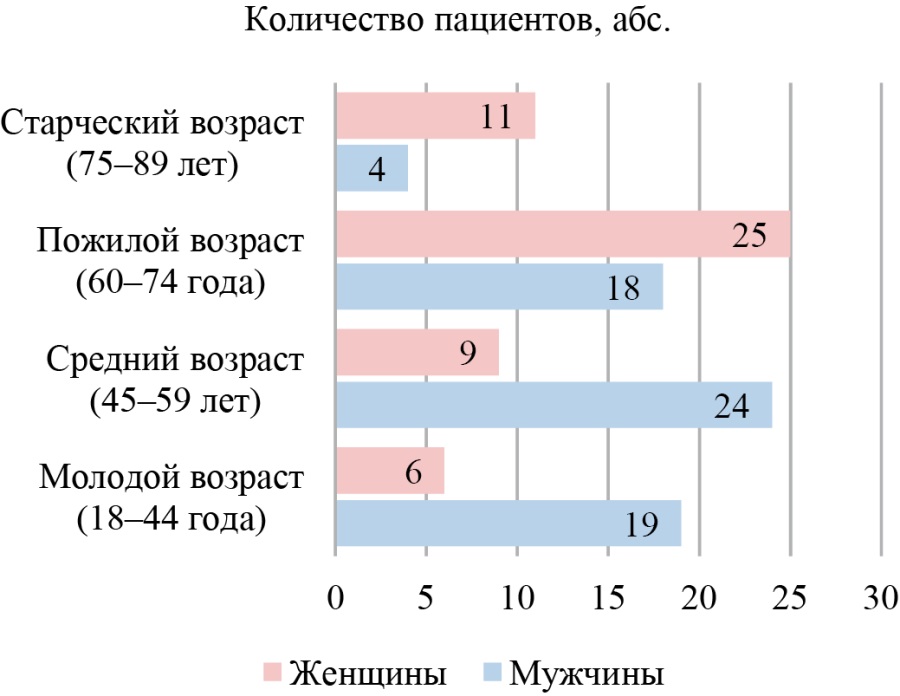
Рис. 2. Распределение пациентов с илиопсоас-абсцессами по полу и возрасту
Примечание: рисунок выполнен авторами.
Fig. 2. Distribution of iliopsoas abscess patients by sex and age
Note: the figure was created by the authors.
Таблица 1. Индекс коморбидности Charlson у пациентов с илиопсоас-абсцессами
Table 1. Charlson Comorbidity Index in iliopsoas abscess patients
Количество баллов | Число пациентов | Доля от общего числа пациентов, % (n = 116) | Накопленная доля, % |
0 | 10 | 8,6 | 8,6 |
1–2 | 33 | 28,4 | 37,0 |
3–4 | 25 | 21,6 | 58,6 |
5–6 | 22 | 19,0 | 77,6 |
7–8 | 19 | 16,4 | 94,0 |
9–10 | 7 | 6,0 | 100,0 |
Примечание: таблица составлена авторами.
Note: the table was compiled by the authors.
Среди сопутствующих заболеваний наиболее часто встречались заболевания сердечно-сосудистой системы, такие как ИБС (стенокардия, постинфарктный кардиосклероз), нарушения ритма, хроническая сердечная недостаточность, гипертоническая болезнь, они были выявлены у 44,8 % (52/116) больных. Сахарный диабет выявлен у 25,9 % (30/116) больных, хронические заболевания печени у 20,7 % (24/116), заболевания центральной нервной системы, влияющие на подвижность, у 16,4 % (19/116), хронические заболевания дыхательной системы (ХОБЛ, эмфизема легких, пневмофиброз) у 10,3 % (12/116), онкологические заболевания в анамнезе (менее 5 лет с момента постановки диагноза) у 8,6 % (10/116), заболевания соединительной ткани у 7,8 % (9/116) больных. Всего же отягощенный коморбидный фон встречался у 78,4 % (91/116) больных.
Этиология и патогенез
По этиологии в нашем наблюдении первичный ИПА диагностирован у 15 (12,9 %, n = 116), вторичный у 101 (87,1 %, n = 116) больного.
Среди вторичных илиопсоас-абсцессов наиболее частым источником инфекции были гнойно-воспалительные заболевания позвоночника (ГВЗП) — 68 (58,6 % от всех ИПА, n = 116) случаев, среди которых у 23,5 % от всех ГВЗП (16/68 пациентов) имелся эпидуральный абсцесс, что потребовало экстренного хирургического вмешательства, у 11,8 % от ГВЗП (8/68) псоас-абсцесс явился осложнением имплант-ассоциированной инфекции. На втором месте по частоте стояли гнойные заболевания тазобедренного сустава: гнойный коксит — 4, септический некроз головки бедренной кости — 5, перипротезная инфекция тазобедренного сустава — 3. На третьем месте находился сакроилеит. У 1 пациента наблюдался посттравматический остеомиелит костей таза с гнойным поражением как тазобедренного, так и крестцово-подвздошного суставов. Таким образом, 76,7 % (89/116) илиопсоас-абсцессов имело остеогенный источник. У 8 пациентов заболевание явилось отдаленным последствием сочетанной травмы. В 15,5 % (18/116) случаев помимо илиопсоас-абсцесса наблюдались и другие гнойные натечники из основного источника инфекции, также потребовавшие хирургической санации. Этиология вторичных ИПА представлена в таблице 2.
Таблица 2. Этиология вторичных илиопсоас-абсцессов
Table 2. Etiology of secondary iliopsoas abscesses
Источник илиопсоас-абсцесса (группа/нозология) | Число пациентов | Доля от числа пациентов с вторичными псоас-абсцессами, % (n = 101) |
Остеогенные источники илиопсоас-абсцесса | 89 | 88,1 |
Гнойно-воспалительные заболевания позвоночника | 68 | 67,3 |
Коксит | 12 | 11,9 |
Сакроилеит | 8 | 7,9 |
Остеомиелит костей таза | 1 | 1,0 |
Заболевания пищеварительной системы | 7 | 6,9 |
Аппендицит | 3 | 3,0 |
Дивертикулит | 1 | 1,0 |
Воспалительные заболевания кишечника (неспецифический язвенный колит) | 1 | 1,0 |
Колоректальный рак | 1 | 1,0 |
Панкреатит | 1 | 1,0 |
Урогенитальные заболевания | 2 | 2,0 |
Паранефральный абсцесс | 1 | 1,0 |
Гнойный орхоэпидидимит, фуникулит | 1 | 1,0 |
Кардиоваскулярные заболевания | 2 | 2,0 |
Эндокардит | 1 | 1,0 |
Парапротезная инфекция после аорто-бедренного бифуркационного шунтирования | 1 | 1,0 |
Параканкрозный абсцесс на фоне метастазов в забрюшинные лимфоузлы | 1 | 1,0 |
Всего | 101 | 100% |
Примечание: таблица составлена авторами.
Note: the table was compiled by the authors.
Учитывая трудности, возникающие при оценке первичности очага инфекции, мы проанализировали частоту встречаемости патогенетических факторов ИПА для всей выборки пациентов (n = 116). Данные представлены в таблице 3.
Таблица 3. Частота выявления у пациентов патогенетических факторов илиопсоас-абсцесса*
Table 3. Pathogenetic factors of iliopsoas abscess in the patients*
Фактор | Число пациентов | Доля от общего числа пациентов, % (n = 116) |
Наличие отдаленного источника инфекции** | ||
Инфекции кожи и мягких тканей | 35 | 30,2 |
Пневмония | 14 | 12,1 |
Инфекция мочевыводящих путей | 6 | 5,2 |
Хронические остеомиелиты | 6 | 5,2 |
Гнойные артриты | 5 | 4,3 |
Внутривенные инъекции наркотиков в бедренную вену | 3 | 2,6 |
Другие источники | 4 | 3,4 |
Повреждающие факторы | ||
Травма в анамнезе | 30 | 25,9 |
Медицинские вмешательства | 11 | 9,5 |
Ишемия | 6 | 5,2 |
Судорожный синдром | 4 | 3,4 |
Переохлаждение | 4 | 3,4 |
Факторы риска, влияющие на реактивность организма и иммунитет | ||
Сахарный диабет | 30 | 25,9 |
ВИЧ-инфекция | 12 | 10,3 |
Иммуносупрессивная терапия, включая глюкокортикоиды | 10 | 8,6 |
Гематологические заболевания | 4 | 3,4 |
Наркомания | 7 | 6,0 |
Хронический алкоголизм | 3 | 2,6 |
Примечания: таблица составлена авторами; * в таблице указано для каждого патогенетического фактора количество пациентов, у которых данный фактор встречается. У одного пациента может быть выявлено более одного фактора, поэтому общая сумма долей отличается от 100 %; ** отдаленные от илиопсоас-абсцесса очаги инфекции, выявленные до операции. Сокращение: ВИЧ — вирус иммунодефицита человека.
Notes: the table was compiled by the authors; * for each of the pathogenetic factors, the table indicates the number of affected patients. More than one factor may be identified in a single patient, so the total percentage differs from 100 %; ** infection foci distant from the iliopsoas abscess, which were detected prior to the procedure. Abbreviation: ВИЧ — human immunodeficiency virus.
Статистически значимых различий в частоте выявления патогенетических факторов риска между первичными и вторичными ИПА выявлено не было.
Наличие отдаленных очагов инфекции, непосредственно не связанных анатомически с ИПА, выявлено у 44,8 % (52/116) больных, при первичных ИПА — в 46,7 % (7/15), при вторичных — в 44,6 % (45/101) случаев (при использовании критерия χ² с поправкой на непрерывность Йейтса p = 1,0).
14,7 % (17/116) больных потребовалось дополнительное хирургическое вмешательство на отдаленном источнике инфекции. Генерализованная инфекция, с выявлением одного и того же возбудителя из отдаленных очагов и илиопсоас-абсцесса, наблюдалась в 12,9 % (15/116) случаев.
Факторы, способствующие повреждению мышцы, выявлены у 44,8 % (52/116) пациентов, при первичных ИПА — в 33,3 % (5/15) случаев, при вторичных — в 46,5 % (47/101) (при использовании критерия χ² с поправкой на непрерывность Йейтса p = 0,496). Учитывались травмы в анамнезе, непосредственно предшествовавшие заболеванию. Под ишемическим фактором подразумевалось наличие зарегистрированного стеноза брюшного отдела аорты и/или общих и наружных подвздошных артерий. Среди медицинских вмешательств учитывались такие, как проведение новокаиновых блокад данной области, биопсия почки, предшествующая ангиография через бедренный доступ и тому подобное.
Среди факторов риска возникновения илиопсоас-абсцесса выделяют следующие заболевания и состояния: сахарный диабет, ВИЧ-инфекция, химиотерапия, прием иммуносупрессантов и глюкокортикостероидов, гематологические заболевания, наркомания, хронический алкоголизм. Данные факторы риска были выявлены у 50,0 % (58/116) больных, в 73,3 % (11/15) случаев при первичных ИПА, и в 46,5 % (47/101) при вторичных ИПА (при использовании критерия χ² с поправкой на непрерывность Йейтса p = 0,097, ОШ 0,316, 95 % ДИ 0,0944–1,06). Пациенты с вторичным иммунодефицитом составили 21,6 % (25/116).
Регионарная лимфаденопатия, выявляемая методами визуализации (СКТ, МРТ) или интраоперационно, диагностирована у 25,5 % (29/116) пациентов, при этом разница в частоте выявления между первичными и вторичными псоас-абсцессами отсутствовала (26,7 % (4/15) при первичных, 24,8 % (25/101) при вторичных ИПА, при использовании точного критерия Фишера p = 1,0, ОШ 0,905, 95 % ДИ 0,264–3,10).
Клиническая картина
Наиболее часто пациенты с ИПА обращались за медицинской помощью в связи с болевым синдромом, который наблюдался у 94,8 % (110/116) больных. Боль обычно локализовалась в поясничной, подвздошно-паховой, крестцово-ягодичной области, а также в проекции тазобедренного сустава, часто иррадиировала в нижнюю конечность. Повышение температуры тела отмечалось у 63,8 % (74/116) больных. Медиана и интерквартильный размах по этому параметру составили 37,6 (36,7–38,5) °C. Температура тела выше 38,0 °C наблюдалась только у 41,4% (48/116) пациентов. Псоас-симптом разной степени выраженности, от рефлекторного сгибания бедра при надавливании на переднюю брюшную стенку в проекции m. iliopsoas и хромоты при ходьбе до выраженной сгибательной контрактуры бедра, встречался у 41,4 % (48/116) больных. Полная триада симптомов отмечена только у 27,6 % (32/116) пациентов. У 30,2 % (35/116) пациентов наблюдался неврологический дефицит, обусловленный преимущественно заболеваниями позвоночника. Другим проявлением заболевания был паховый лимфаденит, который встречался у 14,7 % (17/116) больных. Ипсилатеральный реактивный плевральный выпот наблюдался у 23,3 % (27/116) пациентов, из которых 5,2 % (6/116) потребовались плевральные пункции, а 2,6 % (3/116) дренирование плевральной полости в связи с развитием плеврита.
Диагностика
По данным лабораторного обследования пациентов с ИПА до операции анемия диагностирована у 61,2 % (71/116) больных, лейкоцитоз 12×10⁹/л и выше — у 57,8 % (67/116). Признаки строй белковой недостаточности встречались у 61,2 % (71/116) пациентов. Данные о лабораторных показателях и распределении пациентов до операции по баллам SIRS, SOFA, тяжести состояния, оцененной по шкалам APACHE II и SAPS, представлены в таблице 4.
Таблица 4. Изменения лабораторных показателей и оценка тяжести состояния у пациентов с илиопсоас-абсцессом до операции
Table 4. Changes in laboratory parameters and assessment of the condition severity in iliopsoas abscess patients prior to the procedure
Показатель | M ± SD, Me [ Q1; Q3] | Значения | Число пациентов | Доля от общего, % |
Гемоглобин, г/л (n = 116) | 105 [ 88; 118] | ≥110 | 45 | 38,8 |
95–109 | 36 | 31,0 | ||
80–94 | 20 | 17,2 | ||
65–79 | 14 | 12,1 | ||
<65 | 1 | 0,9 | ||
Лейкоциты, ×10⁹/л (n = 116) | 13,1 [ 9,3; 17,5] | <4 | 2 | 1,7 |
4–9 | 25 | 21,6 | ||
9–15 | 45 | 38,8 | ||
15–30 | 39 | 33,6 | ||
30–50 | 5 | 4,3 | ||
Тромбоциты, ×10⁹/л (n = 116) | 355 [ 246; 462] | <150 | 10 | 8,6 |
150–450 | 73 | 62,9 | ||
450–700 | 28 | 24,1 | ||
700–900 | 4 | 3,4 | ||
900–1000 | 1 | 0,9 | ||
Общий белок, г/л (n = 116) | 61,2 ± 10,4 | >64 | 45 | 38,8 |
55–64 | 41 | 35,3 | ||
45–55 | 21 | 18,1 | ||
<45 | 9 | 7,8 | ||
СОЭ, мм/ч (n = 115) | 52 [ 33; 65] | ≤20 | 18 | 15,7 |
21–50 | 38 | 33,0 | ||
>50 | 59 | 51,3 | ||
С-реактивный белок, мг/л (n = 100) | 120 [ 60,1; 192] | ≤5 | 2 | 2,0 |
6–40 | 14 | 14,0 | ||
40–100 | 26 | 26,0 | ||
100–200 | 34 | 34,0 | ||
>200 | 24 | 24,0 | ||
Прокальцитонин, нг/мл (n = 83) | 0,56 [ 0,115; 1,60] | <0,5 | 41 | 49,4 |
0,5–2 | 28 | 33,7 | ||
2–10 | 11 | 13,3 | ||
>10 | 3 | 3,6 | ||
SIRS (n = 116) | 2 [ 1; 3] | 0–1 | 42 | 36,2 |
2–4 | 74 | 63,8 | ||
SOFA (n = 116) | 0,5 [ 0; 2] | 0 | 58 | 50,0 |
1–3 | 47 | 40,5 | ||
≥4 | 11 | 9,5 | ||
APACHE II (n = 116) | 8 [ 5; 13] | <10 | 65 | 56,0 |
10–19 | 44 | 37,9 | ||
20–29 | 5 | 4,3 | ||
≥30 | 2 | 1,7 | ||
SAPS (n = 116) | 6 [ 3; 9] | 0–4 | 45 | 38,8 |
5–9 | 42 | 36,2 | ||
10–14 | 23 | 19,8 | ||
15–19 | 3 | 2,6 | ||
20–24 | 3 | 2,6 |
Примечания: таблица составлена авторами; в столбце «Показатель» в скобках указано количество пациентов, которым выполнено данное исследование перед операцией. Сокращения: APACHE II (Acute Physiology and Chronic Health Evaluation II) — Шкала оценки острых физиологических расстройств и хронических нарушений состояний II; SAPS (Original Simplified Acute Physiology Score) — Оригинальная упрощенная шкала оценки физиологических расстройств; SIRS (Systemic Inflammatory Response Syndrome) — синдром системного воспалительного ответа; СОЭ — скорость оседания эритроцитов.
Notes: the table was compiled by the authors; In the first column, the number of patients who underwent the evaluation prior to procedure is indicated in parentheses. Abbreviations: APACHE II — Acute Physiology and Chronic Health Evaluation II; SAPS — original Simplified Acute Physiology Score; SIRS — Systemic Inflammatory Response Syndrome; СОЭ — erythrocyte sedimentation rate.
По результатам клинико-лабораторного обследования синдром системной воспалительной реакции (ССВР) выявлен у 63,8 % (74/116) больных, тяжелый сепсис диагностирован у 43,1 % (50/116), септический шок встречался в 2,6 % (3/116) случаев. Наиболее часто ИПА и связанные с ним состояния сопровождались развитием дыхательной недостаточности — 37,9 % (44/116) больных и почечной недостаточностью — 17,2 % (20/116) больных. У 12,1 % (14/116) пациентов наблюдалось угнетение сознания, у 10,3 % (12/116) печеночная недостаточность.
В качестве методов визуализации ИПА применялись УЗИ, СКТ или МРТ. УЗИ было выполнено 75 % (87/116) больных, с помощью УЗИ ИПА был диагностирован в 42,5 % (37/87) случаев. СКТ выполнено 69,8 % (81/116) пациентов, ИПА визуализирован в 92,6 % (75/81) случаев, МРТ выполнено 48,3 % (56/116) пациентов, по МРТ ИПА визуализирован всем пациентам, которым было выполнено данное исследование.
Микробиологическое исследование
Посев крови выполнен 71 пациенту, положительный посев получен в 42,3 % (30/71) случаев. Посев содержимого абсцесса дал положительный результат в 70,7 % (82/116) случаев. В 70,0 % (21 из 30 положительных посевов крови) случаев посев крови и посев из ИПА совпадали.
Этиологический диагноз был определен 75,9 % (88/116) пациентов. При этом определение этиологического возбудителя мы считали установленным, когда посев получен непосредственно из полости илиопсоас-абсцесса, и предполагаемым, если при отрицательном посеве из абсцесса получен положительный посев крови и/или посев из источника ИПА. В нашем исследовании возбудитель ИПА был установленным в 93,2 % (82 из 88 пациентов с определенным этиологическим возбудителем) случаев, предположительным в 6,8 % (6/88) случаев. Еще у 2 пациентов при отрицательном посеве были получены данные бактериоскопии отделяемого из абсцесса. Таким образом, в 77,6 % (90/116) случаев был определен тип возбудителя: у 89 пациентов бактериальный возбудитель согласно окраске по Грамму и у 1 пациента установлен грибковый возбудитель.
Частота выявления различных возбудителей представлена в таблице 5. Всего было выделено 106 штаммов микроорганизмов. Наиболее часто выявляемым микроорганизмом был Staphylococcus aureus — 54 (61,3 %), доля метициллин-резистентных штаммов (MRSA) составила 5 (9,3 %). На втором месте по частоте встречаемости оказалась Klebsiella pneumoniae — 13 (14,7 %), на третьем Escherichia coli — 12 (13,6 %).
Таблица 5. Этиологический возбудитель при илиопсоас-абсцессах
Table 5. Etiologic agents in iliopsoas abscess
Микроорганизм | Количество пациентов, n | Доля микроорганизмов от общего числа выявленных штаммов, % (n = 106) | Доля пациентов, у которых выявлен данный микроорганизм, % (n = 88)* |
Staphylococcus aureus | 54 | 50,9 | 61,3 |
Klebsiella pneumoniae | 13 | 12,3 | 14,7 |
Escherichia coli | 12 | 11,3 | 13,6 |
Acinetobacter baumanii | 7 | 6,6 | 8,0 |
Коагулазонегативный стафилококк (CoNS) | 5 | 4,7 | 5,7 |
Enterococcus spp. | 5 | 4,7 | 5,7 |
Proteus mirabilis | 4 | 3,8 | 4,5 |
В-гемолитический стрептококк | 1 | 0,9 | 1,1 |
Streptococcus pneumoniae | 1 | 0,9 | 1,1 |
Streptococcus pyogenes | 1 | 0,9 | 1,1 |
Serratia marcescens | 1 | 0,9 | 1,1 |
Citrobacter murliniae | 1 | 0,9 | 1,1 |
Candida sp. | 1 | 0,9 | 1,1 |
Примечания: таблица составлена авторами. * в таблице указано для каждого микроорганизма количество пациентов, у которых данный возбудитель выделен. У одного пациента может быть выявлено более одного микроорганизма, поэтому общая сумма долей отличается от 100 %.
Notes: the table was compiled by the authors. *For each of the microorganisms, the table indicates the number of affected patients. More than one microorganism may be identified in the samples of a single patient, so the total percentage differs from 100 %.
В 87,5 % (77 из 88 пациентов с установленным возбудителем) случаев был выделен один возбудитель, в 14,7 % (13/88) случаев выявлена полимикробная флора. У 2 пациентов был заподозрен туберкулез, и они были переведены в специализированный стационар. Хотя Mycobacterium tuberculosis выделить не удалось, у одного пациента выявлены подозрительные на туберкулез изменения в легких, у другого характерные данные из биоптата позвонка при отсутствии легочных проявлений. В 1 (1,1 %, n = 88) случае при посеве из ИПА и источника (позвоночник) выделены Candida sp.
Среди больных с установленным характером возбудителя грамположительная флора была получена у 65,2 % (58 из 89 пациентов с бактериальным возбудителем) пациентов, грамотрицательная флора у 25,8 % (23/89) больных, смешанная грамположительная и грамотрицательная флора в 9,0 % (8/89) случаев. На рисунке 3 представлены данные о частоте встречаемости флоры в зависимости от этиологии ИПА.
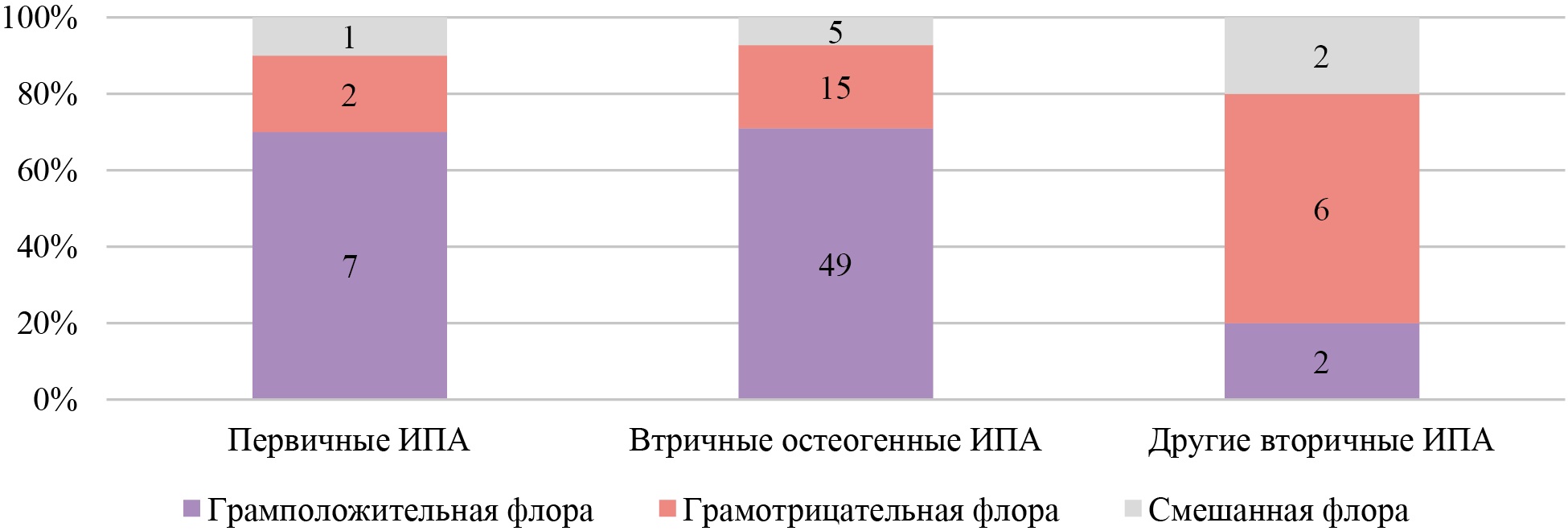
Рис. 3. Частота встречаемости окраски возбудителя по Граму в зависимости от этиологии илиопсоас-абсцесса
Примечание: рисунок выполнен авторами. Сокращение: ИПА — илиопсоас-абсцесс.
Fig. 3. Gram staining analysis in relation to the etiology of iliopsoas abscess
Note: the figure was created by the authors. Abbreviation: ИПА — iliopsoas abscess.
Как видно из рисунка 3, при первичных ИПА и вторичных, обусловленных заболеваниями костей и суставов, наиболее часто встречалась грамположительная флора — в 70,9 % (56/79) случаев против 20,0 % (2/10) (при использовании точного критерия Фишера p = 0,003, ОШ 0,103, 95 % ДИ 0,0202–0,521).
При ИПА, связанных с заболеваниями желудочно-кишечного тракта, в 83,3 % (5/6) случаев была выявлена грамотрицательная флора, а в оставшихся 16,7 % (1/6) смешанная, в целом полимикробная флора при данной этиологии встречалась в 50 % (3/6) случаев.
Наиболее часто полирезистентность, то есть устойчивость бактерии к 2-м и более антибиотикам, наблюдалась при выявлении грамотрицательной флоры (при использовании точного критерия Фишера p < 0,001) (табл. 6), а также при выявлении полимикробной флоры (по точному критерию Фишера p < 0,001, ОШ 30,9, 95 % ДИ 3,77–252) (табл. 7).
Таблица 6. Соотношение окраски микроорганизмов по Граму и полирезистентности
Table 6. Gram staining of microorganisms and multidrug resistance
Окраска по Граму | Полирезистентная флора | Хорошая чувствительность к антибиотикам | Всего |
Гр (+) | 14 (20,9 %) | 53 (79,1 %) | 67 (100 %) |
Гр (-) | 28 (73,7 %) | 10 (26,3 %) | 38 (100 %) |
Candida sp. | 1 (100 %) | 0 | 1 (100 %) |
Всего | 43 (40,6 %) | 63 (60 %) | 106 (100 %) |
Примечание: таблица составлена авторами. Сокращения: Гр — окраска по Граму.
Note: the table was compiled by the authors. Abbreviation: Гр — Gram staining.
Таблица 7. Соотношение наличия у пациента полирезистентной флоры и полимикробной флоры
Table 7. Multidrug-resistant and polymicrobial flora in the patient
Полимикробная/монофлора | Полирезистентная флора | Хорошая чувствительность к антибиотикам | Всего |
Полимикробная флора | 12 (92,3 %) | 1 (7,7 %) | 13 (100 %) |
Моноинфекция | 21 (28,0 %) | 54 (72,0 %) | 75 (100 %) |
Всего | 33 (37,5 %) | 55 (62,5 %) | 88 (100 %) |
Примечание: таблица составлена авторами.
Note: the table was compiled by the authors.
Лечение
Всем пациентам с диагнозом ИПА, включенным в исследование, проводилась антибактериальная терапия и дренирование абсцесса. В 18,1 % (21/116) случаев проводилась антибактериальная монотерапия, в 81,9 % (95/116) использовалась комбинация антибиотиков. Наиболее часто используемыми схемами антибактериальной терапии были: комбинация фторхинолонов I–II поколения с метронидазолом (35,3 %, 41/116) и комбинация карбапенема с ванкомицином или линезолидом (33,6 %, 39/116).
Медиана общей длительности антибактериальной терапии составила 7 (4–8,5) недель.
Было проанализировано соответствие эмпирической антибактериальной терапии посевам и влияние этого фактора на исход. Соответствие начальной антибактериальной терапии посевам наблюдалось в 64,8 % (57 из 88 пациентов с установленным возбудителем) случаев, устойчивость микрофлоры к проводимой терапии в 27,3 % (24/88) случаев, умеренная устойчивость в 8 % (7/88). Наибольшая летальность (28,6 %, 2/7) наблюдалась в группе больных, где выделенная флора была умеренно устойчива к проводимой антибактериальной терапии (против 16,7 % (4/20) в группе с устойчивостью флоры к проводимой терапии и 14,0 % (8/49) в группе с хорошей чувствительностью флоры), но различия не были статистически значимыми (при использовании точного критерия Фишера p = 0,476).
Время от появления симптомов ИПА до операции составило по медиане 14 (7–21) дней. В 93,1 % (108/116) случаев выполнено открытое хирургическое вмешательство, из них в 91,4 % (106/116) выполнялся косой доступ к забрюшинному пространству по Пирогову, в 4,3 % (5/116) доступ по Пирогову дополнялся доступом в верхней трети бедра, 1,7 % (2/116) абсцессов вскрыты поясничным доступом. Малоинвазивное дренирование под ультразвуковой навигацией использовалось в 6,9 % (8/116) случаев, при этом в 5 случаях дренирование проводили со стороны подвздошной области, в 3 — со стороны поясничной области. Медиана длительности открытой операции составила 55 (40–70) минут, малоинвазивного дренирования — 22,5 (20–30) минуты.
У 31,0 % (36/116) больных абсцессы были множественными или многокамерными, у 10,3 % (12/116) имели пиогенную капсулу. Затеки гноя из подвздошно-поясничного пространства, сообщающиеся с основной полостью абсцесса, наблюдались в 21,6 % (25/116) случаев. Локализация затеков была следующей: у 13 (11,2 %, n = 116) больных гной через мышечную лакуну выходил на передне-внутреннюю поверхность верхней трети бедра, у 8 (6,9 %, n = 116) больных через дефект подвздошно-поясничной фасции илиопсоас-абсцесс сообщался с забрюшинным пространством, в том числе наблюдался 1 редкий случай затека гноя на противоположную сторону, у 4 (3,4 %, n = 116) был затек в ягодичную область, у 3 (2,6 %, n = 116) на переднюю брюшную стенку и у 1 (0,9 %, n = 116) больного затек в поясничную область. Медиана длительности стояния дренажа при ИПА составила 16 (12–23) дней. Лечение в ОРИТ в связи с ИПА более 1 суток потребовалось 38,7 % (46/116) пациентов, при этом продолжительность лечения в ОРИТ среди выписанных больных составила 4 (2–8,5) суток, минимальное значение 1 сутки, максимальное 21 сутки.
Среди выживших пациентов медиана продолжительности стационарного лечения в ГБУ СПб НИИ СП им. И. И. Джанелидзе составила 29 (19–43) койко-дней. У выписанных медиана сроков купирования ССВР — 5 (3–9) дней после дренирования ИПА, сроки купирования органной дисфункции — 3 (1–6) дней.
Повторная госпитализация по поводу ИПА потребовалась 4,3 % (5/116) больных. Всего с учетом того, что у 9 (7,8 %, n = 116) пациентов в анамнезе уже были хирургические вмешательства по поводу ИПА до настоящей госпитализации, рецидив илиопсоас-абсцесса наблюдался в 12,1 % (14/116) случаев, все были вторичными ИПА.
Течение послеоперационного периода и прогноз
Под осложнениями обычно понимают любое отклонение от нормального течения послеоперационного периода. В гнойной хирургии, особенно у больных с тяжелым сепсисом, понятие нормального течения весьма расплывчато и заменяется понятием контроля над источником инфекции. Течение послеоперационного периода можно рассматривать как продолжение течения инфекционного процесса, а хирургические вмешательства выполняются по жизненным показаниям.
К тому что, безусловно, можно отнести к осложнениям дренирования ИПА, относятся осложнения, непосредственно связанные с областью хирургического вмешательства. Местные осложнения после операции на ИПА возникли в 9,5 % (11/116) случаев. Нагноение послеоперационной раны наблюдалось в 2,6 % (3/116) случаев, проводилось местное лечение раны. Осложнения, связанные с неустойчивым гемостазом, наблюдались в 6,9 % (8/116) случаев, из которых 2 являлись кровотечением из полости абсцесса в первые сутки после операции, что потребовало экстренного повторного хирургического вмешательства, у 6 больных образовалась гематома, из них 2 пациента получили консервативное лечение гематомы, в 1 случае выполнялась пункция и дренирование под контролем УЗИ, в 3 случаях понадобилось повторное хирургическое вмешательство под наркозом в связи с инфицированием гематомы.
В целом повторные оперативные вмешательства на подвздошно-поясничной мышце понадобились 27 (23,3 %, n = 116) больным, при открытом доступе первичного вмешательства в 19,4 % (21 из 108 открытых вмешательств) случаев, при малоинвазивном доступе — в 75 % (6 из 8 малоинвазивных вмешательств) случаев (при использовании точного критерия Фишера p = 0,002, ОШ 12,4, 95 % ДИ 2,34–66,0). 81,5 % (22/27) повторных вмешательства проведены под общей анестезией, 18,5 % (5/27) под местной анестезией. Причины повторных вмешательств при ИПА собраны в таблице 8.
Таблица 8. Причины повторных хирургических вмешательств при илиопсоас-абсцессах
Table 8. Reasons for repeat surgical procedures for iliopsoas abscesses
Причина повторного вмешательства | Количество повторных вмешательств | Доля от всех повторных вмешательств, % (n = 27) | Доля от общего количества пациентов, % (n = 116) |
Этапная санация | 19 | 70,4 | 16,4 |
Гемостаз | 6 | 22,2 | 5,2 |
Дислокация дренажа | 2 | 7,4 | 1,7 |
Всего | 27 | 100 % | 23,3 % |
Примечание: таблица составлена авторами.
Note: the table was compiled by the authors.
Частота возникновения общих осложнений, не связанных непосредственно с областью хирургического вмешательства, составила 34,5 % (40 из 116). Частота развития всех осложнений послеоперационного периода у пациентов с ИПА по нозологии представлена в таблице 9.
Таблица 9. Количество пациентов с илиопсоас-абсцессом, у которых развились осложнения послеоперационного периода*
Table 9. Number of iliopsoas abscess patients who developed postoperative complications*
Осложнения | Количество пациентов, n | Доля от общего количества пациентов, % (n = 116) |
Госпитальная пневмония | 21 | 18,1 |
Неустойчивый гемостаз | 8 | 6,9 |
Антибиотик-ассоциированный колит | 8 | 6,9 |
Системный кандидоз | 6 | 5,2 |
Флеботромбоз | 4 | 3,4 |
ТЭЛА | 4 | 3,4 |
Инфекция мочевыводящих путей | 4 | 3,4 |
Инфекция области хирургического вмешательства | 3 | 2,6 |
Инфекция центрального венозного катетера | 3 | 2,6 |
Пролежни | 3 | 2,6 |
Декомпенсация ХЗСН | 3 | 2,6 |
Острый инфаркт миокарда | 2 | 1,7 |
Миокардит | 2 | 1,7 |
Эндокардит | 2 | 1,7 |
Перикардит | 1 | 0,9 |
Фибрилляция предсердий | 1 | 0,9 |
Разрыв аневризмы аорты | 1 | 0,9 |
Кровотечение из острых язв желудка | 1 | 0,9 |
Острая задержка мочи | 2 | 1,7 |
Постинъекционный абсцесс | 1 | 0,9 |
Примечания: таблица составлена авторами; * в таблице указано для каждого осложнения количество пациентов, у которых данное осложнение развилось. У одного пациента может быть несколько осложнений, поэтому общая сумма долей отличается от 100 %. Сокращения: ТЭЛА — тромбоэмболия легочной артерии, ХЗСН — хроническая застойная сердечная недостаточность.
Notes: the table was compiled by the authors; * for each of the complications, the table indicates the number of affected patients. More than one complication can develop in a single patient, so the total percentage differs from 100 %. Abbreviations: ТЭЛА — pulmonary embolism, ХЗСН — chronic congestive heart failure.
Из таблицы 9 видно, что наиболее частым осложнением была госпитальная пневмония, которая встречалась у 18,1 % больных, вторыми по значимости были кардиоваскулярные осложнения, которые наблюдались у 12,1 % больных.
Частота развития осложнений в зависимости от их тяжести, оцененной по шкале Clavien — Dindo, представлена в таблице 10, в данной таблице учитывались как местные, так и общие осложнения, и при наличии у одного больного нескольких осложнений учитывалось наиболее тяжелое.
Таблица 10. Оценка тяжести послеоперационных осложнений у пациентов с илиопсоас-абсцессом по Clavien — Dindo
Table 10. Severity assessment of postoperative complications in iliopsoas abscess patients according to the Clavien — Dindo classification
Степень тяжести по Clavien — Dindo | Количество пациентов, n | Доля от всех случаев осложненного течения ИПА, % (n = 45) | Доля от общего числа пациентов, % (n = 116) |
I | 4 | 8,9 | 3,4 |
II | 13 | 28,9 | 11,2 |
IIIa | 2 | 4,4 | 1,7 |
IIIb | 4 | 8,9 | 3,4 |
IVa | 3 | 6,7 | 2,6 |
IVb | 2 | 4,4 | 1,7 |
V | 17 | 37,8 | 14,7 |
Всего | 45 | 100 | 38,7 |
Примечание: таблица составлена авторами. Сокращения: I — отклонения от нормального послеоперационного периода без лечения; II — осложнения, требующие медикаментозного лечения; III — осложнения, требующие хирургических, эндоскопических или радиологических вмешательств: IIIa — без общего обезболивания; IIIb — под общим обезболиванием; IV — жизнеопасные осложнения, требующие интенсивной терапии; V — смерть пациента.
Note: the table was compiled by the authors. Abbreviations: I — deviations from the normal postoperative course without the need for treatment; II — complications requiring pharmacological treatment; III — complications requiring a surgical, endoscopic, or radiological intervention: IIIa — without general anesthesia; IIIb — under general anesthesia; IV — life-threatening complications requiring intensive care; V — death of a patient.
Среди исследуемой группы пациентов летальный исход наступил у 17 (14,7 %, n = 116) больных. При первичных абсцессах летальность составила 6,7 % (1/15), при вторичных 15,8 % (16/101). Хотя при вторичных абсцессах летальность оказалась выше, данные различия оказались статистически незначимыми (при использовании точного критерия Фишера p = 0,694, ОШ 0,379, 95 % ДИ 0,0466–3,09).
От гнойно-септических осложнений скончалось 70,6 % из умерших пациентов, от кардиоваскулярных причин 29,4 %. Данные о причинах смерти у пациентов с ИПА представлены в таблице 11.
Таблица 11. Причины смерти у пациентов с илиопсоас-абсцессом
Table 11. Causes of death in iliopsoas abscess patients
Причина смерти | Число больных, n | Доля от умерших, % (n = 17) |
Тяжелый сепсис, СПОН | 12 | 70,6 |
Острый инфаркт миокарда | 2 | 11,8 |
ТЭЛА | 2 | 11,8 |
Септический разрыв аневризмы аорты | 1 | 5,9 |
Всего: | 17 | 100 % |
Примечание: таблица составлена авторами. Сокращения: СПОН — синдром полиорганной недостаточности, ТЭЛА — тромбоэмболия легочной артерии.
Note: the table was compiled by the authors. Abbreviations: СПОН — multiple organ dysfunction syndrome, ТЭЛА — pulmonary embolism.
Факторы, влияющие на течение заболевания и прогноз
С целью выявления значимых факторов риска неблагоприятного исхода было проанализировано влияние различных показателей на летальность при ИПА, таких как наличие фоновых заболеваний, исходная тяжесть состояния, степень выраженности воспалительной реакции, лабораторные показатели, характеристики самого абсцесса, сроки лечения. Наиболее значимые из этих факторов представлены в таблицах 12 и 13. Ряд этих факторов являются немодифицируемыми, например возраст и наличие сопутствующей патологии.
Таблица 12. Летальность пациентов с илиопсоас-абсцессами при различных факторах риска
Table 12. Case fatality rate in iliopsoas abscess patients under different risk factors
Фактор | Пациенты с благоприятным исходом, абс. (%) | Пациенты с летальным исходом, абс. (%) | ОШ (95 % ДИ) | Уровень статистической значимости, p |
Возраст >60 лет | 46 (46,5 %) | 12 (70,6 %) | 2,77 (0,906–8,44) | 0,115* |
Мужской пол | 55 (55,6 %) | 10 (58,8 %) | 1,14 (0,402–3,25) | 1,0* |
Заболевания центральной нервной системы | 12 (12,1 %) | 7 (41,2 %) | 5,07 (1,62–15,9) | 0,007** |
Заболевания сердечно-сосудистой системы | 39 (39,4 %) | 13 (76,5 %) | 5,0 (1,52–16,5) | 0,010* |
Заболевания дыхательной системы | 6 (6,1 %) | 6 (35,3 %) | 8,45 (2,32–30,8) | 0,002** |
Заболевания печени | 21 (21,2 %) | 3 (17,6 %) | 0,796 (0,209–3,03) | 1,0** |
Сахарный диабет | 23 (23,2 %) | 7 (41,2 %) | 2,31 (0,791–6,76) | 0,138** |
Иммунодефицит | 21 (21,2 %) | 4 (23,5 %) | 1,14 (0,337–3,87) | 0,760** |
Индекс Charlson больше или равен 5 | 35 (35,4 %) | 13 (76,5 %) | 5,94 (1,8–19,6) | 0,004* |
Травматическое повреждение мышцы | 20 (20,2 %) | 10 (58,8 %) | 5,64 (1,91–16,7) | 0,002** |
Другие источники инфекции | 40 (20,4 %) | 12 (70,6 %) | 3,54 (1,16–10,8) | 0,041* |
Пневмония до операции | 9 (9,1 %) | 7 (41,2 %) | 7,0 (2,14–22,9) | 0,002** |
ССВР | 60 (60,6 %) | 14 (82,4 %) | 3,03 (0,818–11,2) | 0,147* |
Тяжелый сепсис | 38 (38,4 %) | 12 (70,6 %) | 3,85 (1,26–11,8) | 0,027* |
Анемия | 58 (58,6 %) | 13 (76,5 %) | 2,3 (0,699–7,55) | 0,259* |
Тромбоцитопения | 6 (6,1 %) | 4 (23,5 %) | 4,77 (1,19–19,2) | 0,039** |
БЭН | 56 (56,6 %) | 15 (88,2 %) | 5,76 (1,25–26,5) | 0,027* |
Полная триада симптомов | 31 (31,3 %) | 1 (5,9 %) | 0,137 (0,0174–1,08) | 0,038** |
Неврологический дефицит | 25 (25,3 %) | 10 (58,8 %) | 4,23 (1,45–12,3) | 0,012* |
Капсула | 12 (12,1 %) | 0 (0 %) | 0,2 (0,0113–3,54) | 0,209** |
Множественные/многокамерные абсцессы | 31 (31,3 %) | 5 (29,4 %) | 0,914 (0,296–2,82) | 1,0* |
Открытый доступ операции | 92 (92,9 %) | 16 (94,1 %) | 0,821 (0,0946–7,13) | 1,0** |
Примечания: таблица составлена авторами; p — статистическая значимость при сравнении группы пациентов, имеющих потенциальный фактор риска, с группой пациентов, у которых данный фактор отсутствует:* при использовании критерия χ² с поправкой на непрерывность Йейтса; ** при использовании точного критерия Фишера. Сокращения: БЭН — белково-энергетическая недостаточность, ССВР — синдром системной воспалительной реакции; ОШ — отношение шансов; ДИ — доверительный интервал.
Notes: the table was compiled by the authors; p — statistical significance when comparing the group of patients with a potential risk factor with the group of patients without this factor * the χ² test with Yates’ continuity correction; ** Fisher’s exact test. Abbreviations: БЭН — protein–energy undernutrition, ССВР — Systemic Inflammatory Response Syndrome; ОШ — odds ratio; ДИ — confidence interval.
Таблица 13. Летальность пациентов с илиопсоас-абсцессом при различных показателях
Table 13. Case fatality rate of iliopsoas abscess patients at different parameters
Фактор | Пациенты с благоприятным исходом (n = 99) | Пациенты с летальным исходом (n = 17) | Уровень статистической значимости, p |
Возраст; Me [ Q1; Q3] | 58,0 [ 44,5; 66,0] | 68,0 [ 58,0; 72,0] | 0,006* |
Индекс Charlson; Me [ Q1; Q3] | 3 [ 2; 5] | 6 [ 5; 8] | 0,001* |
Гемоглобин; Me [ Q1; Q3] | 105 [ 91; 120] | 101 [ 77; 108] | 0,026* |
Лейкоциты; Me [ Q1; Q3] | 12,8 [ 9,32; 17,3] | 14,7 [ 9,6; 20,5] | 0,406* |
Температура тела; Me [ Q1; Q3] | 37,6 [ 36,7; 38,5] | 37,3 [ 36,7; 38,0] | 0,236* |
Общий белок; M ± SD | 62,8 ± 9,57 | 52 ± 10 | <0,001** |
SOFA; Me [ Q1; Q3] | 0 [ 0; 1] | 2 [ 1; 5] | <0,001* |
APACHE II; Me [ Q1; Q3] | 8 [ 5; 12] | 16 [ 11; 20] | <0,001* |
SAPS; Me [ Q1; Q3] | 5 [ 3; 8] | 11 [ 9; 13] | <0,001* |
Время от первых симптомов до операции; Me [ Q1; Q3] | 14 [ 7,5; 22,5] | 13 [ 5; 17] | 0,437* |
Длительность операции; Me [ Q1; Q3] | 45 [ 35; 70] | 55 [ 50; 70] | 0,445* |
Объем абсцесса; Me [ Q1; Q3] | 100 [ 100; 150] | 50 [ 30; 100] | 0,076* |
Примечания: таблица составлена авторами; p — статистическая значимость при сравнении выживших и умерших пациентов: * при использовании U-критерия Манна — Уитни, ** при использовании t-критерия Стьюдента. Сокращения: APACHE II (Acute Physiology and Chronic Health Evaluation II) — Шкала оценки острых физиологических расстройств и хронических нарушений состояний II; SAPS (Original Simplified Acute Physiology Score) — Оригинальная упрощенная шкала оценки физиологических расстройств.
Note: the table was compiled by the authors; p — statistical significance when comparing surviving and deceased patients: * Mann–Whitney U test, ** Student’s t-test. Abbreviations: APACHE II — Acute Physiology and Chronic Health Evaluation II; SAPS — original Simplified Acute Physiology Score.
Уровни С-реактивного белка и прокальцитонина были определены перед операцией не у всех больных. С-реактивный белок был определен у 100 пациентов. У умерших пациентов значение этого показателя было статистически значимо выше, чем в группе выживших пациентов (154 (109–271) г/л у пациентов с неблагоприятным исходом, n = 14, против 116 (52,9–186,0) г/л у выживших пациентов, n = 86 (при использовании U-критерия Манна — Уитни p = 0,042).
Прокальцитонин определен у 83 больных. Различие по уровню прокальцитонина в группе выживших и умерших больных было статистически незначимым (1,3 (0,323–1,92) нг/мл у пациентов с неблагоприятным исходом, n = 16, против 0,49 (0,105–1,54) нг/мл у выживших пациентов, n = 67 (при использовании U-критерия Манна — Уитни p = 0,142).
Дополнительные результаты исследования
В ходе исследования не получены.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Частота абсцессов подвздошно-поясничной мышцы составила 0,06 % среди пациентов хирургического профиля, что совпадает с результатами исследований, проведенных в России в тот же период времени [20]. В более ранних исследованиях (за 1991–2010 гг.) частота составляла 0,01 % среди хирургических больных. Хотя патология остается достаточно редкой, отмечается тенденция к увеличению доли данной категории больных. 50 % (58/116) пациентов с ИПА представляют собой людей молодого и среднего возраста, то есть наиболее экономически активную группу населения. Среди пациентов моложе 60 лет преобладали мужчины, старше 60 лет — женщины. У 78,4 % (91/116) пациентов был отягощенный коморбидный фон. Вторичные илиопсоас-абсцессы составляют большинство у взрослого населения — 87,1 % (101/116). При этом в настоящем исследовании ведущее значение в этиологии вторичных ИПА имели гнойно-воспалительные заболевания позвоночника — 58,6 % (68/116). Клиническая картина носила неспецифический характер, а полная триада симптомов встречалась в 27,6 % (32/116) случаев. Около трети всех пациентов имели неврологический дефицит, обусловленный заболеванием позвоночника, что еще больше затрудняло диагностику.
Неспецифичность клинической картины, которая к тому же часто маскируется симптомами основного заболевания, затрудняет раннюю диагностику ИПА. Это приводит к длительному сроку от появления первых симптомов заболевания до операции — 14 (7–21) дней. Нормальные показатели уровня лейкоцитов, СОЭ, прокальцитонина не исключали наличие гнойного очага, а наибольшей чувствительностью в диагностике воспалительного процесса при ИПА в данном исследовании обладал С-реактивный белок (СРБ). Наиболее часто выявляемым возбудителем при ИПА был Staphylococcus aureus. Для первичных и вторичных ИПА остеогенного происхождения характерна грамположительная флора, а для ИПА желудочно-кишечного происхождения типична грамотрицательная полимикробная флора. Частота развития местных осложнений после оперативного вмешательства по поводу ИПА составила 9,5 % (11/116), а общих осложнений, не связанных непосредственно с областью хирургического вмешательства, 34,5 % (40/116). Летальный исход наступил у 14,7 % (17/116) больных.
Ограничения исследования
Ограничением исследования является его ретроспективный характер, анализ результатов диагностики и лечения основан на вторичных источниках информации (медицинской документации), что обусловило отсутствие некоторых данных. Например, не у всех пациентов были исследованы С-реактивный белок и прокальцитонин, а также выполнен посев крови. Кроме того, редкость ИПА приводит к ограничению размеров выборки, что затрудняет получение некоторых статистических данных, таких как выявление факторов риска развития отдельных осложнений.
Интерпретация результатов исследования
В русскоязычной литературе илиопсоас-абсцесс часто рассматривают как аденофлегмону и отводят ведущую роль лимфогенному пути распространения инфекции [20]. В данном исследовании регионарная лимфаденопатия одинаково часто встречалась при первичных и вторичных абсцессах и была выявлена только в 25 % случаев. Патогенетические факторы, рассматриваемые традиционно для первичных псоас-абсцессов, с одинаковой частотой встречаются и при вторичных абсцессах остеогенного происхождения, что указывает на общую роль данных факторов в патогенезе как основного заболевания, так и ИПА.
На ведущую роль спинальной инфекции как источника вторичных илиопсоас-абсцессов указывает ряд авторов [3][7][8][11][20]. В исследовании Lima и соавт. псоас-абсцесс осложнял течение спондилодисцита в 37,5 % случаев [21]. Также ранее было отмечено, что наличие псоас-абсцесса может быть самостоятельным фактором риска рецидивирующего течения и неблагоприятного прогноза при воспалительных заболеваниях позвоночника [22][23]. Большинство исследователей отмечают ведущую роль S. aureus при ИПА, что совпадает с данными настоящего исследования [1][3][9][12][24]. В эндемичных районах сохраняет свое значение Mycobacterium tuberculosis [25][26]. Ряд исследователей указывает на рост частоты встречаемости мецитиллин-устойчивых штаммов стафилококка (MRSA). Так, в Южной Корее Kim и соавт. отмечают, что на долю MRSA приходится 44,4 % от стафилококковой инфекции [9]. Но, как видно из изложенного ранее, в этом исследовании наибольшую проблему при подборе антибактериальной терапии ИПА представлял собой не MRSA, который по данным авторов встречался относительно редко и к тому же сохранял чувствительность к другим антибиотикам, а грамотрицательная флора, среди которой наиболее часто встречались полирезистентные штаммы. Данные обстоятельства необходимо учитывать при подборе эмпирической антибактериальной терапии. В литературных данных отмечено, что существует связь между характером микрофлоры и этиологией ИПА [1][11][27]. Это также подтверждено и настоящим исследованием.
Оценить частоту развития осложнений после операций по поводу илиопсоас-абсцессов является сложной задачей, поскольку, во-первых, одномоментная радикальная санация ИПА не всегда возможна, особенно при неустраненном первичном источнике инфекции; во-вторых, у многих больных помимо ИПА есть и другие очаги инфекции, которые также могут требовать хирургической санации и иметь собственные осложнения.
При оценке общих осложнений, не связанных непосредственно с областью хирургического вмешательства, трудно разграничить осложнения течения самого заболевания и хирургического вмешательства. Первая группа таких осложнений связана с вынужденным длительным постельным режимом пациентов с ИПА, особенно у пациентов с ИПА вертеброгенного происхождения. Это такие осложнения, как госпитальная пневмония, тромбоз глубоких вен, пролежни, катетер-ассоциированная инфекция мочевыводящих путей. Вторая группа обусловлена необходимостью длительной антибактериальной терапии у пациентов с ИПА, в особенности остеогенных. К ним относится антибиотик-ассоциированный колит, системный кандидоз, инфекция центрального венозного катетера, постинъекционный абсцесс. Третья группа самых тяжелых осложнений — это кардиоваскулярные осложнения, они могут быть обусловлены как декомпенсацией сопутствующей сердечно-сосудистой патологии на фоне сепсиса (острый инфаркт миокарда, нарушения ритма, тромбоэмболия легочной артерии, декомпенсация ХЗСН), так и быть непосредственным следствием течения септического процесса (бактериальный эндокардит, миокардит, перикардит, септический разрыв аневризмы аорты). У одного больного последовательно могут развиваться несколько осложнений, взаимно отягощая друг друга и течение основного заболевания.
Следует отметить, что по литературным данным при инфекционно-гнойных заболеваниях обычно одним из ведущих факторов риска неблагоприятного течения и прогноза указываются поздние сроки выполнения хирургической санации от момента начала заболевания. В настоящем исследовании статистически значимых различий в сроках выполнения оперативного вмешательства у выживших и умерших пациентов выявлено не было. Но тот факт, что у больных с развернутой клинической картиной заболевания летальность значительно ниже, и, напротив, при стертой клинической симптоматике, как у пациентов с неврологическим дефицитом, летальность выше, косвенно указывает, что своевременная диагностика немаловажна для течения заболевания при ИПА.
Более высокая летальность (33,3 % против 8,1 %) наблюдалась при травматическом повреждении мышцы. Характеристики самого абсцесса, такие как объем, наличие капсулы, многокамерных абсцессов, а также выбор доступа при первичной операции и длительность операции, не оказали статистически значимого влияния на исход. Ряд исследователей при изучении факторов риска, влияющих на прогноз, отмечают роль нутритивного статуса пациента и наличие тяжелой сопутствующей патологии [7][12][28]. В исследовании SY Hu et al. более высокая летальность после операции наблюдалась у пациентов с низким уровнем альбумина [4]. Matsuo и соавт. отмечают, что прогностический индекс питания (PNI) менее 45 может быть предиктором исхода [29].
Анализ уровня общего белка показал, что у умерших пациентов наблюдалась статистически значимая гипопротеинемия по сравнению с выжившими (p < 0,001). Наиболее высокая летальность наблюдалась у пациентов с неблагоприятным полиморбидным фоном, при индексе коморбидности Charlson от 5 и выше, у больных с сопутствующими заболеваниями центральной нервной системы, тяжелыми заболеваниями сердечно-сосудистой и дыхательной систем, а также при наличии множественных очагов инфекции. Наиболее высокая летальность (43,8 %) наблюдалась при наличии у больного пневмонии до операции.
Прокальцитониновый тест как предиктор инфекционного процесса и сепсиса не показал статистической значимости для прогноза при ИПА. Возможно, это связано с тем, что пациенты с ИПА, как правило, имели длительный анамнез, диагностический поиск проводился на фоне эмпирической антибактериальной терапии, и прокальцитонин не всегда определялся при манифестации заболевания. Но он показал диагностическую значимость для выявления больных с тяжелым сепсисом (p = 0,002) и оценки динамики лечения. Из лабораторных показателей наиболее значимыми для прогноза исхода оказались уровень С-реактивного белка (СРБ) как индикатора воспалительного процесса (p = 0,042) и тромбоцитопения (p = 0,039). Наличие синдрома системной воспалительной реакции не оказало статистически значимого влияния на исход. В то время как уровень органной недостаточности, оцененный по шкале SOFA, исходная тяжесть состояния, оцениваемая по шкалам APACHE II и SAPS, имели наибольшее прогностическое значение (p < 0,001).
Таким образом, исходя из изложенного выше, можно сделать заключение, что своевременная санация всех источников инфекции, коррекция органной дисфункции, белковой недостаточности и терапия сопутствующей сердечно-легочной патологии могут снизить риск развития летального исхода.
ЗАКЛЮЧЕНИЕ
Илиопсоас-абсцесс имеет неспецифическую клиническую симптоматику, назначение методов визуализации, таких как СКТ и/или МРТ, способствует более точной постановке диагноза. Отсутствие изменений на УЗИ, признаков системной воспалительной реакции не позволяют исключить диагноз псоас-абсцесса. Большинство илиопсоас-абсцессов у взрослых пациентов являются вторичными (87,1 %), что требует диагностического поиска первичного очага инфекции. Диагноз «первичный илиопсоас-абсцесс» у взрослых является диагнозом исключения. Пациенты с илиопсоас-абсцессами в большинстве случаев являются полиморбидными больными, что требует мультидисциплинарного подхода к лечению. Эмпирическая антибактериальная терапия должна включать антибиотики широкого спектра действия, активные в отношении золотистого стафилококка и грамотрицательной флоры. Наибольшее прогностическое значение при абсцессах подвздошно-поясничной мышцы имеют индекс коморбидности Charlson, степень органной дисфункции — шкала SOFA, исходная тяжесть состояния — шкалы APACHE II и SAPS. Риск неблагоприятного исхода выше у пациентов с сопутствующими заболеваниями центральной нервной системы, неврологическим дефицитом, патологией сердечно-сосудистой и дыхательной систем, белковой недостаточностью, тромбоцитопенией.
1. Войно-Ясенецкий В. Ф. (архиепископ Лука). Очерки гнойной хирургии. М. — СПб: ЗАО «Издательство БИНОМ», «Невский диалект»; 2000. 704 с.
2. Санкт-Петербургское общество специалистов по сепсису. Клинические рекомендации по диагностике и лечению тяжелого сепсиса и септического шока в лечебно-профилактических организациях Санкт-Петербурга. СПб., 2016. Available: https://antimicrob.net/wp-content/uploads/2016-Protokoly-lecheniya-sepsisa_Sankt-Peterburg.pdf
Список литературы
1. Sato T, Kudo D, Kushimoto S. Epidemiological features and outcomes of patients with psoas abscess: A retrospective cohort study. Ann Med Surg (Lond). 2021;62:114–118. https://doi.org/10.1016/j.amsu.2021.01.040
2. Ricci MA, Rose FB, Meyer KK. Pyogenic psoas abscess: worldwide variations in etiology. World J Surg. 1986;10(5):834–843. https://doi.org/10.1007/BF01655254
3. Ouellette L, Hamati M, Flannigan M, Singh M, Bush C, Jones J. Epidemiology of and risk factors for iliopsoas abscess in a large community-based study. Am J Emerg Med. 2019;37(1):158–159. https://doi.org/10.1016/j.ajem.2018.05.021
4. Al-Khafaji MQ, Al-Smadi MW, Al-Khafaji MQ, Aslan S, Al-Khafaji YQ, Bagossy-Blás P, Al Nasser MH, Horváth BL, Viola Á. Evaluating Imaging Techniques for Diagnosing and Drainage Guidance of Psoas Muscle Abscess: A Systematic Review. J Clin Med. 2024;13(11):3199. https://doi.org/10.3390/jcm13113199
5. Hu SY, Hsieh MS, Chang YT, Huang CC, Tsai CA, Tsai CL, Hsu CY, Shen CH, Chang YZ. Clinical features, management, and outcome of iliopsoas abscess associated with cardiovascular disorders: a hospital-based observational case series study. BMC Musculoskelet Disord. 2019;20(1):474. https://doi.org/10.1186/s12891-019-2798-3
6. Huang JJ, Ruaan MK, Lan RR, Wang MC. Acute pyogenic iliopsoas abscess in Taiwan: clinical features, diagnosis, treatments and outcome. J Infect. 2000;40(3):248–255. https://doi.org/10.1053/jinf.2000.0643
7. Dietrich A, Vaccarezza H, Vaccaro CA. Iliopsoas abscess: presentation, management, and outcomes. Surg Laparosc Endosc Percutan Tech. 2013;23(1):45–48. https://doi.org/10.1097/SLE.0b013e31826e0ac9
8. Asai N, Ohkuni Y, Yamazaki I, Kawamura Y, Kaneko N, Aoshima M. Clinical manifestations and prognostic factor of iliopsoas abscess. J Glob Infect Dis. 2013;5(3):98–103. https://doi.org/10.4103/0974-777X.116869
9. Kim YJ, Yoon JH, Kim SI, Wie SH, Kim YR. Etiology and outcome of iliopsoas muscle abscess in Korea; changes over a decade. Int J Surg. 2013;11(10):1056–1159. https://doi.org/10.1016/j.ijsu.2013.10.009
10. Sah JK, Adhikari S, Sah G, Ghimire B, Singh YP. Presentation, management and outcomes of iliopsoas abscess at a University Teaching Hospital in Nepal. Innov Surg Sci. 2023;8(1):17–22. https://doi.org/10.1515/iss-2022-0013
11. Wong OF, Ho PL, Lam SK. Retrospective review of clinical presentations, microbiology, and outcomes of patients with psoas abscess. Hong Kong Med J. 2013;19(5):416–423. https://doi.org/10.12809/hkmj133793
12. Fernández-Ruiz M, Estébanez-Muñoz M, López-Medrano F, Aguado JM. Absceso del músculo iliopsoas: tratamiento y evolución en una serie de 35 pacientes [Iliopsoas abscess: therapeutic approach and outcome in a series of 35 patients]. Enferm Infecc Microbiol Clin. 2012;30(6):307– 311. Spanish. https://doi.org/10.1016/j.eimc.2011.09.016
13. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis. 1987;40(5):373–383. https://doi.org/10.1016/0021-9681(87)90171-8
14. Nakamura T, Morimoto T, Katsube K, Yamamori Y, Mashino J, Kikuchi K. Clinical characteristics of pyogenic spondylitis and psoas abscess at a tertiary care hospital: a retrospective cohort study. J Orthop Surg Res. 2018;13(1):302. https://doi.org/10.1186/s13018-018-1005-9
15. Алиева Е.В., Кафтырева Л.А., Макарова М.А., Тартаковский И.С. Практические рекомендации по преаналитическому этапу микробиологических исследований. Часть I. Бактериологические исследования. Лабораторная служба. 2020;9(2):45–66. https://doi.org/10.17116/labs2020902145
16. Knaus WA, Draper EA, Wagner DP, Zimmerman JE. APACHE II: a severity of disease classification system. Crit Care Med. 1985;13(10):818– 829. https://doi.org/10.1097/00003465-198603000-00013
17. Le Gall JR, Loirat P, Alperovitch A, Glaser P, Granthil C, Mathieu D, Mercier P, Thomas R, Villers D. A simplified acute physiology score for ICU patients. Crit Care Med. 1984;12(11):975–977. https://doi.org/10.1097/00003246-198411000-00012
18. Jammer I, Wickboldt N, Sander M, Smith A, Schultz MJ, Pelosi P, Leva B, Rhodes A, Hoeft A, Walder B, Chew MS, Pearse RM; European Society of Anaesthesiology (ESA) and the European Society of Intensive Care Medicine (ESICM); European Society of Anaesthesiology; European Society of Intensive Care Medicine. Standards for definitions and use of outcome measures for clinical effectiveness research in perioperative medicine: European Perioperative Clinical Outcome (EPCO) definitions: a statement from the ESA-ESICM joint taskforce on perioperative outcome measures. Eur J Anaesthesiol. 2015;32(2):88– 105. https://doi.org/10.1097/EJA.0000000000000118
19. Bull FC, Al-Ansari SS, Biddle S, Borodulin K, Buman MP, Cardon G, Carty C, Chaput JP, Chastin S, Chou R, Dempsey PC, DiPietro L, Ekelund U, Firth J, Friedenreich CM, Garcia L, Gichu M, Jago R, Katzmarzyk PT, Lambert E, Leitzmann M, Milton K, Ortega FB, Ranasinghe C, Stamatakis E, Tiedemann A, Troiano RP, van der Ploeg HP, Wari V, Willumsen JF. World Health Organization 2020 guidelines on physical activity and sedentary behaviour. Br J Sports Med. 2020;54(24):1451–1462. https://doi.org/10.1136/bjsports-2020-102955
20. Савельев В.В., Винокуров М.М. Опыт лечения острого илиопсоита в условиях ургентной многопрофильной хирургической клиники. Дальневосточный медицинский журнал. 2019;4:65–70. https://doi.org/10.35177/1994-5191-2019-4-65-70
21. Xu C, Zhou Z, Wang S, Ren W, Yang X, Chen H, Zheng W, Yin Q, Pan H. Psoas abscess: an uncommon disorder. Postgrad Med J. 2024;100(1185):482–487. https://doi.org/10.1093/postmj/qgad110
22. Lima D, Lopes N, Pereira AL, Rodrigues D, Amaral-Silva M, Marques E. Diagnosis and Treatment of Spondylodiscitis: Insights From a Five-Year Single-Center Study. Cureus. 2024;16(11):e74192. https://doi.org/10.7759/cureus.74192
23. Lee SH, Kim J, Kim TH. Treatment Guideline for Patients with Native Culture-negative Pyogenic Vertebral Osteomyelitis. Clin Orthop Relat Res. 2022;480(1):124–136. https://doi.org/10.1097/CORR.0000000000001866
24. Wang SF, Lai PL, Liu HF, Tsai TT, Lin YC, Li YD, Chiu PY, Hsieh MK, Kao FC. Risk Factors of Coexisting Septic Spondylitis and Arthritis: A Case-Control Study in a Tertiary Referral Hospital. J Clin Med. 2021;10(22):5345. https://doi.org/10.3390/jcm10225345
25. Sah JK, Adhikari S, Sah G, Ghimire B, Singh YP. Presentation, management and outcomes of iliopsoas abscess at a University Teaching Hospital in Nepal. Innov Surg Sci. 2023;8(1):17–22. https://doi.org/10.1515/iss-2022-0013
26. Thakral A, Prasad D, Katyal S, Kumar A. Characteristics and Outcomes of Psoas Abscess: Experience From a Tertiary Care Center in North India. Cureus. 2022;14(1):e21358. https://doi.org/10.7759/cureus.21358
27. Aboobakar R, Cheddie S, Singh B. Surgical management of psoas abscess in the Human Immunodeficiency Virus era. Asian J Surg. 2018;41(2):131–135. https://doi.org/10.1016/j.asjsur.2016.10.003
28. Yamashita S, Nakamura M, Akutagawa T, Nakashima O, Tago M, Esaki M, Yamashita SI. Polybacterial Iliopsoas Muscle Abscess as an Indication for Early Diagnosis of Crohn’s Disease. Am J Case Rep. 2023;24:e941399. https://doi.org/10.12659/AJCR.941399
29. Matsuo T, Fujita Y, Amagai T. Prognostic nutritional index as outcome predictor in patients with iliopsoas abscess. Medicine ( Baltimore). 2022;101(43):e31256. https://doi.org/10.1097/MD.0000000000031256
Об авторах
А. А. ШумейкоРоссия
Шумейко Анна Анатольевна — врач-хирург 11-го хирургического отделения
ул. Будапештская, д. 3, литер А, г. Санкт-Петербург, 192242
И. М. Батыршин
Россия
Батыршин Ильдар Муллаянович — доктор медицинских наук, заведующий 11-м хирургическим отделением; преподаватель 2-й кафедры и клиники хирургии усовершенствования врачей
ул. Будапештская, д. 3, литер А, г. Санкт-Петербург, 192242
ул. Академика Лебедева, д. 6ж, г. Санкт-Петербург, 194044
А. Е. Демко
Россия
Демко Андрей Евгеньевич — доктор медицинских наук, профессор, заместитель директора по научной работе; заведующий 2-й кафедрой и клиникой хирургии усовершенствования врачей
ул. Будапештская, д. 3, литер А, г. Санкт-Петербург, 192242
ул. Академика Лебедева, д. 6ж, г. Санкт-Петербург, 194044
Н. Р. Насер
Россия
Насер Надежда Рамезовна — доктор медицинских наук, доцент, старший научный сотрудник отдела хирургических инфекций; профессор кафедры общей хирургии
ул. Будапештская, д. 3, литер А, г. Санкт-Петербург, 192242
ул. Кирочная, д. 41, г. Санкт-Петербург, 195015
Дополнительные файлы
Рецензия
Для цитирования:
Шумейко А.А., Батыршин И.М., Демко А.Е., Насер Н.Р. Опыт лечения абсцессов подвздошно-поясничной мышцы в условиях ургентного многопрофильного стационара: когортное ретроспективное исследование. Кубанский научный медицинский вестник. 2025;32(3):74-93. https://doi.org/10.25207/1608-6228-2025-32-3-74-93
For citation:
Shumeyko A.A., Batyrshin I.M., Demko A.E., Naser N.R. Experience in iliopsoas abscess treatment at a multi-specialty emergency inpatient care facility: A cohort retrospective study. Kuban Scientific Medical Bulletin. 2025;32(3):74-93. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-3-74-93








































