Перейти к:
Анализ эффективности режимов неоадъювантной химиотерапии у пациентов с местнораспространенным HER2/neu-негативным раком молочной железы: нерандомизированное сравнительное исследование
https://doi.org/10.25207/1608-6228-2025-32-2-29-40
Аннотация
Введение. В настоящее время нет единого стандарта в выборе режима неоадъювантной химиотерапии при раке молочной железы. Несмотря на тот факт, что действенность неоадъювантной химиотерапии подтверждена результатами многих клинических исследований, в ряде случаев развивается лекарственная устойчивость опухоли к препаратам, что снижает ожидаемый эффект от проведения неоадъювантной химиотерапии. На сегодняшний день лекарственная устойчивость к неоадъювантной химиотерапии является одной из основных причин неудач при лечении и одной из наиболее сложных проблем в терапии метастатического и местнораспространенного рака молочной железы.
Цель исследования — оценить эффективность неоадъювантной химиотерапии при местнораспространенном HER2/neu-негативном раке молочной железы.
Методы. Проведено нерандомизированное сравнительное исследование с участием 187 женщин с верифицированным диагнозом «первичный местнораспространенный (T3N2, T4N0–3), HER2/neu-негативный (human epidermal growth factor receptor) рак молочной железы» (средний возраст 53,6 ± 7,8 года), проходивших терапию, наблюдение и обследование в государственном бюджетном учреждении здравоохранения Республики Крым «Крымский республиканский онкологический клинический диспансер имени В. М. Ефетова» с 2020 по 2024 г. Всем пациентам на первом этапе неоадъювантной химиотерапии была назначена комбинация препаратов доксорубицин и циклофосфамид внутривенно 1 раз в 21 день суммарно 4 курса с оценкой эффекта. На следующем этапе с учетом иммуногистохимического подтипа исследуемая когорта больных была разделена на подгруппы на основании назначаемых цитостатиков. Больные с люминальными формами рака молочной железы (n = 130) получали химиотерапию в стандартном (175 мг/м 2 1 раз в 21 день суммарно 4 курса — 96 больных) и дозоинтенсивном формате (паклитаксел — 80 мг/м 21 раз в неделю, 12 введений — 34 больные). Пациенты с трижды негативным раком молочной железы (n = 57) получали химиотерапию в стандартном (паклитаксел 175 мг/м 2 1 раз в 21 день суммарно 4 курса — 42 больные) и дозоинтенсивном формате (паклитаксел 80 мг/м 2 в комбинации карбоплатином AUC2 (Area under Curve) 1 раз в неделю, 12 введений — 15 больных). Анализ результатов неоадъювантной химиотерапии осуществляли путем вычисления частоты общего объективного ответа, полного патоморфологического регресса опухоли. Статистический анализ осуществляли программными средствами Microsoft Office Excel 2007 (Microsoft, США), IBM SPSS Statistics, version 23.0, (IBM, США), используя параметрические и непараметрические методы статистики. Для анализа различий частот в двух независимых группах применяли критерий Пирсона (χ2) или точный критерий Фишера (для сравнения очень малых выборок). Отличия считали статистически значимыми при p ≤ 0,05.
Результаты. В ходе неоадъювантной химиотерапии местнораспространенного люминального, HER2/neu-негативного рака молочной железы еженедельное введение таксанов (после терапии антрациклинами) статистические значимо не увеличивает показатели частоты общего объективного ответа и полного патоморфологического регресса опухоли. Частота выявления резистентных форм местнораспространенного рака молочной железы на фоне проводимой терапии таксанами (паклитаксел 175 мг/м 21 раз/21 день) выше по сравнению с антрациклинами (р = 0,005). Еженедельное введение таксанов в комбинации с препаратами платины (после терапии антрациклинами) при местнораспространенном трижды негативном РМЖ статистические значимо не увеличивает показатели частоты общего объективного ответа и полного патоморфологического регресса опухоли. Частота выявления резистентных форм местнораспространенного рака молочной железы на фоне проводимой терапии таксанами (паклитаксел 175 мг/м 21 раз/21 день 4 курса) статистически значимо выше по сравнению с неоадъювантной химиотерапией на основе антрациклиновых цитостатиков (р = 0,02).
Заключение. Применяемые режимы неоадъювантной химиотерапии характеризуются высокой частотой постцитотоксических осложнений в исследуемых подгруппах. В группе люминального РМЖ анализ частоты нежелательных побочных явлений неоадъювантной химиотерапии паклитакселом не выявил статистически значимых отличий при сравнении изучаемых подгрупп, однако стоит отметить, что еженедельный режим характеризуется меньшей нейротоксичностью, при этом демонстрируя высокую гематологическую токсичность. В группе трижды негативного рака молочной железы сочетание еженедельных введений паклитаксела и карбоплатина сопровождается явлениями выраженной астенизации. В связи с чем приоритет в начале лечения должен быть отдан антрациклиновым противоопухолевым препаратам.
Ключевые слова
Для цитирования:
Алиев К.А., Олексенко В.В., Зяблицкая Е.Ю., Телькиева Г.Н., Коваленко М.С., Кубышкин А.В. Анализ эффективности режимов неоадъювантной химиотерапии у пациентов с местнораспространенным HER2/neu-негативным раком молочной железы: нерандомизированное сравнительное исследование. Кубанский научный медицинский вестник. 2025;32(2):29-40. https://doi.org/10.25207/1608-6228-2025-32-2-29-40
For citation:
Aliev K.A., Oleksenko V.V., Zyablitskaya E.Yu., Telkieva G.N., Kovalenko M.S., Kubyshkin A.V. Efficacy analysis of neoadjuvant chemotherapy regimens in patients with HER2/neunegative locally advanced breast cancer: A nonrandomized comparative study. Kuban Scientific Medical Bulletin. 2025;32(2):29-40. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-2-29-40
ВВЕДЕНИЕ
В настоящее время рак молочной железы (РМЖ) является онкопатологией с чрезвычайно высокой заболеваемостью у женщин, а в структуре смертности от злокачественных новообразований (ЗНО) занимает первое место. По данным GLOBOCAN, в 2020 г. РМЖ диагностирован у 2,3 млн пациенток, из них у 685 тыс. явился причиной смерти, что только подтверждает тот факт, что данная патология занимает лидирующее место среди ЗНО женской популяции, следовательно, улучшение показателей ранней диагностики и лечения РМЖ является проблемой глобального значения [1].
Неоадъювантная химиотерапия (НХТ) относится к системным методам воздействия на злокачественную опухоль перед использованием таких локальных методов лечения, как хирургический и лучевой. Если ранее показаниями для НХТ были местнораспространенные и метастатические формы РМЖ, то в последние годы данный подход претерпел существенные изменения, значительно расширив показания для проведения этого метода в лечении даже начальных стадий РМЖ [2]. Цель НХТ — трансформировать неоперабельный РМЖ в операбельный, провести системное воздействие на метастатический процесс, деэскалацию хирургических метода лечения путем увеличения доли органосохранных операций, уменьшения объема лимфаденэктомии и, соответственно, улучшить показатели общей и безрецидивной выживаемости [3].
В настоящее время нет единого стандарта в выборе режима НХТ при РМЖ. Персонализированные схемы НХТ зависят, как правило, от молекулярно-биологического подтипа опухоли. Применение таких препаратов, как антрациклины, доксорубицин и эпирубицин, обычно комбинируется с такими препаратами, как циклофосфамид, эпирубицин и фторурацил. Появление таксанов и их широкий спектр противоопухолевой активности при распространенном РМЖ еще больше повысили эффективность НХТ. Опыт применения таксанов в монорежиме или в комбинации характеризовался высокой противоопухолевой активностью и повышением частоты полного опухолевого регресса [4][5]. При подтипах РМЖ со сверхэкспрессией HER2 в схему НХТ, как правило, добавляют трастузумаб или трастузумаб + пертузумаб, а хорошие клинические результаты только подтверждают правомерность данного подхода [6].
Несмотря на тот факт, что эффективность НХТ подтверждена результатами многих клинических исследований, в ряде случаев развивается лекарственная устойчивость опухоли к препаратам, что снижает ожидаемый эффект от проведения НХТ у больных РМЖ [7][8]. В настоящее время лекарственная устойчивость к НХТ является одной из основных причин неудач при лечении и одной из наиболее сложных проблем в терапии метастатического и местнораспространенного РМЖ. Таким образом, цель данного исследования — провести оценку эффективности НХТ при местнораспространенном HER2/neu-негативном раке молочной железы (T3N2, T4N0–3).
МЕТОДЫ
Дизайн исследования
Проведено нерандомизированное сравнительное исследование с участием 187 женщин с верифицированным диагнозом «первичный местнораспространенный (T3N2, T4N0–3) HER2/neu-негативный (human epidermal growth factor receptor) РМЖ», проходивших терапию, наблюдение и обследование в специализированном онкологическом медицинском учреждении.
Критерии соответствия
Критерии включения
Возраст от 27 до 76 лет, верифицированный диагноз «первичный местнораспространенный (T3N2, T4N0–3) HER2/neu-негативный РМЖ»; информированное добровольное согласие на участие в исследовании.
Критерии невключения
Отказ от подписания информированного согласия пациента, соматические заболевания тяжелой и средней степени в стадии декомпенсации, инфекционная патология, психические заболевания, прием пациентками других лекарственных средств или проведение других видов противоопухолевой терапии, не предусмотренных дизайном исследования.
Критерии исключения
Отказ пациента от дальнейшего участия в исследовании.
Условия проведения исследования
Проанализированы результаты лечения 187 пациенток, исследование было выполнено на базе государственного бюджетного учреждения здравоохранения Республики Крым «Крымский республиканский онкологический клинический диспансер имени В. М. Ефетова».
Продолжительность исследования
Набор групп испытуемых и регистрация результатов проводились в период с 2020 по 2024 годы. Продолжительность периода наблюдения составила 7 месяцев.
Описание медицинского вмешательства
Наличие верификации диагноза по данным истории болезни на основании патогистологического и иммуногистохимического (ИГХ) заключения (молекулярно-биологическое исследование биоптатов опухоли методом ИГХ с определением HER-2-негативного статуса опухоли); классы по МКБ-10: Злокачественное новообразование молочной железы С50 (С50.1, С50.2, С50.3, С50.4, С50.5, С50.6).
Алгоритм обследования больных РМЖ предусматривал проведение следующих этапов. Визуализирующие методики изучения молочных желез и зон потенциального лимфогенного и гематогенного метастазирования: маммография, ультразвуковое исследование (УЗИ), компьютерная томография (КТ) головы, органов грудной и брюшной полости, малого таза, остеосцинтиграфия. Морфологическая верификация опухоли: трепан-биопсия, тонкоигольная биопсия лимфоузлов, ИГХ-исследование, стадирование РМЖ по TNM (Tumor-Node-Metastasis) UICC (Union for International Cancer Control) — 8‑я версия1.
В режиме НХТ на первом этапе всем пациентам проведено лечение препаратами доксорубицин 60 мг в/в и циклофосфамид 600 мг/м² в/в (далее — схема АС) 1 раз в 21 день, суммарно 4 курса. Далее вторым этапом НХТ исследуемая когорта больных, с учетом ИГХ-подтипа, была разделена на подгруппы на основании назначаемых цитостатиков:
а) пациенты с люминальным вариантом РМЖ дополнительно получали паклитаксел в дозировке 175 мг/м² внутривенно (в/в) 1 раз в 21 день, суммарно 4 курса, либо паклитаксел 80 мг/м² в/в 1 раз в неделю — 12 введений;
б) пациенты с трижды негативным РМЖ получали паклитаксел в дозировке 175 мг/м² в/в 1 раз в 21 день, суммарно 4 курса, либо паклитаксел 80 мг/м² в комбинации карбоплатином AUC2 в/в 1 раз в неделю — 12 введений.
После смены режима НПХ или прогрессии злокачественного процесса проводилась промежуточная оценка терапевтического эффекта, включающая инструментальные методы исследования.
Всем пациентам с учетом стадии заболевания, характера опухолевого процесса после курсов химиотерапии была выполнена радикальная мастэктомия с регионарной лимфодиссекцией.
Исходы исследования
Основной исход исследования
Планировалось определение оптимального режима неоадъювантной химиотерапии у больных местнораспространенным HER2/neu-негативным раком молочной железы, оценка эффективности и безопасности стандартных и дозоуплотненных схем химиотерапии.
Дополнительные исходы исследования
Дополнительные исследования в данной работе не предусмотрены и не проводились.
Анализ в подгруппах
Подбор участниц исследуемых групп осуществлялся с соблюдением критериев включения. Группы сформированы из пациенток, обратившихся за медицинской помощью.
Среди пациенток с РМЖ разделение на группы проведено в зависимости от рецепторных свойств к эстрогенам и прогестерону (ЕR — рецептор к эстрогенам (estrogen receptor); PR — рецепторы к прогестерону (progesterone receptor) и митотической активности трансформированных клеток маркером Ki-67). Выделяли тройной негативный (n = 57) и люминальный В (n = 130) подтипы опухоли.
Всех пациентам согласно протоколам лечения местнораспространненого рака молочной железы на первом этапе НХТ была назначена комбинация препаратов доксорубицин и циклофосфамид в/в 1 раз в 21 день, суммарно 4 курса, с оценкой эффекта (187 больных). На следующем этапе больные с люминальными формами РМЖ (n = 130) получали химиотерапию в стандартном (паклитаксел 175 мг/м² в/в 1 раз в 21 день, суммарно 4 курса), n = 96, и дозоинтенсивном формате, n = 34 (паклитаксел 80 мг/м² в/в 1 раз в неделю, 12 введений). В свою очередь, пациенты с трижды негативным РМЖ (n = 57), учитывая неблагоприятный молекулярно-биологический подтип опухоли, получали химиотерапию в стандартном (паклитаксел 175 мг/м² в/в 1 раз в 21 день, суммарно 4 курса), n = 42, и дозоинтенсивном формате, n = 15 (паклитаксел 80 мг/м² в комбинации с карбоплатином AUC2 в/в 1 раз в неделю, 12 введений).
Методы регистрации исходов
Эффективность непосредственных результатов НПХТ оценивалась при помощи: а) основной показатель клинической оценки проведенного лечения — общий объективный ответ (objective response rate — ORR) определяли на основании критериев оценки ответа солидных опухолей RECIST 1.1 [9]; б) основной показатель морфологической оценки проведенного лечения — степень лечебного патоморфоза идентифицировали по Г. А. Лавниковой2 [10]. Для оценки безопасности проводимой НПХТ определялись частота и характер нежелательных явлений, зарегистрированных на фоне проведения лечения.
Анализ результатов НХТ осуществляли после завершения всех этапов лечения путем вычисления степени общего объективного ответа (objective response rate — ORR) и полного патоморфологического регресса опухоли (pathological complete response — pCR). Размер опухолевого очага определяли на основании данных клинического осмотра и показателей лучевой, ультразвуковой (УЗ) диагностики, сопоставляя их на этапе до и после проведения НХТ. Критерии оценки RECIST 1.1 включали следующие варианты:
а) полный регресс (Complete Response (CR)) — полный регресс всех исследуемых и ранее зарегистрированных очагов; редукция размеров всех патологически измененных лимфатических узлов до 10 мм (при измерении по короткой оси);
б) частичный регресс (Partial Response (PR)) — уменьшение суммы диаметров исследуемых очагов более чем на 30 % с учетом отсутствия признаков прогрессирования по новым очагам;
в) прогрессирование заболевания (Progressive Disease (PD)) — увеличение как минимум на 20 % суммы диаметров очаговых поражений; появление одного или нескольких новых очагов поражения, выпота или асцита, связанного с опухолью, также считается прогрессированием;
г) стабилизация заболевания (Stable Disease (SD)) — отсутствие признаков увеличения либо уменьшения суммы диаметров исследуемых очагов, несоответствие критериям CR, PR при отсутствии PD.
I, II, III степени опухолевого регресса соответствовали сохранению более 50 %, более 25 % и менее 25 % паренхиматозных элементов карциномы соответственно (при суммарном исследовании гистологических препаратов из всех участков опухоли). Полный регресс опухоли — IV степень — определяли при отсутствии опухолевой ткани в первичном и метастатическом очагах.
Стратификация степени тяжести побочных эффектов противоопухолевых препаратов проводится на основании критериев, рекомендованных Всемирной организацией здравоохранения (ВОЗ) и Международным противораковым союзом. Токсичность препаратов определяется от 0 (отсутствует) и 1‑й степени (незначительная) до 2‑й (умеренная), 3‑я (тяжелая) и 4‑я (угрожающая жизни). Под нейтропенией (критерии токсичности по шкале NCIC–CTC (National Cancer Institute of Canada-Common Toxicity Criteria)) понималось снижение числа гранулоцитов < 2000 кл/мм³ (0‑я степень), или 1000–1500 кл/мм³ (1 степень, легкая), или 1400–1000 кл/мм³ (2‑я степень, средняя), или 900–500 кл/мм³ (3‑я степень, тяжелая), или <500 кл/мм³ (4‑я степень, угрожающая жизни). Очередные введения химиопрепаратов проводились при абсолютном числе нейтрофилов (АЧН) ≥1,5×10⁹/л. При возникновении эпизода фебрильной нейтропении пациентки продолжали терапию всеми химиопрепаратами в прежних дозах после восстановления АЧН ≥ 1,5×10⁹/л, но в дальнейшем профилактически получали препараты колониестимулирующих факторов со 2-го дня (3 приема). При возникновении других видов токсичности 3–4‑й степени (гепатит, панцитопения) химиотерапия откладывалась до регресса симптомов до 1‑й степени или ниже. Максимальная допустимая отсрочка лечения — пропуск 2 введений химиотерапии. При необходимости более длительного перерыва в лечении принималось решение о выполнении оперативного вмешательства ввиду риска прогрессирования болезни.
Статистический анализ
Принципы расчета размера выборки
Размер выборки предварительно не рассчитывали.
Методы статистического анализа данных
Математический анализ осуществляли программными средствами Microsoft Office Excel 2007 (Microsoft, США), IBM SPSS Statistics, version 23.0, (IBM, США). Для определения нормальности распределения признаков в изучаемых выборках применялся метод Колмогорова — Смирнова. В случае выявления факта распределения изучаемых количественных признаков, отличного от нормального, в анализируемых вариационных рядах использовались непараметрические методы статистики. Для анализа различий частот в двух независимых группах применяли критерий Пирсона (χ²) или точный критерий Фишера (для сравнения очень малых выборок, значение ожидаемого явления менее 10) с учетом особенностей их параметров3 [11]. Отличия считали статистически значимыми при p ≤ 0,05.
РЕЗУЛЬТАТЫ
Участники исследования
Выборка формировалась на основании наличия/отсутствия верифицированного диагноза РМЖ, а также наличия/отсутствия гиперэкспрессии HER2/neu в ткани опухоли и классификации по TNM UICC. Отказавшихся от участия в исследовании пациенток не было ни в одной группе. Дизайн исследования представлен на рисунке.
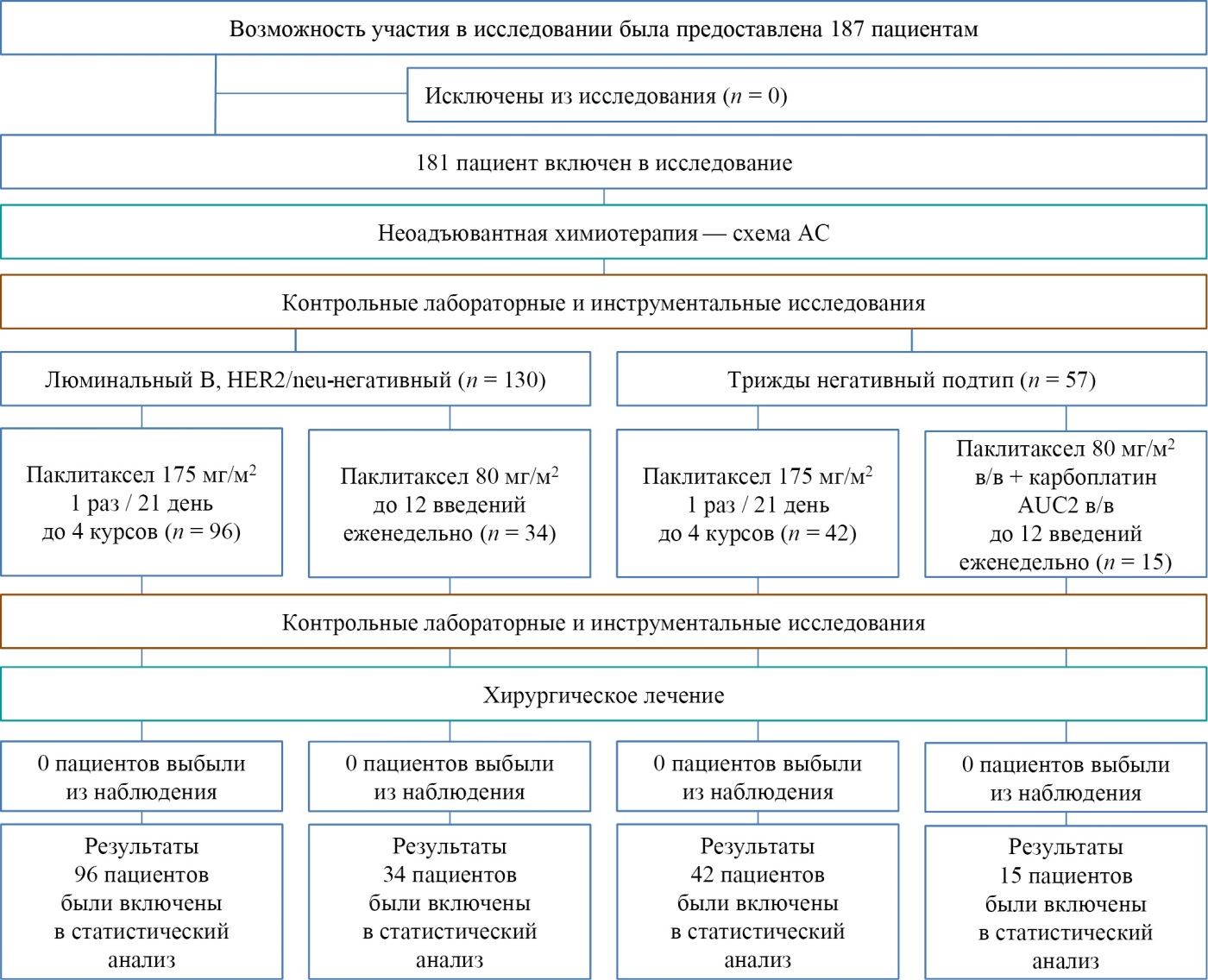
Рис. Блок-схема дизайна исследования
Примечания: блок-схема выполнена авторами (согласно рекомендациям TREND). Сокращения: схема АС — режим неоадъювантной химиотерапии препаратами доксорубицин 60 мг внутривенно и циклофосфамид 600 мг/м² внутривенно 1 раз в 21 день, суммарно 4 курса; HER2/neu — рецептор эпидермального фактора роста, тип 2; AUC2 — карбоплатин AUC2 (Area under Curve); в/в — внутривенно.
Fig. Block diagram of the study design
Notes: performed by the authors (according to TREND recommendations). Abbreviations: схема АС — neoadjuvant chemotherapy regimen with doxorubicin 60 mg and cyclophosphamide 600 mg/m² intravenously once every 21 days within 4 courses; HER2/neu — human epidermal growth factor receptor type 2; AUC2 — carboplatin AUC2 (Area under Curve); в/в — intravenously.
Стадирование РМЖ и выделение соответствующих групп пациенток проводили по Международной классификации опухолей TNM UICC — 8‑я версия. В исследуемую когорту вошли больные с категорией T4–75,4 % (n = 141), T3–24,6 % (n = 46); N3–8,1 % (n = 15), N2–35,8 % (n = 67), N1–46,5 % (n = 87), N0–9,6 % (n = 18). Таким образом, были включены 46 пациенток (24,6 %) со стадией T3N2 и 141 пациентка (75,4 %) со стадией T4N0–3 (среди которых 18 человек с N0, 87 — с N1, 21 — с N2, 15 — с N3). Данные о разделении обследуемых на группы по ИГХ-подтипу приведены в таблице 1.
Таблица 1. Стратификация в группе пациенток в зависимости от молекулярно-биологического подтипа опухоли, абс. (%)
Table 1. Stratification in the group of female patients depending on the molecular-biological subtype of the tumor, abs (%)
|
Стадия рака молочной железы |
Тройной негативный (n = 57), абс. (%) |
Люминальный В (n = 130), абс. (%) |
р-уровень значимости |
|
T3N2 |
10 (17,6 %) |
36 (27,7 %) |
0,196 |
|
T4N0 |
6 (10,5 %) |
12 (9,2 %) |
0,791 |
|
T4N1 |
27 (47,4 %) |
60 (46,2 %) |
0,999 |
|
T4N2 |
8 (14,0 %) |
13 (10 %) |
0,454 |
|
T4N3 |
6 (10,5 %) |
9 (6,9 %) |
0,395 |
Примечания: таблица выполнена авторами. Сокращения: Т3 — размер опухоли более 50 мм в наибольшем измерении; Т4 — опухоль любого размера с прямым распространением на грудную стенку и/или кожу; N0 — нет признаков поражения метастазами регионарных лимфатических узлов; N1 — метастазы в смещаемых подмышечных лимфатических узлах (на стороне поражения); N2 — метастазы в подмышечных лимфатических узлах на стороне поражения, спаянные между собой или фиксированные либо клинически определяемые метастазы во внутренних маммарных (парастернальных) лимфатических узлах при отсутствии клинически явного поражения подмышечных лимфатических узлов; N3 — метастазы в подключичных лимфатических узлах на стороне поражения, либо клинически определяемые метастазы во внутренних маммарных (парастернальных) лимфатических узлах при наличии клинически явного поражения подмышечных лимфатических узлов, либо метастазы в надключичных лимфатических узлах на стороне поражения (независимо от состояния подмышечных и внутренних маммарных лимфатических узлов).
Notes: compiled by the authors. Abbreviations: Т3 — tumor size more than 50 mm per maximum tumor dimension; T4 — tumor of any size with direct extension to the chest wall and/or skin; N0 — no signs of regional lymph node metastasis; N1 — metastases in displaced axillary lymph nodes (on the affected side); N2 — matted or fixed metastases in axillary lymph nodes on the affected side or clinically detectable metastases in internal mammary (parasternal) lymph nodes in the absence of clinically evident axillary lymph node involvement; N3 — metastases in infraclavicular lymph nodes on the affected side, or clinically detectable metastases in internal mammary (parasternal) lymph nodes in the presence of clinically evident axillary lymph node involvement, or metastases in supraclavicular lymph nodes on the affected side (regardless of the state of axillary and internal mammary lymph nodes).
Основные результаты исследования
Люминальный В, HER2/neu-негативный подтип
После 4 курсов НХТ по схеме АС только в 6,1 % (8 больных) случаев на фоне проводимого лечения наблюдалась отрицательная динамика, что потребовало смены режима НХТ. В большинстве случаев — 70 % (91) — в группе больных гормонозависимым HER2/neu-негативным РМЖ наблюдалась позитивная динамика в виде частичного регресса первичной опухоли (табл. 2).
Таблица 2. Частота объективного ответа и степень лечебного патоморфоза опухоли после проведенных курсов неоадъювантной химиотерапии (люминальный В подтип)
Table 2. The objective response rate and the degree of therapeutic pathomorphosis of a tumor after neoadjuvant chemotherapy courses (luminal B subtype)
|
Люминальный В, HER2/neu-негативный, n = 130 |
Схема АС, n = 130, абс. (%) |
Паклитаксел 175 мг/м² 1 раз/21 день до 4 курсов, n = 96, абс. (%) |
Паклитаксел 80 мг/м² до 12 введений еженедельно, n = 34, абс. (%) |
|
Частота объективного ответа |
|||
|
Стабилизация |
31 (23,9 %) |
5 (5,2 %) |
2 (5,9 %) |
|
Частичный регресс |
91 (70 %) |
52 (54,2 %) |
20 (58,8 %) |
|
Полный регресс |
- |
21 (21,9 %) |
7 (20,6 %) |
|
Прогрессия |
8 (6,1 %) |
18 (18,7 %) |
5 (14,7 %) |
|
Степень лечебного патоморфоза по Г. А. Лавниковой |
|||
|
I |
- |
13 (13,5 %) |
5 (14,7 %) |
|
II |
- |
28 (29,2 %) |
9 (26,5 %) |
|
III |
- |
38 (39,6 %) |
14 (41,2 %) |
|
IV |
- |
17 (17,7 %) |
6 (17,6 %) |
Примечания: таблица составлена авторами. Сокращения: схема АС — режим неоадъювантной химиотерапии препаратами доксорубицин 60 мг внутривнно и циклофосфамид 600 мг/м² внутривенно 1 раз в 21 день, суммарно 4 курса; HER2/neu — рецептор эпидермального фактора роста, тип 2; в/в — внутривенно.
Notes: compiled by the authors. Abbreviations: схема АС — neoadjuvant chemotherapy regimen with doxorubicin 60 mg and cyclophosphamide 600 mg/m² intravenously once every 21 days within 4 courses.; HER2/neu — human epidermal growth factor receptor type 2; в/в — intravenously.
При проведении НХТ с применением таксанов лечение было распределено в следующем формате: а) паклитаксел 175 мг/м² 1 раз/21 день до 4 курсов — 96 больных; б) паклитаксел 80 мг/м² до 12 введений еженедельно — 34 больных.
Объективный ответ на проведенную лекарственную терапию таксанами в подгруппе паклитаксела 175 мг/м² 1 раз в 21 день был выявлен у 73 больных (76,1 %), в группе паклитаксела 80 мг/м² еженедельно — 27 больных (79,4 %) соответственно (табл. 2). Прогрессирование процесса (PD) наблюдалось в 18 случаях (18,7 %) в подгруппе паклитаксела 175 мг/м² 1 раз в 21 день и в 5 случаях (14,7 % р = 0,61) в подгруппе паклитаксела 80 мг/м² еженедельно. Помимо ORR после проведения курсов НХТ по результатам исследования операционного материала оценивалась степень лечебного опухолевого патоморфоза. Частота pCR в исследуемых подгруппах демонстрирует практически схожие результаты, без статистически значимых различий; паклитаксел в стандартном режиме: патоморфоз III степени — 38 пациентов (39,6 %), патоморфоз IV cтепени — 17 пациентов (17,7 %), в дозоинтенсивном формате: 14 (41,2 %) и 6 (17,6 %) больных соответственно (табл. 2).
Оценка безопасности НХТ для гормонозависимого РМЖ осуществлялась поэтапно для проводимых режимов цитостатиков. После 4-х курсов комбинации циклофосфамида и доксорубицина для люминального местнораспространенного РМЖ побочные явления наблюдали у 86 (66,2 %) пациенток. Спектр посттерапевтических осложнений включал: лейкопению 3–4‑й степени (40,7 %; 35 больных), тошному и рвоту (39,5 %; 34 больных), анемию 1–2‑й степени (10,5 %; 9 больных), лекарственный гепатит (повышение уровня трансаминаз) (4,7 %; 4 больных), тромбоцитопению (3,5 %; 3 больных), стоматит (1,1 %; 1 больная). При этом у 17 пациенток наблюдались сочетание двух нежелательных явлений: а) лейкопения и тошнота, рвота (14 больных); б) лейтропения и анемия (2 пациентки); в) лейкопения и лекарственный гепатит (1 пациентка).
Осложнения монохимиотерапии с использованием паклитаксела в формате: а) 1 раз в 21 день, до 4 курсов и б) 12 еженедельных введений у пациентов с гормонозависимым РМЖ представлены в таблице 3.
Таблица 3. Частота побочных явлений неоадъювантной химиотерапии паклитакселом
Table 3. Incidence of adverse events of neoadjuvant chemotherapy with paclitaxel
|
Нежелательные явления |
Паклитаксел 175 мг/м² 1 раз/21 день, до 4 курсов, n = 96, абс. (%) |
Паклитаксел 80 мг/м² до 12 введений еженедельно, n = 34, абс, (%) |
р-уровень значимости |
|
Лейкопения III–IV степени |
35 (36,5 %) |
14 (41,2 %) |
0,682 |
|
Сенсорная нейропатия III–IV степени |
22 (22,9 %) |
6 (17,6 %) |
0,631 |
|
Тромбоцитопения |
7 (7,3 %) |
4 (8,8 %) |
0,784 |
|
Анемия |
4 (4,2 %) |
2 (5,9 %) |
0,685 |
|
Лейкопения и полинейропатия |
12 (12,5 %) |
4 (11,8 %) |
0,999 |
|
Лейкопения и тромбоцитопения |
5 (5,2 %) |
2 (5,9 %) |
0,999 |
|
Лейкопения и анемия |
4 (4,2 %) |
2 (5,9 %) |
0,651 |
Примечание: таблица составлена авторами.
Note: compiled by the authors.
Описанные выше осложнения и нежелательные явления, возникшие в результате проведенных курсов НХТ, реализовались у большей части пациенток: трехнедельные введения паклитаксела (68 больных, 70,8 %), еженедельные введения паклитаксела (26 больных, 76,5 %, p = 0,51). Летальных исходов в изучаемых подгруппах не наблюдалось. В каждой из изучаемых подгрупп случаи фебрильной нейтропении наблюдались дважды (р = 0,279), данное осложнение потребовало госпитализации.
Таким образом, анализ результатов цитотоксической терапии местнораспространенного люминального, HER2/neu-негативного РМЖ выявил следующие тенденции. Еженедельное введение таксанов (после терапии антрациклинами) по сравнению с трехнедельным режимом НХТ статистические значимо не увеличивает показатели частичного объективного ответа и степень лечебного опухолевого патоморфоза. Применяемые режимы НХТ характеризуются высокой частотой постцитотоксических осложнений. Анализ частоты нежелательных побочных явлений НХТ паклитакселом не выявил статистически значимых отличий при сравнении изучаемых подгрупп, однако стоит отметить, что еженедельный режим характеризуется меньшей нейротоксичностью, при этом демонстрируя высокую гематологическую токсичность. Частота выявления резистентных форм люминального, HER2/neu-негативного местнораспространенного РМЖ на фоне проводимой терапии таксанами (паклитаксел 175 мг/м² 1 раз/21 день, 4 курса) выше по сравнению с антрациклинами (р = 0,005).
Трижды негативный подтип
Начало курсов НХТ с применением комбинации доксорубицин + циклофосфамид характеризовалось достижением наилучшего объективного ответа у большей части больных (44, 77,2 %). Так же как и в случаях с гормонозависимым HER2/neu-негативным РМЖ, в 5,5 % (5 больных) случаев наблюдалось прогрессирование заболевания на фоне проводимого лечения (табл. 4).
Таблица 4. Частота объективного ответа и степень лечебного патоморфоза после проведенных курсов неоадъювантной химиотерапии (трижды негативный подтип)
Table 4. The objective response rate and the degree of therapeutic pathomorphosis after neoadjuvant chemotherapy courses (triple-negative subtype)
|
Трижды негативный подтип, n = 57 |
Схема АС, n = 57, абс. (%) |
Паклитаксел 175 мг/м² 1 раз/21 день, до 4 курсов, n = 42, абс. (%) |
Паклитаксел 80 мг/м² в/в + карбоплатин AUC2 в/в до 12 введений еженедельно, n = 15, абс. (%) |
|
Частота объективного ответа |
|||
|
Стабилизация |
8 (14,0 %) |
5 (11,9 %) |
1 (6,7 %) |
|
Частичный регресс |
44 (77,2 %) |
20 (47,6 %) |
8 (53,3 %) |
|
Полный регресс |
- |
5 (11,9 %) |
2 (13,3 %) |
|
Прогрессия |
5 (8,8 %) |
12 (28,6 %) |
4 (26,7 %) |
|
Степень лечебного патоморфоза по Г. А. Лавниковой |
|||
|
I |
- |
13 (30,9 %) |
4 (26,7 %) |
|
II |
- |
15 (35,7 %) |
6 (40 %) |
|
III |
- |
9 (21,4 %) |
3 (20 %) |
|
IV |
- |
5 (11,9 %) |
2 (13,3 %) |
Примечания: таблица составлена авторами. Сокращения: схема АС — режим неоадъювантной химиотерапии препаратами доксорубицин 60 мг внутривнно и циклофосфамид 600 мг/м² внутривенно 1 раз в 21 день, суммарно 4 курса; HER2/neu — рецептор эпидермального фактора роста, тип 2; в/в — внутривенно.
Notes: compiled by the authors. Abbreviations: схема АС — neoadjuvant chemotherapy regimen with doxorubicin 60 mg and cyclophosphamide 600 mg/m² intravenously once every 21 days within 4 courses.; HER2/neu — human epidermal growth factor receptor type 2; в/в — intravenously.
При проведении НХТ с использованием схем «таксаны в монорежиме» либо «таксаны в комбинации с препаратами платины» дальнейшее лечение было распределено в следующем формате: а) паклитаксел 175 мг/м² 1 раз/21 день, до 4 курсов — 42 больных; б) паклитаксел 80 мг/м² в/в + карбоплатин AUC2 в/в до 12 введений еженедельно — 15 больных.
Объективный ответ на проведенную лекарственную терапию таксанами либо таксанами в комбинации с препаратами платины был достигнут у 25 (59,5 %) и 10 (66,6 %) больных соответственно (табл. 4). Кроме анализа показателя ORR после проведенных курсов НХТ по результатам исследования операционного материала оценивалась степень лечебного опухолевого патоморфоза. Частота pCR в исследуемых подгруппах также не продемонстрировала статистически значимых отличий; паклитаксел в стандартном режиме: патоморфоз III степени — 9 больных (21,4 %), патоморфоз IV cтепени — 5 пациентов (11,9 %) и паклитаксел в комбинации с карбоплатином в дозоинтенсивном формате: 3 (20 %) и 2 (13,3 %) больных соответственно (табл. 4).
Оценка нежелательных явлений НХТ для трижды негативного РМЖ также была разделена на 2 этапа — режим АС и режим таксаны/таксаны + препараты платины. В результате проведенных курсов лекарственной терапии по схеме АС побочные действия наблюдались у 37 (64,9 %) пациенток. Спектр нежелательных явлений включал: тошному и рвоту (43,2 %, 16 больных), лейкопению 3–4‑й степени (37,9 %, 14 больных), анемию 1–2‑й степени (8,1 %, 3 больных), лекарственный гепатит (8,1 %, 3 больных), стоматит (2,7 %, 1 больная). При этом у 15 пациенток наблюдались сочетание двух нежелательных явлений: а) лейкопения и тошнота, рвота (12 больных); б) лейкопения и тромбоцитопения (2 пациентки); в) лейкопения и анемия (1 пациентка).
Анализ осложнений монохимиотерапии паклитакселом, а также комбинация последнего с препаратами платины в подгруппе больных трижды негативным местнораспространенным РМЖ представлены в таблице 5.
Таблица 5. Частота побочных явлений неоадъювантной полихимиотерапии паклитакселом
Table 5. Incidence of adverse events of neoadjuvant polychemotherapy with paclitaxel
|
Нежелательные явления |
Паклитаксел 175 мг/м² 1 раз/21 день, до 4 курсов, n = 42, абс. (%) |
Паклитаксел 80 мг/м² + карбоплатин AUC2, до 12 введений еженедельно, n = 15, абс. (%) |
р-уровень значимости |
|
Лейкопения III–IV степени |
15 (35,7 %) |
8 (53,3 %) |
0,358 |
|
Сенсорная нейропатия III–IV степени |
9 (21,4 %) |
2 (13,3 %) |
0,762 |
|
Тромбоцитопения |
3 (7,1 %) |
2 (13,3 %) |
0,853 |
|
Анемия |
2 (4,8 %) |
1 (6,7 %) |
0,698 |
|
Астенизация (слабость) |
1 (2,4 %) |
7 (46,7 %) |
0,00017 |
|
Комбинация лейкопении и полинейропатии |
8 (19,0 %) |
2 (13,3 %) |
0,999 |
|
Комбинация лейкопении и астенизации |
1 (4,8 %) |
7 (46,7 %) |
0,0001 |
Примечание: таблица составлена авторами.
Note: compiled by the authors.
Описанные выше осложнения и нежелательные явления, возникшие в результате проведенных курсов НХТ, реализовались у большей части пациенток в группе трехнедельных введений паклитаксела (71,4 %, 30 больных) и еженедельных введений таксанов в комбинации с препаратами платины (86,7 %, 13 больных, p = 0,40). Летальных исходов в изучаемых подгруппах не наблюдалось. В подгруппе паклитаксела в монорежиме случай фебрильной нейтропении был выявлен у одной пациентки, в подгруппе комбинации паклитаксела и карбоплатина данное осложнение отмечено у двух больных (р = 0,166), что потребовало срочной госпитализации.
Таким образом, анализ результатов НХТ местнораспространенного трижды негативного РМЖ выявил следующие тенденции. Еженедельное введение таксанов в комбинации с препаратами платины (после терапии антрациклинами) статистически значимо не увеличивает показатели частичного объективного ответа и степень лечебного патоморфоза. При этом сочетание еженедельных введений паклитаксела и карбоплатина ассоциировано большим количеством нежелательных явлений и осложнений. Так, данная комбинация демонстрирует наиболее высокие показатели выраженной астенизации у больных РМЖ (46,7 %, p = 0,0001). Вероятность выявления резистентных форм трижды негативного местнораспространенного РМЖ при цитотоксической терапии таксанами (паклитаксел 175 мг/м² 1 раз/21 день, до 4 курсов) статистически значимо выше по сравнению с антрациклинами (р = 0,014).
Дополнительные результаты исследования
Дополнительные результаты целью исследования не предусмотрены.
Нежелательные явления
Не отмечены за период наблюдения за пациентами.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
В исследовании продемонстрировано отсутствие преимуществ применения дозоинтенсивных еженедельных введений паклитаксела, а также комбинации паклитаксела и карбоплатина при неоадъювантной химиотерапии местнораспространенного HER2/neu-негативного рака молочной железы. Важным результатом проведенного исследования являются данные об эффективности применения схем, содержащих антрациклиновые противоопухолевые препараты, характеризующиеся меньшей частотой возникновения химиорезистентных форм рака молочной железы.
Обсуждение основного результата исследования
Долгие годы комбинированная терапия с применением антрациклинов и таксанов была рекомендуемым вариантом лекарственного лечения для распространенного РМЖ. Схемы НХТ на основе антрациклинов давали схожие или лучшие результаты выживаемости по сравнению с лечением циклофосфамидом, метотрексатом и фторурацилом (CMF). Более того, было доказано, что добавление таксанов к схемам НХТ на основе антрациклинов увеличивает показатели канцер-специфической и общей выживаемости путем уменьшения частоты рецидивов [12]. Эффективность НХТ при комбинации таксанов и антрациклина была одинакова для опухолей с положительным и отрицательным рецептором эстрогена независимо от возраста, состояния лимфатических узлов, размера опухоли или степени злокачественности, но с применением более высокой кумулятивной дозы и более интенсивным лечением [13][14].
В нашем исследовании применение стандартного подхода (антрациклины 1 раз в 3 недели + таксаны 1 раз в 3 недели, за 4 введения) в сравнении с еженедельным введением таксанов (после терапии антрациклинами) при местнораспространенном люминальном HER2/neu-негативном РМЖ, а также сравнение стандартного подхода еженедельного введения таксанов и комбинации с препаратами платины (после терапии антрациклинами) при местнораспространенном трижды негативном РМЖ не выявило статистически значимого роста показателя частичного объективного ответа и степени лечебного патоморфоза.
Стоит отметить, что при некоторых опухолях первоначальный клинический ответ и уменьшение размера опухоли в ответ на введение цитостатиков является лишь временным событием, что, в свою очередь, ассоциировано с лекарственной опухолевой устойчивостью [15–17]. Так, врожденная или приобретенная лекарственная устойчивость приводит к неэффективности лечения в 90 % случаев при метастатических формах РМЖ [18][19]. Анализируя случаи (31 случай) прогрессии заболевания на фоне проводимых курсов НХТ при люминальном HER2/neu-негативном РМЖ, установили следующее: антрациклин-резистентный РМЖ наблюдался в 8 случаях, таксан-резистентный РМЖ — в 21, антрациклин-таксан-резистентный РМЖ (прогрессия на фоне АС и последующих введений паклитасела) — в 2 случаях. Лечение цитостатиками трижды негативного РМЖ ассоциировано с развитием антрациклин-резистентного РМЖ в 5 случаях, таксан-резистентного РМЖ — в 12, таксан-платино-резистентного РМЖ — в 2, антрациклин-таксан-платино-резистентного РМЖ (прогрессия на фоне АС и последующих введений паклитаксела и препаратов платины) — в 2 случаях. На сегодня не найден оптимальный режим НХТ для пациентов с резистентным HER2-отрицательным РМЖ [20].
Очевидно, что некоторым пациентам целесообразно проведение НХТ с применением комбинации ряда препаратов, а у других целесообразно использовать последовательность применения различных препаратов с одним агентом. Выбор терапии основывается на состоянии пациента, темпах роста опухоли и стадии РМЖ. Терапия резистентного местнораспространенного РМЖ осложняется отсутствием четких клинических рекомендаций. Так называемая salvage-терапия, или терапия «спасения», зачастую представлена небольшим арсеналом препаратов (препараты платины, иринотекан, этопозид), а их эффективность не была изучена в больших когортных клинических исследованиях либо эти препараты недоступны в широкой онкологической практике (липосомальный доксорубицин, связанный с альбумином паклитаксел). На сегодняшний день в случае резистентных форм РМЖ предпочтение отдается таким препаратам, как капецитабин, гемцитабин, винорелбин [21–23].
За последние десятилетия механизмы химиорезистентности ЗНО были прецизионно проанализированы. К ним относятся изменения в мембранном транспорте и повышенное выведение лекарств, опосредованное членами суперсемейства АТФ-связывающей кассеты (ABC), в частности P-гликопротеином и белками, ассоциированными с множественной лекарственной устойчивостью (например, MDR1), что способствует как антрациклиновой, так и таксановой резистентности [24]. Более того, оценка цитотоксичности, вызванная антрациклином, может быть затруднена активированными механизмами репарации ДНК, изменениями активности топоизомеразы II, влияющими на сродство связывания между антрациклинами и TOP II, изменениями в апоптотических сигнальных путях, таких как белок — супрессор опухолей p53, изменениями в метаболизме цистеина и метионина и наличием генетических мутаций [25]. Устойчивость к комбинированному лечению антрациклинами и таксанами остается существенным препятствием в лечении местнораспространенного РМЖ. Лучшее понимание механизмов, приводящих к химиорезистентности, — это определение молекулярно-генетических предикторов, предсказывающих терапевтический ответ, что позволит персонализировать лекарственную терапию и тем самым изменить стратегию лечения местнораспространенного РМЖ.
Ограничения исследования
Данное исследование имеет следующие ограничения: небольшой размер выборки и, следовательно, небольшая статистическая мощность; отсутствие отдаленных данных о безрецидивной выживаемости пациенток ограничивает возможность прогностической оценки.
ЗАКЛЮЧЕНИЕ
Проведение неоадъювантной химиотерапии местнораспространенного HER2/neu-негативного рака молочной железы с включением дозоинтенсивных еженедельных введений паклитаксела 80 мг/м² для люминального РМЖ и еженедельных введений паклитаксела 80 мг/м² в комбинации с карбоплатином AUC2 для трижды негативного РМЖ не увеличивает показатели частичного объективного ответа и степень лечебного патоморфоза опухоли. Применяемые режимы НХТ характеризуются высокой частотой постцитотоксических осложнений в исследуемых подгруппах. В группе люминального РМЖ анализ частоты нежелательных побочных явлений НХТ паклитакселом не выявил статистически значимых отличий при сравнении изучаемых подгрупп. В группе трижды негативного РМЖ сочетание еженедельных введений паклитаксела и карбоплатина сопровождается явлениями выраженной астенизации (4,8 % против 46,7 %, p = 0,0001). Частота выявления резистентных форм местнораспространенного HER2/neu-негативного РМЖ при проведении НХТ в монорежиме таксанами (паклитаксел 175 мг/м² 1 раз/21 день) статистически значимо выше: а) для гормонозависимых опухолей (р = 0,005); б) для трижды негативных опухолей (р = 0,014). В связи с чем приоритет в начале лечения должен быть отдан антрациклиновым противоопухолевым препаратам.
1. TNM Classification of Malignant Tumours. 8th Edition. Brierley J. D., Gospodarowicz M. K., Wittekind C., editors. Wiley-Blackwell; 2017. 272 p.
2. Лавникова Г. А. Гистологический метод количественной оценки терапевтического повреждения опухоли. Методические рекомендации. М., 1979.
3. Банержи А. Медицинская статистика понятным языком: вводный курс. М.: Практическая медицина, 2007.
Список литературы
1. Bray F, Laversanne M, Sung H, Ferlay J, Siegel RL, Soerjomataram I, Jemal A. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229–263. https://doi.org/10.3322/caac.21834
2. Dawood S, Haaland B, Albaracin C, Gupta S, Cortes J, Sim YY, Dent RA. Is the Proportion of Patients Diagnosed with Synchronous Stage IV Breast Cancer Who Survive More than Two Years Increasing over Time? Oncology. 2015;89(2):79–87. https://doi.org/10.1159/000371746. Epub 2015 Apr 1. PMID: 25832113
3. Contreras-Espinosa L, Alcaraz N, De La Rosa-Velázquez IA, Díaz-Chávez J, Cabrera-Galeana P, Rebollar-Vega R, Reynoso-Noverón N, Maldonado-Martínez HA, González-Barrios R, Montiel-Manríquez R, Bautista-Sánchez D, Castro-Hernández C, Alvarez-Gomez RM, Jiménez-Trejo F, Tapia-Rodríguez M, García-Gordillo JA, Pérez-Rosas A, Bargallo-Rocha E, Arriaga-Canon C, Herrera LA. Transcriptome Analysis Identifies GATA3-AS1 as a Long Noncoding RNA Associated with Resistance to Neoadjuvant Chemotherapy in Locally Advanced Breast Cancer Patients. J Mol Diagn. 2021;23(10):1306–1323. https://doi.org/10.1016/j.jmoldx.2021.07.014
4. Dawood S, Broglio K, Gonzalez-Angulo AM, Buzdar AU, Hortobagyi GN, Giordano SH. Trends in survival over the past two decades among white and black patients with newly diagnosed stage IV breast cancer. J Clin Oncol. 2008;26(30):4891–4898. https://doi.org/10.1200/JCO.2007.14.1168
5. Prat A, Pineda E, Adamo B, Galván P, Fernández A, Gaba L, Díez M, Viladot M, Arance A, Muñoz M. Clinical implications of the intrinsic molecular subtypes of breast cancer. Breast. 2015;24 Suppl 2:S26–35. https://doi.org/10.1016/j.breast.2015.07.008
6. Amin MB, Greene FL, Edge SB, Compton CC, Gershenwald JE, Brookland RK, Meyer L, Gress DM, Byrd DR, Winchester DP. The Eighth Edition AJCC Cancer Staging Manual: Continuing to build a bridge from a population-based to a more “personalized” approach to cancer staging. CA Cancer J Clin. 2017;67(2):93–99. https://doi.org/10.3322/caac.21388
7. Pivot X, Asmar L, Buzdar AU, Valero V, Hortobagyi G. A unified definition of clinical anthracycline resistance breast cancer. Br J Cancer. 2000;82(3):529–534. https://doi.org/10.1054/bjoc.1999.0958
8. Trock BJ, Leonessa F, Clarke R. Multidrug resistance in breast cancer: a meta-analysis of MDR1/gp170 expression and its possible functional significance. J Natl Cancer Inst. 1997;89(13):917–931. https://doi.org/10.1093/jnci/89.13.917
9. Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M, Rubinstein L, Shankar L, Dodd L, Kaplan R, Lacombe D, Verweij J. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45(2):228–247. https://doi.org/10.1016/j.ejca.2008.10.026
10. Сазонов С.В., Казанцева Н.В. Рак молочной железы. Современное содержание понятий: лечебный патоморфоз, ответ опухоли на химиотерапию, морфологический регресс опухоли, прогноз заболевания. Вестник Уральской медицинской академической науки. 2016:3(58);85–96. http://dx.doi.org/10.22138/2500-0918-2016-15-3-85-96
11. Вострецова А.С., Булдакова Т.И. Исследование статистических методов анализа данных для оценки состояния человека. Математические методы в технологиях и технике. 2023:5;87–92. https://doi.org/10.52348/2712-8873_MMTT_2023_5_87
12. Early Breast Cancer Trialists’ Collaborative Group (EBCTCG); Peto R, Davies C, Godwin J, Gray R, Pan HC, Clarke M, Cutter D, Darby S, McGale P, Taylor C, Wang YC, Bergh J, Di Leo A, Albain K, Swain S, Piccart M, Pritchard K. Comparisons between different polychemotherapy regimens for early breast cancer: meta-analyses of long-term outcome among 100,000 women in 123 randomised trials. Lancet. 2012;379(9814):432–444. https://doi.org/10.1016/S0140-6736(11)61625-5
13. Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Electronic address: bc.overview@ctsu.ox.ac.uk; Early Breast Cancer Trialists’ Collaborative Group (EBCTCG). Anthracycline-containing and taxane-containing chemotherapy for early-stage operable breast cancer: a patient-level meta-analysis of 100 000 women from 86 randomised trials. Lancet. 2023;401(10384):1277–1292. https://doi.org/10.1016/S0140-6736(23)00285-4
14. Yazilitas D, Sendur MA, Karaca H, Ozdemir N, Aksoy S, Berk V, Yazici O, Ozturk B, Ozkan M, Zengin N, Altundag K. Efficacy of dose dense doxorubicin and cyclophosphamide followed by paclitaxel versus conventional dose doxorubicin, cyclophosphamide followed by paclitaxel or docetaxel in patients with node-positive breast cancer. Asian Pac J Cancer Prev. 2015;16(4):1471–1477. https://doi.org/10.7314/apjcp.2015.16.4.1471
15. Khan MM, Yalamarty SSK, Rajmalani BA, Filipczak N, Torchilin VP. Recent strategies to overcome breast cancer resistance. Crit Rev Oncol Hematol. 2024;197:104351. https://doi.org/10.1016/j.critrevonc.2024.104351
16. Gote V, Nookala AR, Bolla PK, Pal D. Drug Resistance in Metastatic Breast Cancer: Tumor Targeted Nanomedicine to the Rescue. Int J Mol Sci. 2021;22(9):4673. https://doi.org/10.3390/ijms22094673
17. Guo H, Treude F, Krämer OH, Lüscher B, Hartkamp J. PAR-4 overcomes chemo-resistance in breast cancer cells by antagonizing cIAP1. Sci Rep. 2019;9(1):8755. https://doi.org/10.1038/s41598-019-45209-9
18. Longley DB, Johnston PG. Molecular mechanisms of drug resistance. J Pathol. 2005;205(2):275–292. https://doi.org/10.1002/path.1706
19. Dumontet C, Sikic BI. Mechanisms of action of and resistance to antitubulin agents: microtubule dynamics, drug transport, and cell death. J Clin Oncol. 1999;17(3):1061–1070. https://doi.org/10.1200/JCO.1999.17.3.1061
20. Karamouzis MV, Ioannidis G, Rigatos G. Quality of life in metastatic breast cancer patients under chemotherapy or supportive care: a single-institution comparative study. Eur J Cancer Care (Engl). 2007;16(5):433–438. https://doi.org/10.1111/j.1365-2354.2006.00771.x
21. Nelli F, Moscetti L, Natoli G, Massari A, D’Auria G, Chilelli M, Fabbri MA, Frittelli P, Ruggeri EM. Gemcitabine and carboplatin for pretreated metastatic breast cancer: the predictive value of immunohistochemically defined subtypes. Int J Clin Oncol. 2013;18(2):343–349. https://doi.org/10.1007/s10147-012-0384-x
22. Zelek L, Barthier S, Riofrio M, Fizazi K, Rixe O, Delord JP, Le Cesne A, Spielmann M. Weekly vinorelbine is an effective palliative regimen after failure with anthracyclines and taxanes in metastatic breast carcinoma. Cancer. 2001;92(9):2267–2272. https://doi.org/10.1002/1097-0142(20011101)92:9<2267::aid-cncr1572>3.0.co;2-q
23. Seidman AD, Brufsky A, Ansari RH, Hart LL, Stein RS, Schwartzberg LS, Stewart JF, Russell CA, Chen SC, Fein LE, De La Cruz Vargas JA, Kim SB, Cavalheiro J, Zhao L, Gill JF, Obasaju CK, Orlando M, Tai DF. Phase III trial of gemcitabine plus docetaxel versus capecitabine plus docetaxel with planned crossover to the alternate single agent in metastatic breast cancer. Ann Oncol. 2011;22(5):1094–1101. https://doi.org/10.1093/annonc/mdq578
24. Harbottle A, Daly AK, Atherton K, Campbell FC. Role of glutathione S-transferase P1, P-glycoprotein and multidrug resistance-associated protein 1 in acquired doxorubicin resistance. Int J Cancer. 2001;92(6):777–783. https://doi.org/10.1002/ijc.1283
25. Guo B, Tam A, Santi SA, Parissenti AM. Role of autophagy and lysosomal drug sequestration in acquired resistance to doxorubicin in MCF-7 cells. BMC Cancer. 2016;16(1):762. https://doi.org/10.1186/s12885-016-2790-3
Об авторах
К. А. АлиевРоссия
Алиев Казим Алиевич - кандидат медицинских наук, доцент кафедры онкологии
Бульвар Ленина, д. 5/7, г. Симферополь, 7295051
В. В. Олексенко
Россия
Олексенко Виктор Валентинович - доктор медицинских наук, доцент, заведующий кафедрой онкологии
Бульвар Ленина, д. 5/7, г. Симферополь, 7295051
Е. Ю. Зяблицкая
Россия
Зяблицкая Евгения Юрьевна - доктор медицинских наук, ведущий научный сотрудник Центральной научно-исследовательской лаборатории
Бульвар Ленина, д. 5/7, г. Симферополь, 7295051
Г. Н. Телькиева
Россия
Телькиева Галина Николаевна - кандидат медицинских наук, доцент кафедры онкологии
Бульвар Ленина, д. 5/7, г. Симферополь, 7295051
М. С. Коваленко
Россия
Коваленко Маргарита Сергеевна - врач-ординатор кафедры онкологии
Бульвар Ленина, д. 5/7, г. Симферополь, 7295051
А. В. Кубышкин
Россия
Кубышкин Анатолий Владимирович - доктор медицинских наук, профессор, заведующий кафедрой общей и клинической патофизиологии, директор Инжинирингового центра «Генетические и клеточные биотехнологии»
Бульвар Ленина, д. 5/7, г. Симферополь, 7295051
Рецензия
Для цитирования:
Алиев К.А., Олексенко В.В., Зяблицкая Е.Ю., Телькиева Г.Н., Коваленко М.С., Кубышкин А.В. Анализ эффективности режимов неоадъювантной химиотерапии у пациентов с местнораспространенным HER2/neu-негативным раком молочной железы: нерандомизированное сравнительное исследование. Кубанский научный медицинский вестник. 2025;32(2):29-40. https://doi.org/10.25207/1608-6228-2025-32-2-29-40
For citation:
Aliev K.A., Oleksenko V.V., Zyablitskaya E.Yu., Telkieva G.N., Kovalenko M.S., Kubyshkin A.V. Efficacy analysis of neoadjuvant chemotherapy regimens in patients with HER2/neunegative locally advanced breast cancer: A nonrandomized comparative study. Kuban Scientific Medical Bulletin. 2025;32(2):29-40. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-2-29-40








































