Перейти к:
Раннее прогнозирование исходов острого панкреатита разной этиологии: ретроспективное обсервационное исследование
https://doi.org/10.25207/1608-6228-2025-32-2-41-54
Аннотация
Введение. Острый панкреатит остается глобальной проблемой здравоохранения, связанной с высокой летальностью и значительными финансовыми затратами. Хотя до 80 % случаев протекают в легкой форме, остальные могут прогрессировать до тяжелых состояний, требующих активной тактики лечения, эффективность которого во многом зависит от точности ранней оценки риска. Несмотря на многочисленные исследования, не найден достаточно хороший способ прогнозирования неблагоприятного исхода острого панкреатита с учетом его патогенеза, который был бы одинаково хорош для всех этиологических форм, что подчеркивает необходимость дальнейших исследований для улучшения прогностических методов.
Цель исследования — определить прогностическую роль инструментов (шкал и критериев) оценки риска неблагоприятного исхода острого панкреатита различной этиологии.
Методы. Проведено ретроспективное наблюдательное исследование на базе государственного бюджетного учреждения здравоохранения «Краевая клиническая больница № 2» Министерства здравоохранения Краснодарского края в период с 01.01.2023 по 01.11.2023. По критериям включения оценен 541 пациент. В исследование включены 512 человек в возрасте от 18 лет. Пациенты разделены на группы по этиологическому фактору. Произведена оценка статистической значимости имеющихся методов прогнозирования неблагоприятного исхода (quick Sepsis-related Organ Failure Assessment (qSOFA), Bedside Index of Severity in Acute Pancreatitis (BISAP), критерии Systemic Inflammatory Response Syndrome (SIRS), уровень С‑реактивного белка крови) для общей когорты и в группах по этиологии при помощи сравнения их прогностической ценности путем проведения ROC-анализа. Статистическая обработка данных проводилась с использованием пакетов прикладных программ MedCalc v22.020 (MedCalc Software Ltd., Бельгия), Microsoft Office Excel 2016 (Microsoft Corporation, США).
Результаты. В этиологической структуре доминировал алкогольно-алиментарный фактор — 309 (60,3 %) из 512 случаев. Билиарный панкреатит наблюдали в 176 случаях (34,4 %), травматический панкреатит встречался у 27 пациентов (5,3 %). У 35,2 % пациентов когорты острый панкреатит приобретал тяжелый вариант течения. Общая летальность в изучаемой когорте составила 10,5 % (54 пациента). При этом летальность в группах по этиологии различалась: наибольшая частота летальных исходов наблюдалась при билиарном панкреатите — 15,3 % в группе пациентов с билиарным панкреатитом (при алкогольно-алиментарном — 8,1 % для группы пациентов с соответствующей этиологией, при травматическом панкреатите — 7,4 % среди пациентов с травматическим панкреатитом). Отмечалось статистически значимое различие долей летальных исходов при анализе выживаемости пациентов по подгруппам. Пациенты группы билиарного панкреатита имели в 2,3 раза выше риск летального исхода за период наблюдения в сравнении с группой алкогольно-алиментарного острого панкреатита и в 4,3 раза по сравнению с травматическим острым панкреатитом. В результате анализа изучаемой когорты для прогнозирования неблагоприятного исхода наиболее эффективными оказались критерии SIRS (AUC 0,831). Ситуация изменилась при субанализе групп. При алкогольно-алиментарной этиологии острого панкреатита наибольшую прогностическую ценность показала шкала qSOFA (AUC 0,874, ДИ 95 % 0,831–0,909; p < 0,001). В случае билиарного панкреатита критерии SIRS обеспечивают более точное прогнозирование (AUC 0,857, ДИ 95 % 0,796–0,905; p < 0,001). Для травматического панкреатита только критерии SIRS показали значимые прогностические результаты SIRS (AUC 0,700, 95 % ДИ 0,494–0,860; p = 0,014). При этом BISAP, qSOFA и уровень C‑реактивного белка не обладали прогностической значимостью.
Заключение. Имеющиеся инструменты оценки риска неблагоприятного исхода у пациентов с острым панкреатитом демонстрируют разную эффективность в зависимости от этиологии острого панкреатита, подчеркивая необходимость крупномасштабных исследований для создания универсальных многофакторных шкал и/или биомаркеров, способных точно прогнозировать вариант течения заболевания.
Ключевые слова
Для цитирования:
Орбелян Л.К., Дурлештер В.М., Быков (мл.) И.М. Раннее прогнозирование исходов острого панкреатита разной этиологии: ретроспективное обсервационное исследование. Кубанский научный медицинский вестник. 2025;32(2):41-54. https://doi.org/10.25207/1608-6228-2025-32-2-41-54
For citation:
Orbelian L.K., Durleshter V.M., Bykov (j-r) I.M. Early prognosis of outcomes of acute pancreatitis with different etiologies: A retrospective observational study. Kuban Scientific Medical Bulletin. 2025;32(2):41-54. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-2-41-54
ВВЕДЕНИЕ
Острый панкреатит (ОП) продолжает представлять серьезный риск для глобального здравоохранения. Это одна из наиболее частых гастроинтестинальных причин госпитализаций в мире [1], связанная с высокой летальностью и большими финансовыми затратами [2].
Многочисленные исследования были посвящены патогенезу ОП, однако точный механизм этой патологии до сих пор остается непонятным [3]. Существует множество предположений о патофизиологических процессах при ОП, но ни одно из них полностью не объясняет, вследствие чего развивается неблагоприятный исход [4].
В соответствии с обновленной классификацией Атланта-2012 процесс развития ОП разделяется на две фазы [5]. На ранней стадии системные нарушения вторичны по отношению к местному воспалению поджелудочной железы. По мере развития заболевания воспаление принимает генерализованный характер и определяется как синдром системного воспалительного ответа. Риск органной недостаточности и осложнений возрастает при персистирующем синдроме системного воспалительного ответа [5]. До 80 % случаев ОП разрешаются самостоятельно или не требуют длительного лечения. В остальных случаях ОП может приобрести тяжелое течение с высокой частотой осложнений и летальностью. Эта подгруппа пациентов должна быть выявлена на ранних стадиях заболевания и нуждается в активной тактике для минимизации риска летального исхода [6]. Помимо прочего, идентификация легкой формы заболевания важна и необходима во избежание чрезмерного лечения, которое само по себе может представлять риск.
Определение вероятности неблагоприятного исхода на основании тяжести ОП впервые было предложено в 1974 году Рэнсоном [7]. С тех пор предложено множество других многофакторных систем оценки риска неблагоприятного исхода на основе клинических и биохимических параметров. Однако большинство имеющихся на данный момент методов прогнозирования основаны на регистрации показателей, характерных для фазы местных или системных осложнений, а также не учитывают этиологический фактор.
Таким образом, остается открытым вопрос о факторах риска и их вкладе в развитие неблагоприятного исхода. Не менее актуален вопрос возможности прогнозирования летального исхода, что требует проведения исследований.
В данном исследовании будет проведена сравнительная характеристика некоторых имеющихся инструментов прогнозирования тяжести ОП в ранней оценке неблагоприятного исхода.
Цель исследования — определить прогностическую роль инструментов (критерии и шкалы: SIRS, BISAP, qSOFA, СРБ) оценки риска неблагоприятного исхода ОП различной этиологии.
МЕТОДЫ
Дизайн исследования
Проведено ретроспективное наблюдательное исследование. Выполнен анализ данных медицинской документации 512 пациентов с диагнозом «острый панкреатит» (истории болезни).
Условия проведения исследования
Исследование проводилось на базе государственного бюджетного учреждения здравоохранения «Краевая клиническая больница № 2» Министерства здравоохранения Краснодарского края. Исследование включало набор данных в группы за период с 01.01.2023 по 01.11.2023 и их формализацию в программе Excel (Microsoft Office 2016) с последующей статистической обработкой.
Критерии соответствия
Критерии включения
Пациенты старше 18 лет с диагнозом ОП, госпитализированные в экстренном порядке (по линии скорой медицинской помощи, самообращение) в течение 48 часов после появления болевого синдрома в период с 01.01.2023 по 01.11.2023.
Критерии невключения
Пациенты с сопутствующей патологией в стадии декомпенсации, ОП неуточненной этиологии.
Критерии исключения
Пациенты, в медицинских картах которых отсутствовала информация, необходимая для анализа (отсутствие или неполнота лабораторных данных, данных ультразвукового исследования и/или результатов компьютерной томографии).
Описание критериев соответствия (диагностические критерии)
Отбор пациентов включал наличие диагноза ОП при поступлении в стационар на основе клинических данных, результатов лабораторно-инструментального обследования в соответствии с национальными клиническими рекомендациями «Острый панкреатит» (2020 г.), утвержденными Министерством здравоохранения Российской Федерации1.
Подбор участников в группы
В исследование включены 512 пациентов, которые были разделены на группы по этиологическому фактору: алкогольно-алиментарный (n = 309), билиарный (n = 176), травматический (n = 27). Подбор участников представлен в описании критериев соответствия.
Целевые показатели исследования
Основной показатель исследования
При определении и анализе факторов риска неблагоприятного исхода при ОП различной этиологии целевым показателем исследования является эффективность прогнозирования неблагоприятного исхода по численному значению площади фигуры (AUC) из ROC-анализа для различных шкал. Неблагоприятный исход оценивался как госпитальная летальность.
Дополнительные показатели исследования
Дополнительные показатели исследования получить не предполагалось.
Методы измерения целевых показателей
Анализ медицинской документации: ретроспективно оценивалась госпитальная летальность, т. е. летальный исход от всех причин в течение нахождения пациента в стационаре.
На основании ретроспективного анализа проведена сравнительная оценка некоторых имеющихся инструментов прогнозирования неблагоприятного исхода ОП (quick Sepsis-related Organ Failure Assessment (qSOFA); критерии Systemic Inflammatory Response Syndrome (SIRS), шкала Bedside Index of Severity in Acute Pancreatitis (BISAP), уровень С-реактивного белка (СРБ)).
Шкала qSOFA используется для оценки риска возникновения органной дисфункции, а также для прогнозирования неблагоприятного исхода. Шкала включает в себя следующие параметры: изменение уровня сознания по шкале комы Глазго < 15 баллов, систолическое артериальное давление менее 100 мм рт. ст., частоту дыхания ≥ 22 дыханий в минуту [8].
Для определения вероятности неблагоприятного исхода также применялись критерии SIRS, включающие: температуру тела ≥ 38 или ≤ 36 °C, частоту сердечных сокращений ≥ 90 в минуту, частоту дыхания ≥ 20 в минуту или снижение уровня парциального давления диоксида углерода в крови ≤ 32 мм рт. ст., а также уровень лейкоцитов крови более 12×10⁹/л или менее 4×10⁹/л [9].
Оценка возможности использования комплексного инструмента определения вероятности летального исхода, а именно: индекса тяжести ОП (BISAP). В рамках этой шкалы были использованы такие параметры, как: азот мочевины крови > 25 мг/дл, нарушение психического статуса пациентов по шкале комы Глазго (менее 15 баллов), наличие признаков синдрома системного воспалительного ответа (2 и более критерия SIRS), возраст пациента более 60 лет, а также наличие плеврального выпота при визуализации [10].
В рамках сравнения также анализировалась прогностическая значимость концентрации C-реактивного белка (СРБ) крови (мг/л). Определялся уровень СРБ методом иммунотурбидиметрии, при помощи биохимического модуля Сobas c501 (Roche, Швейцария) [11].
Переменные (предикторы, конфаундеры, модификаторы эффекта)
В исследовании конфаундерами могли выступать: неуточненная этиологическая форма ОП, длительность болевого синдрома более 48 часов, а также тяжелая сопутствующая патология. Для снижения модифицирующего эффекта данные факторы были нивелированы на этапе формирования выборок за счет внесения их в состав критериев невключения.
Статистические процедуры
Принципы расчета размера выборки
Размер выборки предварительно не рассчитывался.
Статистические методы
Для оценки характера распределения данных применяли критерии Колмогорова — Смирнова, Шапиро — Уилка. Если данные не соответствовали нормальному распределению, они были представлены в виде медианы и межквартильного размаха. Для оценки статистической значимости количественных и качественных показателей в подгруппах использовался однофакторный дисперсионный анализ (критерий Краскела — Уоллиса, с критерием Данна для апостериорного попарного сравнения) и критерий хи-квадрат при многопольной кросс-табуляции для сравнения долей. Для оценки прогностической значимости модели выполняли ROC-анализ с расчетом площади под ROC-кривой (AUROC (с 95 % доверительным интервалом)) и точек отсечения. Анализ выживаемости произведен с использованием метода Каплана — Майера, сравнением кривых выживаемости (логранговый критерий) [12].
Уровень статистической значимости был установлен на уровне p < 0,05. Статистическая обработка данных проводилась с использованием пакетов прикладных программ MedCalc v22.020 (MedCalc Software Ltd., Бельгия), Microsoft Office Excel 2016 (Microsoft Corporation, США).
РЕЗУЛЬТАТЫ
Формирование выборки исследования
Оценены данные 605 пациентов с диагнозом при поступлении ОП. По критериям включения оценен 541 пациент. В итоговый анализ включены данные 512 пациентов, подходящих для проведения исследования согласно критериям невключения и исключения. Все они были распределены на три группы в зависимости от этиологии развития ОП (алкогольно-алиментарный, билиарный, травматический). Блок-схема формирования групп с учетом критериев невключения/исключения представлена на рисунке 1.
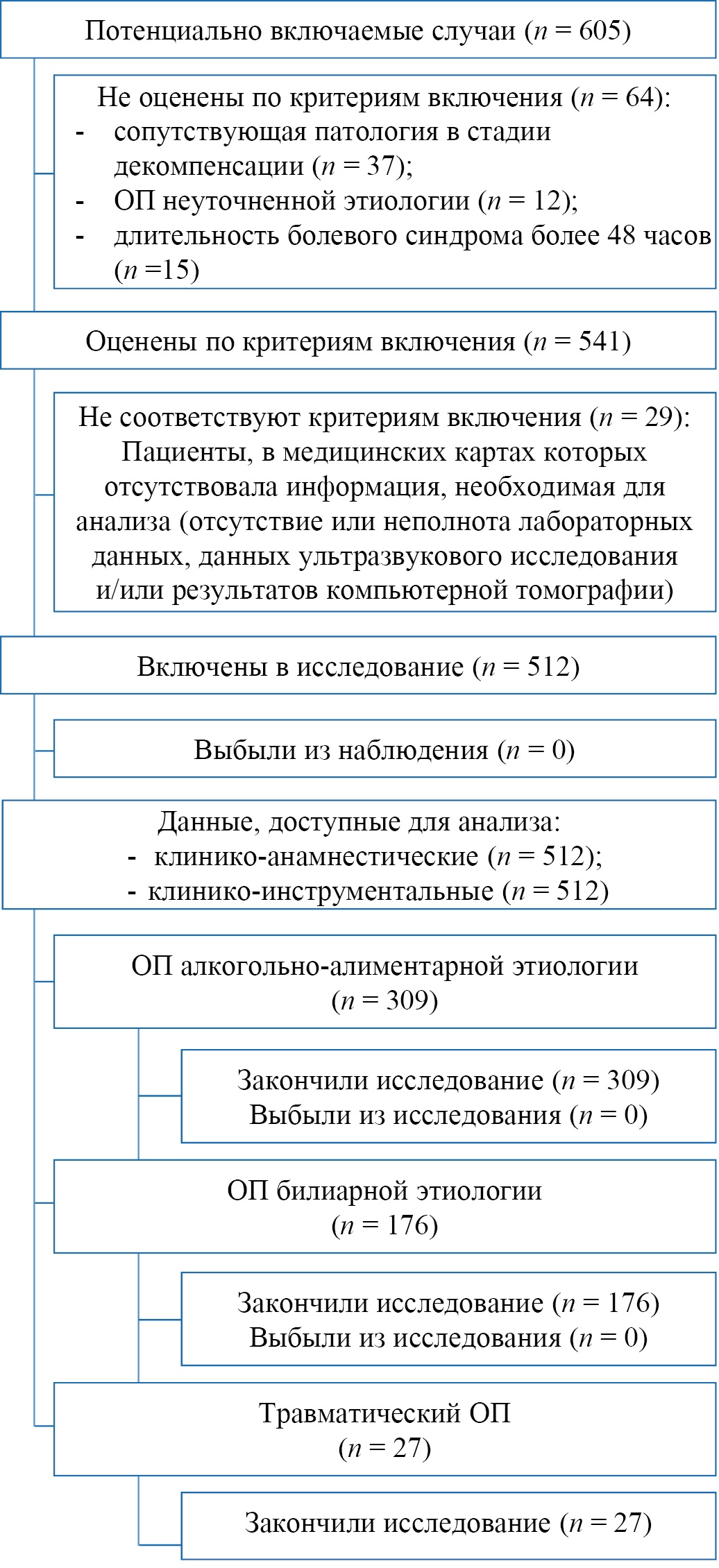
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами (согласно рекомендациям STROBE). Сокращение: ОП — острый панкреатит.
Fig. 1. The block diagram of the study design
Note: performed by the authors (according to STROBE recommendations). Abbreviation: ОП — acute pancreatitis.
Характеристика выборки (групп) исследования
Медиана возраста всей когорты пациентов составила 50 [ 39; 62] лет. По гендерному признаку в когорте преобладали пациенты мужского пола — 302 (59,0 %). Для 243 пациентов выполнено оперативное вмешательство (47,5 %). Эндоскопическое вмешательство (ретроградная холангиопанкреатография (РХПГ), эндоскопическая папиллотомия (ЭПТ), механическая литоэкстракция (МЛЭ), стентирование) применено у 116 пациентов (22,7 %). Дренирование желчных протоков выполнено для 100 больных (19,5 %). Лапароскопические вмешательства были проведены для 17 пациентов (3,3 %) и лапаротомия для 10 больных (2,0 %).
В этиологической структуре доминировал алкогольно-алиментарный фактор — 309 (60,3 %). Билиарный панкреатит наблюдали в 176 случаях (34,4 % от всей когорты), травматический панкреатит встретился у 27 пациентов (5,3 % от всей когорты) (табл. 1).
Таблица 1. Основные характеристики групп по этиологии
Table 1. Main characteristics of groups divided by etiology
Параметр | ОП алкогольно-алиментарной этиологии (n = 309) | ОП билиарной этиологии (n = 176) | Травматический ОП (n = 27) | Уровень статистической значимости, p |
Возраст, лет Me [ Q1; Q3] | 48,0 [ 38,0; 57,0] | 56,0 [ 40,7; 65,0] | 61,0 [ 53,0; 70,0] | <0,0001* |
Мужской пол, n (%) | 204 (66,0 %) | 91 (51,7 %) | 7 (25,9 %) | <0,0001# |
Объем оперативного вмешательства | ||||
Выполненное оперативное вмешательство (все вмешательства), n (%) | 95 (30,7 %) | 121 (68,7 %) | 27 (100,0 %) | <0,0001# |
Эндоскопическое вмешательство (РХПГ, ЭПТ, МЛЭ, стентирование), n (%) | 24 (7,8 %) | 82 (46,6 %) | 10 (37,0 %) | <0,0001# |
Дренирование желчных протоков, n (%) | 53 (17,2 %) | 32 (18,2 %) | 15 (55,6 %) | <0,0001# |
Лапароскопические вмешательства, n (%) | 10 (3,2 %) | 7 (4,0 %) | 0 (0,0 %) | <0,0001# |
Лапаротомия, n (%) | 8 (2,6 %) | 0 (0,0 %) | 2 (7,4 %) | <0,0001# |
Степень тяжести ОП (Атланта, 2012 [13]) | ||||
Легкое течение, n (%) | 140 (45,3 %) | 53 (30,1 %) | 10 (37,0 %) | 0,005# |
Средней тяжести, n (%) | 94 (30,4 %) | 82 (46,6 %) | 5 (18,5 %) | <0,001# |
Тяжелое течение, n (%) | 75 (24,3 %) | 41 (23,3 %) | 12 (44,5 %) | 0,055# |
Примечания: таблица составлена авторами; * критерий Краскела — Уоллиса; # критерий хи-квадрат; p — уровень значимости различия долей для трех подгрупп по этиологии, Me [ Q1; Q3] — медиана [межквартильный размах]. Сокращения: ОП — острый панкреатит; МЛЭ — механическая литоэкстракция; РХПГ — ретроградная холангиопанкреатография; ЭПТ — эндоскопическая папиллотомия.
Notes: compiled by the authors; * Kruskal–Wallis test; # chi-squared test; p — the significance of differences in the shares for the three subgroups divided by etiology; Me [ Q1; Q3] — median [interquartile range]. Abbreviations: ОП — acute pancreatitis; МЛЭ — mechanical lithoextraction; РХПГ — endoscopic retrograde cholangiopancreaticography; ЭПТ — endoscopic papillotomy.
Основные результаты исследования
Проведенное исследование показало, что в 35,2 % среди 512 случаев ОП приобретал тяжелый вариант течения. Общая летальность в изучаемой когорте составила 10,5 % (54 пациента).
Летальность в группах по этиологии статистически значимо различалась — наибольшая частота летальных исходов наблюдалась при билиарном панкреатите — 15,3 % в группе (при алкогольно-алиментарном — 8,1 % в группе, при травматическом панкреатите 7,4 % в группе (по критерию хи-квадрат для многопольных таблиц сопряженности р = 0,038) (табл. 2).
Таблица 2. Оцениваемые прогностические параметры и исход
Table 2. Evaluated prognostic parameters and outcome
Шкалы | Количество пациентов и их доли в группе по этиологии | Уровень значимости (p) для трех групп | ||
ОП алкогольно-алиментарной этиологии (n = 309) | ОП билиарной этиологии (n = 176) | Травматический ОП (n = 27) | ||
qSOFA, баллы | ||||
0 | 264 (85,4 %) | 148 (84,1 %) | 27 (100,0 %) | 0,087# |
1 | 35 (11,4 %) | 5 (2,8 %) | 0 (0,0 %) | 0,002# |
2 | 10 (3,2 %) | 17 (9,7 %) | 0 (0,00 %) | 0,005# |
3 | 0 (0,0 %) | 6 (3,4 %) | 0 (0,00 %) | 0,004# |
SIRS, количество критериев | ||||
0 | 75 (24,3 %) | 30 (17,1 %) | 5 (18,5 %) | 0,164# |
1 | 107 (34,6 %) | 64 (36,4 %) | 7 (25,9 %) | 0,569# |
2 | 69 (22,3 %) | 51 (28,8 %) | 10 (37,1 %) | 0,098# |
3 | 46 (14,9 %) | 8 (4,6 %) | 5 (18,5 %) | 0,002# |
4 | 12 (3,9 %) | 23 (13,1 %) | 0 (0,00 %) | <0,001# |
BISAP, баллы | ||||
0 | 35 (11,3 %) | 20 (11,4 %) | (0,0 %) | 0,181# |
1 | 149 (48,2 %) | 73 (41,5 %) | 10 (37,0 %) | 0,242# |
2 | 80 (25,9 %) | 35 (19,9 %) | 11 (40,7 %) | 0,046# |
3 | 40 (12,9 %) | 37 (21,0 %) | 6 (22,2 %) | 0,047# |
4 | 5 (1,6 %) | 6 (3,4 %) | (0,0 %) | 0,311# |
5 | (0,0 %) | 5 (2,8 %) | (0,0 %) | 0,009# |
СРБ, мг/л Me [ Q1; Q3] | 52,4 [ 8,7; 155,5] | 36,3 [ 9,2; 124,7] | 14,9 [ 12,7; 112,5] | 0,084* |
Длительность пребывания в стационаре, к/д Me [ Q1; Q3] | 6,0 [ 5,0; 10,0] | 9,0 [ 5,0; 12,0] | 14,0 [ 10,0; 16,0] | <0,0001* |
Летальность, n (%) | 25 (8,1 %) | 27 (15,3 %) | 2 (7,4 %) | 0,038# |
Примечания: таблица составлена авторами; * критерий Краскела — Уоллиса; # критерий хи-квадрат, Me [ Q1; Q3] — медиана [межквартильный размах]; p — вероятность ошибки при сравнении средних значений между группами. Сокращения: ОП — острый панкреатит; СРБ — С-реактивный белок, BISAP — индекс тяжести острого панкреатита (Bedside Index of Severity in Acute Pancreatitis); SIRS — синдром системной воспалительной реакции (Systemic Inflammatory Response Syndrome); qSOFA — динамическая оценка органной недостаточности (quick Sepsis-related Organ Failure Assessment).
Notes: compiled by the authors; * Kruskal–Wallis test; # chi-squared test; Me [ Q1; Q3] — median [interquartile range]; p — error probability when comparing average values between groups. Abbreviations: ОП — acute pancreatitis; СРБ — C-reactive protein; BISAP — Bedside Index of Severity in Acute Pancreatitis; SIRS — Systemic Inflammatory Response Syndrome; qSOFA — quick Sepsis-related Organ Failure Assessment.
Индекс qSOFA оценивался для всех групп пациентов. Во всех группах наибольшее число пациентов не имели органной дисфункции по данным шкалы, что является следствием поступления пациентов в ранние сроки начала заболевания, до развития выраженных системных реакций. В группе алкогольно-алиментарного панкреатита 0 баллов по qSOFA нами отмечено у 85,4 % пациентов, в группе билиарного панкреатита — у 84,1 % пациентов, в группе травматического панкреатита — у всех пациентов. Что касается остальных пациентов, то в группе билиарного панкреатита чаще встречались пациенты с органными нарушениями, чем при алкогольно-алиментарной этиологии, при этом пациентов с 3 баллами наблюдали только в группе билиарного панкреатита (p = 0,004).
Количество критериев SIRS также варьировалось между группами. В целом у пятой части пациентов не отмечено признаков системного воспаления при поступлении, при этом больше всего таких пациентов наблюдали в группе алкогольно-алиментарного генеза заболевания (24,3 %). Пациенты с выраженной системной воспалительной реакцией чаще встречались в группе билиарного панкреатита. Так, 4 критерия SIRS наблюдали у 13,1 % пациентов этой группы (по сравнению с 3,9 % в группе алкогольно-алиментарного панкреатита, р < 0,001 для попарного сравнения), в группе же травматического панкреатита таких пациентов не было.
Индекс BISAP в общей группе был распределен следующим образом: половина всех пациентов соответствовала 1 баллу, 24,6 % — 2 баллам, 16,2 % имели значение 3, 10,7 % имели значение 0, 2,1 % — значение 4 и менее 1 % — значение 5. Пациенты с более тяжелым панкреатитом чаще встречались при билиарной этиологии заболевания. Так, индекс BISAP 3 и 4 статистически значимо чаще встречался именно в этой группе (p = 0,003 по сравнению с алкогольно-алиментарным для попарного сравнения), а пациентов с количеством баллов 5 наблюдали только при билиарном панкреатите (по критерию хи-квадрат для многопольного сравнения р = 0,009).
Медианный уровень СРБ для всех пациентов (n = 512) был 42,3 [ 9,0;150,0] мг/л, при этом в группе алкогольно-алиментарного происхождения медиана составила 52,4 мг/л [ 8,7;155,5], в группе билиарной этиологии — 36,3 мг/л [ 9,2;124,7], в группе травматического панкреатита — 14,9 мг/л [ 12,7;115,2]. Различия между группами не достигли статистической значимости (по критерию хи-квадрат для многопольного сравнения p = 0,084).
Длительность пребывания в стационаре статистически значимо различалась между группами. В группе алкогольно-алиментарного генеза медиана длительности составила 6 дней [ 5;10], при билиарном панкреатите — 9 дней [ 5;12], в группе травматической этиологии заболевания — 14 дней [ 10;16]. Таким образом, пациенты с травматическим панкреатитом находились в стационаре длительнее всех, а пациенты группы алкогольно-алиментарного ОП характеризовались наименьшими сроками госпитализации. Различия между группами статистически значимы (p < 0,0001).
Летальность также различалась между группами, что является отражением различий в тяжести заболевания при поступлении. Так при доле для всей когорты, равной 10,5 %, в группе травматического и алкогольно-алиментарного панкреатита она была ниже (7,4 и 8,1 % соответственно), а в группе билиарного выше — 15,3 %.
Отмечалось статистически значимое различие долей при анализе выживаемости пациентов по подгруппам (по критерию хи-квадрат p < 0,001). Выживаемость оценивалась на протяжении 80 дней, а различия между группами анализировались с помощью теста логранка (Log-rank test).
Пациенты группы билиарного панкреатита имели в 2,3387 раза выше риск летального исхода за период наблюдения в сравнении с группой алкогольно-алиментарного ОП и в 4,33 раза по сравнению с травматическим ОП (табл. 3). Отношения рисков статистически значимы, так как не содержат единицу в интервальном промежутке. Пациенты с алкогольно-алиментарным ОП имели в 1,85 раза более высокий риск летального исхода по сравнению с травматическим ОП, однако это различие статистически не значимо, так как доверительный интервал для этого отношения рисков содержит единицу.
Таблица 3. Отношения рисков наступления летального исхода в исследуемых группах пациентов с 95 % доверительным интервалом
Table 3. Risk ratios of fatal outcomes in the studied groups of patients with a confidence interval of 95 %
Коэффициент | ОП алкогольно-алиментарной этиологии | ОП билиарной этиологии | Травматический ОП |
ОП алкогольно-алиментарной этиологии | - | 2,3387* | 0,5397 |
(95 % ДИ 1,281–4,270) | (95 % ДИ 0,210–1,384) | ||
ОП билиарной этиологии | 0,4276* | - | 0,2308* |
(95 % ДИ 0,234–0,780) | (95 % ДИ 0,084–0,633) | ||
Травматический ОП | 1,8528 | 4,3331* | - |
(95 % ДИ 0,722–4,752) | (95 % ДИ 1,578–11,901) |
Примечания: таблица составлена авторами; * p < 0,01. Сокращения: ДИ — доверительный интервал; ОП — острый панкреатит.
Notes: compiled by the authors; * p < 0.01. Abbreviations: ДИ — confidence interval; ОП — acute pancreatitis.
В результате анализа изучаемой когорты для прогнозирования неблагоприятного исхода (летальности) наиболее эффективными оказались критерии SIRS (AUC 0,831, 95 % ДИ 0,795–0,862; p < 0,0001, точка отсечения >1 критерия, чувствительность 88,9 %, специфичность 61,6 %). Остальные инструменты прогнозирования представили меньшую значимость: BISAP (AUC 0,767, 95 % ДИ 0,728–0,803; p < 0,0001, точка отсечения > 1 балла, чувствительность 87,0 %, специфичность 61,1 %), qSOFA (AUC 0,775, 95 % ДИ 0,736–0,810; p < 0,0001, точка отсечения > 0 баллов, чувствительность 61,1 %, специфичность 91,3 %), CРБ (AUC 0,693, 95 % ДИ 0,655–0,736; p < 0,0001, точка отсечения > 46,7 мг/л, чувствительность 87,0 %, специфичность 56,8 %) (рис. 2).
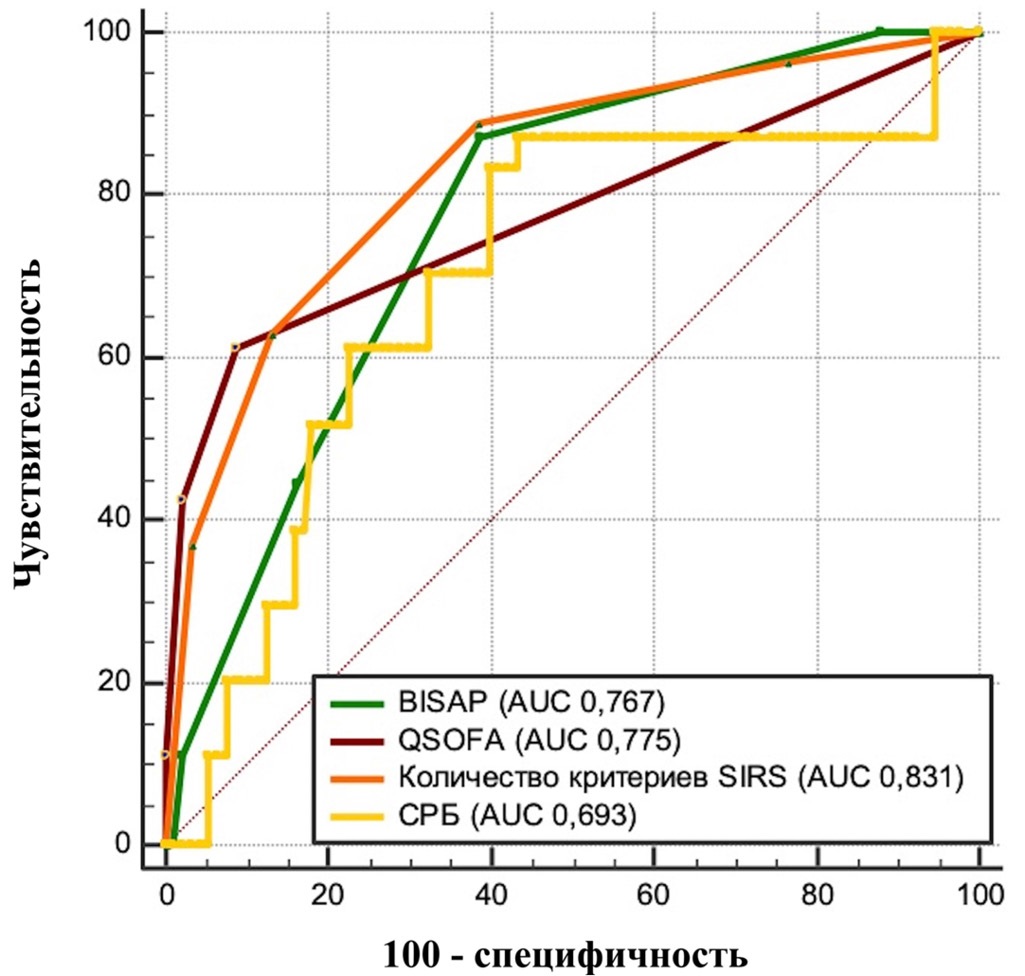
Рис. 2. Прогностическая значимость шкал по величине площади под кривой (AUC) исходя из ROC-анализа для общей когорты пациентов
Примечания: рисунок выполнен авторами. Сокращения: СРБ — С-реактивный белок, BISAP — индекс тяжести острого панкреатита (Bedside Index of Severity in Acute Pancreatitis); SIRS — синдром системной воспалительной реакции (Systemic Inflammatory Response Syndrome); qSOFA — динамическая оценка органной недостаточности (quick Sepsis-related Organ Failure Assessment).
Fig 2. Prognostic value of scales by area under the curve (AUC) based on ROC analysis for the total cohort of patients
Notes: performed by the authors. Abbreviations: СРБ — C-reactive protein; BISAP — Bedside Index of Severity in Acute Pancreatitis; SIRS — Systemic Inflammatory Response Syndrome; qSOFA — quick Sepsis-related Organ Failure Assessment.
При попарном сравнении уровень CРБ обладал статистически значимо меньшей прогностической ценностью по сравнению с критериями SIRS (p = 0,0005), qSOFA (p = 0,01), BISAP (p = 0,03). Статистически незначимой оказалась разница между прогностической способностью BISAP и qSOFA (табл. 4).
Таблица 4. Попарное сравнение методов прогнозирования в общей когорте
Table 4. Pairwise comparison of prognostic methods in the overall cohort
Параметр | qSOFA | Критерии SIRS | СРБ |
BISAP | p = 0,3 | p = 0,04 | p = 0,03 |
qSOFA | - | p = 0,03 | p = 0,01 |
Критерии SIRS | - | - | p = 0,0005 |
Примечания: таблица составлена авторами. Сокращения: СРБ — С-реактивный белок, BISAP — индекс тяжести острого панкреатита (Bedside Index of Severity in Acute Pancreatitis); SIRS — синдром системной воспалительной реакции (Systemic Inflammatory Response Syndrome); qSOFA — динамическая оценка органной недостаточности (quick Sepsis-related Organ Failure Assessment).
Notes: performed by the authors. Abbreviations: СРБ — C-reactive protein; BISAP — Bedside Index of Severity in Acute Pancreatitis; SIRS — Systemic Inflammatory Response Syndrome; qSOFA — quick Sepsis-related Organ Failure Assessment.
Таким образом, хорошей прогностической значимостью в оценке риска летального исхода ОП для всей когорты обладают критерии SIRS (AUC > 0,8). Меньшей, но, тем не менее, удовлетворительной прогностической ценностью обладают шкалы qSOFA и BISAP (AUC 0,7–0,8). Наихудшим инструментом оценки вероятности неблагоприятного исхода является определение уровня СРБ при поступлении (AUC < 0,7).
Однако результаты изменились при субанализе подгрупп, разделенных по этиологии ОП.
При ОП алкогольно-алиментарного генеза лучшей прогностической ценностью обладала шкала qSOFA (AUC 0,874, 95 % ДИ 0,831–0,909; p < 0,0001, точка отсечения была больше нуля баллов, чувствительность 80,0 %, специфичность 91,2 %).
Площадь под кривой для критерия SIRS составила 0,842 (95 % ДИ 0,796–0,88; p < 0,0001, точка отсечения критерия численно была больше двух критериев, чувствительность 84,0 %, специфичность 87,0 %).
Для шкалы BISAP площадь под кривой равна 0,829 (95 % ДИ 0,783–0,869; p < 0,0001, точка отсечения была больше одного балла, чувствительность 100,0 %, специфичность 64,8 %),
Для концентрации СРБ площадь под кривой равна 0,785 (95 % ДИ 0,735–0,830; p < 0,0001, точка отсечения была больше концентрации, равной 112,5 мг/л, чувствительность 100,0 %, специфичность 63,0 %) (рис. 3).
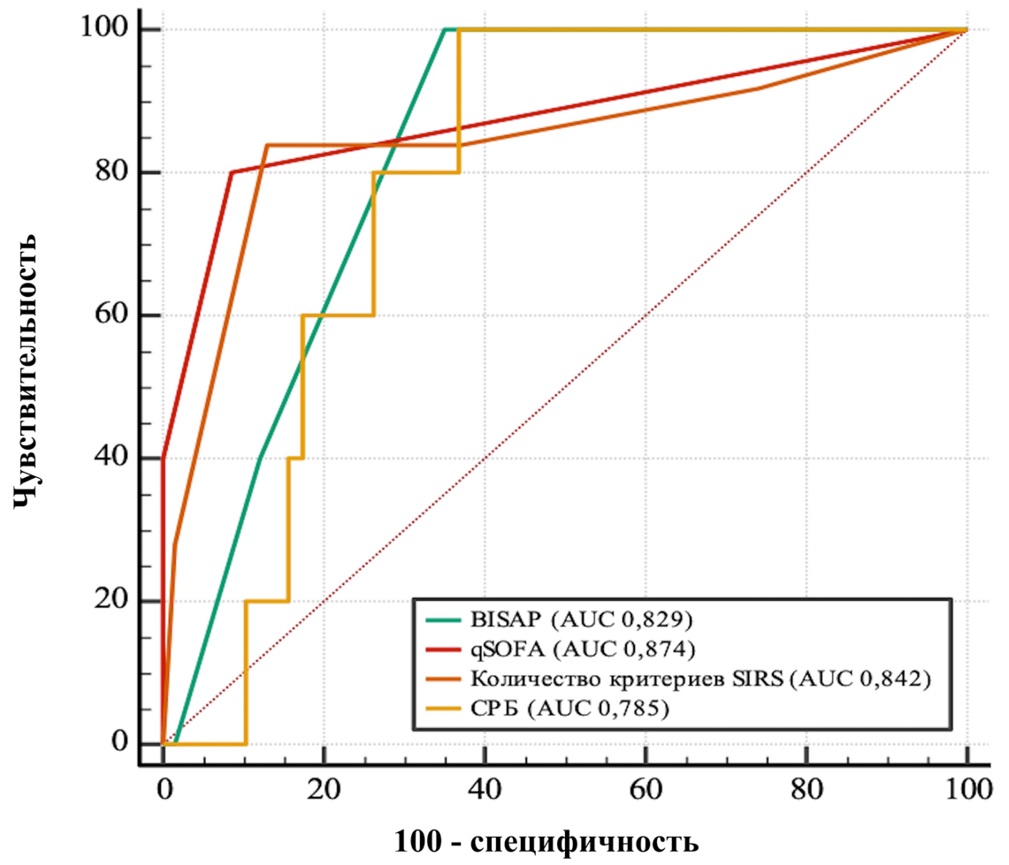
Рис. 3. Прогностическая значимость шкал по величине площади под кривой (AUC) исходя из ROC-анализа в подгруппе алкогольно-алиментарного генеза
Примечания: рисунок выполнен авторами. Сокращения: Сокращения: СРБ — С-реактивный белок, BISAP — индекс тяжести острого панкреатита (Bedside Index of Severity in Acute Pancreatitis); SIRS — синдром системной воспалительной реакции (Systemic Inflammatory Response Syndrome); qSOFA — динамическая оценка органной недостаточности (quick Sepsis-related Organ Failure Assessment).
Fig. 3. Prognostic value of scales by area under the curve (AUC) based on ROC analysis for the subgroup of patients with alcoholic-alimentary pancreatitis
Notes: performed by the authors. Abbreviations: СРБ — C-reactive protein; BISAP — Bedside Index of Severity in Acute Pancreatitis; SIRS — Systemic Inflammatory Response Syndrome; qSOFA — quick Sepsis-related Organ Failure Assessment.
При попарном сравнении шкала qSOFA обладает статистически более значимой прогностической ценностью по сравнению с уровнем СРБ (p = 0,004). Других статистически значимых различий при сравнении не получено.
В случае билиарного панкреатита критерии SIRS обеспечивают более точное прогнозирование (AUC 0,857, 95 % ДИ 0,796–0,905; p < 0,0001, точка отсечения была больше одного критерия, чувствительность 100,0 %, специфичность 63,1 %).
Меньшей ценностью обладает BISAP (AUC 0,705, 95 % ДИ 0,632–0,772; p < 0,0001, точка отсечения была больше одного балла, чувствительность 74,1 %, специфичность 57,1 %).
Для шкалы qSOFA: AUC 0,706, 95 % ДИ 0,633–0,772; p < 0,0001, точка отсечения была больше одного балла, чувствительность 48,2 %, специфичность 93,3 %.
В то же время уровень CРБ обладал наименьшей прогностической значимостью, при этом вовсе не достигая статистической значимости (AUC 0,626, 95 % ДИ 0,550–0,698; p = 0,089, точка отсечения была больше концентрации в 63,6 мг/л, чувствительность 74,1 %, специфичность 67,8 %) (рис. 4).
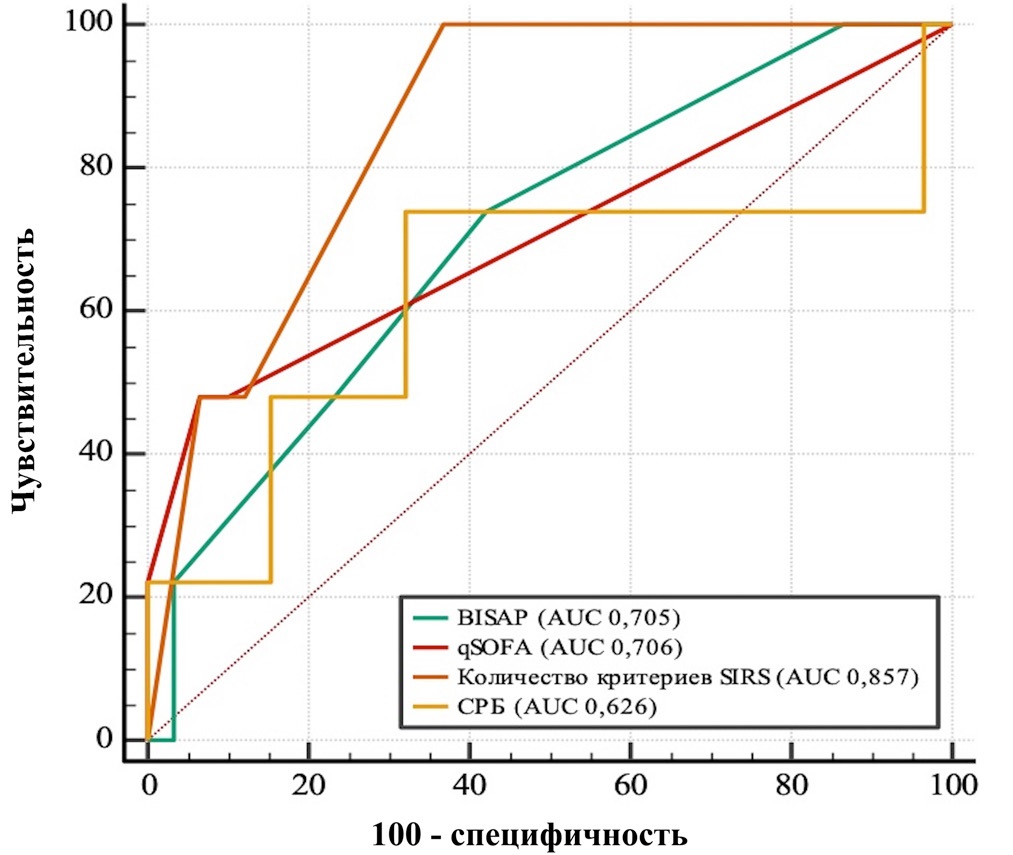
Рис. 4. Прогностическая значимость шкал по величине площади под кривой (AUC) исходя из ROC-анализа в подгруппе билиарного панкреатита
Примечания: рисунок выполнен авторами. Сокращения: СРБ — С-реактивный белок, BISAP — индекс тяжести острого панкреатита (Bedside Index of Severity in Acute Pancreatitis); SIRS — синдром системной воспалительной реакции (Systemic Inflammatory Response Syndrome); qSOFA — динамическая оценка органной недостаточности (quick Sepsis-related Organ Failure Assessment).
Fig. 4. Prognostic value of scales by area under the curve (AUC) based on ROC analysis for the subgroup of patients with biliary pancreatitis
Notes: performed by the authors. Abbreviations: СРБ — C-reactive protein; BISAP — Bedside Index of Severity in Acute Pancreatitis; SIRS — Systemic Inflammatory Response Syndrome; qSOFA — quick Sepsis-related Organ Failure Assessment.
В ходе попарного сравнения критерии SIRS демонстрируют статистически подтвержденную более высокую прогностическую значимость по сравнению с BISAP (p = 0,010) и qSOFA (p = 0,009) и уровнем СРБ (p < 0,001). В то же время различия между BISAP и qSOFA не имеют статистической значимости.
Для травматического ОП только критерии SIRS показали более точные прогностические результаты SIRS (AUC 0,700, 95 % ДИ 0,494–0,860; p = 0,014, точка отсечения была больше или равна одному критерию, чувствительность 100,0 %, специфичность 60,0 %).
Остальные шкалы, BISAP, qSOFA и уровень CРБ, не продемонстрировали прогностической значимости в данном исследовании (рис. 5).
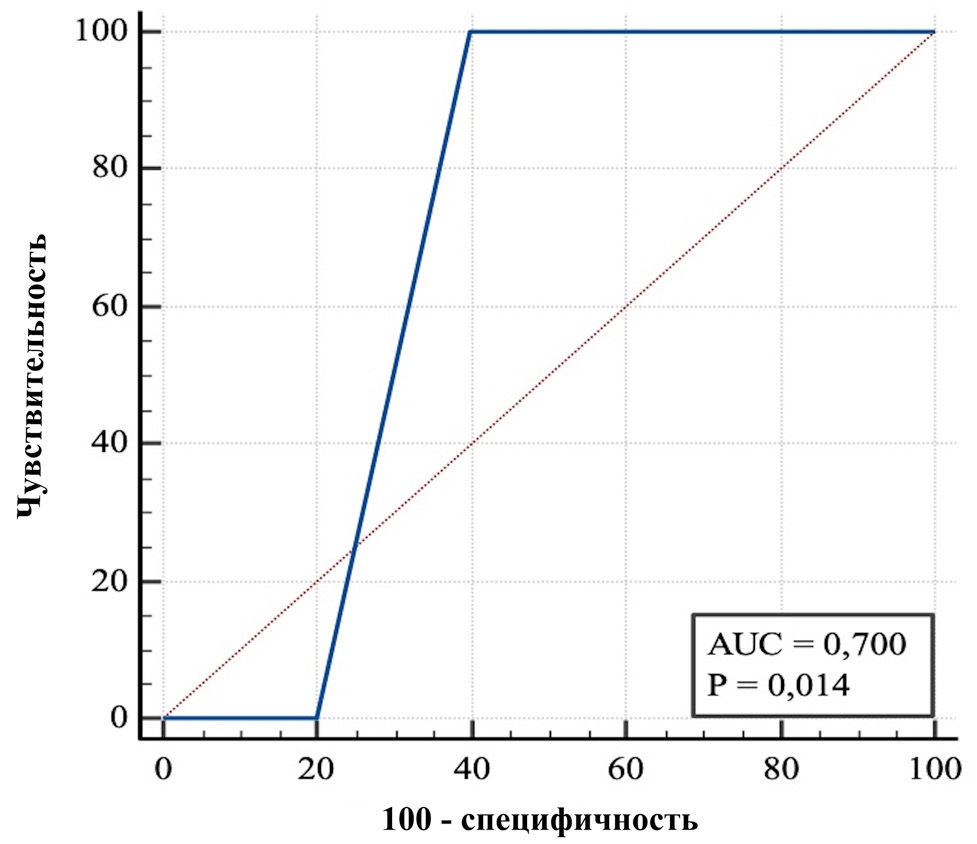
Рис. 5. ROC-кривая для критериев SIRS
Примечания: рисунок выполнен авторами. Сокращения: SIRS — синдром системной воспалительной реакции (Systemic Inflammatory Response Syndrome).
Fig. 5. ROC curve for SIRS criteria
Notes: performed by the authors. Abbreviation: SIRS — Systemic Inflammatory Response Syndrome.
Дополнительные результаты исследования
Дополнительных результатов в ходе исследования выявлено не было.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Полученные результаты подчеркивают, что различные этиологические факторы ОП ассоциированы с разными прогностическими маркерами. В то время как критерии SIRS показали наилучшие прогностические характеристики в общей выборке, а также в группах билиарного и травматического панкреатита, для алкогольно-алиментарного фактора наиболее информативной оказалась шкала qSOFA.
Ограничения исследования
Исследование является одноцентровым и ретроспективным, что не позволило оценить роль инструментов прогнозирования, включающих в себя параметры, не входящие в рутинную клиническую практику центра и требующие проведения проспективного исследования. Полученные для травматического панкреатита данные ограничены малым количеством наблюдений.
Интерпретация результатов исследования
Панкреатит — широко распространенное по всему миру заболевание, которое ежегодно диагностируется приблизительно у 13 миллионов человек [14]. Желчнокаменная болезнь наряду с алкогольно-алиментарным фактором являются ведущими причинами ОП. В последние годы заболеваемость ОП возросла вследствие увеличения случаев злоупотребления алкоголем и ожирения по всему миру [15].
Систематический обзор исследований, проведенных в 51 стране Европы с 1989 по 2015 год, показал, насколько вариабельна может быть этиология ОП в зависимости от региона. В Южной Европе основной причиной ОП выступает желчнокаменная болезнь. При этом в Восточной Европе, включая Россию, больше распространен алкогольно-алиментарный фактор, что соотносится с этиологической структурой нашего исследования, где 59,8 % случаев приходится на данную причину [16]. Общая летальность при ОП варьирует от 3 до 10 % [17].
В рамках проведенного исследования общий уровень летальности среди анализируемой группы достиг 10,4 %, что, вероятно, связано с большим количеством тяжелых форм ОП (24,8 %). По данным литературы, ОП приобретает тяжелое течение в 20 % случаев, причем летальность в этой группе пациентов варьирует от 10 до 30 % [18]. Многочисленные эпидемиологические исследования показали очень противоречивые данные о летальности при различной этиологии в зависимости от географического региона [19]. В некоторых работах летальность оказалась выше в случаях билиарного панкреатита [20][21], что связывают c более частым развитием тяжелых форм ОП при билиарной этиологии [22]. Ряд исследований, напротив, показал большее количество летальных исходов при алкогольной этиологии ОП [23][24], а некоторые исследователи вообще не обнаружили достоверной разницы [25, 26].
Результаты представленного исследования также показывают, что смертность при ОП зависит от его причины. Наибольшее число летальных исходов было зарегистрировано при билиарном ОП, что составило 15,3 %, при этом в группе алкогольно-алиментарного ОП зарегистрировано практически в 2 раза меньше летальных исходов — 8,1 %, а при травматической этиологии — 7,4 %. Это подчеркивает важность этиологического фактора в прогнозировании исходов заболевания (табл. 2).
Исследователи заявляют о том, что в значительной части клинических случаев этиология ОП остается неизвестной [21][24]. Соответственно, и оценить вклад этиологии очень сложно, что и является, вероятно, причиной противоречивых данных литературы. Согласно классификации Атланта-2012, ОП подразделяется на три подтипа в зависимости от степени тяжести заболевания: легкий, среднетяжелый и тяжелый [5]. У 20 % пациентов с ОП наблюдается тяжелое течение заболевания [27]. Наши результаты, включающие данные 512 пациентов, продемонстрировали, что в 24,8 % случаев ОП приобретал тяжелый вариант течения. Уровень смертности при ОП составляет от 3 до 10 %, однако уровень смертности при тяжелых формах ОП резко увеличивается и достигает от 36 до 50 % [2][28]. Если нет адекватного лечения при легкой форме заболевания, ОП может приобрести тяжелое течение. Многочисленные исследования в области ОП, проведенные в последние десятилетия, демонстрируют, что первые 24 часа с момента проявления симптомов имеют определяющее значение в выявлении пациентов, подверженных риску осложнений или летального исхода. Определение этих подгрупп пациентов играет важную роль в разработке различных стратегий по снижению смертности [17]. Однако, несмотря на чрезвычайную важность раннего прогнозирования тяжести ОП, до сих пор точные и надежные диагностические и прогностические предикторы ОП не были установлены.
Существует обширный набор многофакторных систем оценки и биохимических маркеров, используемых для прогнозирования неблагоприятного исхода. Проведен ретроспективный анализ прогностической ценности таких шкал, как qSOFA, BISAP, критерии SIRS, а также уровень СРБ в общей когорте, а также в подгруппах по этиологии.
В исследованиях qSOFA хорошо зарекомендовала себя в качестве инструмента прогнозирования перевода пациента в ОРИТ (AUC 0,730, 95 % ДИ 0,579–0,881; p = 0,002) и развития полиорганной недостаточности (AUC 0,799, 95 % ДИ 0,566–1,000; p = 0,013), что является совершенно логичным, поскольку представляемые шкалой органные нарушения требуют лечения в отделении интенсивной терапии. Однако прогнозирование летальности в этих же исследованиях было представлено шкалой хуже и оказалось статистически не значимо (AUC 0,708, 95 % ДИ 0,393–1,000; p = 0,155) [28][29]. В проведенном исследовании qSOFA хорошо себя зарекомендовала для прогноза неблагоприятного исхода исключительно алкогольно-алиментарного генеза (AUC 0,874, 95 % ДИ 0,831–0,909; p < 0,0001). Важно учитывать, что прогностические свойства qSOFA неспецифичны и не относятся к течению ОП, а отражают лишь вклад органной дисфункции в риск неблагоприятного исхода. qSOFA является инструментом общего назначения [30]. Именно отсутствие специфичности является главным недостатком этой шкалы для возможности раннего прогноза тяжести течения ОП, что подтвердилось низкой прогностической значимостью для других форм ОП.
В 2008 году для прогноза тяжести ОП и неблагоприятного исхода был предложен индекс BISAP. Он был описан как простой инструмент для определения прогноза при ОП [30]. Эффективность шкалы BISAP в прогнозировании тяжелого ОП была подтверждена многочисленными исследованиями [31–33]. Исследователи из Португалии рассчитали площадь под ROC-кривой при прогнозе неблагоприятного исхода с применением шкалы BISAP в случае оценки параметров при поступлении, а также через 48 часов. AUC составила 0,786 и 0,970 соответственно, что свидетельствует о том, что это менее надежный инструмент прогнозирования при использовании непосредственно в момент поступлении пациента [34]. Альтернативные исследования указывают на ограничения шкалы BISAP, обусловленные ее неэффективностью в выявлении пациентов с временным и длительным нарушением функции органов. Потенциально это может приводить к переоценке тяжести состояния [35]. Также в результатах предыдущих работ было показано, что прогностическая ценность шкалы BISAP значительно улучшается в комбинации с другими маркерами и системами прогнозирования [36]. Однако это ограничение значительно затрудняет ее рутинное применение. Результаты нашего исследования показали невысокую ценность шкалы. В общей когорте площадь под кривой (AUC) для BISAP составила 0,770. При этом статистически незначимой оказалась разница между возможностями BISAP и qSOFA. В группе травматического панкреатита индекс BISAP вовсе оказался неинформативен, что накладывает ограничение на его широкое применение при различной этиологии.
Еще одним простым и широко используемым инструментом прогнозирования исхода при ОП являются критерии SIRS [37]. Однако критерии SIRS, как и прочие многофакторные системы, отражают системные расстройства и не зарекомендовали себя для раннего прогнозирования летального исхода. В сравнении с имеющимися шкалами критерии SIRS обладают низкой прогностической ценностью. Как показало исследование [38], способность критериев SIRS прогнозировать неблагоприятный исход далека от идеальной. Ряд исследований показал, что SIRS имеет среднюю эффективность с самой низкой площадью под кривой в прогнозировании тяжелого ОП, панкреонекроза и инфицированного панкреонекроза, что, в свою очередь, объясняет его слабую прогностическую значимость в оценке риска летальности [39].
СРБ — еще один маркер, который широко используется в исследованиях в качестве метода прогноза или оцениваемого исхода. Во многих имеющихся исследованиях СРБ включался как прогностический маркер. В настоящее время принято считать, что уровень СРБ выше 150 мг/дл через 48 ч после поступления позволяет прогнозировать тяжелое течение заболевания [17]. N. Farkas et al. (2019) провели многоцентровое исследование для оценки роли СРБ как инструмента прогнозирования неблагоприятного исхода и пришли к выводу, что уровень СРБ при госпитализации имеет слабую связь с летальностью и тяжестью ОП. Работа показала, что средний уровень СРБ в течение 24 часов после начала симптомов был значительно ниже при легкой форме (8,90 мг/л), чем при среднетяжелой (14,60 мг/л), и тяжелой (51,45 мг/л) (p = 0,006 при сравнении легкий/средней тяжести; p < 0,001 при сравнении легкий/тяжелый; p = 0,059 при сравнении средней тяжести/тяжелый). Однако прогностическая ценность в плане оценки риска летальности и тяжести была далека от совершенства (AUC 0,741, 95 % ДИ 0,627–0,854). Определение максимального уровня СРБ также не позволяло прогнозировать летальность и тяжесть ОП [40]. Несмотря на простоту применения в клинической практике, этот маркер воспаления имеет такие значимые недостатки, как: поздний пик (от 48 до 72 часов) и неспецифичность [41]. Более того, значительно отличались дефиниции ОП и подходы к оценке тяжести и лечению. Современные исследования по оценке СРБ в прогнозировании при ОП включают малое количество пациентов, что ограничивает их ценность. Не так много работ оценивали роль СРБ в прогнозировании при ОП после широкого внедрения Атлантской классификации [13][42]. С учетом того, что, согласно данным литературы, пик СРБ отмечается на 3-и сутки развития ОП [42], ценность результатов представляется сомнительной.
Таким образом, мы видим, что имеющиеся методы обладают невысокой прогностической ценностью, являются малоспецифичными маркерами, а также не учитывают этиологию развития ОП. Применяемые на современном этапе маркеры и системы являются отражением системного воспалительного ответа при ОП, что подчеркивает его безусловную важность в патогенезе. Тем не менее противоречивые результаты, полученные в нашем и других исследованиях, свидетельствуют о том, что это далеко не определяющее звено патогенеза. Вопрос об оптимальном комплексном подходе к диагностике и прогнозе при ОП остается открытым.
ЗАКЛЮЧЕНИЕ
Несмотря на многочисленные исследования патофизиологии ОП, общая смертность от заболевания существенно не улучшилась. Поэтому важны ранняя диагностика и своевременная оценка тяжести. Однако идеальная многофакторная система оценки и/или биохимический маркер для ранней оценки тяжести ОП еще не найдены. Важно отметить, что определение прогноза исхода ОП, основанное на органной дисфункции, а не на патофизиологических процессах, лежащих в основе их развития, — главный недостаток имеющихся шкал. Инструменты оценки риска обладают неодинаковой ценностью при различной этиологии ОП, что необходимо учитывать при прогнозировании риска. Различные этиологические формы имеют общий патогенез, а все имеющиеся системы оценки приводят к разным результатам прогнозирования. Это говорит о том, что необходимо определить маркеры, основанные на патогенезе, позволяющие одинаково для всех этиологических форм ОП в максимально ранние сроки определить прогноз. Крайне важно спланировать и провести крупные многоцентровые исследования для определения параметров, позволяющих создать многофакторные шкалы или выявить биомаркеры для прогнозирования тяжести ОП и мониторинга прогрессирования заболевания, которые можно будет использовать рутинно.
1. Министерство здравоохранения Российской Федерации. Острый панкреатит. Клинические Рекомендации. 2020 г. Available: https://cr.minzdrav.gov.ru/recomend/326_4
Список литературы
1. Peery AF, Crockett SD, Murphy CC, Jensen ET, Kim HP, Egberg MD, Lund JL, Moon AM, Pate V, Barnes EL, Schlusser CL, Baron TH, Shaheen NJ, Sandler RS. Burden and Cost of Gastrointestinal, Liver, and Pancreatic Diseases in the United States: Update 2021. Gastroenterology. 2022;162(2):621–644. https://doi.org/10.1053/j.gastro.2021.10.017
2. Silva-Vaz P, Abrantes AM, Castelo-Branco M, Gouveia A, Botelho MF, Tralhão JG. Murine Models of Acute Pancreatitis: A Critical Appraisal of Clinical Relevance. Int J Mol Sci. 2019;20(11):2794. https://doi.org/10.3390/ijms20112794
3. Saluja A, Dudeja V, Dawra R, Sah RP. Early Intra-Acinar Events in Pathogenesis of Pancreatitis. Gastroenterology. 2019;156(7):1979–1993. https://doi.org/10.1053/j.gastro.2019.01.268
4. Gukovskaya AS, Gukovsky I, Algül H, Habtezion A. Autophagy, Inflammation, and Immune Dysfunction in the Pathogenesis of Pancreatitis. Gastroenterology. 2017;153(5):1212–1226. https://doi.org/10.1053/j.gastro.2017.08.071
5. Chen C, Huang Z, Li H, Song B, Yuan F. Evaluation of extrapancreatic inflammation on abdominal computed tomography as an early predictor of organ failure in acute pancreatitis as defined by the revised Atlanta classification. Medicine (Baltimore). 2017;96(15):e6517. https://doi.org/10.1097/MD.0000000000006517
6. Leppäniemi A, Tolonen M, Tarasconi A, Segovia-Lohse H, Gamberini E, Kirkpatrick AW, Ball CG, Parry N, Sartelli M, Wolbrink D, van Goor H, Baiocchi G, Ansaloni L, Biffl W, Coccolini F, Di Saverio S, Kluger Y, Moore E, Catena F. 2019 WSES guidelines for the management of severe acute pancreatitis. World J Emerg Surg. 2019;14:27. https://doi.org/10.1186/s13017-019-0247-0
7. Ong Y, Shelat VG. Ranson score to stratify severity in Acute Pancreatitis remains valid — Old is gold. Expert Rev Gastroenterol Hepatol. 2021;15(8):865–877. https://doi.org/10.1080/17474124.2021.1924058
8. Evans L, Rhodes A, Alhazzani W, Antonelli M, Coopersmith CM, French C, Machado FR, Mcintyre L, Ostermann M, Prescott HC, Schorr C, Simpson S, Wiersinga WJ, Alshamsi F, Angus DC, Arabi Y, Azevedo L, Beale R, Beilman G, Belley-Cote E, Burry L, Cecconi M, Centofanti J, Coz Yataco A, De Waele J, Dellinger RP, Doi K, Du B, Estenssoro E, Ferrer R, Gomersall C, Hodgson C, Hylander Møller M, Iwashyna T, Jacob S, Kleinpell R, Klompas M, Koh Y, Kumar A, Kwizera A, Lobo S, Masur H, McGloughlin S, Mehta S, Mehta Y, Mer M, Nunnally M, Oczkowski S, Osborn T, Papathanassoglou E, Perner A, Puskarich M, Roberts J, Schweickert W, Seckel M, Sevransky J, Sprung CL, Welte T, Zimmerman J, Levy M. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock 2021. Crit Care Med. 2021;49(11):e1063–e1143. https://doi.org/10.1097/CCM.0000000000005337
9. Harimtepathip P, Lee JR, Griffith E, Williams G, Patel RV, Lebowitz D, Koochakzadeh S. Quick Sepsis-related Organ Failure Assessment Versus Systemic Inflammatory Response Syndrome Criteria for Predicting Organ Dysfunction and Mortality. Cureus. 2018;10(10):e3511. https://doi.org/10.7759/cureus.3511
10. Gupta D, Mandal NS, Arora JK, Soni RK. Comparative Evaluation of Harmless Acute Pancreatitis Score (HAPS) and Bedside Index of Severity in Acute Pancreatitis (BISAP) Scoring System in the Stratification of Prognosis in Acute Pancreatitis. Cureus. 2022;14(12):e32540. https://doi.org/10.7759/cureus.32540
11. Bastian B, Sari I, Pratama FP. Analysis of C-Reactive Protein (CRP) Levels in Venous and Capillary Blood Samples with Immunoturbidimetric Methods. Medicra (Journal of Medical Laboratory Science/Technology). 2022;5(1):1–5. http://dx.doi.org/10.21070/medicra.v5i1.1622
12. Kuzovlev AN, Yadgarov MYa, Berikashvili LB, Ryabova EV, Goncharova DD, Perehodov SN, Likhvantsev VV. Choosing the right statistical test. Russian Journal of Anesthesiology and Reanimatology. 2021;(3):88–93 (In Russ.). https://doi.org/10.17116/anaesthesiology202103188
13. Ektov VN, Khodorkovsky MA, Skorynin OS, Minakov OE. Atlanta 2012 Classification: Terminology and Definitions in the Diagnosis of Acute Pancreatitis. Journal of Experimental and Clinical Surgery. 2021;14(4):325–333 (In Russ.). http://dx.doi.org/10.18499/2070-478x-2021-14-4-325-333
14. Boxhoorn L, Voermans RP, Bouwense SA, Bruno MJ, Verdonk RC, Boermeester MA, van Santvoort HC, Besselink MG. Acute pancreatitis. Lancet. 2020;396(10252):726–734. https://doi.org/10.1016/S0140-6736(20)31310-6
15. Lee PJ, Papachristou GI. New insights into acute pancreatitis. Nat Rev Gastroenterol Hepatol. 2019;16(8):479–496. https://doi.org/10.1038/s41575-019-0158-2
16. Roberts SE, Morrison-Rees S, John A, Williams JG, Brown TH, Samuel DG. The incidence and aetiology of acute pancreatitis across Europe. Pancreatology. 2017;17(2):155–165. https://doi.org/10.1016/j.pan.2017.01.005
17. Silva-Vaz P, Abrantes AM, Castelo-Branco M, Gouveia A, Botelho MF, Tralhão JG. Multifactorial Scores and Biomarkers of Prognosis of Acute Pancreatitis: Applications to Research and Practice. Int J Mol Sci. 2020;21(1):338. https://doi.org/10.3390/ijms21010338
18. Olson E, Perelman A, Birk JW. Acute management of pancreatitis: the key to best outcomes. Postgraduate Medical Journal. 2019;95(1124):328–333. http://dx.doi.org/10.1136/postgradmedj-2018-136034
19. Matta B, Gougol A, Gao X, Reddy N, Talukdar R, Kochhar R, Goenka MK, Gulla A, Gonzalez JA, Singh VK, Ferreira M, Stevens T, Barbu ST, Nawaz H, Gutierrez SC, Zarnescu NO, Capurso G, Easler J, Triantafyllou K, Pelaez-Luna M, Thakkar S, Ocampo C, de-Madaria E, Cote GA, Wu BU, Paragomi P, Pothoulakis I, Tang G, Papachristou GI. Worldwide Variations in Demographics, Management, and Outcomes of Acute Pancreatitis. Clin Gastroenterol Hepatol. 2020;18(7):1567–1575.e2. https://doi.org/10.1016/j.cgh.2019.11.017
20. Chen Y, Zak Y, Hernandez-Boussard T, Park W, Visser BC. The epidemiology of idiopathic acute pancreatitis, analysis of the nationwide inpatient sample from 1998 to 2007. Pancreas. 2013;42(1):1–5. https://doi.org/10.1097/MPA.0b013e3182572d3a
21. Shaka H, Asotibe JC, Achebe I, Pudasaini G. Higher Inpatient Morbidity and Mortality in Biliary Pancreatitis Compared to Hypertriglyceridemia-Induced Pancreatitis: A Nationwide Retrospective Study. Cureus. 2020 Sep 10;12(9):e10351. https://doi.org/10.7759/cureus.10351
22. Goel KS, Garg G, Singla SL. Evaluation of clinical profile of acute pancreatitis in a tertiary centre. International Surgery Journal. 2021;8(2):583. http://dx.doi.org/10.18203/2349-2902.isj20210368
23. Formanchuk T, Shaprinskiy V, Formanchuk A. Clinical and simple laboratory data associated with fatal outcomes in patients with acute pancreatitis. Acta Facultatis Medicae Naissensis. 2022;39(1):14–22. http://dx.doi.org/10.5937/afmnai39-32308
24. Bai Y, Liu Y, Jia L, Jiang H, Ji M, Lv N, Huang K, Zou X, Li Y, Tang C, Guo X, Peng X, Fang D, Wang B, Yang B, Wang L, Li Z. Severe acute pancreatitis in China: etiology and mortality in 1976 patients. Pancreas. 2007;35(3):232–237. https://doi.org/10.1097/MPA.0b013e3180654d20
25. Garcia SC, Toolis M, Ubels M, Mollah T, Paul E, Pandey A, Thia B, Wong T, Tiruvoipati R. Comparison of clinical characteristics and outcomes between alcohol-induced and gallstone-induced acute pancreatitis: An Australian retrospective observational study. SAGE Open Med. 2021;9:20503121211030837. https://doi.org/10.1177/20503121211030837
26. Samanta J, Dhaka N, Gupta P, Singh AK, Yadav TD, Gupta V, Sinha SK, Kochhar R. Comparative study of the outcome between alcohol and gallstone pancreatitis in a high-volume tertiary care center. JGH Open. 2019;3(4):338–343. https://doi.org/10.1002/jgh3.12169
27. Zhang D, Wang M, Zhang Y, Xia C, Peng L, Li K, Yin H, Li S, Yang X, Su X, Huang H. Novel insight on marker genes and pathogenic peripheral neutrophil subtypes in acute pancreatitis. Front Immunol. 2022;13:964622. https://doi.org/10.3389/fimmu.2022.964622
28. Párniczky A, Kui B, Szentesi A, Balázs A, Szűcs Á, Mosztbacher D, Czimmer J, Sarlós P, Bajor J, Gódi S, Vincze Á, Illés A, Szabó I, Pár G, Takács T, Czakó L, Szepes Z, Rakonczay Z, Izbéki F, Gervain J, Halász A, Novák J, Crai S, Hritz I, Góg C, Sümegi J, Golovics P, Varga M, Bod B, Hamvas J, Varga-Müller M, Papp Z, Sahin-Tóth M, Hegyi P; Hungarian Pancreatic Study Group. Prospective, Multicentre, Nationwide Clinical Data from 600 Cases of Acute Pancreatitis. PLoS One. 2016;11(10):e0165309. https://doi.org/10.1371/journal.pone.0165309
29. Rasch S, Pichlmeier EM, Phillip V, Mayr U, Schmid RM, Huber W, Lahmer T. Prediction of Outcome in Acute Pancreatitis by the qSOFA and the New ERAP Score. Dig Dis Sci. 2022;67(4):1371–1378. https://doi.org/10.1007/s10620-021-06945-z
30. Askim Å, Moser F, Gustad LT, Stene H, Gundersen M, Åsvold BO, Dale J, Bjørnsen LP, Damås JK, Solligård E. Poor performance of quick-SOFA (qSOFA) score in predicting severe sepsis and mortality — a prospective study of patients admitted with infection to the emergency department. Scand J Trauma Resusc Emerg Med. 2017;25(1):56. https://doi.org/10.1186/s13049-017-0399-4
31. Márta K, Lazarescu AM, Farkas N, Mátrai P, Cazacu I, Ottóffy M, Habon T, Erőss B, Vincze À, Veres G, Czakó L, Sarlós P, Rakonczay Z, Hegyi P. Aging and Comorbidities in Acute Pancreatitis I: A Meta-Analysis and Systematic Review Based on 194,702 Patients. Front Physiol. 2019;10:328. https://doi.org/10.3389/fphys.2019.00328
32. Valverde-López F, Matas-Cobos AM, Alegría-Motte C, Jiménez-Rosales R, Úbeda-Muñoz M, Redondo-Cerezo E. BISAP, RANSON, lactate and others biomarkers in prediction of severe acute pancreatitis in a European cohort. J Gastroenterol Hepatol. 2017;32(9):1649–1656. https://doi.org/10.1111/jgh.13763
33. Hagjer S, Kumar N. Evaluation of the BISAP scoring system in prognostication of acute pancreatitis — A prospective observational study. Int J Surg. 2018;54(Pt A):76–81. https://doi.org/10.1016/j.ijsu.2018.04.026
34. Silva-Vaz P, Abrantes AM, Morgado-Nunes S, Castelo-Branco M, Gouveia A, Botelho MF, Tralhão JG. Evaluation of Prognostic Factors of Severity in Acute Biliary Pancreatitis. Int J Mol Sci. 2020;21(12):4300. https://doi.org/10.3390/ijms21124300
35. Kim TY, Kim SJ, Kim YS, Lee JW, Park EJ, Lee SJ, Lee KJ, Cha YS. Delta neutrophil index as an early predictive marker of severe acute pancreatitis in the emergency department. United European Gastroenterol J. 2019;7(4):488–495. https://doi.org/10.1177/2050640619838359
36. Han T, Cheng T, Liao Y, Lai Q, Tang S, Liu B, He Y, Lei C, Cao Y, Cao Y. Thrombo-Inflammatory Prognostic Scores Improve BISAP-Based Risk Stratification in Acute Pancreatitis Patients: A Retrospective Cohort Study. J Inflamm Res. 2022;15:3323–3335. https://doi.org/10.2147/JIR.S366246
37. Jain S, Midha S, Mahapatra SJ, Gupta S, Sharma MK, Nayak B, Jacob TG, Shalimar, Garg PK. Interleukin-6 significantly improves predictive value of systemic inflammatory response syndrome for predicting severe acute pancreatitis. Pancreatology. 2018;18(5):500–506. https://doi.org/10.1016/j.pan.2018.05.002
38. Laudari U, Thapa A, Bohara TP, Rupakheti S, Joshi MR. Early identification of patients at risk of acute severe pancreatitis with Systemic Inflammatory Response Syndrome score at admission. Journal of Kathmandu Medical College. 2019;8(2):92–95. http://dx.doi.org/10.3126/jkmc.v8i2.28171
39. Li M, Xing XK, Lu ZH, Guo F, Su W, Lin YJ, Wang DH. Comparison of Scoring Systems in Predicting Severity and Prognosis of Hypertriglyceridemia-Induced Acute Pancreatitis. Dig Dis Sci. 2020 Apr;65(4):1206–1211. https://doi.org/10.1007/s10620-019-05827-9
40. Farkas N, Hanák L, Mikó A, Bajor J, Sarlós P, Czimmer J, Vincze Á, Gódi S, Pécsi D, Varjú P, Márta K, Hegyi PJ, Erőss B, Szakács Z, Takács T, Czakó L, Németh B, Illés D, Kui B, Darvasi E, Izbéki F, Halász A, Dunás-Varga V, Gajdán L, Hamvas J, Papp M, Földi I, Fehér KE, Varga M, Csefkó K, Török I, Hunor-Pál F, Mickevicius A, Maldonado ER, Sallinen V, Novák J, Ince AT, Galeev S, Bod B, Sümegi J, Pencik P, Szepes A, Szentesi A, Párniczky A, Hegyi P. A Multicenter, International Cohort Analysis of 1435 Cases to Support Clinical Trial Design in Acute Pancreatitis. Front Physiol. 2019;10:1092. https://doi.org/10.3389/fphys.2019.01092
41. Párniczky A, Lantos T, Tóth EM, Szakács Z, Gódi S, Hágendorn R, Illés D, Koncz B, Márta K, Mikó A, Mosztbacher D, Németh BC, Pécsi D, Szabó A, Szücs Á, Varjú P, Szentesi A, Darvasi E, Erőss B, Izbéki F, Gajdán L, Halász A, Vincze Á, Szabó I, Pár G, Bajor J, Sarlós P, Czimmer J, Hamvas J, Takács T, Szepes Z, Czakó L, Varga M, Novák J, Bod B, Szepes A, Sümegi J, Papp M, Góg C, Török I, Huang W, Xia Q, Xue P, Li W, Chen W, Shirinskaya NV, Poluektov VL, Shirinskaya AV, Hegyi PJ, Bátovský M, Rodriguez-Oballe JA, Salas IM, Lopez-Diaz J, Dominguez-Munoz JE, Molero X, Pando E, Ruiz-Rebollo ML, Burgueño-Gómez B, Chang YT, Chang MC, Sud A, Moore D, Sutton R, Gougol A, Papachristou GI, Susak YM, Tiuliukin IO, Gomes AP, Oliveira MJ, Aparício DJ, Tantau M, Kurti F, Kovacheva-Slavova M, Stecher SS, Mayerle J, Poropat G, Das K, Marino MV, Capurso G, Małecka-Panas E, Zatorski H, Gasiorowska A, Fabisiak N, Ceranowicz P, Kuśnierz-Cabala B, Carvalho JR, Fernandes SR, Chang JH, Choi EK, Han J, Bertilsson S, Jumaa H, Sandblom G, Kacar S, Baltatzis M, Varabei AV, Yeshy V, Chooklin S, Kozachenko A, Veligotsky N, Hegyi P; Hungarian Pancreatic Study Group. Antibiotic therapy in acute pancreatitis: From global overuse to evidence based recommendations. Pancreatology. 2019;19(4):488–499. https://doi.org/10.1016/j.pan.2019.04.003
42. Vasudevan S, Goswami P, Sonika U, Thakur B, Sreenivas V, Saraya A. Comparison of Various Scoring Systems and Biochemical Markers in Predicting the Outcome in Acute Pancreatitis. Pancreas. 2018;47(1):65–71. https://doi.org/10.1097/MPA.0000000000000957
Об авторах
Л. К. ОрбелянРоссия
Орбелян Людмила Кареновна - аспирант кафедры хирургии № 3
ул. им. Митрофана Седина, д. 4, Краснодар, 350063
В. М. Дурлештер
Россия
Дурлештер Владимир Моисеевич - доктор медицинских наук, профессор, заведующий кафедрой хирургии № 3; заместитель главного врача по хирургии
ул. им. Митрофана Седина, д. 4, Краснодар, 350063
ул. Красных партизан, д. 6, к. 2, Краснодар, 350012
И. М. Быков (мл.)
Россия
Быков Илья Михайлович (мл.) - студент лечебного факультета
ул. им. Митрофана Седина, д. 4, Краснодар, 350063
Дополнительные файлы
Рецензия
Для цитирования:
Орбелян Л.К., Дурлештер В.М., Быков (мл.) И.М. Раннее прогнозирование исходов острого панкреатита разной этиологии: ретроспективное обсервационное исследование. Кубанский научный медицинский вестник. 2025;32(2):41-54. https://doi.org/10.25207/1608-6228-2025-32-2-41-54
For citation:
Orbelian L.K., Durleshter V.M., Bykov (j-r) I.M. Early prognosis of outcomes of acute pancreatitis with different etiologies: A retrospective observational study. Kuban Scientific Medical Bulletin. 2025;32(2):41-54. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-2-41-54
JATS XML








































