Перейти к:
Сравнительная оценка цитокинового профиля у пациентов детского возраста с гнездной алопецией с учетом наличия сопутствующих атопических заболеваний: обсервационное когортное поперечное исследование
https://doi.org/10.25207/1608-6228-2025-32-4-82-95
Аннотация
Введение. Гнездная алопеция — аутоиммунное заболевание волосяных фолликулов, часто ассоциирующееся с атопическими заболеваниями. Изучение цитокинового профиля при коморбидности с атопией важно для выделения ключевых иммунных механизмов и специфических иммунофенотипов. Исследование направлено на выявление иммунных различий при гнездной алопеции в зависимости от атопического статуса.
Цель исследования: оценить содержание основных провоспалительных и регуляторных цитокинов в сыворотке крови у пациентов с гнездной алопецией с учетом наличия атопических заболеваний и тяжести процесса.
Методы. Обсервационное когортное поперечное исследование проведено на базе государственного бюджетного учреждения здравоохранения города Москвы «Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения города Москвы» с участием 44 пациентов (5–17 лет) с гнездной алопецией, разделенных на 2 группы: группа 1 — пациенты без атопии (n = 17), группа 2 — с сопутствующими атопическими болезнями (n = 27). Тяжесть гнездной алопеции оценивали по шкале SALT (Severity of Alopecia Tool). Концентрация цитокинов исследована методом мультиплексного анализа (Luminex 200, набор ProcartaPlex Human Cytokine&Chemokine Panel 1A 34plex). Из 34 целевых показателей гранулоцитарно-макрофагальный колониестимулирующий фактор, интерлейкин‑1β, интрерлейкин‑15 исключены из анализа из-за отсутствия детекции у ≥20 участников. Остальные 31 показатель сравнивались между самими группами и с сопоставимой группой здорового контроля (n = 30). Оценивалась корреляция уровня концентрации цитокинов в сыворотке крови с тяжестью алопеции. Статистическая обработка данных проводилась с помощью пакетов программного обеспечения Statistica 10.0 (StatSoft, США) и Microsoft Excel 2016 (Microsoft Corporation, США). Уровень статистической значимости α = 0,05. Для расчета коэффициента корреляции (r) и его статистической значимости (p) использовался коэффициент Спирмена. Для графического изображения полученных результатов применялась программа SCImagoGraphica (SCImago LAB, Испания).
Результаты. Различия между группами 1, 2 и контролем выявлены для 18 цитокинов. В группе 2 у пациентов с атопией наблюдались различия с контролем (p < 0,005) в распределении всех цитокинов 2 -го типа иммунного ответа, цитокинов 1-го типа (интерлейкин‑2, интерлейкин‑12, фактор некроза опухоли альфа и бетта) и цитокинов Т-хелперов 17 (интерлейкины ‑21, -22, -23 и -27), кроме интерлейкина‑17 А. В группе 1 (без атопии) уровни интерлейкина‑4, интерлейкина‑9 и Eotaxin не отличались от контролей, но интерлейкин‑17 А был повышен (p = 0,007). Прямое сравнение распределения цитокинов между группами 1 и 2 не выявило статистически значимых различий ни по одному из показателей. Анализ корреляции между уровнем цитокинов у пациентов с гнездной алопецией и степенью тяжести заболевания был проведен у всех пациентов без разделения их по атопическому статусу в связи с ограниченным размером выборки в подгруппах. Уровни интерлейкинов ‑1 альфа, -10, -21, -22, -23, -27 и фактора некроза опухоли бета положительно коррелировали с тяжестью алопеции, особенно интерлейкина‑23 (r = 0,372, p = 0,008); отрицательная корреляция с показателями шкалы SALT выявлена для интерлейкина‑2 (r = –0,457, p = 0,011) и интерлейкина‑4 (r = –0,489, p = 0,006).
Заключение. Результаты подтверждают многокомпонентный и системный характер иммунных нарушений при гнездной алопеции. Цитокины профиля Т-хелперов 2, очевидно, вовлекаются в патофизиологический процесс, при этом наличие коморбидных атопических заболеваний усиливает влияние ответа Т-хелперов 2, потенциально модулируя экспрессию интерлейкина‑17A. Тяжелое течение алопеции связано с активацией медиаторов Т-хелперов 17 (кроме интерлейкина‑17A) и снижением интерлейкинов ‑2 и -4. Полученные данные обосновывают целесообразность персонализированной терапии с учетом атопического статуса и цитокинового профиля.
Ключевые слова
Для цитирования:
Потекаев Н.Н., Терещенко Г.П., Жукова О.В., Гаджигороева А.Г., Ханферьян Р.А. Сравнительная оценка цитокинового профиля у пациентов детского возраста с гнездной алопецией с учетом наличия сопутствующих атопических заболеваний: обсервационное когортное поперечное исследование. Кубанский научный медицинский вестник. 2025;32(4):82-95. https://doi.org/10.25207/1608-6228-2025-32-4-82-95
For citation:
Potekaev N.N., Tereshchenko G.P., Zhukova O.V., Gadzhigoroeva A.G., Khanferyan R.A. Comparative evaluation of cytokine profiles in pediatric alopecia areata patients considering concomitant atopic diseases: An observational cohort cross-sectional study. Kuban Scientific Medical Bulletin. 2025;32(4):82-95. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-4-82-95
ВВЕДЕНИЕ
Гнездная алопеция (ГА) представляет собой хроническое генетически детерминированное заболевание, характеризующееся иммуноопосредованным повреждением волосяных фолликулов, приводящим к стойкому или временному нерубцовому выпадению волос [1]. Основной особенностью молекулярного профиля при ГА считается доминирующее повышение уровня Th1/IFN-γ (Т-хелперы-1/интерферон-γ; англ. T helper cell1/interferon-γ), что согласуется с данными о ведущей роли этого типа иммунного ответа в инициации срыва иммунологической толерантности и активации аутовоспалительных механизмов повреждения клеток волосяной луковицы [2]. Однако наряду с Th1-цитокинами в очагах выпадения волос и в сыворотке крови выявлена гиперсекреция множества других провоспалительных медиаторов, что указывает на девиацию иммунного ответа по нескольким путям [3–5]. В настоящее время ГА рассматривается как заболевание с аутоиммунным компонентом при участии различных субпопуляций Т-лимфоцитов и связанных c ними цитокинов, однако комплексная иммунная панель при ГА до конца не изучена. При этом пересматривается роль Th1/IFN-γ как главного патогенетического медиатора, так как попытки таргетного блокирования IFN-γ при ГА не продемонстрировали терапевтической эффективности [6]. Многокомпонентный иммунный профиль подтверждают результаты успешного лечения ГА ингибиторами JAK (ингибиторы янус-киназ; англ. Janus Kinase Inhibitor), которые являются антагонистами передачи сигналов не только IFN-γ, но и ряда других цитокинов (IL-2, IL-4, IL-7, IL-9, IL-15, IL-17 (интерлейкин; англ. interleukin)), уровень которых повышен при ГА [7].
Среди коморбидных патологий при ГА выделяют болезни атопического спектра. Отчетливая взаимосвязь между этими состояниями подтверждается тем, что атопические заболевания являются наиболее частыми сопутствующими расстройствами при ГА, а также результатами молекулярно-генетических исследований [8][9]. Так, участок гена, кодирующего IL-13, играющий важную эффекторную роль в развитии атопического воспаления, был выделен как один из значимых локусов восприимчивости при ГА в общегеномной ассоциации, а мутации гена белка филаггрина у пациентов с сопутствующими атопическими заболеваниями имели выраженную связь с тяжелым течением ГА [10–12]. Причинно-следственная связь между атопией и ГА недавно была подтверждена результатами менделевской рандомизации с использованием масштабных генетических данных [13]. Согласно клинико-эпидемиологическим исследованиям атопический фон способствует неблагоприятному течению ГА, проявляющемуся в ранней манифестации, частых рецидивах и развитии распространенных форм [14]. В настоящее время активно изучается патогенетическое значение участия Th2-иммунного ответа при ГА. Влияние атопии на иммунологические механизмы ГА подтверждается положительными результатами лечения ГА дупилумабом — антагонистом рецепторов IL-4/IL-13, особенно у пациентов с высоким уровнем общего IgE (иммуноглобулин; англ. immunoglobulin) и/или сопутствующими атопическими заболеваниями [15][16]. Таким образом, изучение патогенетической гетерогенности ГА с определением ключевых иммунных механизмов и выделением определенных иммунофенотипов может иметь важное значение для разработки таргетных методов терапии с учетом персонифицированного подхода и наличия коморбидных состояний. При ГА, как и при других заболеваниях, цитокины являются главными участниками иммунопатологических процессов и рассматриваются в качестве основных мишеней для терапевтического воздействия.
Цель исследования: оценить содержание основных провоспалительных и регуляторных цитокинов в сыворотке крови у пациентов с гнездной алопецией с учетом наличия атопических заболеваний и тяжести процесса.
МЕТОДЫ
Дизайн исследования
Проведено обсервационное когортное поперечное исследование с участием 44 пациентов детского возраста (от 5 до 17 лет) с верифицированным диагнозом ГА, которые получали амбулаторную помощь в специализированном медицинском учреждении дерматологического профиля. Часть пациентов имела сопутствующие аллергические заболевания. Материалом исследования служили клинико-анамнестические данные пациентов и венозная кровь. Контрольную группу составили 30 условно здоровых доноров (дети от 5 до 17 лет, имеющие постоянную регистрацию на территории г. Москва и Московской области), которые были отобраны среди лиц, проходивших профилактические осмотры (код МКБ-10: Z04.8) (для оформления в спортивные кружки/секции и оздоровительные лагеря) в медицинском учреждении, где проводилось исследование.
Условия проведения исследования
Исследование проводилось на базе государственного бюджетного учреждения здравоохранения города Москвы «Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения города Москвы» в период с апреля 2022 по сентябрь 2024 г.
Критерии соответствия
Критерии включения
Возраст от 5 до 17 лет, верифицированные диагнозы «гнездная алопеция», «аллергический ринит/риноконъюнктивит», «бронхиальная астма», «атопический дерматит»; наличие активных проявлений перечисленных заболеваний на период исследования; отсутствие кожных, соматических и инфекционных заболеваний для опытной и контрольной групп; подписанное добровольное информированное на согласие на проведение исследования, подписанное либо самим участником (от 15 лет), либо законными представителями.
Критерии невключения
Прием системных глюкокортикостероидов и иммуносупрессивных препаратов за 3 месяца до начала и на период исследования; беременность, период лактации; отказ от подписания информированного согласия.
Критерии исключения
Отказ пациентов или их законных представителей от дальнейшего участия в исследовании.
Описание критериев соответствия (диагностические критерии)
Для всех участников исследования, за исключением контрольной группы, — наличие подтвержденных диагнозов: гнездная алопеция (коды МКБ-10: L63.0; L63.1; L63.2; L63.8), аллергический ринит/риноконъюнктивит, бронхиальная астма, атопический дерматит (коды МКБ-10: J30.1; J30.2; J30.3, J30.4; J45.0; J45.8; H10.1; L20.8), установленных на основании стандартных диагностических критериев согласно действующим федеральным клиническим рекомендациям по данным нозологиям1. При постановке диагноза учитывались клинико-анамнестические данные пациентов и сведения из медицинской документации; пациенты, имеющие аллергические заболевания, при необходимости были консультированы врачами аллергологами-иммунологами.
Подбор участников в группы
Подбор участников в исследуемые группы осуществлялся среди пациентов, обратившихся за медицинской помощью в лечебное учреждение на основании критериев соответствия. Все участники с диагнозом ГА были распределены на две группы в зависимости от наличия сопутствующих атопических заболеваний. В первую группу вошли пациенты с ГА без атопии (n = 17), вторую группу составили пациенты с сопутствующими болезнями атопического спектра (n = 27). Контрольную группу (группа 3) составили 30 условно здоровых детей (n = 30).
Целевые показатели исследования
Основной показатель исследования
Основные показатели исследования включали: содержание цитокинов в сыворотке крови выраженные в стандартных единицах измерения п/мл (пикограмм на миллилитр); различия в концентрациях цитокинов между группами пациентов с атопическими заболеваниями, без атопических заболеваний и здоровым контролем; а также коэффициенты корреляции Спирмена между уровнями цитокинов и тяжестью ГА.
Перечень анализируемых цитокинов: Eotaxin (эотаксин); GM-SCF (гранулоцитарно-макрофагальный колониестимулирующий фактор, англ. Granulocyte-macrophage Colony-stimulating Factor); GRO-α (онкоген, регулируемый ростом альфа, англ. Growth-Regulated Oncogene alpha); IFN-α; IFN-γ; IL-1RA; IL-1γ; IL-1β; IL-2; IL-4; IL-5; IL-6; IL-7; IL-8/CXCL8 (хемокиновый лиганд С–С 8, англ. C–X–C motif chemokine ligand 8); IL-9; IL-10; IL-12p70; IL-13; IL-15; IL-17A/CTLA-8 (антиген 8, ассоциированный с цитотоксическими T-лимфоцитами, англ. Cytotoxic T-lymphocyte-associated antigen 8); IL-18; IL-21; IL-22; IL-23; IL-27; IL-31; IP-10/CXCL10 (индуцируемый гамма-интерфероном белок 10, англ. interferon-inducible protein-10); MCP-1/CCL2 (моноцитарный хемотаксический протеин-1, англ. Monocyte chemoattractant protein-1/хемокин (мотив C–C) лиганд 2; англ. Chemokine (CC-motif) ligand 2); MIP-1α/CCL3 (макрофагальный воспалительный белок 1 альфа; macrophage inflammatory protein-1 alpha); MIP-1β/CCL4 (макрофагальный воспалительный белок 1 бета; macrophage inflammatory protein-1 beta); RANTES/CCL5 (Регулируемый при активации, экспрессируемый и секретируемый нормальными Т-клетками; англ. Regulated upon Activation, Normal T Cell Expressed and Secreted); SDF-1 alpha (Фактор 1 альфа, производный стромальных клеток; англ. Stromal Cell-Derived Factor 1 alpha); TNF-α (фактор некроза опухоли-альфа; англ. tumor necrosis factor-alpha); TNF-β.
Дополнительные показатели исследования
Оценка тяжести ГА согласно общепринятой шкале SALT (оценка тяжести алопеции; англ. Severity of Alopecia Tool), учитывающей площадь потери волос на скальпе [17].
Методы измерения целевых показателей
У всех участников проводился забор крови из локтевой вены с последующим центрифугированием в течение 10 минут при частоте 3000 об/мин для отделения сыворотки. Сыворотка замораживалась при температуре –20 °C до непосредственного проведения лабораторного исследования.
Для мультиплексного исследования концентрации цитокинов в сыворотке крови использовали метод мультиплексного анализа по технологии xMAP с детекцией на проточном флуориметре Luminex 200 с применением панели ProcartaPlex Human Cytokine&ChemokinePanel 1A 34plex (Invitrogen, ThermoFisher Scientific, США) в соответствии с протоколом, указанным в инструкции производителя2.
Показатель тяжести ГА SALT (%) рассчитывался по стандартизированному методу с использованием графической репрезентации скальпа и площади его поверхности. Данный метод заключается в измерении процента выпадения волос в каждой из 4 областей кожи головы: правый профиль (составляющий 18 % от общей площади кожи головы), левый профиль (18 %), макушка (40 %) и область затылка (24 %). Общее значение SALT составляет сумму процента выпадения волос для каждой области скальпа, умноженного на относительную площадь этой области, и рассчитывается по следующей формуле: SALT (%) = (R × 0,18) + (L × 0,18) + (V × 0,40) + (O × 0,24), где: R (%) — процент площади облысения в области правого профиля; L (%) — процент площади облысения в области левого профиля; V (%) — процент площади облысения в области макушки; O (%) — процент площади облысения в затылочной области [17].
Переменные (предикторы, конфаундеры, модификаторы эффекта)
К искажающим факторам, способным влиять на результаты иммунологического исследования по определению уровня цитокинов в сыворотке крови, можно отнести другие воспалительные процессы, не связанные с изучаемыми заболеваниями, такие как: инфекционные, аутоиммунные и тяжелые соматические заболевания, а также состояния беременности, лактации и применение системной иммунотерапии. Эти условия были исходно отнесены к критериям невключения.
Статистические процедуры
Принцип расчета размера выборки
Предварительный расчет выборки не проводился.
Статистические методы
Статистическая обработка данных проводилась с помощью пакетов программного обеспечения Statistica 10.0 (StatSoft, США) и Microsoft Excel 2016 (Microsoft Corporation, США). Для количественных переменных рассчитывались среднее значение (M) и стандартная ошибка среднего (m). При анализе показателей тяжести ГА также применялись такие методы описательной статистики, как медиана (Me) и межквартильный размах (IQR). При сравнении показателей между группами использовались тесты: хи-квадрат для пола, ANOVA для возраста, критерий Краскела — Уоллиса для показателя тяжести ГА (SALT). Для сравнения распределения цитокинов в выборках применялся U-критерий Манна — Уитни с избранным уровнем статистической значимости α = 0,05. Для расчета коэффициента корреляции (r) и его статистической значимости (p) использовался коэффициент Спирмена. Для проверки распределения на нормальность использовались тесты Колмогорова — Смирнова и Шапиро — Уилка. Для графического изображения полученных результатов применялась программа SCImagoGraphica (SCImago LAB, Испания).
РЕЗУЛЬТАТЫ
Формирование выборки (групп) исследования
За период исследования были отобраны 44 пациента детского возраста, имеющие заболевание «гнездная алопеция», которые соответствовали критериям включения и невключения. Исходный показатель тяжести ГА и забор крови для оценки уровня анализируемых цитокинов проводился до начала лечения. Параллельно была набрана контрольная группа, состоящая из условно здоровых детей (n = 30). На основании клинико-анамнестических данных все пациенты с ГА были разделены на две группы: в первую группу вошли 17/44 (38,6 %) пациентов только с ГА, вторую группу составили 27/44 (61,4 %) участников, имеющих ГА и атопические заболевания. Исключения участников из исследования на всех этапах не было. Блок-схема исследования представлена на рисунке 1.
Характеристики выборки (групп) исследования
Средний возраст всех пациентов с ГА в обеих группах составил 10,93 ± 0,64 года; пациентов мужского пола было 45,45 % (20/44), женского пола — 54,55 % (24/44).
При анализе основных демографических показателей, таких как пол и возраст, значения в трех группах были сопоставимы для сравнения, различия между группами были статистически не значимы (p > 0,05) (табл. 1).
Проверка распределения данных в группах на нормальность показала отклонение от нормального распределения.
Основные результаты исследования
Из числа 34 цитокинов, представленных в применяемой иммунологической панели, такие цитокины, как GM-SCF, IL-1 beta, IL-15, не удалось определить у более чем 20 участников, распределенных по всем группам, в связи с чем данные цитокины были исключены из дальнейшего сравнительного анализа.
У пациентов с ГА в обеих группах не отмечалось различий от группы контроля в распределении следующих 13 цитокинов: GRO alpha (CXCL1), IFN-alpha, IFN gamma, IL-1RA, IL-1 alpha, IL-6, IL-7, IL-18, IL-27, MIP-1 alpha (CCL3), IP-10 (CXCL10), MIP-1 beta (CCL4), SDF-1 alpha. Различия в группах 1 и 2 с контролем выявлены для 18 цитокинов (табл. 2).
Статистически значимые различия (p < 0,05) между группой 1 (пациенты с ГА, не имеющие атопических заболеваний) и контрольной группой (группа 3) были выявлены в распределении следующих 14 цитокинов: IL-2, IL-5, IL-8 (CXCL8), IL-10, IL-12p70, IL-13, IL-17A (CTLA-8), IL-21, IL-22, IL-23, IL-31, MCP-1 (CCL2), RANTES (CCL5), TNF-beta (табл. 2).
Между группой 2 (пациенты с ГА и сопутствующими атопическими заболеваниями) и контрольной группой (группа 3) значимые различия наблюдались при распределении 17 аналитов: Eotaxin (ССL11), IL-2, IL-4, IL-5, IL-8 (CXCL8), IL-9, IL-10, IL-12p70, IL-13, IL-21, IL-22, IL-23, IL-31, MCP-1 (CCL2), RANTES (CCL5), TNF-альфа, TNF-бета (табл. 2).
Прямое сравнение распределения цитокинов между группами 1 и 2 (пациенты с ГА, имеющие и не имеющие атопических заболеваний) не выявило статистически значимых различий ни по одному из анализированных показателей.
На рисунке 2 представлена графическая интерпретация распределения в группах цитокинов, имеющих статистически значимые различия.
Таким образом, у пациентов с ГА в обеих группах отмечено повышение уровня многих цитокинов, продуцируемых различными типами иммунных клеток, включая Th1, Th2 и Th17. Это свидетельствует о выраженных иммунных нарушениях при ГА, затрагивающих провоспалительные и регуляторные пути. При этом наличие сопутствующего атопического фона ассоциировано с более широким спектром иммунной дисрегуляции: количество цитокинов, уровни которых значимо отличались от контроля, было выше в группе пациентов с атопией (группа 1) по сравнению с группой без атопии (группа 1) (17 против 14 соответственно).
В группе пациентов с атопическим типом ГА зарегистрированы различия с контрольной группой в распределении практически всех Th2-медиаторов: IL-4, IL-5, IL-9, IL-10, IL-13, IL-31, а также хемокина Eotaxin/CCL11. В то же время у пациентов с ГА, не имеющих болезней атопического круга, содержание в крови IL-4, IL-9 и Eotaxin/CCL11 не отличались от здоровых контролей (p > 0,05). Это указывает на то, что при коморбидности ГА и атопии наблюдается отчетливая активация Th2-звена иммунитета.
В первой группе у пациентов с ГА без атопических болезней наблюдалось выраженное повышение уровня всех цитокинов Th17-профиля, включая IL-17A (p = 0,007). У пациентов второй группы с атопией значение IL-17A не отличалось от контрольной группы (p = 0,3), хотя отмечены значимые различия (p = 0,001) в концентрации других Th17-ассоциированных цитокинов, таких как IL-21, IL-22 и IL-23.
В обеих группах отмечались значительные различия с группой контроля (p < 0,05) в распределении Th1 цитокинов (IL-2, IL-12, TNF-бета) и хемокинов (IL-8, MCP-1/CCL2, RANTES/CCL5). Концентрация в крови TNF-α отличалась только у пациентов с атопией (p = 0,001).
Отсутствие различий в цитокиновых профилях между группой пациентов с ГА, ассоциированной с атопическими заболеваниями, и группой без атопической коморбидности при сравнении друг с другом свидетельствует об общем паттерне дисрегуляции цитокинов при ГА. В то же время, несмотря на общность основных иммунных механизмов заболевания, наличие атопического статуса накладывает определенные особенности, преимущественно в виде более выраженной активации Th2-компонента.
Анализ корреляции между уровнем цитокинов у пациентов с ГА и степенью тяжести заболевания (согласно индексу SALT) был проведен у всех пациентов с ГА (n = 44) без разделения их по атопическому статусу в связи с ограниченным размером выборки в подгруппах. 11 из 31 измеренных цитокинов были исключены из корреляционного анализа, так как их уровни не достигли порога надежного количественного определения или демонстрировали неприемлемое распределение данных для этого вида анализа. Корреляционный анализ выполнен для 20 интерлейкинов и хемокинов из представленных в используемой мультиплексной иммунологической панели: Eotaxin (CCL11), IL-1 alpha, IL-2, IL-4, IL-5, IL-8 (CXCL8), IL-9, IL-10, IL-12p70, IL-13, IL-17A (CTLA-8), IL-21, IL-22, IL-23, IL-27, IL-31, MCP-1 (CCL2), RANTES (CCL5), TNF-alpha, TNF-beta. Результаты корреляционного анализа, включая значения коэффициента корреляции (r) и уровня статистической значимости (p) для каждого из исследуемых аналитов, представлены в таблице 3.
Согласно полученным данным, достоверные различия при оценке корреляции были определены для 9 анализируемых показателей. Анализ выявил два противоположных паттерна корреляции. Уровень таких цитокинов, как IL-1-alpha, IL-10, IL-21, IL-22, IL-23, IL-27 и TNF-beta, имел положительную корреляцию с тяжестью ГА (p < 0,05), что может указывать на возможное участие этих медиаторов в процессах, связанных с прогрессированием заболевания и поддержанием хронического воспалительного процесса. Отрицательная корреляция с тяжестью ГА была выявлена для IL-2 и IL-4 (r = –0,457, p = 0,011 и r = –0,489, p = 0,006 соответственно), что может свидетельствовать о том, что данные цитокины больше активизируются на ранних стадиях заболевания, а по мере прогрессирования и хронизации патологического процесса их влияние уменьшается.
Дополнительные результаты исследования
Среднее значение показателя тяжести ГА у всех участников составило 51,63 ± 6,12 %; распределение значений SALT было не нормальным и характеризовалось значительным разбросом, что подтверждается показателями непараметрической статистики: медианой 43,50 % и межквартильным размахом 81,25 (18,75; 100,00) %. Это означает, что 50 % пациентов (от 25-го до 75-го процентиля) имели потерю волос в диапазоне от легкой (18,75 %) до тотальной/универсальной (100 %). Стратификация пациентов по степени тяжести на основе SALT выявила следующее распределение: пациентов с легкой степенью ГА (SALT < 25 %) было 36,4 % (16/44), со среднетяжелой степенью (SALT 25–49 %) — 18,2 % (8/44), с тяжелым и очень тяжелым течением ГА (SALT 50–100 %) — 45,4 % (20/44).
В 1-й группе у пациентов без атопических заболеваний SALT был равен 58,58 ± 9,06 %, медиана — 59,6 %, межквартильный размах — 75,1 (18,1; 93,2) %. Пациенты с легкой степенью ГА составили 29,5 % (5/17), с ГА средней тяжести — 17,6 % (3/17), с тяжелыми формами — 52,9 % (9/17). Таким образом, более половины пациентов в 1-й группе имели тяжелое течение алопеции.
Во 2-й группе у пациентов, имеющих сопутствующие атопические заболевания, индекс SALT составил 50,94 ± 7,35 %, медиана — 41,6, межквартильный размах 81,4 (18,6; 100,0) %. Эти данные указывают на значительную вариабельность внутри группы. Количество пациентов с легкой степенью ГА было 40,7 % (11/27), со среднетяжелой степенью — 18,6 % (5/27), с тяжелым течением ГА — 40,7 % (11/27). Проведенный статистический анализ с использованием непараметрического критерия Краскела — Уоллиса не выявил статистически значимых различий в общих показателях SALT между группой пациентов без атопических заболеваний (группа 1) и группой 2 пациентов с атопическими заболеваниями (p = 0,28).
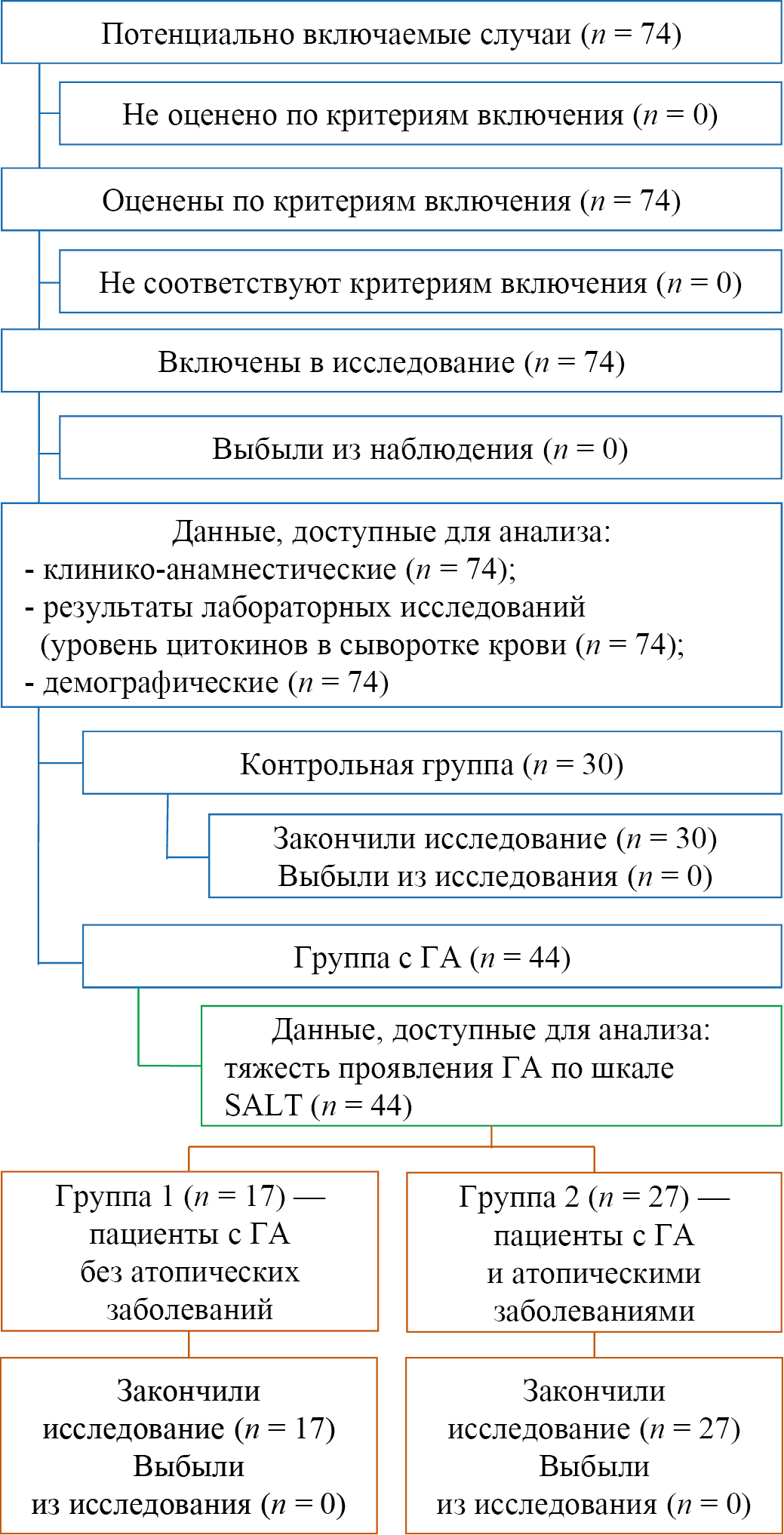
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами (согласно рекомендациям STROBE). Сокращения: ГА — гнездная алопеция; SALT — оценка тяжести алопеции.
Fig. 1. Block diagram of the study design
Note: The block diagram was created by the authors (as per STROBE recommendations). Abbreviations: ГА — alopecia areata; SALT — Severity of Alopecia Tool.
Таблица 1. Значения демографических параметров (возраст, пол) в исследуемых группах
Table 1. Demographic parameters (age and sex) of the study groups
|
Показатели |
Группа 1 (n = 17) |
Группа 2 (n = 27) |
Группа 3 (n = 30) |
Уровень значимости р |
|
Средний возраст, лет |
10,00 ± 1,14 |
11,52 ± 0,76 |
11,13 ± 0,68 |
0,62 (ANOVA) |
|
Пол: мужской (абс., %); женский (абс., %) |
8/17 (47,1 %) 9/17 (52,9 %) |
12/27 (44,4 %) 15/27 (55,6 %) |
13/30 (43,3 %) 17/30 (56,7 %) |
0,65 (хи-квадрат) |
Примечание: таблица составлена авторами.
Note: The table was compiled by the authors.
Таблица 2. Показатели оценки различий распределений цитокинов в изучаемых группах
Table 2. Measures of differences in the distributions of cytokine levels in the study groups
|
Цитокины |
Значение уровня значимости (р, Манн — Уитни) при оценке различий распределения цитокинов в группах |
||
|
Группы 1 и 2 |
Группы 1 и 3 |
Группы 2 и 3 |
|
|
Eotaxin CCL11 |
0,860 |
0,126 |
0,042* |
|
IL-2 |
0,682 |
0,001* |
0,001* |
|
IL-4 |
0,794 |
0,083 |
0,030* |
|
IL-5 |
0,469 |
0,001* |
0,001* |
|
IL-8 (CXCL8) |
0,597 |
0,008* |
0,001* |
|
IL-9 |
0,571 |
0,099 |
0,030* |
|
IL-10 |
0,668 |
0,001* |
0,001* |
|
IL-12p70 |
0,416 |
0,001* |
0,001* |
|
IL-13 |
0,735 |
0,001* |
0,001* |
|
IL-17A (CTLA-8) |
0,427 |
0,007* |
0,300 |
|
IL-21 |
0,543 |
0,001* |
0,001* |
|
IL-22 |
0,796 |
0,001* |
0,001* |
|
IL-23 |
0,656 |
0,001* |
0,001* |
|
IL-31 |
0,330 |
0,001* |
0,001* |
|
MCP-1 (CCL2) |
0,860 |
0,049* |
0,038* |
|
RANTES (CCL5) |
0,355 |
0,001* |
0,001* |
|
TNF-alpha |
0,553 |
0,119 |
0,001* |
|
TNF-beta |
0,647 |
0,001* |
0,001* |
Примечания: таблица составлена авторами; * статистическая значимость различий (p < 0,05). Сокращения: CCL — хемокин (мотив C–C) лиганд; IL — интерлейкин; CXCL — хемокиновый лиганд С–С; CTLA — антиген, ассоциированный с цитотоксическими T-лимфоцитами; MCP — моноцитарный хемотаксический протеин; RANTES — регулируемый при активации, экспрессируемый и секретируемый нормальными Т-клетками; TNF — фактор некроза опухоли.
Notes: The table was compiled by the authors; * statistical significance of differences (p < 0.05). Abbreviations: CCL — Chemokine (CC-motif) ligand; IL — interleukin; CXCL — C–X-C motif chemokine ligand; CTLA — Cytotoxic T-lymphocyte-associated antigen; MCP — Monocyte chemoattractant protein; RANTES — Regulated upon Activation, Normal T Cell Expressed and Secreted; TNF — Tumor necrosis factor.
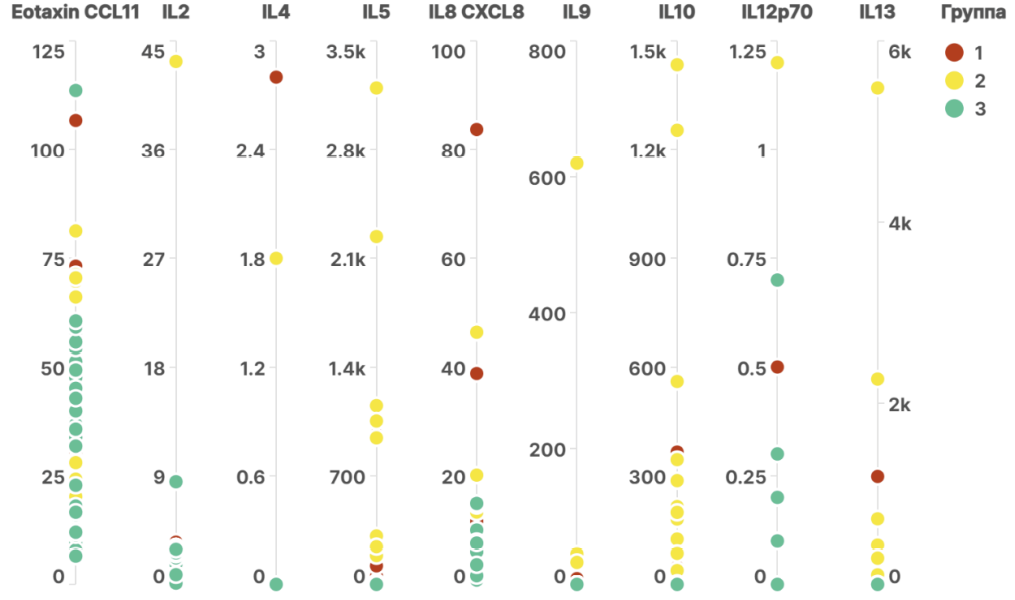
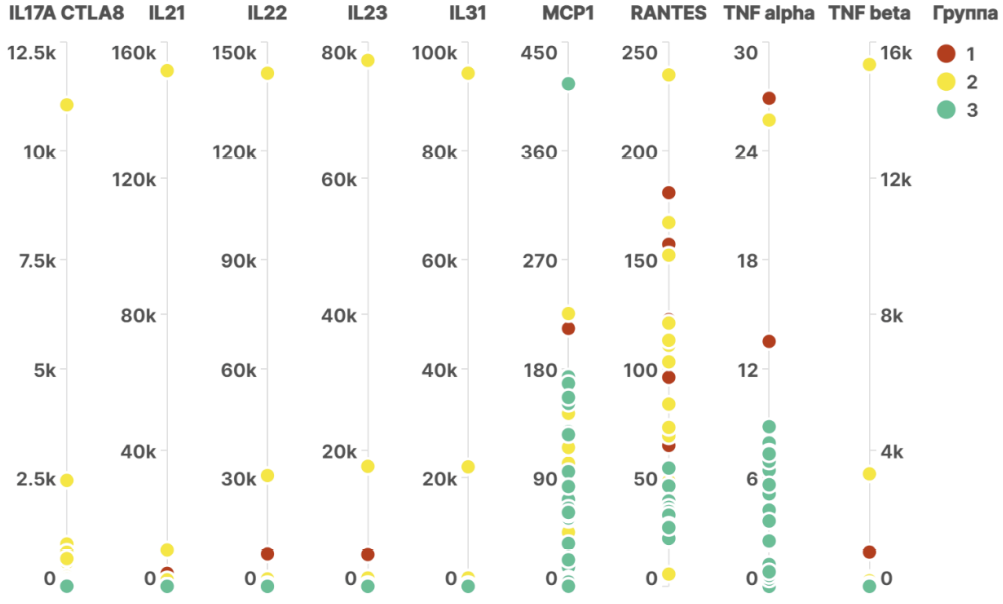
Рис. 2. Распределение цитокинов в изучаемых группах
Примечания: рисунок выполнен авторами; описание: при сравнении распределений c помощью непараметрического критерия Манна — Уитни было выявлено, что распределения представленных цитокинов в контрольной группе статистически значимо отличались от распределений, наблюдавшихся в группах 1 и 2. Сокращения: CCL — хемокин (мотив C–C) лиганд; IL — интерлейкин; CXCL — хемокиновый лиганд С–С; CTLA — антиген, ассоциированный с цитотоксическими T-лимфоцитами; MCP — моноцитарный хемотаксический протеин; RANTES — регулируемый при активации, экспрессируемый и секретируемый нормальными Т-клетками; TNF — фактор некроза опухоли.
Fig. 2. Distribution of cytokine levels in the study groups
Notes: The figure was created by the authors; description: The comparison of distributions performed using the nonparametric Mann–Whitney U test revealed that the distributions of cytokine levels in the control group were statistically significantly different from those observed in Groups 1 and 2. Abbreviations: CCL — Chemokine (CC-motif) ligand; IL — interleukin; CXCL — C–X-C motif chemokine ligand; CTLA — Cytotoxic T-lymphocyte-associated antigen; MCP — Monocyte chemoattractant protein; RANTES — Regulated upon Activation, Normal T Cell Expressed and Secreted; TNF — Tumor necrosis factor.
Таблица 3. Оценка корреляции между концентрацией цитокинов и степенью тяжести гнездной алопеции
Table 3. Analysis of the correlation between cytokine levels and the severity of alopecia areata
|
Степень тяжести ГА Цитокины |
r |
p |
n |
|
Eotaxin (CCL11) |
0,020 |
0,918 |
30 |
|
IL-1 alpha |
0,357* |
0,011 |
44 |
|
IL-2 |
-0,457* |
0,011 |
30 |
|
IL-4 |
-0,489** |
0,006 |
30 |
|
IL-5 |
0,190 |
0,186 |
44 |
|
IL-8 (CXCL8) |
0,044 |
0,817 |
30 |
|
IL-9 |
0,228 |
0,217 |
31 |
|
IL-10 |
0,285* |
0,045 |
44 |
|
IL-12p70 |
-0,216 |
0,253 |
30 |
|
IL-13 |
0,185 |
0,197 |
44 |
|
IL-17A (CTLA-8) |
0,189 |
0,188 |
44 |
|
IL-21 |
0,311* |
0,028 |
44 |
|
IL-22 |
0,297* |
0,036 |
44 |
|
IL-23 |
0,372** |
0,008 |
44 |
|
IL-27 |
0,288* |
0,043 |
44 |
|
IL-31 |
0,273 |
0,055 |
44 |
|
MCP-1 (CCL2) |
-0,130 |
0,463 |
34 |
|
RANTES (CCL5) |
-0,023 |
0,899 |
34 |
|
TNF-alpha |
0,061 |
0,730 |
34 |
|
TNF-beta |
0,329* |
0,020 |
44 |
Примечания: таблица составлена авторами; * уровень достоверности корреляции p < 0,05; ** уровень достоверности корреляции p < 0,01. Сокращения: ГА — гнездная алопеция; CCL — хемокин (мотив C–C) лиганд; IL — интерлейкин; CXCL — хемокиновый лиганд С–С; CTLA — антиген, ассоциированный с цитотоксическими T-лимфоцитами; MCP — моноцитарный хемотаксический протеин; RANTES — регулируемый при активации, экспрессируемый и секретируемый нормальными Т-клетками; TNF — фактор некроза опухоли.
Notes: The table was compiled by the authors; * correlation significance level of p < 0.05; ** correlation significance level of p < 0.01. Abbreviations: ГА — alopecia areata; CCL — Chemokine (CC-motif) ligand; IL — interleukin; CXCL — C–X-C motif chemokine ligand; CTLA — Cytotoxic T-lymphocyte-associated antigen; MCP — Monocyte chemoattractant protein; RANTES — Regulated upon Activation, Normal T Cell Expressed and Secreted; TNF — Tumor necrosis factor.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Повышение уровней Th1-, Th2- и Th17-цитокинов указывает на многокомпонентные системные иммунные нарушения при ГА. Интерлейкины и хемокины, связанные с Th2-профилем, очевидно, вовлекаются в патогенез ГА. При ассоциации ГА с атопическими заболеваниями участие Th2-иммунного ответа более выражено, что может подавлять активность IL-17A. Тяжелое течение ГА связано с активацией основных Th17-медиаторов, кроме IL-17A, при этом экспрессия IL-2 и IL-4 снижается при прогрессировании и хронизации патологического процесса.
Ограничения исследования
Ограничением данного исследования можно считать относительно небольшое число пациентов в выборке, что не позволило провести оценку корреляции уровня цитокинов с тяжестью ГА в каждой группе и могло влиять на статистические параметры.
Интерпретация результатов исследования
Интерлейкины и хемокины представляют собой пептидные соединения, которые опосредуют межклеточные взаимодействия при физиологических и патологических процессах. Для более точного понимания иммунопатологических механизмов наиболее целесообразно определение экспрессии цитокинов в очагах поражения. Однако выявление повышенного уровня цитокинов в системном кровотоке позволяет оценить степень функциональной активности различных типов иммунных клеток, а также судить о тяжести и системности патологического процесса.
В настоящее время границы нормального содержания цитокинов в сыворотке/плазме крови четко не установлены, и их значения варьируют в широких пределах в зависимости от используемых технологий определения, тест-систем и реагентов. Это обстоятельство указывает на нецелесообразность использования норм, приведенных в литературных источниках и в инструкциях производителей, и для обеспечения достоверной оценки цитокинового статуса в каждом исследовании рекомендуется формирование соответствующей контрольной группы [18][19]. В нашем исследовании уровень цитокинов у пациентов с ГА сравнивался со значениями в контрольной группе практически здоровых лиц, сопоставимой с целевой группой по основным демографическим показателям.
Текущие исследования цитокинового профиля при ГА показывают неоднозначные результаты. Так, в одних исследованиях отмечается, что при ГА наблюдается значительное повышение уровня Th1 (IFN-γ) и Th17 (IL-17) и снижение уровня Th2-цитокинов (IL-4, IL-13). Цитокины IFN-γ и IL-17 рассматриваются как инициаторы и основные участники иммунологических реакций при ГА, при этом наблюдается положительная зависимость их уровня с активностью заболевания и площадью потери волос [4][20][21]. Другие исследования указывают на то, что при ГА наблюдается активация медиаторов Th1, Th2 и IL-23 без значимого превышения уровня IL-17 [22][23]. Также приводятся данные, указывающие на то, что активная стадия ГА сопровождается гиперсекрецией Th2-интерлейкинов и хемокинов, а Th1/IFN-γ связан с хронизацией патологического процесса [5].
IL-23 представляет собой регуляторный цитокин, инициирующий активацию Т-хелперов, дифференцировку Th17-лимфоцитов и секрецию ими эффекторных провоспалительных цитокинов (TNF-α, IFN-γ, IL-17 и др.), поддерживая Th17 иммунный ответ. Результаты его определения при ГА также носят противоречивый характер: в одном исследовании IL-23 рассматривается как один из ведущих участников патогенеза ГА и потенциальный кандидат на таргетную иммуносупрессивную терапию [22], а по другим данным уровень IL-23 при ГА не отличался от контрольной группы [20].
Что касается вовлечения Th2-типа иммунного ответа, в настоящее время предполагается, что, хотя Th2-активация не является основной в патофизиологии ГА, обнаружение повышенной экспрессии Th2-медиаторов указывает на возможность выделения определенного иммунофенотипа ГА [22]. Эта концепция подтверждается значительной взаимосвязью ГА с атопическими заболеваниями, которые характеризуются иммунными нарушениями с преобладанием Th2-воспаления [24]. При ГА была выявлена гиперсекреция Th2-цитокинов, таких как IL-4, IL-5, IL-6, IL-13, CCL13, CCL17, CCL18, CCL22, CCL26; более того, IL-4, IL-13, CCL13 и CCL17 ассоциировались с тяжелым хроническим течением заболевания и плохим прогнозом ответа на терапию [25][26]. Однако на сегодняшний день не существует четкого понимания, в каких случаях цитокины Th 2-го типа при ГА играют основную патогенную роль. Активация этих медиаторов отмечена не только у пациентов с сопутствующими атопическими расстройствами, но и без атопии, особенно при распространенных формах потери волос [25][26].
В настоящем исследовании цитокины Th2-профиля также определялись у всех пациентов c ГА независимо от наличия атопических заболеваний. В группе с атопической ГА были повышены практически все исследуемые медиаторы Th2-профиля, включая ключевой цитокин IL-4, а также IL-9 и хемокин — Eotaxin/CCL11. У пациентов с ГА без атопии распределение уровней IL-4, IL-9 и Eotaxin/CCL11 не отличалось от контрольной группы. Это логично указывает на более активное вовлечение Th2-иммунного ответа у пациентов с ГА и атопическими заболеваниями. Eotaxin/CCL11 считается медиатором аллергических реакций, участвуя в привлечении Th-2-лимфоцитов, эозинофилов и базофилов в очаг воспаления. IL-9 также связан с иммунными реакциями организма в защите против паразитов и в развитии аллергического воспаления [27].
Распределение основного Th17-ассоциированного цитокина IL-17A у пациентов с атопическим типом ГА не отличалось от контрольной группы, однако наблюдались различия между группой с ГА без атопических заболеваний. Корреляция между тяжестью ГА и уровнем IL-17A в нашем исследовании не установлена. Эти данные свидетельствуют о том, что наличие атопических заболеваний может влиять на определенные иммунные пути при ГА, в частности подавляя активность IL-17A. В то же время у пациентов обеих групп выявлены различия в распределениях других цитокинов Th17-профиля (IL-21, IL-22 и IL-23), что указывает на вовлечение Th17-иммунного ответа в патогенез ГА. Более того, уровень этих цитокинов, особенно IL-23, имел положительную связь с тяжестью ГА (r = 0,372; p = 0,008). Эти данные представляют интерес в контексте сопоставления с результатами корреляции уровня цитокинов и индекса SALT. Учитывая, что уровень IL-4 продемонстрировал выраженную отрицательную корреляцию с тяжестью ГА (r = –0,489; p = 0,06), в то время как Th17-цитокины (кроме IL-17A) имели положительную связь, можно предположить, что IL-4 играет важную патогенетическую роль в активной стадии алопеции, особенно при наличии коморбидной атопической патологии, и способен модулировать некоторые провоспалительные сигналы Th17-оси. При прогрессировании и хронизации патологического процесса активация Th17-иммунного ответа увеличивается, свидетельствуя о сложных перекрестных регуляторных механизмах. Для подтверждения этих гипотез могут быть полезны дальнейшие исследования, направленные на прямое изучение механизмов действия IL-4 в отношении Th17-цитокинов и как эти взаимодействия изменяются при различных стадиях и формах алопеции, а также в зависимости от наличия атопических заболеваний. Наши результаты во многом согласуются с данными, представленными M. Suárez-Fariñas et al. [22], в которых указывается, что основными медиаторами, формирующими иммунный профиль ГА, являются цитокины, ассоциированные с Th1/Th2 лимфоцитами и IL-23.
Концентрация в сыворотке крови пациентов с ГА Th1-продуцируемых цитокинов IFN-γ и IL-15, которым отводится ведущая роль в патогенезе ГА, в нашем исследовании не отличалась от контроля. Это, возможно, объясняется их функциональной активностью именно в очагах поражения. Подтверждением участия Th1-ответа при ГА является обнаружение IL-12, который считается основным индуктором Th1-лимфоцитов. IL-23 и IL-27 также, помимо влияния на дифференцировку Th17-лимфоцитов, способствуют развитию и поддержанию Th1-иммунного ответа. Иммунная ось IL-12/23 была выделена как основная в патогенезе ряда аутоиммунных заболеваний, таких как псориаз, псориатический артрит, болезнь Крона, язвенный колит. IL-12 и IL-23 имеют общую субъединицу, что стало основой для создания биологических препаратов, нейтрализующих активность этих цитокинов. Учитывая значительную экспрессию этих медиаторов, представляются целесообразными исследования эффективности блокирования пути IL-12/23 при ГА.
Согласно полученным результатам, у всех пациентов с ГА, независимо от наличия атопических заболеваний, наблюдалось повышение уровня цитокинов IL-2, TNF и хемокинов (IL-8, MCP-1/CCL2 и RANTES/CCL5. IL-8, MCP-1/CCL2 и RANTES/CCL5), которые являются факторами привлечения многих иммунных клеток в очаг поражения. MCP-1/CCL2 вызывает секрецию активированными тучными клетками гистамина и метаболитов арахидоновой кислоты. RANTES/CCL5 выступает медиатором аллергических и клеточно-опосредованных реакций, способствуя хемотаксису моноцитов, Th1-лимфоцитов и участвуя в дегрануляции эозинофилов, синтезе гистамина и усилении выработки IgE [27].
Роль цитокинов TNF и IL-2 в патогенезе ГА отмечена во многих исследованиях [4]. Эти цитокины относят преимущественно к Th1-профилю, однако они обладают выраженными плейотропными эффектами в отношении разных типов иммунных клеток. IL-2 стимулирует клональную экспрессию активированных CD4+ и CD8+ лимфоцитов, а также модулирует экспрессию IFN-γ и основных молекул гистосовместимости, координируя процессы поддержания и подавления иммунологической толерантности [28]. Высокий уровень IL-2 при ГА дополнительно указывает на связь заболевания с Th1-профилем. В настоящем исследовании получена отрицательная корреляция между уровнем IL-2 и тяжестью ГА, что может свидетельствовать о важной роли этого цитокина в инициировании патологического процесса [29].
Известно, что цитокины TNF-семейства (TNF-α и TNF-β) имеют близкое структурное и функциональное сходство. Исследования показывают, что TNF-α оказывает выраженное антипролиферативное действие на эпителиальные клетки и кератиноциты, и его повышенный уровень при ГА коррелирует с длительностью и тяжестью заболевания [30]. Однако описаны случаи развития ГА на фоне анти-TNF-терапии [31]. Эти данные приводят к неоднозначному пониманию его значения при ГА. Возможно, TNF является посредником в каскаде иммунных реакций. Показано, что активация генов TNF-α способствует привлечению эозинофилов, тучных клеток и Th2-лимфоцитов, формируя иммунологическую среду, насыщеннуюTh2-цитокинами [32]. Кроме этого, высказана гипотеза о его потенциальной защитной роли, поскольку TNF-α способен ингибировать повышенную экспрессию молекул гистосовместимости 1-го класса (MHCI) в клетках волосяных фолликулов, которая индуцируется IFN-γ, а также подавлять активность плазматических дендритных клеток, синтезирующих IFN-γ. Таким образом, TNF, возможно, регулирует эффекты IFN-γ, в то же время способствуя нарушению цикла роста волос [33]. В данном исследовании TNF-α был повышен у пациентов с атопической ГА, подтверждая результаты, полученные N. Barahmani и соавт. [29], а TNF-β имел положительную корреляцию с тяжестью ГА.
В числе других изучаемых цитокинов мы обнаружили положительную корреляцию между IL-1 и IL-10 с тяжестью ГА. IL-1α является активным провоспалительным медиатором, способствующим активации и привлечению иммунных клеток к очагам воспаления. При ГА он рассматривается как мощный индуктор выпадения и ингибитор роста волос, а полиморфизм гена антагониста IL-1 относят к одному из маркеров восприимчивости и тяжелого течения алопеции [34]. Особый интерес вызывает увеличение уровня IL-10 у пациентов с распространенными формами ГА. IL-10 относят к одному из основных противовоспалительных цитокинов, который усиливает активность Th2-лимфоцитов, участвует в гиперпродукции IgE и ингибирует выработку Th1- и Th17-медиаторов. При ГА он рассматривается как один из факторов, поддерживающих иммунную привилегию волосяного фолликула [35]. IL-10 вырабатывается многими иммунными клетками, такими как макрофаги, тучные клетки, Т-лимфоциты, в том числе Foxp3+ регуляторные Т-клетки (Treg). Функциональная роль Foxp3+ Treg при ГА в настоящее время активно изучается в связи c их потенциальной способностью уменьшать перифолликулярный инфильтрат и восстанавливать иммунную толерантность волосяного фолликула [36]. Повышение IL-10 при увеличении степени тяжести ГА можно интерпретировать как компенсаторный ответ организма, активизирующийся по мере ухудшения состояния с целью подавления аутоиммунного воспаления.
Таким образом, несмотря на органоспецифический характер повреждения, при ГА отмечается активация многих провоспалительных и регуляторных цитокинов не только в очагах поражения, но и в периферическом кровотоке, что указывает на многокомпонентный характер иммунных нарушений с признаками системного воспалительного процесса. Как и при некоторых других хронических иммуноопосредованных дерматозах, таких как атопический дерматит и псориаз, наблюдаемая при ГА иммунная дисрегуляция может приводить к развитию целого ряда коморбидных патологий. Это подтверждается данными о частом возникновении у пациентов с ГА других аутоиммунных, атопических заболеваний, метаболических расстройств и сердечно-сосудистых нарушений [37][38]. Так, в недавнем исследовании в сыворотке крови при ГА были выделены биомаркеры, ассоциирующиеся с развитием патологии сердечно-сосудистой системы [39]. Пациенты с распространенными формами и длительным течением ГА рассматриваются как основная группа риска развития последствий системного воспаления [40].
Противоречивые результаты исследований цитокинового профиля при ГА нацеливают на выделение специфических иммунофенотипов, связанных с преимущественной активацией определенных иммунных путей. С этой целью требуется проведение кластерного анализа, включающего большое количество участников и выделяющего такие критерии, как возраст, стадия активности, длительность, тяжесть ГА, уровень IgE, наличие сопутствующих заболеваний. Для углубленного понимания иммунологических изменений, лежащих в основе патофизиологии ГА, также необходимо определение экспрессии цитокинов в очагах поражения и сопоставление их с показателями сывороточных значений. Полученные результаты могут быть полезны для разработки целевых терапевтических мишеней, влияющих на конкретные иммунные механизмы, способствуя более эффективному и безопасному лечению ГА.
ЗАКЛЮЧЕНИЕ
Проведенный в нашем исследовании сравнительный анализ распределения большого количества цитокинов в сыворотке крови у пациентов с ГА, включая пациентов, имеющих сопутствующие атопические заболевания, продемонстрировал дисрегуляцию большого количества интерлейкинов и хемокинов, ассоциированных с Th1-, Th2- и Th17-субпопуляциями лимфоцитов, что может указывать на системный и многокомпонентный характер патологического процесса. Цитокины Th2-профиля, очевидно, вовлекаются в патофизиологический процесс при ГА, что позволяет рассматривать патогенетическую обоснованность некоторых терапевтических воздействий. При ассоциации ГА с атопическими болезнями активность Th2 иммунного ответа более выражена, потенциально оказывая определенное влияние на Th17-ось. Тяжелое течение ГА, характеризующееся хронизацией патологического процесса, коррелирует с активацией Th17-ассоциированных медиаторов.
1 Российское общество дерматовенерологов и косметологов. Федеральные клинические рекомендации по ведению больных алопецией гнездной. 2015
2 ProcartaPlex™ Human Cytokine/Chemokine Convenience Panel 1A (34-Plex): user guide//Thermo Fisher Scientific. — URL: https://assets.fishersci.com/TFS-Assets/LSG/manuals/MAN0019787_ProcartaPlexHumanCytokineChemokineConveniencePanel_1A_34-Plex_UG.pdf (дата обращения: 04.03.2025).
Список литературы
1. Zhou C, Li X, Wang C, Zhang J. Alopecia Areata: an Update on Etiopathogenesis, Diagnosis, and Management. Clin Rev Allergy Immunol. 2021;61(3):403–423. https://doi.org/10.1007/s12016-021-08883-0
2. Ito T, Tokura Y. The role of cytokines and chemokines in the T-cell-mediated autoimmune process in alopecia areata. Exp Dermatol. 2014;23(11):787–791. https://doi.org/10.1111/exd.12489
3. Suchonwanit P, Kositkuljorn C, Pomsoong C. Alopecia Areata: An Autoimmune Disease of Multiple Players. Immunotargets Ther. 2021;10:299–312. https://doi.org/10.2147/ITT.S266409
4. Waśkiel-Burnat A, Osińska M, Salińska A, Blicharz L, Goldust M, Olszewska M, Rudnicka L. The Role of Serum Th1, Th2, and Th17 Cytokines in Patients with Alopecia Areata: Clinical Implications. Cells. 2021;10(12):3397. https://doi.org/10.3390/cells10123397
5. Czarnowicki T, He HY, Wen HC, Hashim PW, Nia JK, Malik K, Estrada Y, Kimmel GW, Taliercio M, Krueger JG, Guttman-Yassky E. Alopecia areata is characterized by expansion of circulating Th2/Tc2/ Th22, within the skin-homing and systemic T-cell populations. Allergy. 2018;73(3):713–723. https://doi.org/10.1111/all.13346
6. Guttman-Yassky E, Nia JK, Hashim PW, Mansouri Y, Alia E, Taliercio M, Desai PN, Lebwohl MG. Efficacy and safety of secukinumab treatment in adults with extensive alopecia areata. Arch Dermatol Res. 2018;310(8):607–614. https://doi.org/10.1007/s00403-018-1853-5
7. Потекаев Н.Н., Терещенко Г.П., Гаджигороева А.Г. Ингибиторы янус-киназ в терапии коморбидных заболеваний — атопического дерматита и гнездной алопеции: обзор литературы и опыт клинической практики. Медицинский Совет. 2024;2:44–53. https://doi.org/10.21518/ms2024-055
8. Campos-Alberto E, Hirose T, Napatalung L, Ohyama M. Prevalence, comorbidities, and treatment patterns of Japanese patients with alopecia areata: A descriptive study using Japan medical data center claims database. J Dermatol. 2023;50(1):37–45. https://doi.org/10.1111/1346-8138.16615
9. Kridin K, Renert-Yuval Y, Guttman-Yassky E, Cohen AD. Alopecia Areata Is Associated with Atopic Diathesis: Results from a Population-Based Study of 51,561 Patients. J Allergy Clin Immunol Pract. 2020 Apr;8(4):1323–1328.e1. https://doi.org/10.1016/j.jaip.2020.01.052
10. Jagielska D, Redler S, Brockschmidt FF, Herold C, Pasternack SM, Garcia Bartels N, Hanneken S, Eigelshoven S, Refke M, Barth S, Giehl KA, Kruse R, Lutz G, Wolff H, Blaumeiser B, Böhm M, Blume-Peytavi U, Becker T, Nöthen MM, Betz RC. Follow-up study of the first genome-wide association scan in alopecia areata: IL13 and KIAA0350 as susceptibility loci supported with genome-wide significance. J Invest Dermatol. 2012;132(9):2192–2197. https://doi.org/10.1038/jid.2012.129
11. Buket Basmanav F, Betz RC. Recent advances in the genetics of alopecia areata. Med Genet. 2023;35(1):15–22. https://doi.org/10.1515/medgen-2023-2004
12. Betz RC, Pforr J, Flaquer A, Redler S, Hanneken S, Eigelshoven S, Kortüm AK, Tüting T, Lambert J, De Weert J, Hillmer AM, Schmael C, Wienker TF, Kruse R, Lutz G, Blaumeiser B, Nöthen MM. Lossof-function mutations in the filaggrin gene and alopecia areata: strong risk factor for a severe course of disease in patients comorbid for atopic disease. J Invest Dermatol. 2007;127(11):2539–2543. https://doi.org/10.1038/sj.jid.5700915
13. Xu W, Zhang H, Wan S, Xie B, Song X. Genetic links between atopy, allergy, and alopecia areata: insights from a Mendelian randomization study. Allergy Asthma Clin Immunol. 2024;20(1):32. https://doi.org/10.1186/s13223-024-00892-w
14. Терещенко Г.П., Потекаев Н.Н., Гаджигороева А.Г., Жукова О.В., Голоусенко И.Ю. Клинико-эпидемиологические особенности атопического типа гнездной алопеции. Клиническая дерматология и венерология. 2024;23(2):155–160. https://doi.org/10.17116/klinderma202423021155
15. Guttman-Yassky E, Renert-Yuval Y, Bares J, Chima M, Hawkes JE, Gilleaudeau P, Sullivan-Whalen M, Singer GK, Garcet S, Pavel AB, Lebwohl MG, Krueger JG. Phase 2a randomized clinical trial of dupilumab (anti-IL-4Rα) for alopecia areata patients. Allergy. 2022;77(3):897–906. https://doi.org/10.1111/all.15071
16. David E, Shokrian N, Del Duca E, Meariman M, Glickman J, Ghalili S, Jung S, Tan K, Ungar B, Guttman-Yassky E. Dupilumab induces hair regrowth in pediatric alopecia areata: a real-world, single-center observational study. Arch Dermatol Res. 2024;316(7):487. https://doi.org/10.1007/s00403-024-03225-4
17. Olsen EA, Hordinsky MK, Price VH, Roberts JL, Shapiro J, Canfield D, Duvic M, King LE Jr, McMichael AJ, Randall VA, Turner ML, Sperling L, Whiting DA, Norris D; National Alopecia Areata Foundation. Alopecia areata investigational assessment guidelines--Part II. National Alopecia Areata Foundation. J Am Acad Dermatol. 2004;51(3):440– 447. https://doi.org/10.1016/j.jaad.2003.09.032
18. Wang T, Giltiay NV, Lood C, Wang N, Han BK. Evaluation of B cell related markers and autoantibodies in rheumatoid arthritis patients treated with abatacept. Front Immunol. 2025;16:1504454. https://doi.org/10.3389/fimmu.2025.1504454
19. Арсентьева Н.А., Любимова Н.Е., Бацунов О.К., Семёнов А.В., Тотолян А.А. Особенности цитокинового профиля плазмы крови здоровых жителей Гвинейской Республики. Медицинская иммунология. 2020;22(4):765–778. https://doi.org/10.15789/1563-0625-AOB-2073
20. Gautam RK, Singh Y, Gupta A, Arora P, Khurana A, Chitkara A. The profile of cytokines (IL-2, IFN-γ, IL-4, IL-10, IL-17A, and IL-23) in active alopecia areata. J Cosmet Dermatol. 2020;19(1):234–240. https://doi.org/10.1111/jocd.12970
21. Bain KA, McDonald E, Moffat F, Tutino M, Castelino M, Barton A, Cavanagh J, Ijaz UZ, Siebert S, McInnes IB, Astrand A, Holmes S, Milling SWF. Alopecia areata is characterized by dysregulation in systemic type 17 and type 2 cytokines, which may contribute to disease-associated psychological morbidity. Br J Dermatol. 2020;182(1):130–137. https://doi.org/10.1111/bjd.18008
22. Suárez-Fariñas M, Ungar B, Noda S, Shroff A, Mansouri Y, Fuentes-Duculan J, Czernik A, Zheng X, Estrada YD, Xu H, Peng X, Shemer A, Krueger JG, Lebwohl MG, Guttman-Yassky E. Alopecia areata profiling shows TH1, TH2, and IL-23 cytokine activation without parallel TH17/TH22 skewing. J Allergy Clin Immunol. 2015;136(5):1277– 1287. https://doi.org/10.1016/j.jaci.2015.06.032
23. Aşkın Ö, Yücesoy SN, Coşkun E, Engin B, Serdaroğlu S. Evaluation of the level of serum Interleukins (IL-2, IL-4, IL-15 andIL-17) and its relationship with disease severity in patients with alopecia areata. An Bras Dermatol. 2021;96(5):551–557. https://doi.org/10.1016/j.abd.2021.03.006
24. Chu SY, Chen YJ, Tseng WC, Lin MW, Chen TJ, Hwang CY, Chen CC, Lee DD, Chang YT, Wang WJ, Liu HN. Comorbidity profiles among patients with alopecia areata: the importance of onset age, a nationwide population-based study. J Am Acad Dermatol. 2011;65(5):949–956. https://doi.org/10.1016/j.jaad.2010.08.032
25. Attia EA, El Shennawy D, Sefin A. Serum Interleukin-4 and Total Immunoglobulin E in Nonatopic Alopecia Areata Patients and HLADRB1 Typing. Dermatol Res Pract. 2010;2010:503587. https://doi.org/10.1155/2010/503587
26. Song T, Pavel AB, Wen HC, Malik K, Estrada Y, Gonzalez J, Hashim PW, Nia JK, Baum D, Kimmel G, Singer GK, Krueger JG, Guttman-Yassky E. An integrated model of alopecia areata biomarkers highlights both TH1 and TH2 upregulation. J Allergy Clin Immunol. 2018;142(5):1631– 1634.e13. https://doi.org/10.1016/j.jaci.2018.06.029
27. Кибалина И.В., Цыбиков Н.Н., Фефелова Е.В. Динамика уровня хемокина ENA-78/CXCL5 в сыворотке крови и кожном экссудате у пациентов с атопическим дерматитом. Медицинская иммунология. 2022;24(2):401–406. https://doi.org/10.15789/1563-0625-DOT-2461
28. Kasumagić-Halilovic E, Cavaljuga S, Ovcina-Kurtovic N, Zecevic L. Serum Levels of Interleukin-2 in Patients with Alopecia Areata: Relationship with Clinical Type and Duration of the Disease. Skin Appendage Disord. 2018 Oct;4(4):286–290. https://doi.org/10.1159/000486462
29. Barahmani N, Lopez A, Babu D, Hernandez M, Donley SE, Duvic M. Serum T helper 1 cytokine levels are greater in patients with alopecia areata regardless of severity or atopy. Clin Exp Dermatol. 2010;35(4):409–416. https://doi.org/10.1111/j.1365-2230.2009.03523.x
30. Kasumagic-Halilovic E, Prohic A, Cavaljuga S. Tumor necrosis factor-alpha in patients with alopecia areata. Indian J Dermatol. 2011;56(5):494–496. https://doi.org/10.4103/0019-5154.87124
31. Tauber M, Buche S, Reygagne P, Berthelot JM, Aubin F, Ghislain PD, Cohen JD, Coquerelle P, Goujon E, Jullien D, Brixi H, Jeudy G, Guennoc X, Martin A, Brénaut E, Hoppé E, Bertolotti A, Bardin T, Delaporte E, Allez M, Bachelez H, Seneschal J, Viguier M; Groupe de Recherche sur Psoriasis de Société Française de, Dermatologie; Club Rhumatismes et Inflammation (CRI); Groupe d'études thérapeutiques des affections inflammatoires du tube digestif (GETAID). Alopecia areata occurring during anti-TNF therapy: a national multicenter prospective study. J Am Acad Dermatol. 2014;70(6):1146–1149. https://doi.org/10.1016/j.jaad.2014.03.005
32. Altin J, Shen C, Liston A. Understanding the genetic regulation of IgE production. Blood Rev. 2010;24(4-5):163–169. https://doi.org/10.1016/j.blre.2010.06.002
33. Simakou T, Butcher JP, Reid S, Henriquez FL. Alopecia areata: A multifactorial autoimmune condition. J Autoimmun. 2019;98:74–85. https://doi.org/10.1016/j.jaut.2018.12.001
34. Gregoriou S, Papafragkaki D, Kontochristopoulos G, Rallis E, Kalogeromitros D, Rigopoulos D. Cytokines and other mediators in alopecia areata. Mediators Inflamm. 2010;2010:928030. https://doi.org/10.1155/2010/928030
35. Šutić Udović I, Hlača N, Massari LP, Brajac I, Kaštelan M, Vičić M. Deciphering the Complex Immunopathogenesis of Alopecia Areata. Int J Mol Sci. 2024;25(11):5652. doi: 10.3390/ijms25115652
36. Gilhar A, Laufer-Britva R, Keren A, Paus R. Frontiers in alopecia areata pathobiology research. J Allergy Clin Immunol. 2019;144(6):1478–1489. https://doi.org/10.1016/j.jaci.2019.08.035
37. Lee S, Lee H, Lee CH, Lee WS. Comorbidities in alopecia areata: A systematic review and meta-analysis. J Am Acad Dermatol. 2019;80(2):466– 477.e16. https://doi.org/10.1016/j.jaad.2018.07.013
38. Conic RRZ, Chu S, Tamashunas NL, Damiani G, Bergfeld W. Prevalence of cardiac and metabolic diseases among patients with alopecia areata. J Eur Acad Dermatol Venereol. 2021;35(2):e128–e129. https://doi.org/10.1111/jdv.16864
39. Glickman JW, Dubin C, Renert-Yuval Y, Dahabreh D, Kimmel GW, Auyeung K, Estrada YD, Singer G, Krueger JG, Pavel AB, Guttman-Yassky E. Cross-sectional study of blood biomarkers of patients with moderate to severe alopecia areata reveals systemic immune and cardiovascular biomarker dysregulation. J Am Acad Dermatol. 2021;84(2):370–380. https://doi.org/10.1016/j.jaad.2020.04.138
40. Glickman JW, Dubin C, Dahabreh D, Han J, Del Duca E, Estrada YD, Zhang N, Kimmel GW, Singer G, Krueger JG, Pavel AB, Guttman-Yassky E. An integrated scalp and blood biomarker approach suggests the systemic nature of alopecia areata. Allergy. 2021;76(10):3053–3065. https://doi.org/10.1111/all.14814
Об авторах
Н. Н. ПотекаевРоссия
Потекаев Николай Николаевич - доктор медицинских наук, профессор, директор, Ленинский пр-т, д. 17, г. Москва, 119071
заведующий кафедрой кожных болезней и косметологии факультета дополнительного профессионального образования, ул. Островитянова, д. 1, г. Москва, 6117513
Г. П. Терещенко
Россия
Терещенко Галина Павловна - кандидат медицинских наук, заведующая консультативно-диагностическим центром, Ленинский пр-т, д. 17, г. Москва, 119071;
доцент кафедры дерматовенерологии, аллергологии и косметологии медицинского института, ул. Миклухо-Маклая, д. 6, г. Москва, 117198
О. В. Жукова
Россия
Жукова Ольга Валентиновна - доктор медицинских наук, профессор, главный врач, Ленинский пр-т, д. 17, г. Москва, 119071;
заведующая кафедрой дерматовенерологии, аллергологии и косметологии медицинского института, ул. Миклухо-Маклая, д. 6, г. Москва, 117198
А. Г. Гаджигороева
Россия
Гаджигороева Аида Гусейхановна - доктор медицинских наук,, руководитель научного отдела клинической дерматовенерологии и косметологии, Ленинский пр-т, д. 17, г. Москва, 119071;
доцент кафедры дерматовенерологии, аллергологии и косметологии медицинского института, ул. Миклухо-Маклая, д. 6, г. Москва, 117198
Р. А. Ханферьян
Россия
Ханферьян Роман Авакович - доктор медицинских наук, профессор, профессор кафедры дерматовенерологии, аллергологии и косметологии медицинского института,
ул. Миклухо-Маклая, д. 6, г. Москва, 117198
Дополнительные файлы
Рецензия
Для цитирования:
Потекаев Н.Н., Терещенко Г.П., Жукова О.В., Гаджигороева А.Г., Ханферьян Р.А. Сравнительная оценка цитокинового профиля у пациентов детского возраста с гнездной алопецией с учетом наличия сопутствующих атопических заболеваний: обсервационное когортное поперечное исследование. Кубанский научный медицинский вестник. 2025;32(4):82-95. https://doi.org/10.25207/1608-6228-2025-32-4-82-95
For citation:
Potekaev N.N., Tereshchenko G.P., Zhukova O.V., Gadzhigoroeva A.G., Khanferyan R.A. Comparative evaluation of cytokine profiles in pediatric alopecia areata patients considering concomitant atopic diseases: An observational cohort cross-sectional study. Kuban Scientific Medical Bulletin. 2025;32(4):82-95. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-4-82-95
JATS XML








































