Перейти к:
Особенности патогенетических механизмов гиперпигментаций кожи: когортное проспективное исследование
https://doi.org/10.25207/1608-6228-2025-32-4-33-48
Аннотация
Введение. Приобретенные гиперпигментации кожи патогенетически связаны с повышенной активностью меланоцитов и синтезом меланина, а также с насыщением им соседних кератиноцитов. Однако вопрос молекулярных механизмов возникновения не раскрыт в полной мере. Для поддержания повышенного клеточного метаболизма и синтетического процесса в ходе меланогенеза требуется большое количество энергии и пластических субстратов для построения клеточных мембран. Таким образом, представлялось актуальным изучить газотранспортную функцию эритроцитов крови и уровней липопротеидов различных классов в сыворотке крови у пациентов с гиперпигментацией с целью выявления их возможного вклада в патогенез данного состояния.
Цель исследования: выявить системные изменения показателей крови у пациентов с приобретенной гиперпигментацией кожи до и после лечения, а также оценить их возможный вклад в механизмы формирования кожной гиперпигментации.
Методы. В когортном проспективном исследовании приняли участие 50 женщин в возрасте 42–44 года, проживающих в г. Ростове-на-Дону, обратившихся за медицинской помощью в клинику общества с ограниченной ответственностью «Давинчи групп». Основная группа, 25 пациентов со средним возрастом 41,88 ± 1,45 года, имела гиперпигментацию и контрольная группа лиц со средним возрастом 41,84 ± 1,57 года не имела гиперпигментации, так как обратилась в клинику с косметологическими целями. Лабораторный этап исследований был проведен на базе лаборатории кафедры общей и клинической биохимии № 1 федерального государственного бюджетного образовательного учреждения высшего образования «Ростовский государственный медицинский университет» Министерства здравоохранения Российской Федерации. Образованы две группы (по 25 человек) по критерию наличия или отсутствия гиперпигментации. Целевым показателем исследования было скрининг липидного и холестеринового профилей в сыворотке крови, оценка уровня 2,3‑дифосфоглицерата и продуктов углеводного обмена в эритроцитах. Определение уровня общего холестерина, триацилглицеридов и липопротеидов высокой плотности осуществлялось ферментативным колориметрическим методом с использованием диагностических наборов «Chronolab AG» (Chronolab, Швейцария). Концентрация липопротеидов низкой плотности определялась турбидиметрическим методом, а липопротеидов очень низкой плотности рассчитывалась по формуле «концентрация триацилглицеридов / 5». Количественное определение уровня 2,3‑дифосфоглицерата проводилось методом неэнзиматического анализа в трихлоруксуснокислом фильтрате гемолизированных эритроцитов, а также концентрации лактата и пирувата — с использованием автоматизированного биохимического анализатора VitaLine‑200 («Витал Девелопмент Корпорэйшн», Россия). Собранную базу данных анализировали при помощи описательного и сравнительного статистического анализа в программе Statistica 12.0 (StatSoft, США). Различия считались статистически значимыми при p < 0,05.
Результаты. В ходе изучения метаболических особенностей обмена липопротеидов различных классов у пациентов с гиперпигментацией отмечалось повышение уровней отдельных классов липопротеидов по сравнению с контрольной группой. Статистически значимо повышался уровень концентрации общего холестерина, триацилглицеридов, а также отмечалась тенденция к снижению липопротеидов высокой плотности. Установлено, что медианное значение уровня общего холестерина в крови пациентов с гиперпигментацией достоверно превышает аналогичный показатель в контрольной группе на 22,2% относительно контроля (p = 0,003), а также статистически значимо увеличивается медиана концентрации триацилглицеридов относительно контроля (p = 0,032). У женщин с клиническими проявлениями гиперпигментации кожи выявлено снижение концентрации пирувата на 58,5% по сравнению с контрольной группой (p = 0,029), при этом зафиксировано значимое превышение уровня лактата на 193,9% относительно группы контроля (p < 0,001). Статистически значимо повышался уровень лактата в основной группе после лечения по сравнению со значениями до лечения и приближался к контрольным значениям (р = 0,609). При этом медиана концентрации 2,3‑дифосфоглицерата в основной группе до лечения была больше по сравнению с медианой в контрольной группе, однако различие статистически не значимо (р = 0,139).
Заключение. Установлено, что у пациентов с гиперпигментацией статистически значимо увеличен уровень отдельных классов липопротеидов, таких как триацилглицериды, и общего холестерина в крови. Изменения уровня концентрации указанных показателей свидетельствуют о постоянной потребности клеток в синтезе мембранных липидов и поддержании повышенного клеточного метаболизма, который необходим для повышенной регенерации эпидермиса. Полученные данные свидетельствуют об изменении приоритета распределении кислорода в клеточных структурах и тканях, что сопровождается значительным повышением уровня лактата и развитием локальной тканевой гипоксии.
Для цитирования:
Глушкова М.В., Саркисян О.Г., Сидоренко О.А. Особенности патогенетических механизмов гиперпигментаций кожи: когортное проспективное исследование. Кубанский научный медицинский вестник. 2025;32(4):33-48. https://doi.org/10.25207/1608-6228-2025-32-4-33-48
For citation:
Glushkova M.V., Sarkisian O.G., Sidorenko O.A. Pathogenetic mechanisms of skin hyperpigmentation: A cohort prospective study. Kuban Scientific Medical Bulletin. 2025;32(4):33-48. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-4-33-48
ВВЕДЕНИЕ
В настоящее время отмечается неуклонный рост гиперпигментаций кожи в популяции, что отрицательно сказывается на качестве жизни пациентов [1]. Известно, что патогенез гиперпигментаций связывают с воспалением в ответ на УФ-излучение, нарушением системы антиоксидантной защиты организма, избыточной чувствительностью меланоцитов, избыточной продукцией меланина, генетической предрасположенностью, приемом фотосенсибилизирующих препаратов, гормональной дисфункцией, предшествующим повреждением кожного покрова и рядом других мало изученных факторов [2–6]. Проблема гиперпигментаций кожи наиболее распространена среди женщин, и обращаемость среди них также выше [7]. Наиболее распространенными в популяции являются идиопатическая (мелазма) [8] и вторичная (поствоспалительная) формы заболевания [9]. Мелазма и поствоспалительная гиперпигментация представляют собой нарушения пигментации кожи, которые чаще всего наблюдаются у женщин в возрасте от 25 до 50 лет с высокими (III–VI) фототипами кожи по классификации Фицпатрика [10–12]. Мелазма характеризуется появлением симметричных коричневых пятен и возникает на первично неизмененной коже, в то время как поствоспалительная гиперпигментация является следствием разрешения любых воспалительных дерматозов и сопровождается увеличением чувствительности меланоцитов. Эти состояния могут быть вызваны множеством факторов, которые необходимо учитывать при выборе методов лечения и профилактики [2][3][12].
Меланогенез реализуется в высокоспециализированных клетках эпидермиса — меланоцитах, которые располагаются среди базальных кератиноцитов. Меланоциты имеют множество дендритических отростков, которые могут распространяться на расстояние до 100 мкм от тела клетки. Распределение меланоцитов и характер их ветвления в норме обеспечиваются контактом практически каждого базального кератиноцита терминальными отделами дендритов, а также контактом отростков меланоцитов между собой. Морфофункциональный комплекс, образуемый меланоцитом и окружающими его кератиноцитами, называется «эпидермально-меланиновая единица». Синтез меланина осуществляется в меланоцитах в специализированных органеллах — меланосомах. В процессе своего развития они проходят четыре последовательные стадии созревания, в ходе которых, продвигаясь к периферическим отделам меланоцита, наращивают свою электронно-оптическую плотность. Посредством цитокринного механизма зрелые меланосомы передаются кератиноцитам [13][14].
Предшественником меланинов в пигментных клетках является тирозин [15][16]. Выделяют эумеланины и феомеланины. Эумеланины — черные нерастворимые высокомолекулярные гетерополимеры 5,6-дигидроксииндола и его предшественников. Феомеланины — желтые или красновато-коричневого цвета полимеры, растворимые в разбавленных щелочных растворах. Синтез меланинов представляет собой сложный, многоступенчатый и разветвленный биохимический процесс. Начальная реакция — гидроксилирование тирозина с образованием ДОФА (дигидроксифенилаланина) — катализируется тирозиназой, использующей в качестве кофактора ионы меди (Cu+). Тирозиназа — ключевой фермент, регулирующий скорость производства меланина, при этом для ее активности строго требуется нейтральный рН 7. Реальный рН кожи определяется результатом суммарной активности нескольких транспортных белков, переносящих ионы. Таким образом, ионный гомеостаз в меланосомах имеет решающее значение для синтеза меланина. Дефекты ионно-транспортной системы во время старения кожи приводят к различным аномалиям пигментации [13][15][17]. При повреждении базальной мембраны и базальных кератиноцитов меланин, который они содержат, попадает в верхние слои дермы. Там он поглощается макрофагами, которые мигрируют к очагам воспаления [13]. Регуляция меланогенеза представляет собой сложный и многоуровневый биологический процесс. В настоящее высказываются предположения об участии радикальных цепных реакций в процессах пигментообразования. Ключевым ферментом является тирозиназа, которая активизируется УФО путем разрушения пептидазы и глютатиона, блокирующих тирозиназу [14][18][19].
Результаты ряда исследований указывают на наличие в местах мелазмы выраженных изменений по типу солнечного эластоза, что дает основание предполагать наличие кумулятивного воздействия ультрафиолетового излучения, сопровождающегося индукцией продукции воспалительных цитокинов [20][21].
Альтернативным вариантом развития мелазмы является увеличение уровня сосудистого эндотелиального фактора роста (vascular endothelial growth factor, VEGF), что сопровождается усилением ангиогенеза в пораженных участках кожи [22]. В клинической практике данный феномен выявляется эмпирически при дерматоскопии пораженных очагов или в ходе 3D-диагностики кожи. В отдельных публикациях выявлено повышение экспрессии рецепторов к эстрогену и прогестерону в участках гиперпигментации, что подчеркивает роль гормональных факторов в патогенезе мелазмы. Указанные стероиды стимулируют меланогенез через ДОФАхром-таутомеразу и тирозиназу. Активация тирозиназы может происходить как прямым действием гормонов, так и опосредованно — через повышение внутриклеточного уровня циклического аденозинмонофосфата (цАМФ) [23].
Одним из признаков кожной гиперпигментации является локализованный гиперкератоз в патологическом очаге, ассоциированный с повышенной клеточной пролиферацией и накоплением меланина в клетках [19]. Пролиферация и гиперкератоз обусловлены потребностью эпидермиса в липидах, необходимых для поддержания структурной целостности и функциональной активности клеток. При этом транспортной формой липидов в крови являются липопротеиды различных классов. Они транспортируют к тканям липиды для построения клеточных мембран, синтеза стероидных гормонов и жирные кислоты для поддержания клеточного метаболизма. Следует отметить, что циркулирующие в крови липопротеиды постоянно обмениваются компонентами между различными типами. Липопротеиды сыворотки крови играют важную роль в поддержании гомеостаза холестерина, поэтому их функциональные и физико-химические характеристики важны в оценке адаптационных возможностей организма [24][25]. Одним из адаптационных механизмов является модификация липидного состава мембран, что обусловлено способностью ряда фосфолипидов функционировать в качестве синергистов антиоксидантной системы, ингибируя процессы перекисного окисления. Кроме того, свободный холестерол способствует стабилизации мембранных структур, подавляя перекисное окисление упорядоченных липидов путем ограничения молекулярной подвижности жирнокислотных остатков фосфолипидов, что является формой метаболической адаптации.
Цель исследования: выявить системные изменения показателей крови у пациентов с приобретенной гиперпигментацией кожи до и после лечения, а также оценить их возможный вклад в механизмы формирования кожной гиперпигментации.
МЕТОДЫ
Дизайн исследования
В рамках когортного проспективного исследования было обследовано 25 жительниц Ростова-на-Дону, обратившихся к дерматологу с жалобами на гиперпигментацию кожи, а также 25 женщин из того же города, обратившихся косметологу для проведения профилактических процедур.
Условия проведения
Амбулаторное наблюдение (в том числе инструментальные исследования; аппаратные процедуры) участниц исследования выполнено на базе клинико-диагностического центра «Давинчи» (общество с ограниченной ответственностью «Давинчи групп»). Лабораторные исследования выполнены на базе лаборатории кафедры общей и клинической биохимии № 1 федерального государственного бюджетного образовательного учреждения высшего образования «Ростовский государственный медицинский университет» Министерства здравоохранения Российской Федерации. Период проведения исследования: с марта 2023 по май 2024 года. Общая продолжительность наблюдения за пациентами составляла 4 месяца, с учетом длительности лечения до полного выздоровления пациента.
Критерии соответствия
Критерии включения
Для всех участников исследования: пол — женский; возраст 42–44 года; наличие письменного информированного добровольного согласия на участие в исследовании.
Для основной группы: верифицированный диагноз: «мелазма», «поствоспалительная гиперпигментация».
Критерии невключения
Наличие онкологических заболеваний; наличие острых или хронических болезней в фазе обострения, не относящихся к исследуемым нозологическим формам (например, декомпенсированная патология сердечно-сосудистой системы, органов дыхания, почек, ВИЧ-инфекция и прочее); неврологические и психические расстройства; неконтролируемый прием лекарственных препаратов, прием биологически активных добавок, лекарственных трав, отягощенный аллергологический анамнез.
Критерии исключения
Отказ от дальнейшего наблюдения, проведения медицинских вмешательств, нарушение режима назначений лекарственных препаратов.
Описание критериев соответствия (диагностические критерии)
Установление диагноза «Мелазма» (код по МКБ-10 L81.1) или «Поствоспалительная гиперпигментация» (код по МКБ-10 L81.0) осуществлялось на основании клинической картины и инструментально-диагностического исследования, в соответствии с действующими клиническими рекомендациями 2022 г.1, с применением диагностических приборов: дерматоскоп DermLite handyscope (FotoFinder, Германия), лампа Вуда ОЛДД-01 (NV–LAB, Россия), Antera 3D Standart (Miravex, Ирландия)
Подбор участников в группы
Набор участников исследования проводился в две группы согласно критериям включения. Первая группа с наличием гиперпигментации: основная группа (n = 25), пациентки с верифицированным диагнозом «мелазма» и «поствоспалительная гиперпигментация». Вторая группа с отсутствием гиперпигментации: группа контроля (n = 25), условно здоровые пациентки.
Пациенты с «мелазмой» и «поствоспалительной гиперпигментацией» (ПВГ) получали топическую терапию и дополнительно проходили курс лечения низкоинтенсивным лазерным излучением.
Меланин как хромофор способен поглощать свет с длиной волны от 250 до 1200 нм [26]. Период термальной релаксации меланосом составляет около 1 мс, что позволяет избежать повреждения окружающих тканей при воздействии на меланин, что обеспечивается применением лазера с модуляцией добротности в импульсном режиме [26][27]. Применяли технологию Q-Switch на иттрий-алюминиевом гранате, легированном неодимом. Технология лазерного тонирования предполагает использование низкой плотности потока энергии и многопроходной обработки патологических участков. Исследования показывают, что коллимированный лазерный луч QSL вызывает минимальное повреждение клеток меланоцитов, обеспечивает медленное нагревание меланосом, разрушая меланосомы и гранулы меланина, сохраняя при этом целостность клеточной мембраны и ядра. Данный механизм известен как «субклеточный селективный фототермолиз» [27][28]. Он включает процесс дендрэктомии, при котором осуществляется обрезка длинных дендритных отростков гиперактивных меланоцитов, что ведет к функциональному подавлению этих клеток и снижению количества меланосом [28].
Терапия пациентов с мелазмой проводилась в соответствии с клиническими рекомендациями2 и предусматривала ежедневное применение в течение 12 недель косметических осветляющих кремов (дневного и ночного), содержащих комбинацию активных компонентов: глабридина, андрографолида и лизина азелата. Начиная со второй недели курса лечения на пораженные участки кожи утром один раз в две недели воздействовали импульсным лазерным излучением длиной волны 1064 нм аппаратом Fоtona StarWalker MaQX (Fotona, Словения) с манипулой R28, диаметром пятна 8 мм, длительностью импульса 5 нс и временем воздействия на каждый пораженный участок 1 мин для каждого режима работы лазера по схеме: первая процедура — воздействие выполняют в режиме работы MaQX1 с плотностью потока энергии (ППЭ) 1,4 Дж/см 2. Вторая процедура — сначала воздействие выполняют в режиме работы MaQX1 с ППЭ 1,4 Дж/см 2, затем в режиме MaQX2 c ППЭ 2,8 Дж/см 2. Третья и четвертая процедуры — сначала в режиме MaQX1 с ППЭ 1,4 Дж/см 2, далее — в режиме MaQX2 с ППЭ 2,8 Дж/см 2, затем — в режиме MaQX5 с ППЭ 7,0 Дж/см 2. Пятая и шестая процедуры — сначала воздействие выполняют в режиме работы MaQX1 c ППЭ 1,4 Дж/см 2, затем — в режиме MaQX2 с ППЭ 2,8 Дж/см 2; потом — в режиме MaQX5 с ППЭ 7,0 Дж/см 2 и далее воздействие выполняют в режиме работы MaQX10 с ППЭ 14 Дж/см 2. Курс лечения составляет 12 недель.
У пациентов с ПВГ применялась топическая терапия в том же объеме, что и при идиопатической форме, при этом аппаратное лечение отличалось. Применялся терапевтический лазер «Fotona Dynamis», (Fotona, Словения). Начиная со второй недели курса лечения на пораженные участки кожи утром один раз в три недели воздействовали импульсным лазерным излучением длиной волны 1064 нм в микросекундном диапазоне в режиме FRAC3 манипулой R33, с диаметром пятна 4 мм — плотностью потока энергии 20 Дж/см2, время воздействия 1 мин на каждый пораженный участок, переходя последовательно на пятно 9 мм с плотностью потока энергии 10 Дж/см 2, также в течение 1 мин на каждый пораженный участок. Курс лечения составляет 12 недель, включал 4 процедуры, которые по режиму работы не отличались одна от другой.
Целевые показатели исследования
Основной показатель исследования
Целевым показателем исследования был скрининг липидного и холестеринового профиля в сыворотке крови (общий холестерин (ОХ), триглицериды (ТГ), липопротеиды высокой плотности (ЛПВП), липопротеиды низкой плотности (ЛПНП), липопротеиды очень низкой плотности (ЛПОНП)), оценка уровня 2,3-дифосфоглицерата (2,3-ДФГ) и продуктов углеводного обмена (концентрацию лактата и пирувата) в эритроцитах до и после проведенного лечения, а также оценка их возможного вклада в механизмы формирования кожной гиперпигментации.
Дополнительные показатели исследования
Не предусмотрены.
Методы измерения целевых показателей
Забор биологического материала осуществляли в утренние часы с соблюдением голодной диеты не менее 8 часов, из локтевой вены.
Содержание ОХ, ТГ, ЛПВП определялось ферментативным колориметрическим методом с использованием наборов «ChronolabAG» (Chronolab, Швейцария), ЛПНП — турбидиметрическим методом, ЛПОНП — расчетным методом (концентрация ЛПОНП = концентрации ТГ/5). Единицы измерения данных показателей — ммоль/л.
В эритроцитах венозной крови участников исследования определяли уровень 2,3-ДФГ неэнзиматическим методом в ТХУ-фильтрате (трихлоруксусная кислота) гемолизированных эритроцитов по концентрации неорганического фосфора в пробах [29] и концентрацию лактата и пирувата аппаратными методами (биохимический анализатор VitaLine-200 («Витал Девелопмент Корпорэйшн», Россия)). Расчет производили по калибровочному графику производителя, полученные результаты выражали в ммоль/л. Концентрацию лактата определяли по реакции окрашивания параоксидифенила с уксусным альдегидом, образующимся из лактата в присутствии серной, фосфорной кислот и ионов меди. Концентрацию 2,3-ДФГ определяли методом, основанным на колориметрическом измерении содержания фосфатов в хлорнокислом экстракте после удаления кислоторастворимых нуклеотидов абсорбцией на активированном угле3.
Расчетные формулы:
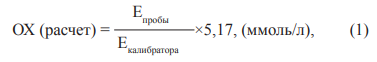
где ОХ — концентрация холестерина в пробе; Е — оптическая плотность образца/калибровочной пробы.

где ЛПВП — концентрация липопротеидов высокой плотности в пробе.
ЛПНП = Общий холестерин – холестерин супернатанта, (ммоль/л),(4);
где ЛПНП — концентрация липопротеидов низкой плотности. в пробе.
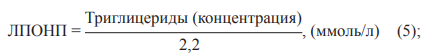
где ЛПОНП — концентрация липопротеидов очень низкой плотности в пробе.
Лактат (расчет) = Лактат (опыт)×Лактат (опыт)×0,6, (ммоль/л), (6)
ПВК (расчет) = ПВК (график)×40×5, (ммоль/л) (7)
где ПВК — концентрация пирувата.

где 2,3 ДФГ — концентрация 2,3-дифосфоглицерата в пробе.
Результаты дерматологического лечения оценивались критериальными клиническими шкалами. Для оценки площади и тяжести протекания мелазмы и ПВГ, а также потенциального ответа на терапию применялась шкала The Melasma Area and Severity Index (MASI) [30], которая включает процент площади поражения различных зон лица (лоб (f) — 30 %, правая скуловая область (rm) — 30 %, левая скуловая область (lm) — 30 % и подбородок (c) — 10 %), выраженность и гомогенность пигментации (по шкале о 0 до 4). Итоговая сумма оценки может быть от 0 до 48. А также применялся клинический индекс mMASI (The modified Melasma Area and Severity Index), предназначенный для оценки площади и тяжести протекания мелазмы и ПВГи потенциального ответа на терапию. Он включает определение процента площади поражения лица по зонам, от 0 до 6, а также выраженность пигментации от 0 до 4. Итоговая сумма оценки от 0 до 24.
До начала терапии всем пациентам определялась степень тяжести мелазмы на основании расчета индексов MASI и MSS. Оценка эффективности терапии проводилась с учетом динамики индекса MASI до лечения и через 12 недель терапии.
Переменные (предикторы, конфаундеры, модификаторы эффекта)
Наличие сердечно-сосудистых заболеваний (в частности, гипертонической болезни и ишемической болезни сердца), а также метаболического синдрома потенциально могло исказить результаты анализа биоматериалов. Для нивелирования влияния переменных на результаты исследования данные состояния были определены как критерии невключения при формировании исследуемых групп.
Статистические процедуры
Принципы расчета размера выборки
Размер выборки предварительно не рассчитывался.
Статистические методы
Собранную базу данных в программе Excel 2016 (MS Office, США) анализировали при помощи описательного и сравнительного статистического анализа при использовании программы Statistica 12.0 (StatSoft, США). Количественные данные проверялись на подчинение нормальному закону распределения (НЗР) с помощью критерия Колмогорова — Смирнова. Параметры выборки с нормальным распределением числовых значений отражали в виде среднего и стандартного отклонения в формате (M ± SD). Выборки, которые не подчинялись НЗР, описывались медианой и первым и третьим квартилями в виде Ме (Q1; Q3). Сравнивали числовые распределения в выборках при помощи параметрического критерия Стьюдента или непараметрических критериев Манна — Уитни для независимых выборок, парного критерия Стьюдента и Вилкоксона для зависимых выборок (до лечения и после лечения), при помощи критерия Краскела — Уоллиса проводили дисперсионный анализ. Категориальные данные описывались при помощи абсолютных и относительных значений, сравнение групп проводили при помощи точного критерия Фишера (для малых выборок) и/или критерия χ2 Пирсона. Во всех случаях сравнительного анализа различия считались статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
Формирование выборки исследования
Для проведения исследования были сформированы две группы. В основную группу включены 25 пациентов с приобретенными гиперпигментациями кожи. Оценивались результаты до лечения и после. Отказавшихся от участия в исследование пациентов не было. Параллельно была набрана контрольная группа (n = 25) здоровых испытуемых лиц (рис. 1).
Характеристики выборки (групп) исследования
Испытуемые лица, включенные в контрольную и опытную группы, были сопоставимы по полу (все женщины), по возрасту и по другим показателям (табл. 1). По объему разделенные группы были одинаковы: 25 человек — с гиперпигментацией кожи, средний возраст 41,88 ± 1,45 года; 25 человек — практически здоровых (ПЗ) лиц, средний возраст 41,84 ± 1,57 года (р = 0,926). Статистически не значимы были различия средних значений для роста, веса и индекса массы тела (ИМТ) (табл. 1). Группы сопоставимы.
Основные результаты исследования
Были изучены метаболические особенности обмена липопротеидов у пациентов с гиперпигментацией. Отмечалось повышение уровня отдельных классов липопротеидов по сравнению с контрольной группой. Статистически значимо повышены уровни концентрации общего холестерина, триглицеридов, а также выявлена тенденция к снижению по ЛПВП (табл. 2).
При анализе числовых распределений концентраций различных классов липопротеидов как у пациентов с гиперпигментацией, так и у лиц контрольной группы с помощью проверки на нормальность по критериям Колмогорова и Смирнова установлено, что большинство распределений не соответствовало нормальному закону распределения. Поэтому описание распределений показателей (концентрации) осуществляли в виде медиан и сравнение распределений показателей проводили с помощью непараметрических методов. Однако часть числовых значений (количество от одного до четырех) в полтора раза превышало межквартильный интервал, и такие значения существенно искажали общие закономерности распределения. Указанные числовые значения отнесены к выбросам и в дальнейшем расчете показателя не учитывались.
Так, медиана концентрации ОХ (рис. 2) у пациентов с гиперпигментацией статистически значимо отличалось от аналогичной медианы для группы контроля, на 22,2 % (р = 0,003).
Дисперсионный анализ значений показателя ОХ для трех групп: основная до лечения, основная после лечения, контрольная группа, с помощью критерия Краскела — Уоллиса показал значимое (р < 0,001) изменение концентрации ОХ для этих трех групп. Попарное сравнение значений медиан для групп до лечения и после лечения с помощью критерия Вилкоксона выявило статистически значимое уменьшение концентрации ОХ после лечения: с 6,32 (5,44; 11,37) ммоль/л перед лечением до 4,44 (4,15; 5,50) ммоль/л после лечения (р < 0,001) (рис. 3). Показатель ОХ основной группы после лечения был близок к значению контрольной группы (р = 0,055 по критерию Манна — Уитни).
Выявлено более высокое содержание ТГ, медиана концентрации ТГ (рис. 4) у пациентов с гиперпигментацией статистически значимо отличалось от аналогичной медианы для группы контроля, на 53,6 % (табл. 2) при р = 0,032.
Дисперсионный анализ значений показателя ТГ для трех групп: основная до лечения, основная после лечения, контрольная группа, с помощью критерия Краскела — Уоллиса показал значимое (р = 0,049) изменение концентрации ТГ. Попарное сравнение значений медиан для групп до лечения и после лечения с помощью критерия Вилкоксона выявило значимое уменьшение концентрации ТГ после лечения: с 1,72 (1,15; 2,05) ммоль/л перед лечением (табл. 2) до 1,04 (1,04; 1,35) ммоль/л после лечения (р = 0,012) (рис. 5). Показатель ТГ после лечения был близок к значению контрольной группы (р = 0,915 по критерию Манна — Уитни).
Следует отметить, что концентрации атерогенных фракций ЛПОНП, ЛПНП при гиперпигментации были выше, чем в контроле, однако эти различия в настоящем исследовании не были статистически значимыми для ЛПОНП (ошибка р = 0,246) и для ЛПНП (ошибка р = 0,455) (табл. 2). В случае сравнения значений концентраций ЛПНП и ЛПОНП для трех групп по критерию Краскела — Уоллиса установлено статистически значимое изменение для ЛПНП (р < 0,001) (рис. 6) и не значимое для ЛПОНП (р = 0,814) (рис. 7).
Попарное сравнение для концентрации ЛПНП показало значимое различие значения медианы после лечения, равное 0,41 (0,18; 0,95) ммоль/л (табл. 3), от значения медианы для контроля, равное 1,43 (1,15; 2,50) ммоль/л (табл. 2), и от значений медианы до лечения, равное 2,38 (0,70; 5,33) ммоль/л. В случае для ЛПОНП попарное сравнение не выявило значимых различий. Изменения данных показателей могут быть связаны с повышенным поступлением эфиров холестерина в эпидермальную ткань.
Значения концентрации ЛПВП имели тенденцию к снижению в основной группе на 17,0 % по сравнению с контролем (р = 0,042) (табл. 2). По критерию Краскела — Уоллиса с помощью дисперсионного анализа для трех групп сравнения установлено статистически значимое изменение для ЛПВП (р = 0,039) (рис. 5).
После лечения значения концентрации ЛПВП были значимо больше значений ЛПВП для основной группы до лечения, но существенно не отличались от значений для контроля (р = 0,468). Очевидно, изменения изучаемых показателей связаны с повышенным поступлением эфиров холестерина в эпидермальную ткань.
Исследование концентраций лактата в эритроцитах крови лиц исследуемых групп установило, что медиана значений концентрации лактата для пациентов группы до лечения, равная 10,20 (9,32; 10,92) ммоль/л, статистически значимо больше, чем значение медианы концентрации лактата для лиц группы контроля 3,47 (2,91; 3,84) ммоль/л (р < 0,001) (табл. 4). Дисперсионный анализ медиан трех групп по концентрации лактата выявил значимые различия (р < 0,001) (рис. 8). Попарное сравнение значений медиан концентраций лактата для группы до лечения и после лечения с помощью критерия Вилкоксона показывает значимые различия между значениями медиан для группы «до лечения» и «после лечения» (табл. 5), но отсутствие различия между значениями медиан для контроля и для группы после лечения (р = 0,609) (рис. 8).
Концентрация ПВК эритроцитов крови в основной группе до лечения была равна 2,16 (1,60; 2,36) ммоль/л и была статистически значимо (р = 0,029) ниже медианы контроля 5,20 (0,23; 5,60) ммоль/л (табл. 4). Критерий Краскела — Уоллиса дисперсионного анализа также статистически значимо показал различия медиан в трех группах (р = 0,023) (рис. 9). Однако медианы концентраций ПВК до лечения и после лечения были практически одинаковыми (р = 0,162) (табл. 5).
Отмечено статистически незначимое (на 85,0 %; p = 0,139) увеличение значений медианы концентрации 2,3-ДФГ в эритроцитах крови у пациентов основной группы 13,30 (9,69; 26,82) по сравнению с контролем — 7,19 (5,85; 21,29) (табл. 5). Отсутствие значимого различия концентраций 2,3-ДФГ, вероятно, связано с большим разбросом числовых значений в сравниваемых группах (рис. 10). Можно предположить, что повышенная концентрация лактата на фоне сохранения постоянного уровня 2,3-ДФГ свидетельствует о том, что ткань получает достаточное количество кислорода, но часть концентрации кислорода используется не на тканевое дыхание, а на усиленный синтез меланина и насыщение им соседних кератиноцитов. Однако авторы предполагают, что в основной клинической группе происходит изменение приоритета потребления кислорода в сторону синтеза меланина. Таким образом, распределение его внутри клетки происходит по-разному в норме и при гиперпигментации.
Эффективность дерматологического лечения оценивалась двумя критериальными клиническими шкалами: MASI и mMASI (табл. 6).
Сравнительный анализ значений клинических индексов по двум шкалам показал, что все пациенты после лечения понизили значения своих клинических индексов. Так, для пациентов по шкале MASI медианное значение до лечения было равно 12,0 (7,2; 13,2) балла, а после лечения — 2,7 (1,8; 2,7) балла. При этом различия статистически значимы (р < 0,001).
Для пациентов по шкале mMASI медианное значение до лечения было равно 7,3 (6,6; 7,6) балла, а после лечения — 2,4 (1,2; 3,0) балла, и различия также статистически значимы (р < 0,001). Результаты измерений по двум шкалам доказывают значимость терапевтического эффекта, оказываемого для пациентов основной группы исследования во время лечения.
Дополнительные результаты исследования
Дополнительные результаты в ходе исследования не получены.
Таблица 1. Средние значения (M ± SD) некоторых показателей для лиц сравниваемых групп при их сопоставимости
Table 1. Mean values (M ± SD) of some indicators for individuals of the compared groups if comparable
|
Показатели |
Группы |
Уровень статистической значимости, p* |
|
|
Основная (n = 25) |
Контрольная (n = 25) |
||
|
Возраст, лет |
41,88 ± 1,45 |
41,84 ± 1,57 |
0,926 |
|
Рост, см |
166,76 ± 3,61 |
166,52 ± 4,93 |
0,845 |
|
Вес, кг |
65,80 ± 6,28 |
63,08 ± 5,96 |
0,123 |
|
ИМТ, кг/м 2 |
23,70 ± 2,56 |
22,81 ± 2,52 |
0,221 |
Примечания: таблица составлена авторами; р* — статистическая значимость по критерию Стьюдента для независимых выборок. Сокращение: ИМТ — индекс массы тела.
Notes: the table was compiled by the authors; p* — statistical significance according to Student’s criterion for independent samples. Abbreviation: ИМТ — body mass index.
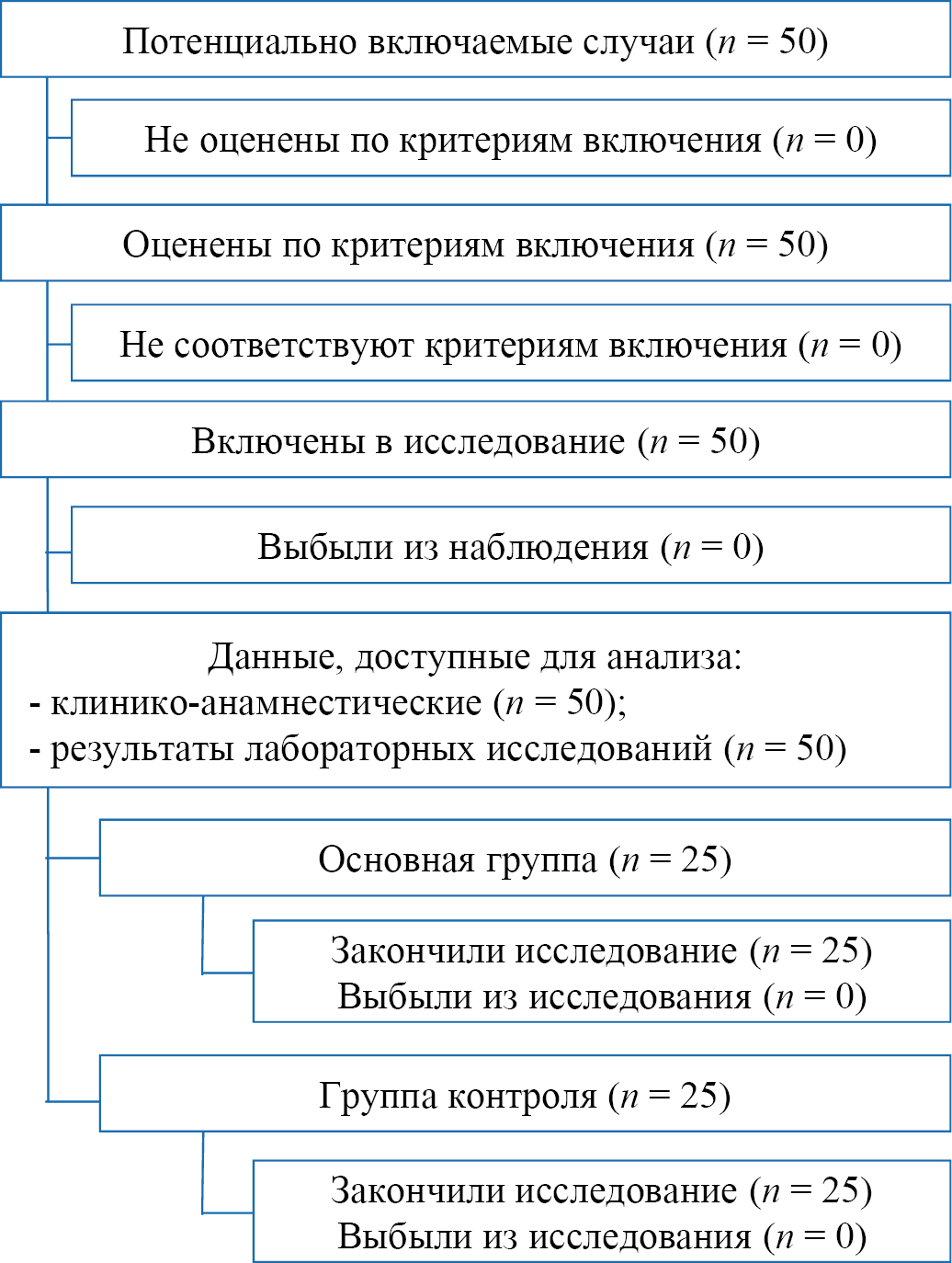
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами (согласно рекомендациям STROBE).
Fig. 1. Block diagram of the study design
Note: the block diagram was created by the authors (as per STROBE recommendations).
Таблица 2. Значения медиан Me (Q1; Q3) концентрации различных липопротеидов в крови лиц исследуемых групп
Table 2. Values of median Me (Q1; Q3) concentrations of different lipoproteins in the blood of individuals of the groups under study
|
Показатели |
Группы |
Уровень статистической значимости, p* |
|
|
Основная (n = 25) |
Контрольная (n = 25) |
||
|
ОХ, ммоль/л |
6,32 (5,44; 11,37), n = 22 |
5,17 (5,17; 6,20), n = 21 |
0,003 |
|
ТГ, ммоль/л |
1,72 (1,15; 2,05), n = 23 |
1,12 (0,57; 1,72), n = 24 |
0,032 |
|
ЛПВП, ммоль/л |
1,61 (1,55; 2,06), n = 23 |
1,94 (1,71; 2,71), n = 23 |
0,042 |
|
ЛПНП, ммоль/л |
2,38 (0,70; 5,33), n = 25 |
1,43 (1,15; 2,50), n = 24 |
0,455 |
|
ЛПОНП, ммоль/л |
0,52 (0,52; 0,82), n = 25 |
0,52 (0,26; 0,78), n = 24 |
0,246 |
Примечания: таблица составлена авторами; р* — статистическая значимость согласно критерию Манна — Уитни; при расчете показателей не учитывались числовые значения выбросов, искажающих общую тенденцию, поэтому количество данных в группе может быть меньше количества лиц в группе. Сокращения: ОХ — общий холестерин, ТГ — триглицериды, ЛПВП — липопротеиды высокой плотности, ЛПНП — липопротеиды низкой плотности, ЛПОНП — липопротеиды очень низкой плотности.
Notes: the table was compiled by the authors; p* — statistical significance according to the Mann — Whitney test; numerical values of outliers distorting the general trend were not considered in the calculation of indicators, and therefore the amount of data in the group may be less than the number of individuals in the group. Abbreviations: ОХ — total cholesterol, ТГ — triglycerides, ЛПВП — high-density lipoproteins, ЛПНП — low-density lipoproteins, ЛПОНП — very low-density lipoproteins.
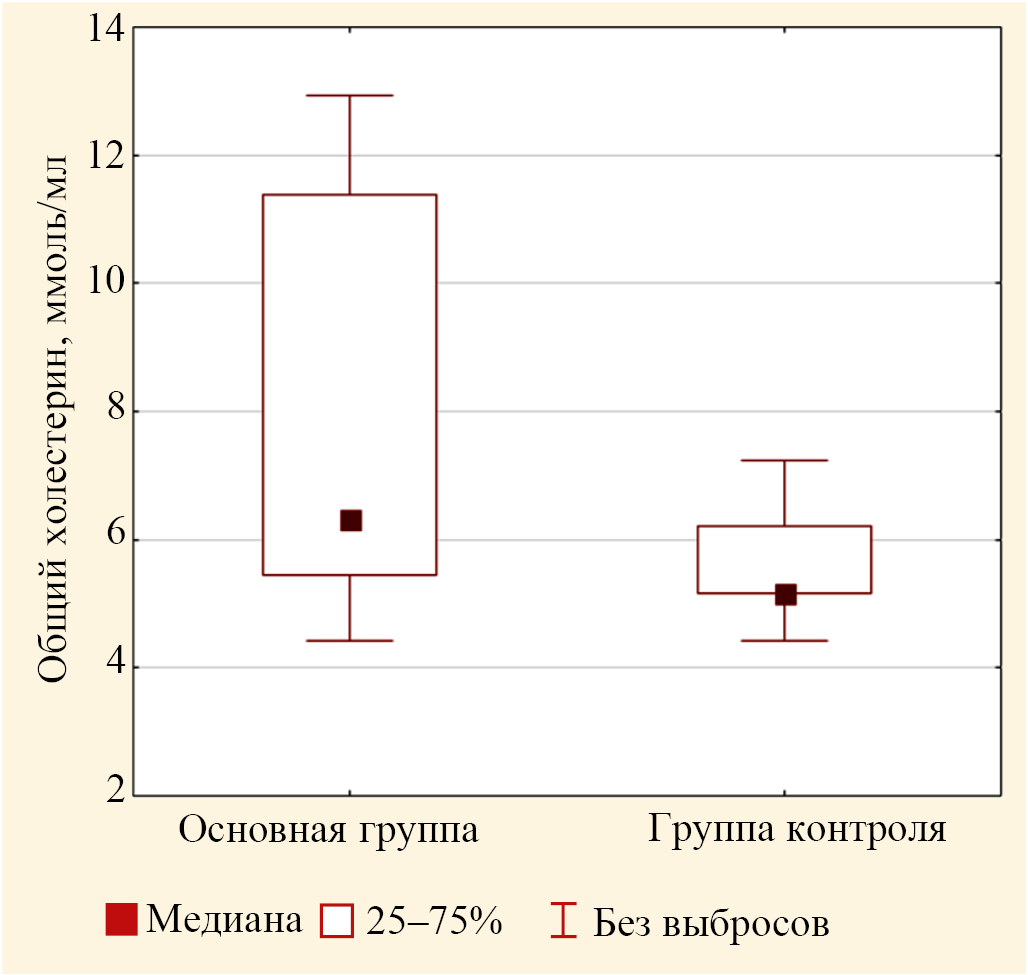
Рис 2. Медианные значения концентрации общего холестерина в крови лиц основной группы (до лечения) и контрольной группы (выбросы не включены)
Примечание: рисунок выполнен авторами.
Fig. 2. Median values of total cholesterol concentrations in the blood of individuals in the study group (before treatment) and control group (outliers not included)
Note: the figure was created by the authors.
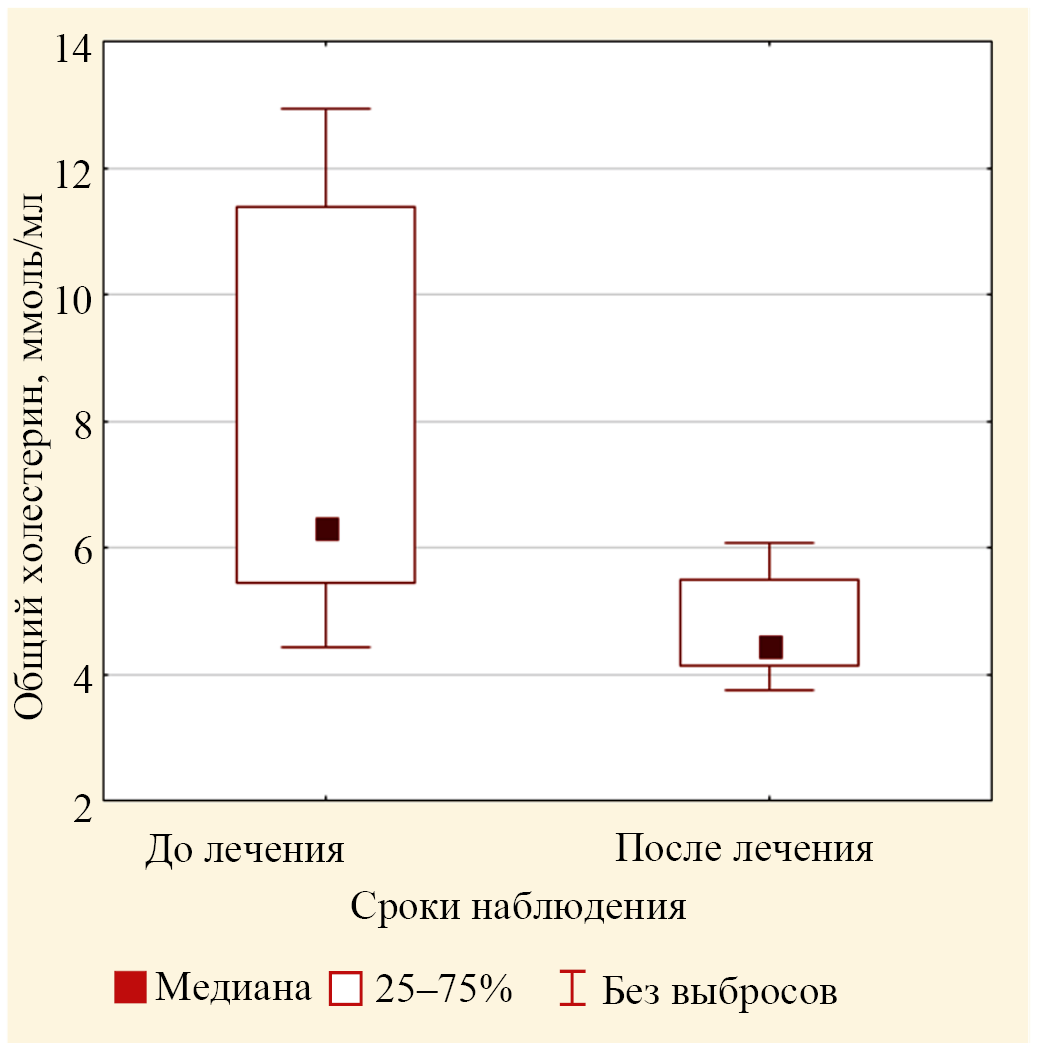
Рис. 3. Значения медиан концентрации общего холестерина в крови пациентов основной группы до лечения и после лечения (выбросы не включены)
Примечание: рисунок выполнен авторами.
Fig. 3. Values of median concentrations of total cholesterol in the blood of patients of the study group before treatment and after treatment (outliers not included)
Note: the figure was created by the authors.
Таблица 3. Медианные значения Me (Q1; Q3) уровней концентрации липопротеидов в крови пациентов в основной группе до лечения и после лечения
Table 3. Median Me (Q1; Q3) values of blood lipoprotein concentration levels in patients of the study group before and after treatment
|
Показатели |
Сроки наблюдения |
Уровень статистической значимости, p* |
|
|
До лечения |
После лечения |
||
|
ОХ, ммоль/л |
6,32 (5,44; 11,37), n = 22 |
4,44 (4,15; 5,50), n = 22 |
<0,001 |
|
ТГ, ммоль/л |
1,72 (1,15; 2,05), n = 23 |
1,04 (1,04; 1,35), n=23 |
0,012 |
|
ЛПВП, ммоль/л |
1,61 (1,55; 2,06), n = 23 |
2,26 (1,94; 3,23) n = 23 |
0,004 |
|
ЛПНП, ммоль/л |
2,38 (0,70; 5,33), n = 25 |
0,41 (0,18; 0,95), n = 25 |
<0,001 |
|
ЛПОНП, ммоль/л |
0,52 (0,52; 0,82), n = 25 |
0,52 (0,26; 0,78), n = 25 |
0,325 |
Примечания: таблица составлена авторами; р* — статистическая значимость согласно парному критерию Вилкоксона; при расчете показателей не учитывались числовые значения выбросов, искажающих общую тенденцию, поэтому количество данных в группе может быть меньше количества лиц в группе. Сокращения: ОХ — общий холестерин, ТГ — триглицериды, ЛПВП — липопротеиды высокой плотности, ЛПНП — липопротеиды низкой плотности, ЛПОНП — липопротеиды очень низкой плотности.
Notes: the table was compiled by the authors; p* — statistical significance according to the paired Wilcoxon test; numerical values of outliers distorting the general trend were not considered in the calculation of indicators, and therefore the amount of data in the group may be less than the number of individuals in the group. Abbreviations: ОХ — total cholesterol, ТГ — triglycerides, ЛПВП — high-density lipoproteins, ЛПНП — low-density lipoproteins, ЛПОНП — very low-density lipoproteins.

Рис. 4. Значения медиан концентрации триглицеридов в крови пациентов основной группы до лечения и после лечения и в крови лиц группы контроля (выбросы не включены)
Примечание: рисунок выполнен авторами.
Fig. 4. Values of median triglyceride concentrations in the blood of patients of the study group before and after treatment and in the blood of the control group (outliers not included)
Note: the figure was created by the authors.
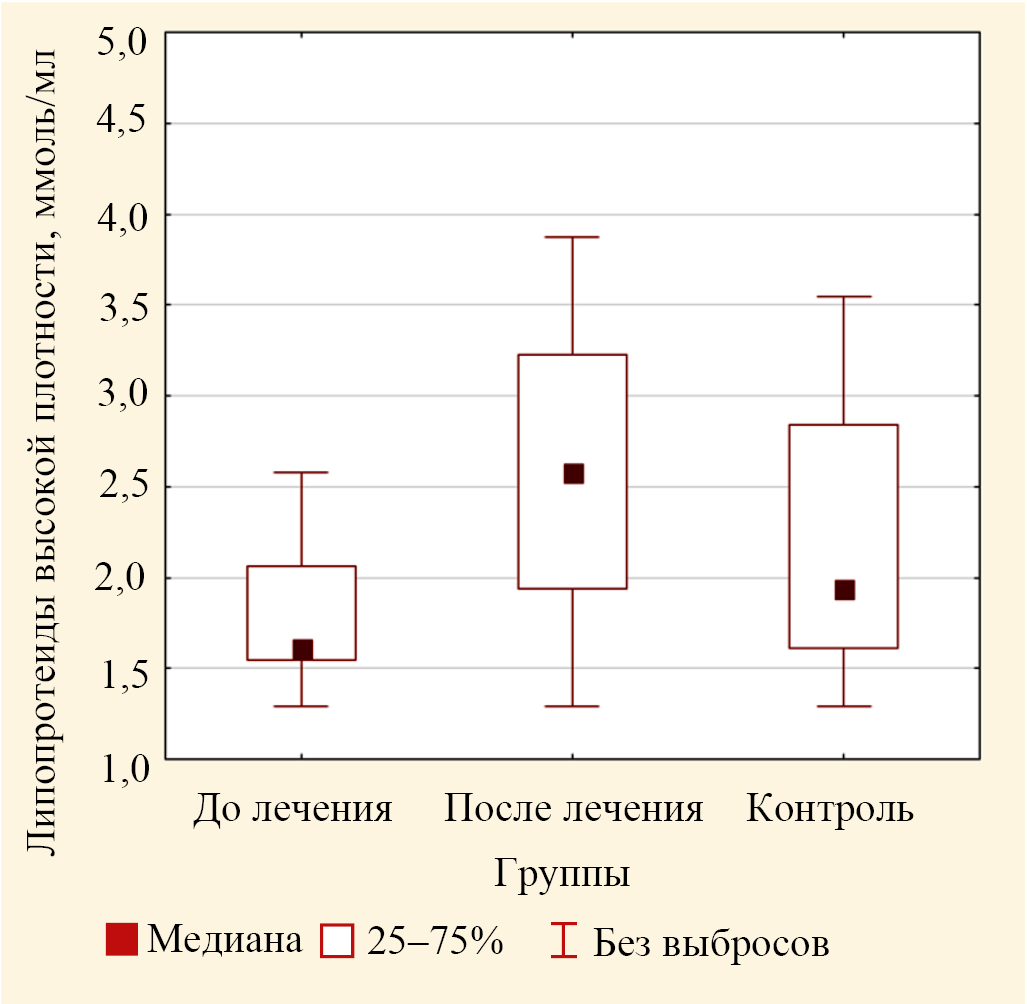
Рис. 5. Значения медиан концентрации липопротеидов высокой плотности в крови пациентов основной группы до лечения и после лечения и в крови лиц группы контроля (выбросы не включены)
Примечание: рисунок выполнен авторами.
Fig. 5. Values of median concentrations of high-density lipoproteins in the blood of the patients of the study group before and after treatment and in the blood of the control group (outliers not included)
Note: the figure was created by the authors.
Таблица 4. Медианные значения Me (Q1; Q3) уровней концентрации лактата, пирувата и 2,3-дифосфоглицерата в эритроцитах пациентов в основной группе до лечения и контроля
Table 4. Median Me (Q1; Q3) values of lactate, pyruvate and 2,3-diphosphoglycerate concentration levels in erythrocytes of patients in the study group before treatment and the control
|
Показатели |
Группа |
Уровень статистической значимости, p* |
|
|
Основная (n = 25) |
Контрольная (n = 25) |
||
|
Лактат, ммоль/л |
10,20 (9,32; 10,92), n = 24 |
3,47 (2,91; 3,84), n = 22 |
<0,001 |
|
ПВК, ммоль/л |
2,16 (1,60; 2,36), n = 25 |
5,20 (0,23; 5,60), n = 25 |
0,029 |
|
2,3-ДФГ, ммоль/л |
13,30 (9,69; 26,82), n = 25 |
7,19 (5,85; 21,29), n = 24 |
0,139 |
Примечания: таблица составлена авторами; р* — статистическая значимость согласно критерию Манна — Уитни; при расчете показателей не учитывались числовые значения выбросов, искажающих общую тенденцию, поэтому количество данных в группе может быть меньше количества лиц в группе. Сокращения: ПВК — пируват; 2,3-ДФГ — 2,3-дифосфоглицерат.
Notes: the table was compiled by the authors; p* — statistical significance according to the Mann — Whitney test; numerical values of outliers distorting the general trend were not considered in the calculation of indicators, and therefore the amount of data in the group may be less than the number of individuals in the group. Abbreviations: ПВК — pyruvate, 2,3-ДФГ — 2,3-diphosphoglycerate.
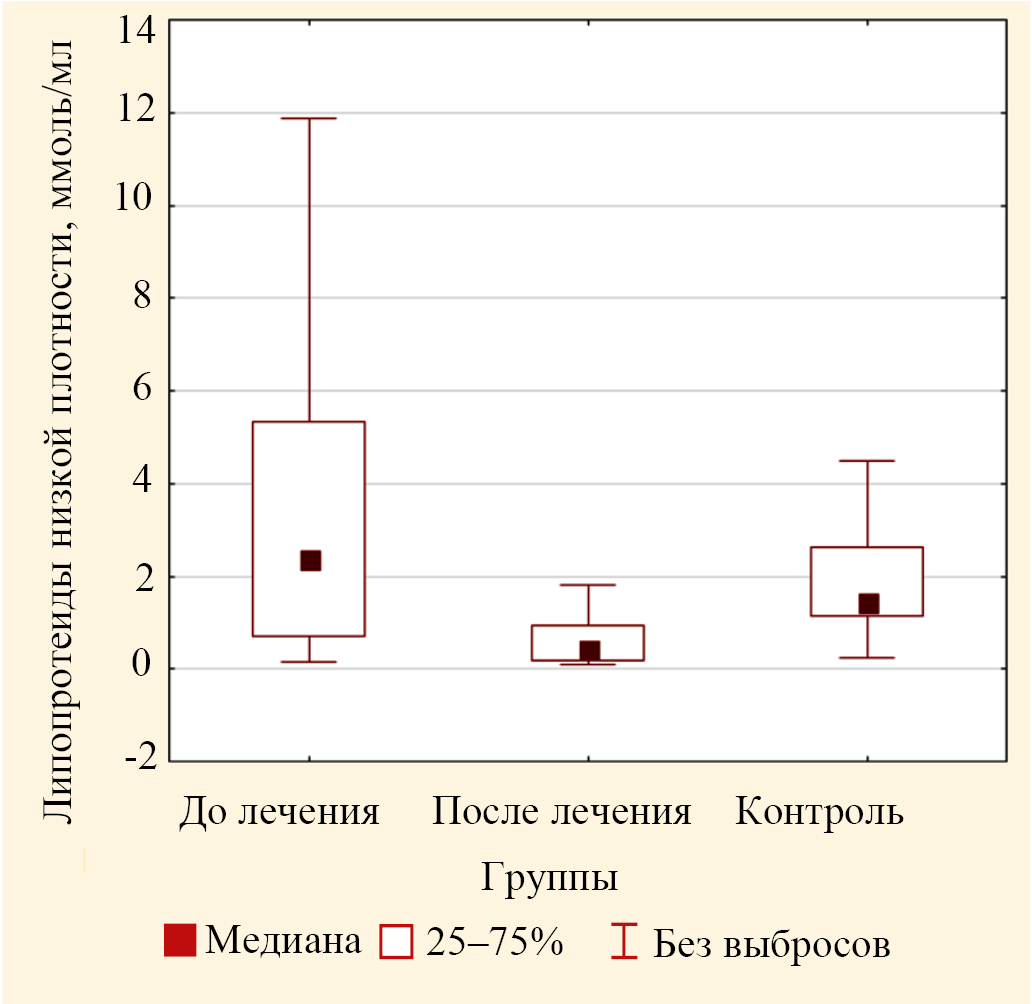
Рис. 6. Значения медиан концентрации липопротеидов низкой плотности в крови пациентов основной группы до лечения и после лечения и в крови лиц группы контроля (выбросы не включены)
Примечание: рисунок выполнен авторами.
Fig. 6. Values of median concentrations of low-density lipoproteins in the blood of patients of the study group before and after treatment and in the blood of the control group (outliers not included)
Note: the figure was created by the authors.
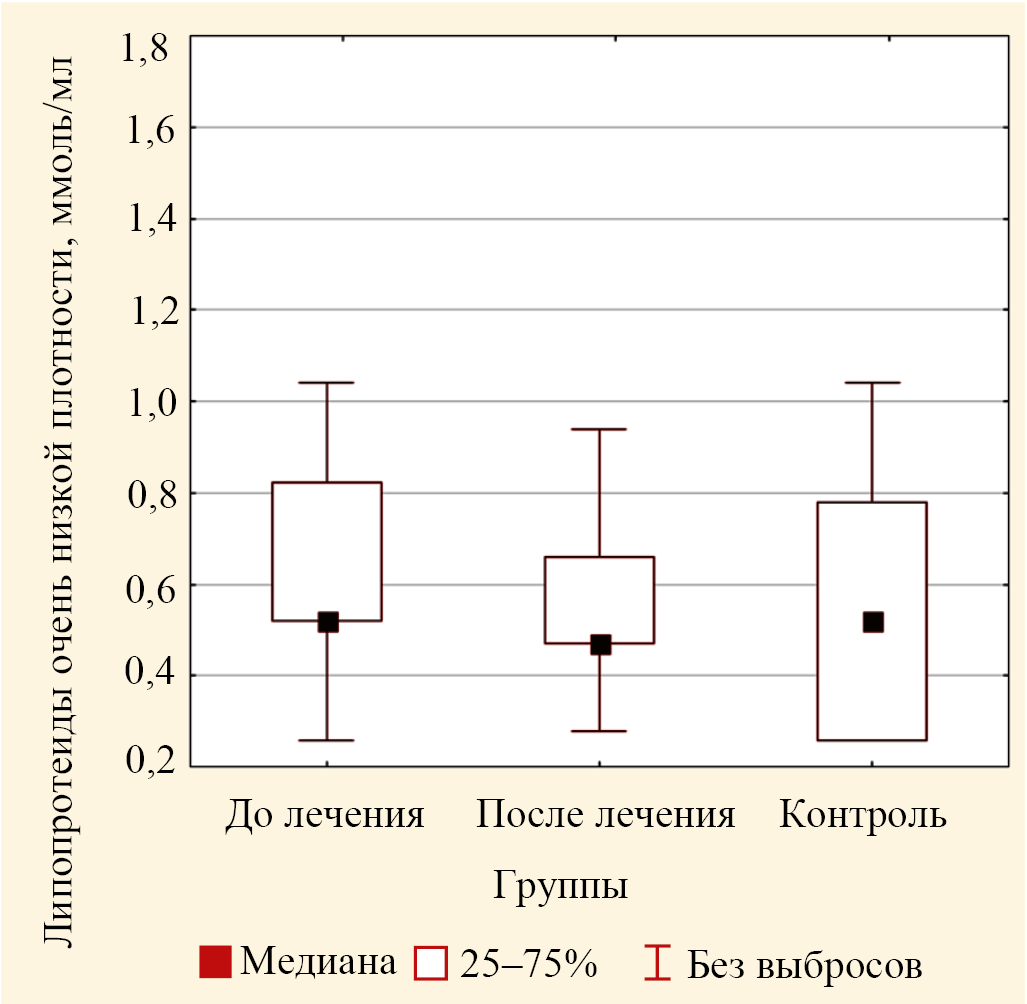
Рис. 7. Значения медиан концентрации липопротеидов очень низкой плотности в крови пациентов основной группы до лечения и после лечения и в крови лиц группы контроля (выбросы не включены)
Примечание: рисунок выполнен авторами.
Fig. 7. Values of median concentrations of very low density lipoproteins in the blood of the patients of the study group before and after treatment and in the blood of the control group (outliers not included)
Note: the figure was created by the authors.
Таблица 5. Медианные значения Me (Q1; Q3) уровней концентрации лактата, пирувата и 2,3-дифосфоглицерата в эритроцитах пациентов в основной группе до лечения и после лечения
Table 5. Median Me (Q1; Q3) values of lactate, pyruvate and 2,3-diphosphoglycerate concentration levels in erythrocytes of patients in the study group before and after treatment
|
Показатели |
Сроки наблюдения |
Уровень статистической значимости, p* |
|
|
До лечения |
После лечения |
||
|
Лактат, ммоль/л, |
10,20 (9,32; 10,92), n = 24 |
3,18 (2,70; 3,72), n = 22 |
<0,001 |
|
ПВК, ммоль/л |
2,16 (1,60; 2,36), n = 25 |
2,28 (0,24; 2,48), n = 25 |
0,162 |
|
2,3-ДФГ, ммоль/л |
13,30 (9,69; 26,82), n = 25 |
10,86 (3,67; 21,42), n = 25 |
0,288 |
Примечания: таблица составлена авторами; р* — статистическая значимость согласно парному критерию Вилкоксона; при расчете показателей не учитывались числовые значения выбросов, искажающих общую тенденцию, поэтому количество данных в группе может быть меньше количества лиц в группе. Сокращения: ПВК — пируват; 2,3-ДФГ — 2,3-дифосфоглицерат.
Notes: the table was compiled by the authors; p* — statistical significance according to the paired Wilcoxon test; numerical values of outliers distorting the general trend were not considered in the calculation of indicators, and therefore the amount of data in the group may be less than the number of individuals in the group. Abbreviations: ПВК — pyruvate, 2,3-ДФГ — 2,3-diphosphoglycerate.
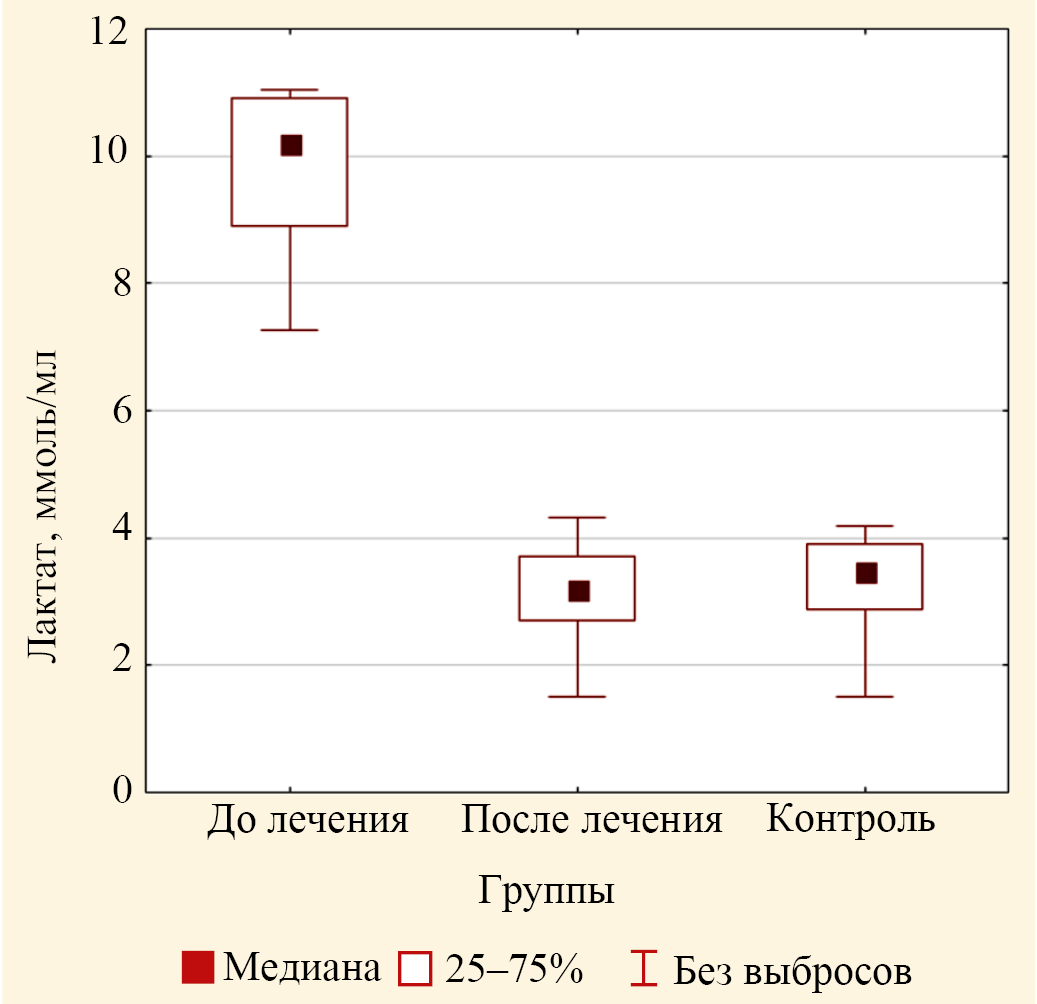
Рис. 8. Значения медиан концентрации лактата в эритроцитах пациентов основной группы до лечения и после лечения и лиц группы контроля (выбросы не включены)
Примечание: рисунок выполнен авторами.
Fig. 8. Values of medians of lactate concentration in erythrocytes of patients of the study group before and after treatment and control group (outliers not included)
Note: the figure was created by the authors.
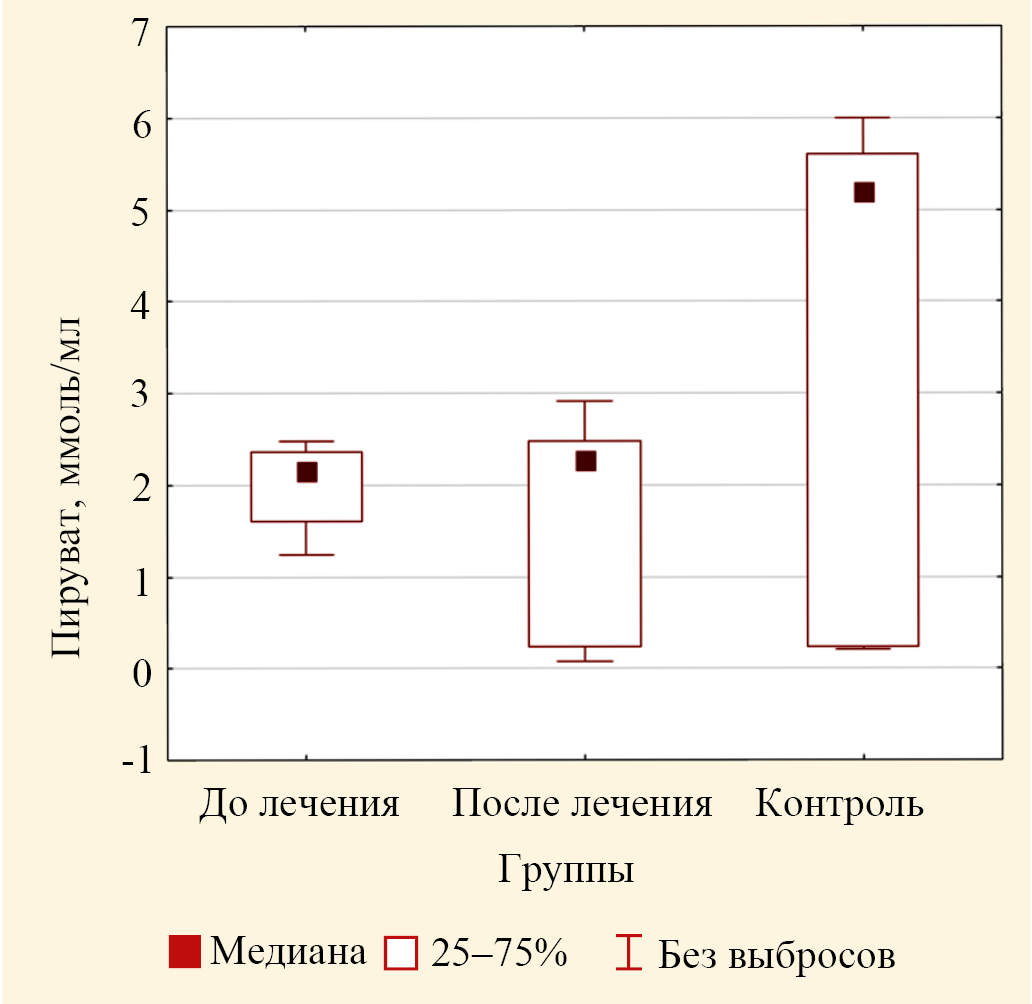
Рис. 9. Значения медиан концентрации пирувата в эритроцитах пациентов основной группы до лечения и после лечения и лиц группы контроля (выбросы не включены)
Примечание: рисунок выполнен авторами.
Fig. 9. Values of medians of pyruvate concentration in erythrocytes of patients of the study group before and after treatment and control group (outliers not included)
Note: the figure was created by the authors.
Таблица 6. Медианные значения Me (Q1; Q3) клинических индексов пациентов для различных шкал в основной группе «до лечения» и «после лечения»
Table 6. Median Me (Q1; Q3) values of patients’ clinical indices for different scales in the study group “before treatment” and “after treatment”
|
Шкала |
Сроки наблюдения |
Уровень статистической значимости, p* |
|
|
До лечения (n = 25) |
После лечения (n = 25) |
||
|
MASI, балл |
12,0 (7,2; 13,2) |
2,7 (1,8; 2,7) |
<0,001 |
|
mMASI, балл |
7,3 (6,6; 7,6) |
2,4 (1,2; 3,0) |
<0,001 |
Примечания: таблица составлена авторами; р* — статистическая значимость согласно парному критерию Вилкоксона. Сокращения: MASI — The Melasma Area and Severity Index; mMASI — The modified Melasma Area and Severity Index.
Notes: the table was compiled by the authors; p* — statistical significance according to the paired Wilcoxon test. Abbreviations: MASI — The Melasma Area and Severity Index; mMASI — The modified Melasma Area and Severity Index.
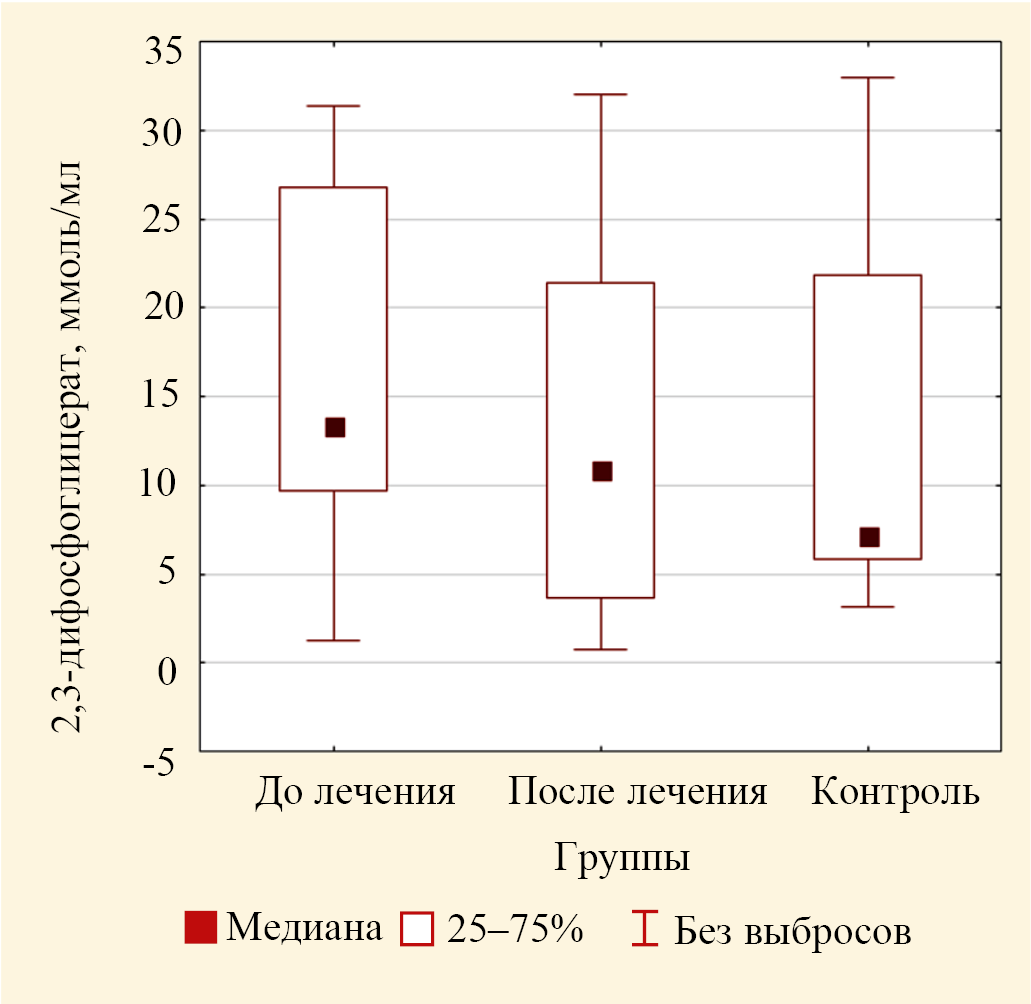
Рис. 10. Значения медиан концентрации 2,3-дифосфоглицерата в эритроцитах пациентов основной группы до лечения и после лечения и лиц группы контроля (выбросы не включены)
Примечание: рисунок выполнен авторами.
Fig. 10. Values of medians of 2,3-diphosphoglycerate concentration in erythrocytes of patients of the study group before treatment and after treatment and control group (outliers not included)
Note: the figure was created by the authors.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
На основании проведенного исследования было установлено, что среди пациентов основной группы статистически значимо было повышено в сыворотке крови содержание ОХ, ТГ. В контрольной группе данные показатели были в рамках референсных значений. При этом показатели после лечения в основной клинической группе имели значения, близкие к контрольным. Повышенные уровни ЛПНП и ЛПОНП, зафиксированные в группе до лечения, могут рассматриваться как компенсаторная реакция на усиление липидного и структурного метаболизма в коже. После лечения наблюдалась положительная динамика — снижение уровней ОХ, ТГ, ЛПНП при одновременном повышении ЛПВП, что свидетельствует о нормализации уровня транспортных форм липидов и подтверждает системный эффект проводимой терапии. Снижение концентрации пирувата в сторону увеличения лактата в эритроцитах пациентов с гиперпигментацией свидетельствует о неравномерном распределении кислорода в коже, нарушении микроциркуляции в патологическом очаге. А именно об изменении приоритета потребления кислорода не только на тканевое дыхание, но и на обеспечение усиленного меланогенеза. У пациентов основной клинической группы после лечения концентрация лактата приближалась к референсным значениям. После курса лечения концентрация лактата приблизилась к норме и сравнялась со значениями в контрольной группе, в то время как уровень пирувата достоверно не изменился, а уровень 2,3-ДФГ снизился. Произошедшие изменения могут свидетельствовать о восстановлении микроциркуляции и нормализации тканевого дыхания. Стабилизация показателей после терапии демонстрирует не только локальное, но и возможное системное воздействие терапии на восстановление метаболического гомеостаза.
Ограничения исследования
Не выявлены.
Интерпретация результатов исследования
При анализе результатов было установлено, что у пациентов с гиперпигментацией значимо увеличен уровень отдельных классов липопротеидов, таких как триацилглицериды и общий холестерин. Изменения данных показателей свидетельствуют о постоянной потребности клеток в синтезе мембранных липидов и поддержании повышенного клеточного метаболизма, который необходим для повышенной регенерации эпидермиса. Физиологическая роль липопротеидов в обеспечении транспорта холестерина и триглицеридов к периферическим тканям имеет важное значение в условиях интенсивной пролиферации и метаболической активности эпидермальных клеток. Гиперактивность меланоцитов и кератиноцитов в очагах гиперпигментации требует повышенного поступления как энергетических субстратов, так и компонентов для построения клеточных мембран и синтеза меланина.
Нарушение газотранспортной и энергетической функции эритроцитов у пациенток с гиперпигментацией основной группы до лечения говорит об активации анаэробного гликолиза в условиях тканевой гипоксии. Данные изменения обусловлены нарушением микроциркуляции в дерме, особенно в зоне гиперпигментации, где потребление кислорода повышено вследствие меланогенеза. Гипоксия в данном случае может быть связана как с очаговым сосудистым спазмом или перегрузкой капиллярного русла, так и с неравноценным перераспределением кислорода между метаболически активными клетками. Результаты свидетельствуют об изменении локальной оксигенации патологической ткани с вовлечением метаболических систем жизнеобеспечения, к которым можно отнести циркулирующий эритроцитарный пул, запускающий как механизмы повреждения, так и формирование защитно-адаптационных реакций, реализуемых на молекулярно-мембранном уровне и направленных на обеспечение тканевого гомеостаза и приспособление клеточной популяции в целом.
Процесс гиперпигментации, вероятно, тесно связан с изменениями в микроциркуляции и, как следствие, с нарушением кислородного транспорта. Изучение функционального состояния эритроцитов в обеспечении метаболической регуляции их кислородтранспортной функции позволяет подробнее изучить их возможную роль в процессе формирования гиперпигментаций. Такие показатели, как концентрация лактата, пирувата и уровень 2,3-ДФГ, позволяют оценить способность эритроцитов переносить кислород и поддерживать гомеостаз. Относительное постоянство 2,3-ДФГ в клинической группе указывает на наличие адаптационных механизмов, которые позволяют предположить, что поступает к коже нормальное количество кислорода, но расходуется оно различным образом. Это свидетельствует о том, что эритроциты могут адаптироваться к изменяющимся условиям, поддерживая свою структурно-функциональную целостность.
Таким образом, повышенная концентрация лактата на фоне сохранения постоянного уровня 2,3-ДФГ говорит о том, что часть кислорода используется не на тканевое дыхание, а на усиленный синтез меланина и насыщение им соседних кератиноцитов. Другими словами, происходит изменение приоритета потребления кислорода в сторону синтеза меланина. Увеличение концентрации лактата можно рассматривать как приспособительную реакцию на процесс усиления потребления кислорода тканью и клетками при гиперпигментации [31][32].
В складывающейся метаболической ситуации усиленный синтез меланина требует участия большого количества кислорода. Активация синтеза меланина в меланоците, связанного с гиперпигментацией, а также передача его окружающим кератиноцитам сопровождается еще более повышенным потреблением кислорода, что приводит к его неравномерному распределению между структурами клеток и метаболическими путями.
Одним из клинических признаков гиперпигментаций кожи является локализованный гиперкератоз в патологическом очаге, который обусловлен высоким уровнем клеточной пролиферации и накоплением меланина в клетках [3]. Процессы клеточной пролиферации и гиперкератоз имеют прямую связь с увеличенной потребностью эпидермиса в липидах. Следует отметить, что транспортными формами липидов в крови являются липопротеиды различных классов, которые играют ключевую роль в поддержании гомеостаза холестерина. Поэтому функциональное и физико-химическое состояние данных транспортных структур представляется важным звеном в оценке адаптивных возможностей организма [33][34]. Изменение соотношения различных фракций липопротеидов может стать возможным предиктором формирования гиперпигментации кожи.
Воздействие ультрафиолетового солнечного излучения инициирует воспалительные реакции в коже, что приводит к усиленной активности меланоцитов и образованию гиперпигментированных участков [35][36]. При системном воспалении наблюдается увеличение содержания липидов и изменение профиля липопротеидов в крови, что имеет типовой стереотипный защитный характер. Это возрастание связано с тем, что липопротеины уменьшают токсичность липополисахаридов и действуют как скевенджеры свободных радикалов, угнетая перекисные процессы [36]. То есть адаптационные реакции на уровне липидного обмена играют важную роль в защите кожи от повреждений, вызванных воспалением и солнечным излучением.
Очевидно, высокий уровень концентрации ЛПНП, который в нашем исследовании был равен 2,38 (0,70; 5,33) ммоль/л для пациентов с приобретенными гиперпигментациями кожи, связан с активным поступлением эфиров холестерина в эпидермальный слой, которые гидролизуются до своих мономеров, используемых на построение клеточных мембран, а высшие жирные кислоты (ВЖК) активно используются в обеспечении энергозатрат патологического процесса.
Согласно последним исследованиям, процесс фотостарения и пигментации связывают с метаболическим перепрограммированием, обеспечиваемым окислением жирных кислот4. Переключение в метаболических процессах может быть связано с заметным увеличением дермальной белой жировой ткани (dWat) в стареющей коже. Кожные адипоциты проходят циклические процессы дедифференцировки и редифференцировки, что приводит к повышенному высвобождению свободных жирных кислот во внеклеточное пространство в процессе дифференцировки [35][36]. Одним из критически важных факторов, влияющих на эти процессы, является белок адипонектин5, который регулирует множественную активность посредством эндокринных, паракринных или аутокринных механизмов [37]. А также выявлены окислительные модификации фосфолипидов в стареющих дермальных фибробластах, которые ассоциированы с секреторным фенотипом, характерным для старения. Вероятно, взаимосвязь данных процессов имела отражение и в нашем исследовании.
Известно, что продукты перекисного окисления липидов (ПОЛ) играют ключевую роль в патогенезе различных дерматологических нарушений, включая приобретенные гиперпигментации кожи. Пероксидация липидного бислоя приводит к повреждению клеточных мембран, что, в свою очередь, вызывает их разрушение и высвобождение лизосомальных ферментов. Эти ферменты активируют образование вазоактивных веществ, таких как гистамин и брадикинин. В результате возникает воспалительная реакция, которая способствует еще большему истощению энергетического потенциала клеток, особенно в условиях недостаточной оксигенации. Эти механизмы могут ускорять повреждение тканей и усугублять симптомы гиперпигментации. Известно, что воспаление как физиологическое явление вызывает изменение транспортных форм липидов, так имеет место и обратное явление, проявляющееся в клинических проявлениях на фоне нарушения липидного обмена [38, 39].
Постоянная перестройка основных макромолекулярных компонентов приводит к необходимым изменениям клеточного окружения. Процессы перестройки межклеточного вещества являются важной составной частью физиологического ремоделирования ткани [35][38].
ЗАКЛЮЧЕНИЕ
В результате исследования выявлено, что у пациентов с гиперпигментацией статистически значимо увеличены уровни концентрации отдельных классов липопротеидов, общего холестерина, равного 6,32 (5,44; 11,37) ммоль/л, и триглицеридов, равного 1,72 (1,15; 2,05) ммоль/л, по сравнению с уровнями концентрации аналогичных липопротеидов у лиц контрольной группы, что может свидетельствовать о постоянной потребности клеток в синтезе мембранных липидов и поддержании повышенного клеточного метаболизма, который необходим для повышенной регенерации эпидермиса. Повышение концентрации лактата у пациентов с гиперпигментациями (10,20 (9,32; 10,92) ммоль/л) и относительная нормализация концентрации лактата после лечения свидетельствуют об изменении приоритета потребления поступающего кислорода в клетку, участвующего не только в процессе тканевого дыхания, но и в усиленном синтезе и насыщении клеток меланином. Формирующаяся хроническая тканевая гипоксия, которая сопровождает нарушения микроциркуляции при гиперпигментациях кожи, является мощным стимулятором активации перекисного окисления липидов, а также определяет изменение соотношения отдельных классов липопротеидов.
Возникает необходимость дальнейшего изучения системных адаптационных механизмов у пациентов, страдающих гиперпигментацией, для понимания механизмов ее формирования. Целесообразность изучения системного биохимического профиля у пациентов с гиперпигментациями кожи позволит разработать оптимальные схемы медикаментозной коррекции.
1 Общероссийская общественная организация «Российское общество дерматовенерологов и косметологов». Клинические рекомендации. Хлоазма. 2022.
Общероссийская общественная организация «Российское общество дерматовенерологов и косметологов». Клинические рекомендации. Послевоспалительная гиперпигментация. 2022.
2 Там же.
3 Луганова И. С., Блинов М. Н. Определение 2,3-БФГ неэнзиматическим методом и АТФ в эритроцитах больных хроническим лимфолейкозом. Лабораторное дело. 1975;7:652–654.
4 Бауманн Л. Косметическая дерматология: принципы и практика. М.: Медпресс-информ, 2021. 692 с.
5 Хабаров В. Н. Коллаген в эстетической дерматологии. М.: ГЭОТАР-Медиа, 2017. 240 с.
Список литературы
1. Muller B, Flament F, Jouni H, Sextius P, Tachon R, Wang Y, Wang H, Qiu H, Qiu J, Amar D, Delaunay C, Jablonski NG, Passeron T. A Bayesian network meta-analysis of 14 molecules inhibiting UV daylight-induced pigmentation. J Eur Acad Dermatol Venereol. 2024;38(8):1566– 1574. https://doi.org/10.1111/jdv.19910
2. Lambert KA, Clements CM, Mukherjee N, Pacheco TR, Shellman SX, Henen MA, Vögeli B, Goldstein NB, Birlea S, Hintzsche J, Caryotakis G, Tan AC, Zhao R, Norris DA, Robinson WA, Wang Y, VanTreeck JG, Shellman YG. SASH1 S519N Variant Links Skin Hyperpigmentation and Premature Hair Graying to Dysfunction of Melanocyte Lineage. J Invest Dermatol. 2025;145(1):144–154.e3. https://doi.org/10.1016/j.jid.2024.04.027
3. Tisack A, Mohammad TF. Drug-Induced Pigmentation: A Review. Drugs. 2024;84(9):1071–1091. https://doi.org/10.1007/s40265-024-02062-z
4. Lee KW, Cho YY, Kim KD. RCHY1 and OPTN: an E3-ligase and an autophagy receptor required for melanophagy, respectively. Autophagy. 2024;20(10):2352–2353. https://doi.org/10.1080/15548627.2024.237 0058
5. da Rosa GP, Vide J, Azevedo F, Mota A. Skin hyperpigmentation heralding an ectopic adrenocorticotropic hormone production. J Dermatol. 2024;51(8):e251–e252. https://doi.org/10.1111/1346-8138.17323
6. Sharma AN, Kincaid CM, Mesinkovska NA. The Burden of Melasma: Race, Ethnicity, and Comorbidities. J Drugs Dermatol. 2024;23(8):691– 693. https://doi.org/10.36849/JDD.8233
7. Thawabteh AM, Jibreen A, Karaman D, Thawabteh A, Karaman R. Skin Pigmentation Types, Causes and Treatment-A Review. Molecules. 2023;28(12):4839. https://doi.org/10.3390/molecules28124839
8. Doolan BJ, Gupta M. Melasma. Aust J Gen Pract. 2021;50(12):880–885. https://doi.org/10.31128/AJGP-05-21-6002
9. Shenoy A, Madan R. Post-Inflammatory Hyperpigmentation: A Review of Treatment Strategies. J Drugs Dermatol. 2020 Aug 1;19(8):763–768. https://doi.org/10.36849/JDD.2020.4887
10. Mar K, Maazi M, Khalid B, Ahmed R, Wang OJE, Khosravi-Hafshejani T. Prevention of Post-Inflammatory Hyperpigmentation in Skin of Colour: A Systematic Review. Australas J Dermatol. 2025;66(3):119–126. https://doi.org/10.1111/ajd.14432
11. Wakamatsu K, Ito S. Recent Advances in Characterization of Melanin Pigments in Biological Samples. Int J Mol Sci. 2023;24(9):8305. https://doi.org/10.3390/ijms24098305.
12. Wiriyasermkul P, Moriyama S, Nagamori S. Membrane transport proteins in melanosomes: Regulation of ions for pigmentation. Biochim Biophys Acta Biomembr. 2020;1862(12):183318. https://doi.org/10.1016/j.bbamem.2020.183318
13. Wang F, Ma W, Fan D, Hu J, An X, Wang Z. The biochemistry of melanogenesis: an insight into the function and mechanism of melanogenesis-related proteins. Front Mol Biosci. 2024;11:1440187. https://doi.org/10.3389/fmolb.2024.1440187
14. Zhou S, Zeng H, Huang J, Lei L, Tong X, Li S, Zhou Y, Guo H, Khan M, Luo L, Xiao R, Chen J, Zeng Q. Epigenetic regulation of melanogenesis. Ageing Res Rev. 2021;69:101349. https://doi.org/10.1016/j.arr.2021.101349
15. Longo DL, Stefania R, Aime S, Oraevsky A. Melanin-Based Contrast Agents for Biomedical Optoacoustic Imaging and Theranostic Applications. Int J Mol Sci. 2017;18(8):1719. https://doi.org/10.3390/ijms18081719
16. Malik S, Le L, Boissy RE, Brideau-Andersen A, Sondergaard B. Botulinum neurotoxin type DC (BoNT/DC) cleavage of VAMP3 reduces melanin production in melanocytes. Toxicon. 2025;261:108372. https://doi.org/10.1016/j.toxicon.2025.108372
17. Naik PP, Farrukh SN. Influence of Ethnicities and Skin Color Variations in Different Populations: A Review. Skin Pharmacol Physiol. 2022;35(2):65–76. https://doi.org/10.1159/000518826
18. Wang Y, Xiong B, Xing S, Chen Y, Liao Q, Mo J, Chen Y, Li Q, Sun H. Medicinal Prospects of Targeting Tyrosinase: A Feature Review. Curr Med Chem. 2023;30(23):2638–2671. https://doi.org/10.2174/0929867329 666220915123714
19. Babbush KM, Babbush RA, Khachemoune A. The Therapeutic Use of Antioxidants for Melasma. J Drugs Dermatol. 2020;19(8):788–792. https://doi.org/10.36849/JDD.2020.5079
20. Бычкова Н.Ю., Лемытская В.Е., Соколовская Ю.А., Жукова О.В., Касихина Е.И. Обзор современных методов лечения мелазмы. Медицинский совет. 2024;18(14):108–116. https://doi.org/10.21518/ms2024-349
21. Иконникова Е.В., Корчажкина Н.Б., Стенько А.Г. Лазерные технологии в коррекции неопухолевых меланиновых гиперпигментаций кожи. Физиотерапия, бальнеология и реабилитация. 2018;17(1):19– 24. http://dx.doi.org/10.18821/1681-3456-2018-17-1-19-24
22. Zhang C, Wu T, Shen N. Effect of platelet-rich plasma combined with tranexamic acid in the treatment of melasma and its effect on the serum levels of vascular endothelial growth factor, endothelin-1 and melatonin. Pak J Med Sci. 2022;38(8):2163–2168. https://doi.org/10.12669/pjms.38.8.6786
23. Espósito ACC, Cassiano DP, da Silva CN, Lima PB, Dias JAF, Hassun K, Bagatin E, Miot LDB, Miot HA. Update on Melasma-Part I: Pathogenesis. Dermatol Ther (Heidelb). 2022;12(9):1967–1988. https://doi.org/10.1007/s13555-022-00779-x
24. Свирщевская Е.В., Матушевская Е.В. Роль липидов в барьерных свойствах кожи. Клиническая дерматология и венерология. 2019;18(3):360–365. https://doi.org/10.17116/klinderma201918031360
25. Baker P, Huang C, Radi R, Moll SB, Jules E, Arbiser JL. Skin Barrier Function: The Interplay of Physical, Chemical, and Immunologic Properties. Cells. 2023;12(23):2745. https://doi.org/10.3390/cells12232745
26. Iranmanesh B, Khalili M, Mohammadi S, Amiri R, Aflatoonian M. The efficacy of energy-based devices combination therapy for melasma. Dermatol Ther. 2021;34(3):e14927. https://doi.org/10.1111/dth.14927
27. Shah SD, Aurangabadkar SJ. Laser Toning in Melasma. J Cutan Aesthet Surg. 2019;12(2):76–84. https://doi.org/10.4103/JCAS.JCAS_179_18
28. Балтабаев М.К., Курбанова Д.Ч. Оптимизация методов лечения мелазмы (хлоазмы). Научное обозрение Медицинские науки. 2023;3:73–79. http://dx.doi.org/10.17513/srms.1345
29. Dyce BJ, Bessman SP. A rapid nonenzymatic assay for 2,3-DPG in multiple specimens of blood. Arch Environ Health. 1973;27(2):112–115. https://doi.org/10.1080/00039896.1973.10666331
30. Pandya AG, Hynan LS, Bhore R, Riley FC, Guevara IL, Grimes P, Nordlund JJ, Rendon M, Taylor S, Gottschalk RW, Agim NG, Ortonne JP. Reliability assessment and validation of the Melasma Area and Severity Index (MASI) and a new modified MASI scoring method. J Am Acad Dermatol. 2011;64(1):78–83, 83.e1–2. https://doi.org/10.1016/j.jaad.2009.10.051
31. Алиева А.С., Усова Е.И., Звартау Н.Э., Шляхто Е.В. Результаты первого этапа имплементационного исследования по внедрению клинических рекомендаций по нарушениям липидного обмена в рутинную практику. Российский кардиологический журнал. 2024;29(1):5724. https://doi.org/10.15829/1560-4071-2024-5724
32. Ежов М.В., Сергиенко И.В., Кухарчук В.В. Клинические рекомендации по нарушениям липидного обмена 2023. Что нового? Атеросклероз и дислипидемии. 2023;3(52):5–9. https://doi.org/10.34687/2219-8202.JAD.2023.03.0001
33. Sochorová M, Audrlická P, Červená M, Kováčik A, Kopečná M, Opálka L, Pullmannová P, Vávrová K. Permeability and microstructure of cholesterol-depleted skin lipid membranes and human stratum corneum. J Colloid Interface Sci. 2019;535:227–238. https://doi.org/10.1016/j.jcis.2018.09.104
34. Bonté F, Girard D, Archambault JC, Desmoulière A. Skin Changes During Ageing. Subcell Biochem. 2019;91:249–280. https://doi.org/10.1007/978-981-13-3681-2_10
35. Хабаров В.Н. Коллаген, эластин, гиалуроновая кислота в молекулярной косметологии. М.: ГЭОТАР-Медиа; 2024. 21 с. https://doi.org/10/33029/9704-7993-3-KEG-2024-1-368
36. Cayo A, Segovia R, Venturini W, Moore-Carrasco R, Valenzuela C, Brown N. mTOR Activity and Autophagy in Senescent Cells, a Complex Partnership. Int J Mol Sci. 2021;22(15):8149. https://doi.org/10.3390/ijms22158149
37. Narzt MS, Pils V, Kremslehner C, Nagelreiter IM, Schosserer M, Bessonova E, Bayer A, Reifschneider R, Terlecki-Zaniewicz L, Waidhofer-Söllner P, Mildner M, Tschachler E, Cavinato M, Wedel S, Jansen-Dürr P, Nanic L, Rubelj I, El-Ghalbzouri A, Zoratto S, Marchetti-Deschmann M, Grillari J, Gruber F, Lämmermann I. Epilipidomics of Senescent Dermal Fibroblasts Identify Lysophosphatidylcholines as Pleiotropic Senescence-Associated Secretory Phenotype (SASP) Factors. J Invest Dermatol. 2021;141(4S):993–1006.e15. https://doi.org/10.1016/j.jid.2020.11.020
38. Kruglikov IL, Zhang Z, Scherer PE. Skin aging: Dermal adipocytes metabolically reprogram dermal fibroblasts. Bioessays. 2022;44(1):e2100207. https://doi.org/10.1002/bies.202100207
39. Тлиш М.М., Шавилова М.Е. Современные возможности поддерживающей терапии и коррекции поствоспалительных изменений кожи у пациентов с акне. Вестник дерматологии и венерологии. 2021;97(4):92–99. https://doi.org/10.25208/vdv1241
Об авторах
М. В. ГлушковаРоссия
Глушкова Мария Владимировна - аспирант кафедры кожных и венерических болезней, пер. Нахичеванский, д. 29, г. Ростов-на-Дону, 344022;
научный руководитель отделения дерматологии и врачебной косметологии клиники, ул. Толмачева, д. 117, ком. 4, г. Ростов-на-Дону, 344090
О. Г. Саркисян
Россия
Саркисян Олег Грачикович - доктор медицинских наук, доцент, заведующий кафедрой общей и клинической биохимии № 1,
пер. Нахичеванский, д. 29, г. Ростов-на-Дону, 344022
О. А. Сидоренко
Россия
Сидоренко Ольга Анатольевна - доктор медицинских наук, профессор, заведующий кафедрой кожных и венерических
болезней,
пер. Нахичеванский, д. 29, г. Ростов-на-Дону, 344022
Дополнительные файлы
Рецензия
Для цитирования:
Глушкова М.В., Саркисян О.Г., Сидоренко О.А. Особенности патогенетических механизмов гиперпигментаций кожи: когортное проспективное исследование. Кубанский научный медицинский вестник. 2025;32(4):33-48. https://doi.org/10.25207/1608-6228-2025-32-4-33-48
For citation:
Glushkova M.V., Sarkisian O.G., Sidorenko O.A. Pathogenetic mechanisms of skin hyperpigmentation: A cohort prospective study. Kuban Scientific Medical Bulletin. 2025;32(4):33-48. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-4-33-48
JATS XML








































