Перейти к:
Мультилокусные модели полиморфных генов и их роль в оценке риска хронического апикального периодонтита: проспективное одноцентровое исследование «случай-контроль»
https://doi.org/10.25207/1608-6228-2025-32-5-18-31
Аннотация
Введение. Хронический апикальный периодонтит — это воспалительное заболевание, ассоциированное с инфекцией корневых каналов, которое представляет значительную проблему в стоматологии. Его распространенность стремительно растет среди взрослого населения. Заболеванию свойственна вариабельность воспалительных реакций и резорбция костной ткани. Генетические факторы играют центральную роль в патогенезе. Однонуклеотидные полиморфизмы оказывают значительное влияние на экспрессию генов и функциональную активность белков. Современные исследования подчеркивают необходимость интеграции генетических данных в клиническую стоматологию.
Цель исследования: определение роли межгенных ассоциаций ключевых генов модуляции воспалительных и иммунных реакций в наследственной предрасположенности к развитию хронического апикального периодонтита.
Методы. Проспективное одноцентровое исследование «случай-контроль» проведено с ноября 2024 по апрель 2025 года на базе федерального государственного бюджетного образовательного учреждения высшего образования «Ярославский государственный медицинский университет» Министерства здравоохранения Российской Федерации и общества с ограниченной ответственностью «Медицинский центр диагностики и профилактики «Содружество». Участвовали 200 пациентов: 150 с хроническим апикальным периодонтитом и 50 здоровых (контроль). Диагноз подтвержден клинически и рентгенологически. Изучены однонуклеотидные полиморфизмы 8 генов: IL-10, IL-1β, TNF-α, GSTP1, CYP1A2, TP53, COL1A1, MMP-9 методом полимеразной цепной реакции в реальном времени. Статистический анализ выполнен с использованием программ JMP Pro v.18.0 (SAS Institute Inc., https://www.jmp.com, 2024), Haplostats v.1.9.7 (Schaid, D. J., & Sinnwell, J. P., Software for haplotype-based association analysis, CШA) и MDR v.3.0.2 (Multifactor Dimensionality Reduction, Source Forge, США). Выявлялись наилучшие модели для различных сочетаний полиморфизмов, имеющие наибольший показатель согласованности (CVC) и наименьшую ошибку предсказания (Testing Balanced Accuracy). Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты. Исследование выявило значимые межгенные взаимодействия, связанные с развитием хронического апикального периодонтита, с использованием MDR-анализа. Трехлокусная модель IL-1β×TNF-α×MMP-9 показала наибольшую прогностическую ценность (сбалансированная точность 79,8 %, перекрестная проверка 10/10), подчеркивая синергию воспалительных цитокинов и протеолитических процессов. Анализ равновесия Харди — Вайнберга выявил отклонения для CYP1A2 и TP53 в группе с хроническим апикальным периодонтитом, указывающие на влияние средовых факторов. Граф Фрюхтермана — Рейнгольда подтвердил сильное взаимодействие между IL-1β и TNF-α, тогда как COL1A1 демонстрировал умеренную связь. Полученные данные свидетельствуют о мультигенной природе предрасположенности к хроническому апикальному периодонтиту и открывают возможности для персонализированной диагностики и терапии, учитывающей комбинированный эффект генов.
Заключение. Результаты исследования могут стать основой для разработки персонализированных стратегий диагностики и лечения, учитывающих генетический профиль пациентов. Интеграция таких подходов позволит улучшить прогнозирование течения заболевания, оптимизировать лечебные подходы и снизить риск развития осложнений патологического процесса.
Для цитирования:
Багрянцева Н.В. Мультилокусные модели полиморфных генов и их роль в оценке риска хронического апикального периодонтита: проспективное одноцентровое исследование «случай-контроль». Кубанский научный медицинский вестник. 2025;32(5):18-31. https://doi.org/10.25207/1608-6228-2025-32-5-18-31
For citation:
Bagryantseva N.V. Multilocus models of polymorphic genes and their role in assessing the risk of chronic apical periodontitis: A prospective single-center case control study. Kuban Scientific Medical Bulletin. 2025;32(5):18-31. https://doi.org/10.25207/1608-6228-2025-32-5-18-31
ВВЕДЕНИЕ
Хронический апикальный периодонтит (ХАП) — воспалительное заболевание периапикальных тканей, ассоциированное с инфекцией корневых каналов, представляет значительную проблему в стоматологической практике. Его распространенность достигает 52 % среди взрослого населения, при этом у 5 % пациентов наблюдаются клинически выраженные формы патологии [1][2]. Заболевание развивается как результат сложного взаимодействия микробной инфекции корневых каналов и генетической предрасположенности, что определяет вариабельность воспалительных реакций, иммунного ответа и резорбции костной ткани. ХАП не только снижает качество жизни пациентов, но и требует комплексных терапевтических подходов, учитывающих индивидуальные особенности патогенеза [3–5].
Генетические факторы играют центральную роль в модуляции патологических процессов при ХАП. Особое внимание уделяется кандидатным генам, таким как провоспалительные цитокины (IL-1β (интерлейкин), TNF-α (фактор некроза опухоли)), противовоспалительные медиаторы (IL-10), матриксные металлопротеиназы (MMP) и регуляторы костного метаболизма [3][6]. Например, полиморфизмы в генах IL-1β и TNF-α ассоциированы с повышенной продукцией провоспалительных маркеров, что усиливает деструкцию тканей [1][4]. Напротив, вариации в гене IL-10 могут ограничивать избыточный иммунный ответ, замедляя прогрессирование заболевания [7]. Экспериментальные данные на моделях животных подтверждают эти наблюдения: блокировка рецептора IL-17RA приводит к выраженной потере костной массы, что подчеркивает роль цитокинов в регуляции остеокластогенеза [2][8].
Однонуклеотидные полиморфизмы (SNPs) — наиболее распространенная форма генетических вариаций, оказывают значимое влияние на экспрессию генов и функциональную активность белков [2][5][7]. Так, SNPs в гене CYP2D6, участвующем в метаболизме ксенобиотиков, могут снижать эффективность лекарственной терапии за счет изменения фармакокинетики препаратов [9]. Полиморфизмы TP53, регулирующего апоптоз и репарацию ДНК, ассоциированы с нарушением элиминации поврежденных клеток, что способствует хронизации воспаления [10]. Вариации в гене COL1A1, ответственном за синтез коллагена I типа, влияют на структурную целостность периодонтальной связки и регенерацию костной ткани [11]. Интересен парадоксальный эффект SNPs в гене MMP-9: снижение протеолитической активности фермента может приводить к накоплению поврежденных белков, усиливая воспалительный ответ, несмотря на теоретическое замедление резорбции кости [12].
Современные исследования подчеркивают необходимость интеграции генетических данных в клиническую практику. Анализ равновесия Харди — Вайнберга (HWE) для SNPs выявил значимые отклонения в контрольных группах, что может отражать влияние внешних факторов, таких как воздействие токсинов, на распределение генотипов [4][13]. Например, для CYP1A2 отклонения от HWE в контрольной популяции указывают на связь его полиморфизмов с метаболизмом ксенобиотиков, что требует учета при интерпретации данных [14].
Цель исследования — определение роли межгенных ассоциаций ключевых генов модуляции воспалительных и иммунных реакций в наследственной предрасположенности к развитию хронического апикального периодонтита.
МЕТОДЫ
Дизайн исследования
Проведено одноцентровое проспективное исследование типа «случай-контроль». Исследование включало две группы пациентов: группу пациентов с хроническим апикальным периодонтитом (n = 150) и контрольную группу (n = 50) здоровых пациентов без признаков воспалительных заболеваний. Лечение ХАП заключалось в удалении пораженного зуба.
Условия проведения исследования
Работа выполнена на базе федерального государственного бюджетного образовательного учреждения высшего образования «Ярославский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО ЯГМУ Минздрава России) на кафедре клинической стоматологии и челюстно-лицевой хирургии № 1 и стоматологического отделения общества с ограниченной ответственностью «Медицинский центр диагностики и профилактики «Содружество» с ноября 2024 по апрель 2025 года.
Критерии соответствия
Критерии включения
Для всех исследуемых групп: пациенты обоего пола в возрасте от 18 до 65 лет; добровольное согласие на участие в исследовании;
— для основной группы: наличие верифицированного диагноза «хронический апикальный периодонтит»; возможность удаления пораженного зуба;
— для контрольной группы: санированная полость рта (отсутствие зубов с пульпитом или хроническим апикальным периодонтитом).
Критерии невключения
Для всех исследуемых групп: пациенты с острым апикальным периодонтитом; присутствие стоматита или других инфекционных воспалений полости рта; курение; наличие сахарного диабета и/или хронических воспалительных заболеваний; беременность или период лактации; прием антибиотиков, кортикостероидов или нестероидных противовоспалительных средств (НПВС) за месяц до начала исследования; история химиотерапии или предшествующего облучения головы/шеи; ранее выполненная операция резекции верхушки корня или наличие перелома корня на пораженном зубе, осложнения в процессе заживления.
Критерии исключения
Для всех исследуемых групп: отказ от участия в исследовании; расстройства личности, которые могли затруднить понимание и выполнение рекомендаций врача; пациенты, у которых изменилось состояние здоровья или были проведены хирургические вмешательства на момент исследования.
Описание критериев соответствия (диагностические критерии)
Отбор пациентов включал наличие диагноза «хронический апикальный периодонтит», который был верифицирован клинически и рентгенологически. Заболевание характеризовалось деструкцией костной ткани в области верхушки одного или нескольких корней пораженного зуба. Пораженный зуб удалялся ввиду невозможности терапевтического лечения. Контрольная группа состояла из пациентов без признаков воспалительных заболеваний периодонта, которые регулярно проходили стоматологические осмотры и имели полностью санированную полость рта.
Подбор участников в группы
В исследование были включены 200 пациентов, которые были разделены на две группы. Основную группу (случай) составили 150 пациентов, которые имели верифицированный хронический апикальный периодонтит (ХАП). Одновременно была сформирована группа контроля (контроль), представленная условно здоровыми добровольцами в количестве 50 человек. В описании критериев соответствия приведена детализация в подборе участников.
Целевые показатели исследования
Основные показатели исследования
Определение роли межгенных ассоциаций ключевых генов модуляции воспалительных и иммунных реакций в наследственной предрасположенности к развитию хронического апикального периодонтита. Выявление наилучших моделей для различных сочетаний полиморфизмов, имеющих наибольший показатель согласованности (CVC) и наименьшую ошибку предсказания (Testing Balanced Accuracy).
Дополнительные показатели исследования
Оценка различий распределения генотипов полиморфных вариантов изучаемых генов.
Методы измерения целевых показателей
Путем венепункции локтевой вены у всех пациентов проводился забор крови в вакуумную пробирку Lab-Vac (Shandong Chengwu Medical Products Factory, Китай) объемом 6 мл. Транспортировка и хранение материала осуществлялись в течение 12 часов после взятия. Далее проводился анализ однонуклеотидных полиморфизмов (SNP) методом полимеразной цепной реакции с флуоресцентной схемой детекции продуктов в режиме реального времени (ПЦР-РВ). Для анализа выделенной из лейкоцитов цельной крови геномной ДНК человека использовались наборы реагентов для ПЦР-РВ «ДНК-экспресс-кровь» (ООО НПФ «Литех», Россия) и «ДНК-Экстран 1» (НПК ЗАО «Синтол», Россия). Реакция амплификации проводилась с использованием «Амплификатора детектирующего “ДТпрайм” модификации 5M3» (ООО «НПО ДНК-Технология», Россия) без стадии электрофореза. Проводились две реакции амплификации с двумя парами аллель-специфичных праймеров для каждого полиморфизма. Для флуоресцентной детекции амплифицированного фрагмента ДНК применялся интеркалирующий асимметричный цианиновый краситель SYBR (Synthetic Bromide) Green I (Molecular Probes Inc., США). Анализ накопления флуоресцентного сигнала по 6-карбоксифлуоресцеин (FAM) каналу осуществляли с использованием программного обеспечения «DT-Master» (ООО «НПО ДНК-Технология», Россия). При наличии гомозиготного генотипа сигнал наблюдался только по одному каналу флуоресценции, в то время как гетерозиготный генотип давал сигнал по обоим каналам. Результаты анализа позволяли определить три типа заключений: гомозигота по аллели 1, гетерозигота и гомозигота по аллели 2. Изучались следующие однонуклеотидные полиморфизмы:
- rs1800896 (c.-1082G>A) гена интерлейкин-10 (IL-10, хромосома 1 в локусе 1q32.1), характеризующийся заменой гуанина на аденин в позиции –1082 относительно транскрипционной стартовой точки (TSS) промоторной области, который ассоциирован с повышенным уровнем экспрессии IL-10;
- rs1143627 (с.-31T>C) гена интерлейкин-1 β (IL-1 β, хромосома 2 в локусе 2q14.1), характеризующийся заменой тимина на цитозин в позиции –31 относительно TSS промоторной области, который ассоциирован со снижением транскрипционной активности и уровня экспрессии IL-1 β;
- rs1800629 (c.-308G>A) гена фактор некроза опухоли альфа (TNF-α, хромосома 6 в локусе 6q21.3), характеризующийся заменой гуанина на аденин в позиции –308 относительно транскрипционной стартовой точки промоторной области, который ассоциирован с повышенной экспрессией TNF- α;
- rs1695 (p.Ile105Val) гена глутатион-S-трансфераза P1 (GSTP1, хромосома 11 в локусе 11q13.2), характеризующийся заменой изолейцина на валин в позиции 105 относительно старт-кодона, который ассоциирован со снижением ферментативной активности GSTP1;
- rs2069522 (с.-2015T>C) гена, кодирующего цитохром P450 1A2 (CYP1A2, хромосома 7 в локусе 7q22.1), характеризующийся заменой тимина на цитозин в позиции 2015 относительно транскрипционной стартовой точки (TSS) промоторной области, который ассоциирован с изменением активности фермента CYP1A2, участвующего в метаболизме ксенобиотиков;
- rs17884159 (с. 215C>T) гена супрессора опухоли P53 (TP53, хромосома 17 в локусе 17q13.1), характеризующийся заменой цитозина на тимин в позиции 215 кодирующей области, что приводит к замене аминокислоты (p.Pro72Arg) и ассоциировано с нарушением функции белка p53;
- rs1107946 (с. 1997G>T) гена, кодирующего коллаген тип 1 A1 (COL1A1, хромосома 17 в локусе 17q21.33), характеризующийся заменой гуанина на тимин в позиции 1997 кодирующей области, что связано с изменением структуры коллагена;
- rs17576 (p.Gln279Arg) гена, кодирующего матриксную металлопептидазу 9 (MMP-9, хромосома 20 в локусе 20q11.2), характеризующийся заменой глутамина на аргинин в позиции 279, которая ассоциирована со снижением протеолитической активности MMP-9.
Переменные (предикторы, конфаундеры, модификаторы эффекта)
Предикторы: неучтенные генетические полиморфизмы.
Конфаундеры: возраст, пол, курение, сопутствующие заболевания.
Модификаторы эффекта: прием лекарственных препаратов, хирургические вмешательства, инфекции полости рта.
Таким образом, переменные, которые бы могли исказить результаты, исходно были отнесены к критериям исключения и отсутствовали в исследуемых группах.
Статистические процедуры
Принципы расчета размера выборки
Размер выборки был рассчитан с учетом мощности исследования, установленной на уровне 80 % при α < 0,05. Рассчитанный минимальный объем выборки составил 45 наблюдений для каждой из групп, учитывая возможное непосещение или позднее исключение.
Статистические методы
Статистический анализ проводился с использованием пакета прикладных программ JMP Pro Statistical Discovery v. 18.0 (SAS Institute Inc., https://www.jmp.com, 2024). Результаты генотипирования были статистически обработаны для проверки их соответствия равновесию Харди — Вайнберга. Категориальные данные описывались через абсолютные и относительные частоты. При многопольной кросс-табуляции для сравнения долей применялся, в зависимости от числа наблюдений, критерий хи-квадрат Пирсона либо точный двусторонний критерий Фишера. Статистическая значимость особенности распределения исследуемых генотипов в изучаемых группах проверялась с помощью оценки показателей отношения шансов (ОШ) и их доверительных интервалов (ДИ). Оценка характера распределения количественных данных осуществлялась с помощью критерия Шапиро — Уилка. В зависимости от полученного результата оценивания рассчитывали либо среднее арифметическое (М), стандартное отклонение (SD), либо медиану (Ме), нижнюю и верхнюю квантиль [LQ, HQ]. Этим же принципом руководствовались при выборе критериев для статистического сопоставления двух исследуемых независимых групп: t-теста и теста Манна — Уитни. Для углубленного анализа ассоциаций и уменьшения многофакторной размерности в исследуемых группах было использовано программное обеспечение Haplostats v. 1.9.7 (Schaid, D. J., & Sinnwell, J. P., Software for haplotype-based association analysis, CШA) и MDR (Multifactor Dimensionality Reduction, Source Forge, США) v. 3.0.2, предназначенное для статистического анализа гаплотипов с признаками и ковариатами, когда фаза сцепления неоднозначна. Метод MDR дает возможность оценивать ген-генные и генно-средовые взаимодействия, ассоциированные с качественными фенотипами с учетом коррекции на качественные ковариаты и проводить их валидацию с помощью пермутационного теста. Также он позволяет проводить кросс-валидацию моделей, оценивать характер (synergy, additive, redundancy) и силу (доля вклада в энтропию) этих взаимодействий и их визуализировать графически. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
РЕЗУЛЬТАТЫ
Формирование выборки (групп) исследования
С целью повышения обобщающей способности (внешней валидности) результатов исследования, пациенты, обратившиеся за медицинской помощью, включались в исследование после первичного приёма на основе случайной выборки. Отбор осуществлялся с использованием компьютерной программы для генерации случайных чисел: из каждых 10 обратившихся в исследование включались 5, отобранных по данному принципу. Всего участники были распределены на две группы – исследуемая (случай) группа с ХАП (n = 150) и контрольная (n = 50) (рис. 1).
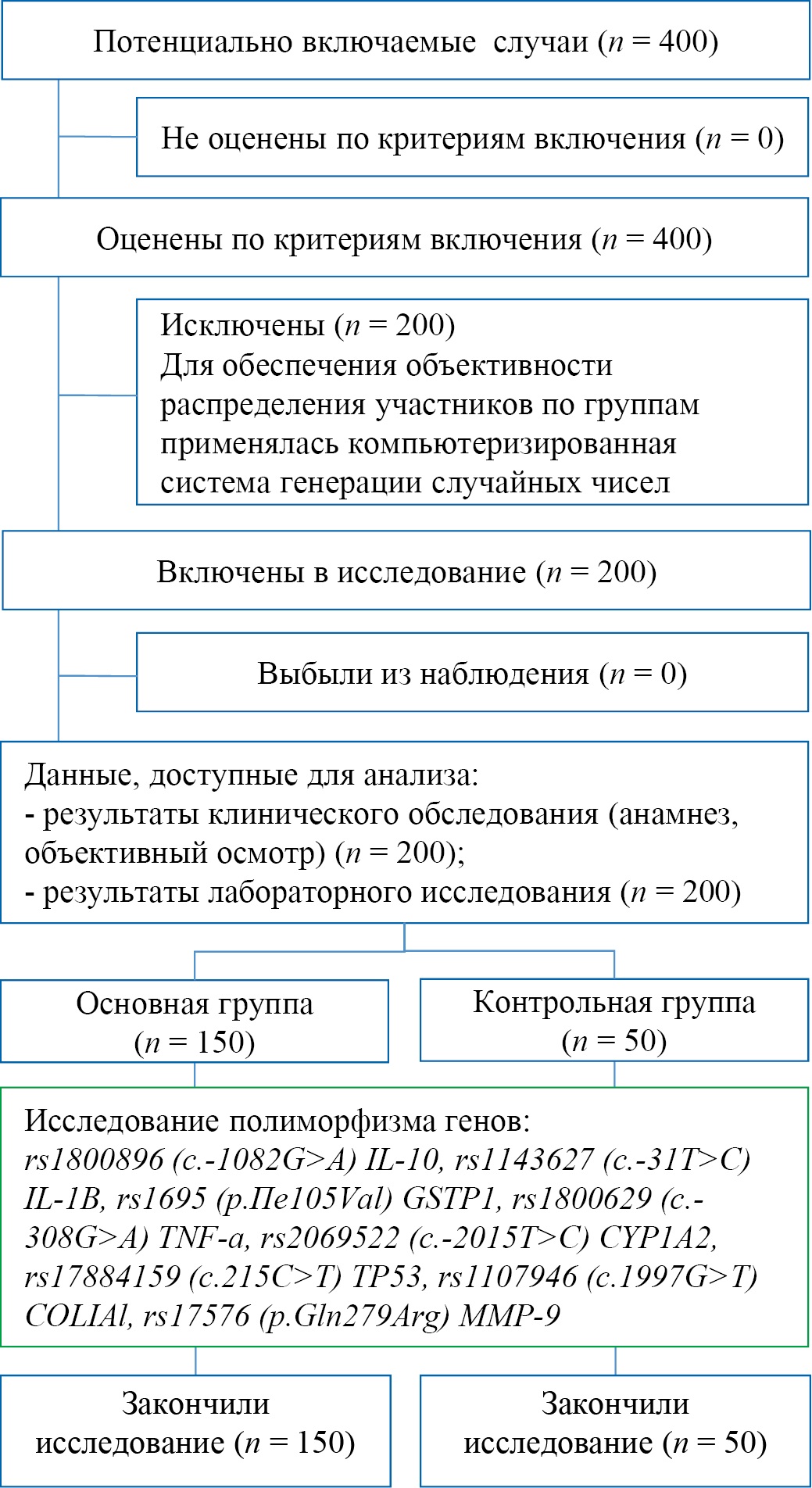
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена автором (согласно рекомендациям STROBE). Сокращения: rs — эталонный однонуклеотидный полиморфизм; c. — позиция относительно стартового кодона гена; p. — изменение на уровне белка; IL-10 — интерлейкин-10; IL-1β — интерлейкин-1 бета; GSTP1 — глутатион-S-трансфераза П1; TNF-α — фактор некроза опухоли-альфа; CYP1 А2 — цитохром П450 1 А2; TP53 — опухолевый супрессор П53; COL1A1 — коллаген тип 1 A1; MMP-9 — матриксная металлопептидаза 9.
Fig. 1. Study design
Notes: The flow diagram was made by the author (with accordance with STROBE guidelines). Abbreviations: rs — reference single nucleotide polymorphism; c. — position relative to start codon; p. — protein polymorphism; IL-10 — interleukin-10; IL-1β — interleukin-1β; GSTP-1 — glutathione-S-transferase P1; TNF-α — tumor necrosis factor α; CYP1A2 — cytochrome P450 1A2; TP53 — tumor suppressor P53; COL1A1 — type 1A1 collagen; MMP9 — matrix metal peptidase 9.
Контрольная группа формировалась из добровольцев, соответствующих критериям включения и не имеющих признаков воспалительных заболеваний полости рта. Такая методология обеспечила строгую стандартизацию выборки и минимизацию потенциальных источников смещения данных. Конфиденциальность данных была обеспечена анонимизацией образцов и шифрованием электронных записей. Информированное согласие участников включало право на отказ от участия в любой момент без объяснения причин.
Характеристики выборки (групп) исследования
Между возрастными показателями двух групп, t-критерием, статистически значимых различий не выявлено (р > 0,05). Средний возраст в исследуемой группе составил 33,6 ± 9,2 года; в контрольной — 31,5 ± 8,4 года. Не обнаружено статистически значимых различий в половом составе групп. В исследуемой группе мужчин и женщин было равное количество — по 75 человек. Такая же пропорция наблюдалась в контрольной группе — по 25 человек обоего пола.
Основные результаты исследования
В рамках настоящего исследования, направленного на углубленное понимание сложных молекулярно-генетических механизмов, лежащих в основе развития хронического апикального периодонтита (ХАП), была поставлена задача определить роль специфических межгенных ассоциаций ключевых генов в модуляции воспалительных и иммунных реакций. Хронический апикальный периодонтит представляет собой персистирующее воспалительное заболевание тканей, окружающих верхушку корня зуба, характеризующееся деструкцией костной ткани и формированием периапикальных очагов поражения. Патогенез этого состояния является многофакторным, где значительное взаимодействие генетической предрасположенности и факторов окружающей среды играет критическую роль. Для решения поставленной задачи был проведен комплексный анализ распределения частот генотипов и аллелей в четко определенных исследуемых группах: группе пациентов с верифицированным диагнозом ХАП и контрольной группе лиц, сопоставимых по основным демографическим параметрам. Анализ охватил восемь предварительно отобранных полиморфных маркеров (однонуклеотидных полиморфизмов, SNP), расположенных в генах, кодирующих белки, непосредственно участвующие в регуляции иммунного ответа, воспалительных каскадах, метаболизме ксенобиотиков и контроле клеточного цикла. Детальные результаты первичного распределения генотипов для всех изученных локусов в сравниваемых группах представлены в сводной таблице 1.
Таблица 1. Распределение генотипов по полиморфным маркерам в исследуемых группах
Table 1. Distribution of genotypes across polymorphic markers in trial groups
|
Полиморфизм |
Генотип |
Все наблюдения |
Группа |
||||
|
Контроль |
Случай |
||||||
|
n |
% |
n |
% |
n |
% |
||
|
rs1800896 |
A/A |
17 |
8 |
2 |
4 |
15 |
10 |
|
G/A |
68 |
34 |
9 |
18 |
59 |
39 |
|
|
G/G |
115 |
57 |
39 |
78 |
76 |
51 |
|
|
rs1143627 |
C/C |
23 |
12 |
4 |
8 |
19 |
13 |
|
T/C |
82 |
41 |
12 |
24 |
70 |
47 |
|
|
T/T |
95 |
48 |
34 |
68 |
61 |
41 |
|
|
rs1800629 |
A/A |
75 |
38 |
30 |
60 |
45 |
30 |
|
A/G |
95 |
48 |
14 |
28 |
81 |
54 |
|
|
G/G |
30 |
15 |
6 |
12 |
24 |
16 |
|
|
rs1695 |
A/A |
80 |
40 |
12 |
24 |
68 |
45 |
|
A/G |
75 |
38 |
21 |
42 |
54 |
36 |
|
|
G/G |
45 |
22 |
17 |
34 |
28 |
19 |
|
|
rs2069522 |
C/C |
12 |
6 |
0 |
0 |
12 |
8 |
|
T/C |
10 |
5 |
2 |
4 |
8 |
5 |
|
|
T/T |
178 |
89 |
48 |
96 |
130 |
87 |
|
|
rs17884159 |
C/C |
174 |
87 |
47 |
94 |
127 |
85 |
|
C/T |
20 |
10 |
3 |
6 |
17 |
11 |
|
|
T/T |
6 |
3 |
0 |
0 |
6 |
4 |
|
|
rs1107946 |
A/A |
10 |
5 |
3 |
6 |
7 |
5 |
|
C/A |
45 |
22 |
10 |
20 |
35 |
23 |
|
|
C/C |
145 |
72 |
37 |
74 |
108 |
72 |
|
|
rs17576 |
A/A |
80 |
40 |
23 |
46 |
57 |
38 |
|
A/G |
82 |
41 |
21 |
42 |
61 |
41 |
|
|
G/G |
38 |
19 |
6 |
12 |
32 |
21 |
|
Примечание: таблица составлена автором. Сокращения: rs — эталонный однонуклеотидный полиморфизм; c. — позиция относительно стартового кодона гена; p. — изменение на уровне белка; IL-10 — интерлейкин-10; IL-1β — интерлейкин-1 бета; GSTP1 — глутатион-S-трансфераза П1; TNF-α — фактор некроза опухоли-альфа; CYP1 А2 — цитохром П450 1 А2; TP53 — опухолевый супрессор П53; COL1A1 — коллаген тип 1 A1; MMP-9 — матриксная металлопептидаза 9.
Note: The table is compiled by the author. Abbreviations: rs — reference single nucleotide polymorphism; c. — position relative to start codon; p. — protein polymorphism; IL-10 — interleukin-10; IL-1β — interleukin-1β; GSTP-1 — glutathione-S-transferase P1; TNF-α — tumor necrosis factor α; CYP1A2 — cytochrome P450 1A2; TP53 — tumor suppressor P53; COL1A1 — type 1A1 collagen; MMP9 — matrix metal peptidase 9.
Первым этапом анализа стал традиционный однолокусный анализ, целью которого была оценка потенциальных ассоциаций отдельных исследуемых однонуклеотидных полиморфизмов с индивидуальным риском развития хронического апикального периодонтита. Этот метод позволяет выявить статистически значимые различия в частоте встречаемости определенных генотипов или аллелей между группой больных и контрольной группой, что может указывать на вклад конкретного генетического варианта в предрасположенность к заболеванию или, наоборот, на его защитную функцию. Среди восьми проанализированных полиморфных маркеров статистически значимые различия в распределении генотипов были надежно установлены для нескольких ключевых генов, что подчеркивает их потенциальную вовлеченность в патогенез ХАП.
Так, при анализе полиморфизма rs1800896 (c.-1082G>A), расположенного в промоторной области гена интерлейкина-10 (IL-10), кодирующего важнейший противовоспалительный цитокин, было обнаружено, что гомозиготный генотип A/A встречался статистически достоверно чаще в группе пациентов, страдающих хроническим апикальным периодонтитом (10 % случаев), по сравнению с лицами из контрольной группы (всего 4 % случаев). Статистическая значимость этой разницы была подтверждена критерием хи-квадрат Пирсона (χ² = 3,92, p = 0,048). Эта находка позволяет предполагать, что генотип A/A полиморфизма rs1800896 гена IL-10 может ассоциироваться с повышенной восприимчивостью к развитию ХАП. Напротив, гомозиготный генотип G/G для того же самого полиморфного маркера rs1800896 наблюдался статистически достоверно чаще в контрольной группе здоровых индивидов (78 %) по сравнению с группой пациентов с ХАП (51 %; χ² = 5,14, p = 0,023). Такое распределение указывает на возможное протективное значение генотипа G/G, то есть его носители могут иметь сниженный риск развития хронического воспаления периапикальных тканей.
Аналогично, значимые ассоциации были выявлены и для полиморфизма rs1143627 (c.-31T>C) гена интерлейкина-1 бета (IL-1β), кодирующего мощный провоспалительный цитокин, играющий центральную роль в инициации и поддержании воспалительной реакции, в том числе в тканях пародонта. Гомозиготный вариант T/T данного SNP был статистически достоверно чаще распространен среди здоровых лиц контрольной группы (68 % против 41 % в группе ХАП; χ² = 6,87, p = 0,009), что также позволяет рассматривать его как потенциально защитный генотип. В противоположность этому гетерозиготный вариант T/C полиморфизма rs1143627 наблюдался статистически достоверно чаще у пациентов с установленным диагнозом хронического апикального периодонтита (47 % против 24 % в контроле; χ² = 5,93, p = 0,015), что свидетельствует о его возможной ассоциации с повышенным риском развития данного заболевания. Полученные данные хорошо согласуются с обширным массивом литературных сведений, подчеркивающих провоспалительную активность IL-1β как фактора, способствующего деструкции костной ткани, и противовоспалительный, иммуносупрессивный эффект IL-10. Эта конвергенция результатов независимых исследований существенно подтверждает фундаментальную важность дисбаланса в системе этих цитокинов в сложном патогенезе хронических воспалительных заболеваний пародонта, включая и апикальный периодонтит [4][15].
Для получения более целостной картины взаимосвязей между изучаемыми генетическими факторами и их потенциальным взаимодействием с факторами окружающей среды (условно обозначенными как Disease), была применена современная методика визуализации сетей ген-средовых и ген-генных связей. Эта визуализация была реализована с использованием силового алгоритма Камада и Каваи (Kamada—Kawai algorithm), который эффективно размещает узлы (гены, факторы) на плоскости таким образом, чтобы длины связей между ними максимально соответствовали заданным силам притяжения или отталкивания, отражающим силу взаимодействия. Результирующая графическая модель, представленная на рисунке 2, во многом подтверждает и наглядно отражает закономерности, установленные в ходе предшествующего однолокусного анализа, демонстрируя относительную близость или удаленность ключевых генетических маркеров друг от друга и от узла Disease.
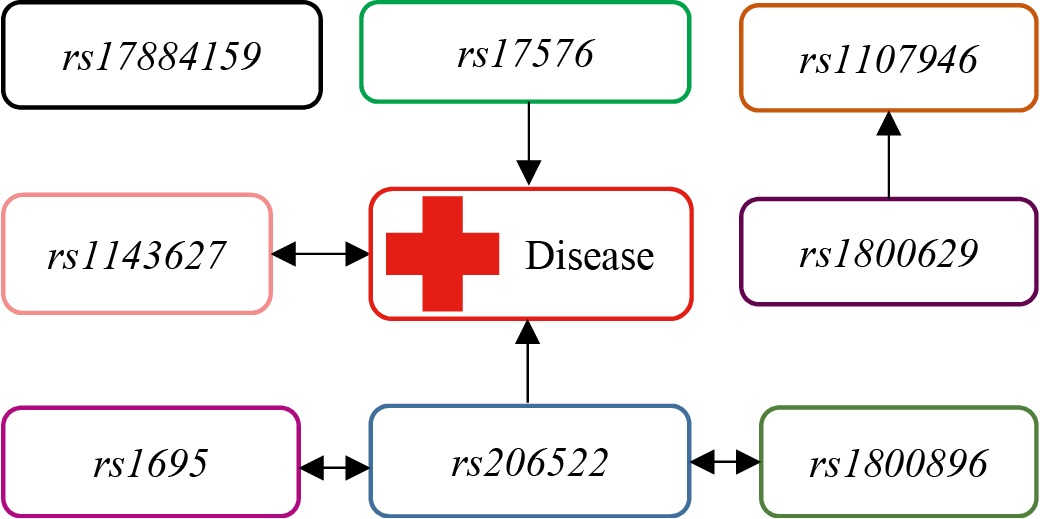
Рис. 2. Одноранговое ген-средовое и ген-генное взаимодействие по алгоритму Камада — Каваи
Примечание: рисунок выполнен автором. Сокращение: rs — эталонный однонуклеотидный полиморфизм.
Fig. 2. Single-layer gene-environment and gene-gene interaction using Kamada—Kawai algorithm
Note: the figure is made by the author. Abbreviation: rs — reference single nucleotide polymorphism.
Однако важно подчеркнуть, что одноранговое (попарное) взаимодействие, на котором фокусируется однолокусный анализ, зачастую не способно дать полного и исчерпывающего представления о всей сложности существующих взаимосвязей в рамках изучаемых биологических явлений, особенно когда речь идет о многофакторных заболеваниях, таких как ХАП, где вероятны сложные эпистатические эффекты и нелинейные взаимодействия между множеством генов и средовыми триггерами.
Важным этапом в любом генетико-ассоциативном исследовании является проверка соответствия наблюдаемых частот генотипов в изучаемых популяциях ожидаемым частотам, предсказываемым законом равновесия Харди — Вайнберга (Hardy—Weinberg Equilibrium, HWE). Это фундаментальное правило популяционной генетики гласит, что при отсутствии влияния внешних факторов (мутаций, миграций, отбора, дрейфа генов и неслучайного скрещивания) частоты генотипов по одному аутосомному локусу остаются постоянными из поколения в поколение. Отклонения от HWE в контрольной группе могут указывать на проблемы с качеством генотипирования или на нерепрезентативность выборки, в то время как отклонения только в группе пациентов могут сигнализировать о влиянии самого заболевания на структуру популяции. Результаты данного анализа для всех восьми исследованных однонуклеотидных полиморфизмов представлены в таблице 2.
Таблица 2. Результаты точного теста на равновесие Харди — Вайнберга
Table 2. Sensitive test results for Hardy—Weinberg equilibrium
|
Полиморфизм |
Группа |
Гетерозиготы |
Гомозиготы |
Общее кол-во |
р-уровень |
||
|
1‑й аллель |
2‑й аллель |
1‑й аллель |
2‑й аллель |
||||
|
rs1800896 |
Все |
115 |
17 |
68 |
298 |
102 |
0,1400 |
|
Контроль |
39 |
2 |
9 |
87 |
13 |
0,1700 |
|
|
Случай |
76 |
15 |
59 |
211 |
89 |
0,5600 |
|
|
rs1143627 |
Все |
95 |
23 |
82 |
272 |
128 |
0,4200 |
|
Контроль |
34 |
4 |
12 |
80 |
20 |
0,0830 |
|
|
Случай |
61 |
19 |
70 |
192 |
108 |
1,0000 |
|
|
rs1800629 |
Все |
75 |
30 |
95 |
245 |
155 |
1,0000 |
|
Контроль |
30 |
6 |
14 |
74 |
26 |
0,0650 |
|
|
Случай |
45 |
24 |
81 |
171 |
129 |
0,2500 |
|
|
rs1695 |
Все |
80 |
45 |
75 |
235 |
165 |
0,0014 |
|
Контроль |
12 |
17 |
21 |
45 |
55 |
0,2700 |
|
|
Случай |
68 |
28 |
54 |
190 |
110 |
0,0079 |
|
|
rs2069522 |
Все |
178 |
10 |
12 |
366 |
34 |
0,0001 |
|
Контроль |
48 |
2 |
0 |
98 |
2 |
1,0000 |
|
|
Случай |
130 |
8 |
12 |
268 |
32 |
0,0001 |
|
|
rs17884159 |
Все |
174 |
20 |
6 |
368 |
32 |
0,0004 |
|
Контроль |
47 |
3 |
0 |
97 |
3 |
1,0000 |
|
|
Случай |
127 |
17 |
6 |
271 |
29 |
0,0006 |
|
|
rs1107946 |
Все |
145 |
45 |
10 |
335 |
65 |
0,0190 |
|
Контроль |
37 |
10 |
3 |
84 |
16 |
0,0890 |
|
|
Случай |
108 |
35 |
7 |
251 |
49 |
0,0760 |
|
|
rs17576 |
Все |
80 |
82 |
38 |
242 |
158 |
0,0540 |
|
Контроль |
23 |
21 |
6 |
67 |
33 |
0,7500 |
|
|
Случай |
57 |
61 |
32 |
175 |
125 |
0,0450 |
|
Примечание: таблица составлена автором. Сокращения: rs — эталонный однонуклеотидный полиморфизм; c. — позиция относительно стартового кодона гена; p. — изменение на уровне белка; IL-10 — интерлейкин-10; IL-1β — интерлейкин-1 бета; GSTP1 — глутатион-S-трансфераза П1; TNF-α — фактор некроза опухоли-альфа; CYP1 А2 — цитохром П450 1 А2; TP53 — опухолевый супрессор П53; COL1A1 — коллаген тип 1 A1; MMP-9 — матриксная металлопептидаза 9.
Note: The table is compiled by the author. Abbreviations: rs — reference single nucleotide polymorphism; c. — position relative to start codon; p. — protein polymorphism; IL-10 — interleukin-10; IL-1β — interleukin-1β; GSTP-1 — glutathione-S-transferase P1; TNF-α — tumor necrosis factor α; CYP1A2 — cytochrome P450 1A2; TP53 — tumor suppressor P53; COL1A1 — type 1A1 collagen; MMP9 — matrix metal peptidase 9.
Анализ показал, что в контрольной группе здоровых индивидов все исследуемые однонуклеотидные полиморфизмы находились в состоянии равновесия Харди — Вайнберга (p > 0,05 для всех тестов). Это является важным индикатором репрезентативности контрольной выборки и отсутствия существенных систематических ошибок при проведении генотипирования. В группе пациентов с хроническим апикальным периодонтитом ситуация была иной. Статистически значимые отклонения от ожидаемого равновесия Харди — Вайнберга были надежно выявлены для трех конкретных полиморфных маркеров:
— rs1695 (p.Ile105Val) в гене глутатион-S-трансферазы Пи 1 (GSTP1), фермента, играющего ключевую роль в детоксикации реактивных кислородных видов и ксенобиотиков;
— rs2069522 (c.-2015T>C) в промоторной области гена цитохрома P450 1A2 (CYP1A2), важного фермента метаболизма различных веществ, включая потенциально токсичные;
— rs17884159 (c.215C>T) в гене опухолевого супрессора p53 (TP53), белка — «стража генома», регулирующего клеточный цикл, апоптоз и ответ на повреждение ДНК.
Обнаруженные отклонения от HWE исключительно в группе больных ХАП для этих специфических локусов не могут быть объяснены артефактами генотипирования или неслучайным подбором выборки, учитывая соблюдение HWE в контроле по этим же маркерам. Следовательно, наиболее вероятными причинами таких отклонений являются либо влияние специфических факторов окружающей среды (например, курение, особенности питания, воздействие токсинов), которые могут по-разному влиять на носителей определенных генотипов в условиях хронического воспаления, либо действие селективного давления со стороны самого персистирующего воспалительного процесса в периапикальных тканях. Такое давление может опосредованно влиять на жизнеспособность или репродуктивный успех носителей определенных генетических вариантов на протяжении времени, хотя для подтверждения этого требуются специальные популяционно-генетические исследования. Этот результат подчеркивает принципиальную необходимость учета статуса равновесия Харди — Вайнберга и, в частности, выявленных отклонений для полиморфизмов генов GSTP1, CYP1A2 и TP53 при последующей интерпретации данных ассоциаций и взаимодействий в контексте ХАП [2][16].
Учитывая ограниченность информации, которую можно получить из анализа отдельных локусов, и высокую вероятность сложных нелинейных взаимодействий между множественными генетическими факторами и средой в развитии многофакторных заболеваний, для углубленного изучения этих взаимосвязей при хроническом апикальном периодонтите был применен метод Multifactor Dimensionality Reduction (MDR). MDR представляет собой непараметрический и модельно-свободный подход, специально разработанный для выявления и характеристики сложных взаимодействий высокого порядка в данных с высокой размерностью (множеством переменных) при ограниченном размере выборки. Суть метода заключается в редукции размерности данных путем объединения комбинаций многоуровневых переменных (генотипов, факторов среды) в новые бинарные переменные (высокий/низкий риск), что позволяет эффективно визуализировать и оценивать многомерные паттерны взаимодействий.
MDR-анализ был последовательно проведен для всех исследуемых однонуклеотидных полиморфизмов и узла Disease (Заболевание), представляющего совокупность средовых факторов. Этот анализ позволил выявить и охарактеризовать несколько статистически значимых многолокусных моделей, описывающих комбинированное действие ключевых генов и их взаимодействие со средой, ассоциированное с риском развития ХАП. Процесс построения и валидации моделей в MDR включает следующие ключевые шаги: 1) разделение исходных данных на обучающую и тестовую части (кросс-валидация); 2) оценку всех возможных комбинаций факторов (вплоть до заданного порядка взаимодействия, например 2-факторные, 3-факторные модели); 3) выбор оптимальной комбинации факторов на обучающей выборке; 4) оценка предсказательной способности выбранной модели на тестовой выборке. Все полученные модели были тщательно отобраны и оценены по строгим наглядным критериям.
Основными критериями качества модели в MDR являются согласованность при кросс-валидации и сбалансированная точность тестирования. Согласованность при кросс-валидации (Cross-Validation Consistency — CVC): показатель, отражающий, насколько стабильно данная комбинация факторов выбирается как лучшая в разных подвыборках при кросс-валидации (максимальное значение 10 при 10-fold CV). Высокий CVC (близкий к 10) указывает на надежность и воспроизводимость модели. Сбалансированная точность тестирования (Testing Balanced Accuracy — TBA): среднее значение чувствительности (доля верно предсказанных больных) и специфичности (доля верно предсказанных здоровых) на тестовой выборке. Высокое значение TBA (близкое к 1,0, или 100 %) и, соответственно, низкая ошибка предсказания свидетельствуют о хорошей предсказательной силе модели.
Одновременно с этим для оценки информативности и силы выявленных взаимодействий в рамках построенных моделей оценивался уровень энтропии (I). В контексте теории информации энтропия измеряет степень неопределенности или количество информации, содержащейся во взаимодействии. В MDR-анализе энтропийный анализ позволяет количественно определить вклад каждой отдельной переменной (гена, фактора) и их парных взаимодействий в общую предсказательную способность модели. Чем выше значение энтропии для взаимодействия, тем больший вклад оно вносит в объяснение фенотипической изменчивости (в данном случае риска ХАП). Детальные результаты MDR-анализа, включая лучшие модели, их CVC, TBA и значения энтропии для отдельных эффектов и взаимодействий, представлены в таблице 3.
Таблица 3. Основные характеристики MDR-моделей
Table 3. Characteristics of MDR-models
|
Модель |
CVC |
TBA |
I |
|
rs1143627 × rs1800629 |
9/10 |
73,2 |
4,5 % |
|
rs1143627 × rs1800629 × rs17576 |
10/10 |
79,8 |
6,2 % |
|
rs1143627 × rs1800629 × rs17576 × rs1107946 |
8/10 |
71,4 |
5,1 % |
Примечание: таблица составлена автором. Сокращения: rs — эталонный однонуклеотидный полиморфизм; CVC — cогласованность перекрестной проверки; TBA — тест сбалансированной точности; I — доля вклада в энтропию.
Note: the table is compiled by the author. Abbreviations: rs — reference single nucleotide polymorphism; CVC — cross-validation comparison; TBA — test for balanced accuracy; I — entropy contribution.
Для наглядного представления сложной структуры выявленных взаимосвязей между генетическими факторами и их комбинациями были использованы два типа специализированных визуализаций, построенных на основе результатов MDR-анализа и энтропийных оценок.
Первой была дендрограмма (рис. 3). Эта визуализация отображает иерархическую структуру связей между различными однонуклеотидными полиморфизмами и их многокомпонентными сочетаниями. Дендрограмма, построенная с использованием алгоритма, учитывающего значения энтропии из MDR-анализа, позволяет увидеть «близость» факторов с точки силы их взаимодействия в контексте риска заболевания. Основная информация представлена на дендрограмме в виде узлов (листьев) и ветвей (линий). Каждый лист дендрограммы представляет собой один конкретный однонуклеотидный полиморфизм или средовый фактор (в данном случае узел Disease). Высота ветвей, соединяющих листья, является ключевым показателем: она указывает на степень связи (силу взаимодействия) между соответствующими генетическими факторами. Короткие ветви свидетельствуют о том, что однонуклеотидные полиморфизмы расположены близко друг к другу в иерархии взаимодействий, что предполагает более тесную функциональную или эпистатическую связь между ними в патогенезе ХАП. Более длинные ветви, напротив, указывают на слабую связь или отсутствие значимого взаимодействия между данными факторами в рамках построенной модели.
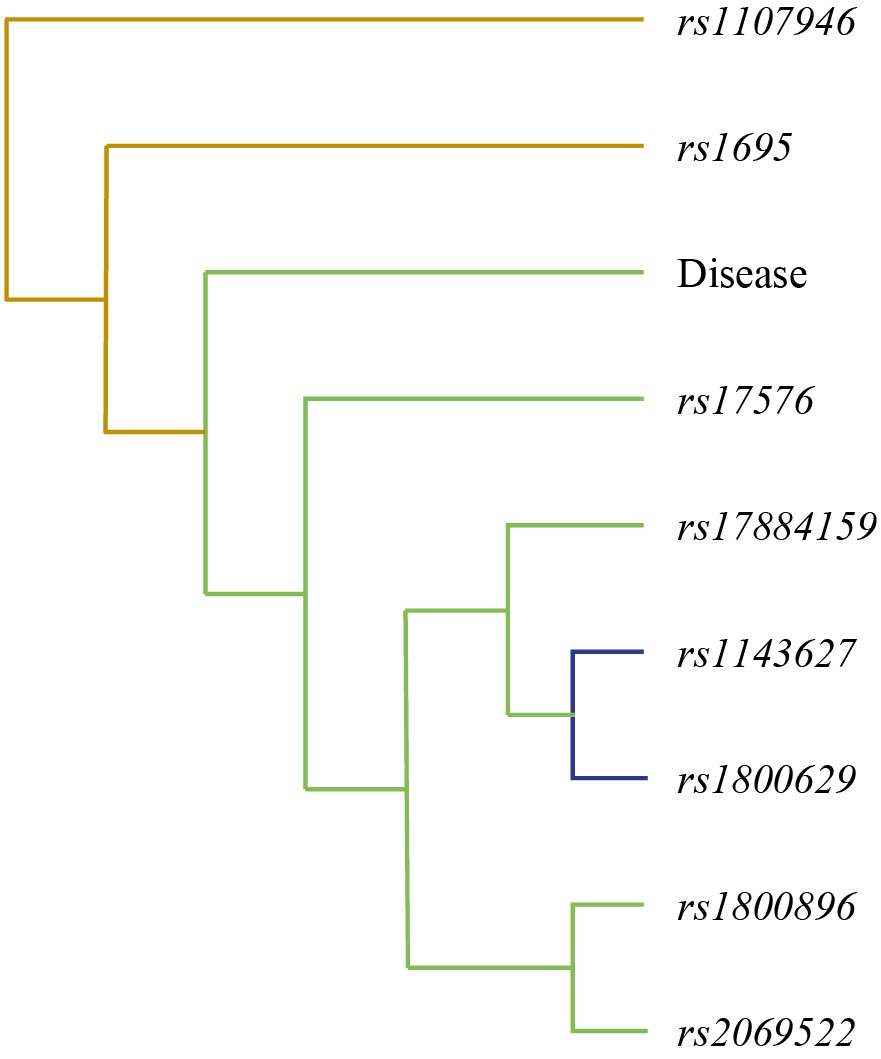
Рис. 3. Дендрограмма ген-средовых и межгенных взаимодействий при хроническом апикальном периодонтите
Примечания: рисунок выполнен автором; названия узлов, представленных на дендрограмме в последовательности сверху-вниз — rs1107946 (с. 1997G>T) COL1A1, rs1695 (p.Ile105Val) GSTP1, Disease, rs17576 (p.Gln279Arg) MMP-9, rs17884159 (с. 215C>T) TP53, rs1143627 (с.-31T>C) IL-1 β, rs1800629 (c.-308G>A) TNF-α, rs1800896 (c.-1082G>A) IL-10, rs2069522 (с.-2015T>C) CYP1A2. Сокращение: rs — эталонный однонуклеотидный полиморфизм.
Fig. 3. Tree diagram of gene-environment and gene-gene interaction in chronic apical periodontitis
Notes: The figure is made by the author. Tree node labels from top to bottom: rs1107946 (с. 1997G>T) COL1A1, rs1695 (p.Ile105Val) GSTP1, Disease, rs17576 (p.Gln279Arg) MMP-9, rs17884159 (с. 215C>T) TP53, rs1143627 (с.-31T>C) IL-1 β, rs1800629 (c.-308G>A) TNF-α, rs1800896 (c.-1082G>A) IL-10, rs2069522 (с.-2015T>C) CYP1A2. Abbreviation: rs — reference single nucleotide polymorphism.
Для более детального отображения характера и направления взаимодействий был построен граф ген-средовых и межгенных связей (рис. 4), ассоциированных с развитием хронического апикального периодонтита. Этот граф визуализирует не только факт наличия связи, но и ее силу, выраженную через долю вклада в общую энтропию (информативность) модели. Граф был сконструирован с использованием алгоритма Фрюхтермана — Рейнгольда (Fruchterman—Reingold algorithm). Этот алгоритм позиционирует узлы графа (представляющие гены/SNP или фактор Disease) на плоскости таким образом, чтобы минимизировать пересечение связей и равномерно распределить узлы, притягивая связанные узлы и отталкивая несвязанные. Ребра графа (связи между узлами) могут быть направленными или ненаправленными (в зависимости от модели) и часто имеют толщину, пропорциональную силе взаимодействия (вкладу в энтропию). Ключевым преимуществом алгоритма Фрюхтермана — Рейнгольда является его способность хорошо справляться с «шумом» в данных и эффективно визуализировать даже сложные графы, содержащие большое количество узлов и разнообразных связей, при этом сохраняя относительную читаемость и наглядность.
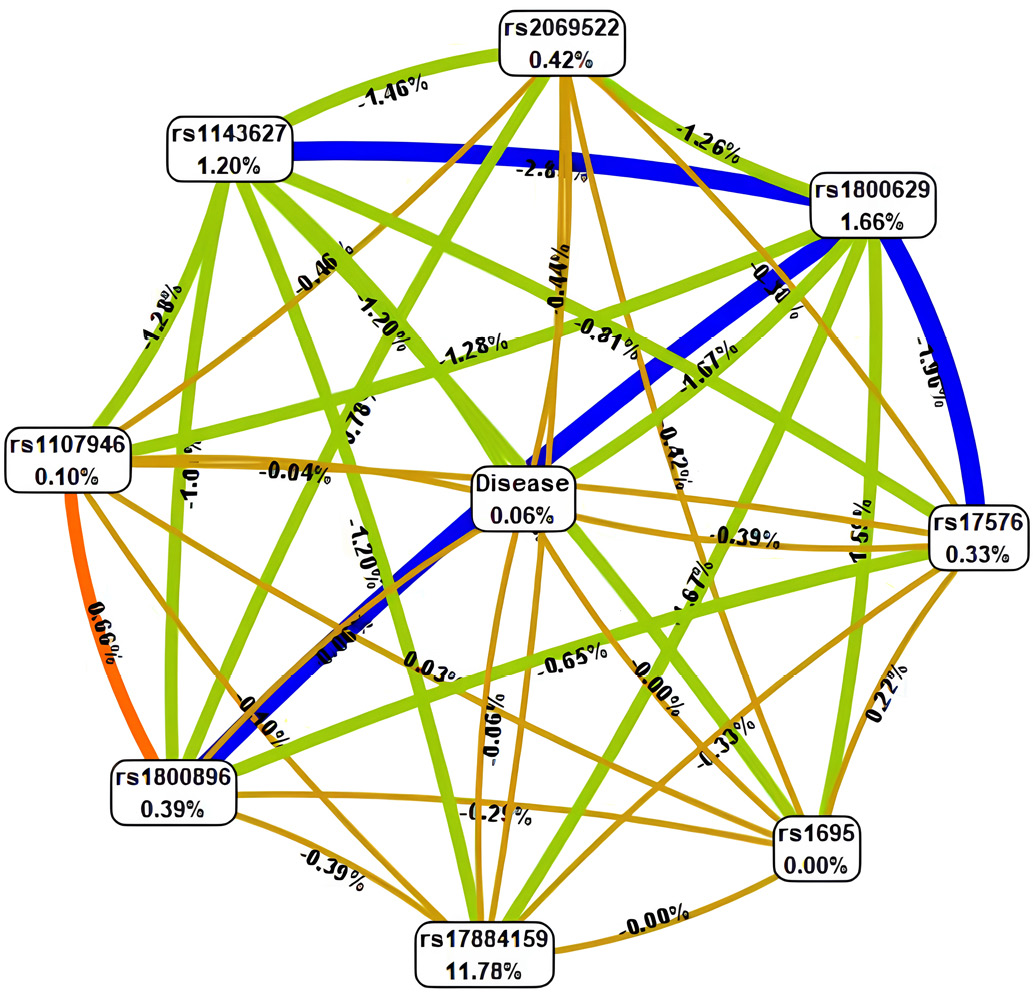
Рис. 4. Граф ген-генных и генно-средовых взаимодействий полиморфных локусов изучаемых генов с наличием хронического апикального периодонтита
Примечания: рисунок выполнен автором; направленность взаимодействий между генами-кандидатами и наличием хронического апикального периодонтита (Disease) обозначаются линиями разного цвета: синего — выраженный синергизм, зеленого — умеренный синергизм, оранжевого — выраженный антагонизм, красного — умеренный антагонизм, коричневого — аддитивное взаимодействие. Сила и направленность взаимодействий представлены в % энтропии. Сокращение: rs — эталонный однонуклеотидный полиморфизм.
Fig. 4. Gene-gene and gene-environment interactions of polymorphic loci of the analyzed genes in chronic apical periodontitis
Notes: The figure is made by the author. Interactions between candidate genes and the presence of chronic apical periodontitis (Disease) are marked by different color lines: blue stands for pronounced synergism; green represents moderate synergism; orange denotes pronounced antagonism; red moderate antagonism; brown additive interaction. Force and direction of interactions are represented in entropy ratios ( %). Abbreviation: rs — reference single nucleotide polymorphism.
Таким образом, рисунок 4 предоставляет комплексное графическое представление паттернов взаимодействий, выявленных MDR-анализом, показывая, какие гены наиболее тесно координируют свое действие друг с другом и с факторами среды, формируя предрасположенность к ХАП.
Дополнительные результаты исследования
В ходе выполнения данного комплексного исследования, помимо описанных выше основных результатов, связанных с выявлением ассоциаций отдельных полиморфизмов, анализом HWE, применением MDR-метода и визуализацией взаимодействий, проводился поиск других потенциальных закономерностей или значимых эффектов. Это включало, помимо прочего, анализ распределения аллельных частот, проверку ассоциаций в подгруппах (например, по полу) и оценку других статистических моделей. Однако на основании проведенного анализа и примененных статистических критериев значимости дополнительных результатов, выходящих за рамки уже представленных основных результатов, в ходе данного исследования выявлено не было. Все значимые ассоциации и взаимодействия были описаны в предыдущем разделе.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Исследование выявило значимые межгенные взаимодействия, связанные с развитием хронического апикального периодонтита (ХАП), с использованием MDR-анализа. Трехлокусная модель IL-1β×TNF-α×MMP-9 показала наибольшую прогностическую ценность (сбалансированная точность 79,8 %, перекрестная проверка 10/10), подчеркивая синергию воспалительных цитокинов и протеолитических процессов. Анализ равновесия Харди — Вайнберга выявил отклонения для CYP1A2 и TP53 в группе ХАП, указывающие на влияние средовых факторов. Граф Фрюхтермана — Рейнгольда подтвердил сильное взаимодействие между IL-1β и TNF-α, тогда как COL1A1 демонстрировал умеренную связь. Полученные данные свидетельствуют о мультигенной природе предрасположенности к ХАП и открывают возможности для персонализированной диагностики и терапии, учитывающей комбинированный эффект генов.
Ограничения исследования
В исследовании анализировался лишь определенный набор однонуклеотидных полиморфизмов, выбранных на основе предыдущих знаний. Это означает, что исследование не охватывает все генетические варианты, которые могут влиять на риск возникновения ХАП. Относительно небольшой размер выборки может ограничить статистическую мощность исследования и затруднить выявление слабых ассоциаций. Хотя метод MDR выявляет важные комбинации SNP, понимание биологических механизмов, лежащих в основе этих взаимодействий, может быть сложным.
Интерпретация результатов исследования
Полученные данные демонстрируют мультигенную природу наследственной предрасположенности к хроническому апикальному периодонтиту (ХАП), где ключевую роль играют не отдельные полиморфизмы, а их комбинированное действие. Наиболее информативной моделью стал трехлокусный вариант IL-1β×TNF-α×MMP-9, характеризующийся идеальной перекрестной проверкой (10/10) и высокой сбалансированной точностью (79,8 %). Этот результат подчеркивает синергию провоспалительных цитокинов (IL-1β, TNF-α) и протеолитического фермента MMP-9, участвующих в деструкции внеклеточного матрикса и периапикальной кости. Такая комбинация согласуется с данными литературы, где аналогичные взаимодействия описаны при воспалительных заболеваниях пародонта [2][5][7].
Анализ равновесия Харди — Вайнберга (HWE) показал стабильность генетического фона в контрольной группе, что подтверждает репрезентативность выборки. В группе ХАП отклонения наблюдались для полиморфизмов CYP1A2 (rs2069522) и TP53 (rs17884159) (p < 0,001), что может быть связано с влиянием воспалительного процесса или экзогенных факторов, модифицирующих метаболизм ксенобиотиков [2][4]. Эти наблюдения перекликаются с исследованиями, где отклонения от HWE в основной группе указывали на ген-средовые взаимодействия при перинатальных осложнениях гестационного сахарного диабета [13].
Подобные эффекты ранее описывались при анализе генов, связанных с перинатальными осложнениями, что подчеркивает общие механизмы ген-средовых взаимодействий при мультифакторных патологиях [1][6][17].
Граф Фрюхтермана — Рейнгольда позволил визуализировать силу межгенных взаимодействий. Самые толстые линии (синий цвет) соответствовали выраженному синергизму между IL-1β и TNF-α, что согласуется с их ролью в запуске воспалительной реакции. Зеленые линии (умеренный синергизм) связывали TNF-α с MMP-9, усиливая деструкцию тканей, тогда как оранжевые (антагонизм) отражали противовоспалительное действие IL-10, ограничивающее чрезмерную активацию TNF-α. Коричневые линии (аддитивное взаимодействие) касались генов структурных белков, таких как COL1A1, что коррелирует с их меньшим влиянием на воспалительный процесс по сравнению с цитокинами. Визуализация подтверждает, что синергия между IL-1β и TNF-α является критической для патогенеза ХАП, что согласуется с данными других исследований, демонстрирующих аналогичные закономерности при воспалительных заболеваниях пародонта [3][8][18].
Трехлокусная модель IL-1β×TNF-α×MMP-9 превосходит двух- и четырехлокусные варианты по всем метрикам (чувствительность 79,8 %, специфичность 84,4 %), что делает ее предпочтительной для клинического применения. Ее эффективность сопоставима с трехлокусной моделью ESR1×FSHR×CYP19A1, разработанной в исследовании для прогнозирования снижения овариального резерва [11].
Это свидетельствует об универсальности MDR-анализа в выявлении эпистатических эффектов при сложных заболеваниях [6][19]. Четырехлокусная модель (IL-1β×TNF-α×MMP-9×COL1A1) продемонстрировала снижение прогностической ценности (сбалансированная точность 71,4 %), вероятно, из-за меньшего вклада COL1A1, ответственного за структурную целостность коллагена I типа, в воспалительный ответ по сравнению с активацией цитокинов и металлопротеиназ [10][11]. Подобная тенденция наблюдалась в работе, где добавление генов регуляторов ангиогенеза (VEGF-A, eNOS) в модель PPARG×eNOS×TCF7L2 повысило чувствительность, но усложнило интерпретацию [5].
Особого внимания заслуживает парадоксальный эффект снижения активности MMP-9, который теоретически должен замедлять резорбцию кости, но в реальности способствует накоплению поврежденных белков и усугублению воспаления [1][4][20]. Эта закономерность перекликается с наблюдениями, где снижение протеолитической активности ассоциировалось с повышенным риском аутоиммунных реакций [10].
Практическая значимость исследования заключается в возможности создания персонализированных алгоритмов диагностики и терапии ХАП. Генетический скрининг, включающий комбинации SNP (например, IL-1β×TNF-α), позволит заранее выявлять пациентов с высоким риском, как это уже применяется в репродуктивной медицине для прогнозирования перинатальных осложнений. Интеграция таких данных в клиническую практику может улучшить исходы лечения за счет раннего вмешательства и коррекции факторов риска, например метаболизма ксенобиотиков (CYP1A2) или апоптоза (TP53) [1][5].
Полученные результаты открывают перспективы для внедрения MDR-анализа в стоматологическую практику, обеспечивая переход от массового подхода к персонализированной медицине. Дальнейшие исследования должны быть направлены на уточнение роли COL1A1 и TP53 в ремоделировании тканей, а также на интеграцию средовых факторов в прогнозные модели, чтобы повысить их клиническую релевантность. Полученные данные подтверждают, что ХАП развивается вследствие сложных ген-генных и ген-средовых взаимодействий, недоступных для анализа классическими методами, и открывают новые пути для управления этой патологией [2][3][18][20].
Клиническая значимость трехлокусной модели IL-1β×TNF-α×MMP-9 заключается в ее способности учитывать не только воспалительные, но и деструктивные процессы, что особенно важно при планировании комплексного лечения ХАП. Интеграция таких данных в стоматологическую практику может улучшить прогнозирование течения ХАП, оптимизировать терапевтические схемы и снизить риск развития тяжелых форм заболевания. Полученные результаты согласуются с современными тенденциями в биомедицинских исследованиях, где акцент делается на персонализированный подход, учитывающий комбинированный эффект генов и средовых факторов [1][3][16][18].
ЗАКЛЮЧЕНИЕ
Таким образом, исследование подтверждает, что ХАП развивается вследствие сложных ген-генных и ген-средовых взаимодействий, недоступных для анализа классическими методами. Полученные данные открывают перспективы для внедрения MDR-анализа в стоматологическую практику, обеспечивая переход от массового подхода к персонализированной медицине. Интеграция таких моделей в клиническую практику может улучшить исходы лечения за счет раннего выявления пациентов с высоким риском развития хронического воспаления и коррекции факторов риска, таких как метаболизм ксенобиотиков (CYP1A2) или апоптоз (TP53).
Список литературы
1. Inchingolo F, Martelli FS, Gargiulo Isacco C, Borsani E, Cantore S, Corcioli F, Boddi A, Nguyễn KCD, De Vito D, Aityan SK, Pham VH, Dipalma G, Ballini A. Chronic Periodontitis and Immunity, Towards the Implementation of a Personalized Medicine: A Translational Research on Gene Single Nucleotide Polymorphisms (SNPs) Linked to Chronic Oral Dysbiosis in 96 Caucasian Patients. Biomedicines. 2020;8(5):115. https://doi.org/10.3390/biomedicines8050115
2. Liu X, Li H. A Systematic Review and Meta-Analysis on Multiple Cytokine Gene Polymorphisms in the Pathogenesis of Periodontitis. Front Immunol. 2022;12:713198. https://doi.org/10.3389/fimmu.2021.713198
3. Heidari Z, Moudi B, Mahmoudzadeh-Sagheb H. Immunomodulatory factors gene polymorphisms in chronic periodontitis: an overview. BMC Oral Health. 2019;19:29. https://doi.org/10.1186/s12903-019-0715-7
4. Руденкова Т.В., Костюк С.А., Полуян О.С., Юдина Н.А., Яковлева-Малых М.О. Оптимизация молекулярно-биологического анализа для идентификации нуклеотидных последовательностей генетических детерминант IL-1β, COL2A1, MMP-8 у пациентов с заболеваниями периодонта. Современная стоматология. 2020;3:54–59.
5. Kriauciunas A, Zekonis G, Liutkeviciene R. Periodontitis association with IL-8 gene polymorphisms. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2022;166(1):28–39. https://doi.org/10.5507/bp.2021.066
6. Falatah AM, Alturki SA, Aldahami AI, Alrashidi NA, Sinnah Y, Aldgeel RM, Alanazi KZ, Alkhaled AS, ALjuaid TS, Alotaibi NH, Altwijri WJ. Exploring the Influence of Genetic Single-Nucleotide Polymorphism (SNPs) on Endodontic Pathologies: A Comprehensive Review. Cureus. 2024;16(11):e74389. https://doi.org/10.7759/cureus.74389
7. Saremi L, Esmaeili S, Ghaffari ME, Shahbazi S, Lotfipanah S, Kadkhodazadeh M. Evaluation of matrix metalloproteinase-1, -2, -3, -7, and -13 gene polymorphisms in patients with chronic periodontitis and healthy controls. Clin Oral Investig. 2023;27(12):7417–7423. https://doi.org/10.1007/s00784-023-05331-5
8. Юдина Н.А., Яковлева-Малых М.О., Костюк С.А., Руденкова Т.В. Микробный фактор, генетическая предрасположенность и новая классификация заболеваний периодонта. Современная стоматология. 2021;1:43–50.
9. da Silva FRP, Pessoa LDS, Shin JI, Alves EHP, Koga RS, Smith CV, Vasconcelos DFP, Pereira ACTDC. Polymorphisms in the interleukin genes and chronic periodontitis: A field synopsis and revaluation by Bayesian approaches. Cytokine. 2021;138:155361. https://doi.org/10.1016/j.cyto.2020.155361
10. Brodzikowska A, Górski B. Polymorphisms in Genes Involved in Inflammation and Periodontitis: A Narrative Review. Biomolecules. 2022;12(4):552. https://doi.org/10.3390/biom12040552
11. Тихомирова Е.А. Генетические предикторы развития пародонтита: проблемы и перспективы (обзор литературы). Пародонтология. 2022;27(1):32–60. https://doi.org/10.33925/1683-3759-2022-27-1-32-59
12. Казеко Л.А., Бенеш Ю.Д. Матриксные металлопротеиназы как потенциальный диагностический маркер воспалительных и неопластических процессов в полости рта. Современная стоматология. 2019;2:17–20.
13. Chatterjee S, Rajasekar A. Association Analysis of MMP-13 (rs2252070) Gene Polymorphism and the Susceptibility to Chronic Periodontitis. Cureus. 2024;16(4):e57426. https://doi.org/10.7759/cureus.57426
14. Alotaibi DH, Altalhi AM, Sambawa ZM, Koppolu P, Alsinaidi AA, Krishnan P. The association of matrix metalloproteinase gene polymorphisms and periodontitis: an overview. J Pharm Bioallied Sci. 2020;12(Suppl 1):S37–S42. https://doi:10.4103/jpbs.JPBS_136_20
15. Loka AM, Ponnaiyan D, Parthasarathy H, Tadepalli A, Victor DJ. Association of the CASP3 rs4647602 Gene Polymorphism with Periodontitis in South Indians of Tamil Ethnicity. Genet Test Mol Biomarkers. 2022;26(7-8):391–397. https://doi.org/10.1089/gtmb.2022.0018
16. Sarfaraz D, Karimian M, Farmohammadi A, Yaghini J. The -592C>A variation of IL-10 gene and susceptibility to chronic periodontitis: A genetic association study and in-silico analysis. J Oral Biosci. 2021;63(4):378–387. https://doi.org/10.1016/j.job.2021.09.005
17. Abasijiang A, Lin J, Ma T, Zhao J. Evaluation of the Genetic Association and Methylation of Immune Response Pathway Genes with the Risk of Chronic Periodontitis in the Uighur Population. Genet Test Mol Biomarkers. 2021;25(5):317–324. https://doi.org/10.1089/gtmb.2020.0334
18. Lee CY, Chang CH, Teng NC, Chang HM, Huang WT, Huang YK. Associations between the phenotype and genotype of MnSOD and catalase in periodontal disease. BMC Oral Health. 2019;19(1):201. https://doi.org/10.1186/s12903-019-0877-3
19. Petean IBF, Silva-Sousa AC, Marañón-Vásquez GA, Paula-Silva FWG, Küchler EC, Antunes LS, Segato RAB, da Silva LAB, Mazzi-Chaves JF, Lopes-Olhê FC, Sousa-Neto MD. Interaction between polymorphisms in TNF-α and RANKL genes is associated with the development of persistent apical periodontitis, in Brazilian subjects. Arch Oral Biol. 2025;169:106106. https://doi.org/10.1016/j.archoralbio.2024.106106
20. Majumder P, Panda SK, Ghosh S, Dey SK. Interleukin gene polymorphisms in chronic periodontitis: A case-control study in the Indian population. Arch Oral Biol. 2019;101:156–164. https://doi.org/10.1016/j.archoralbio.2019.03.015
Об авторе
Н. В. БагрянцеваРоссия
Багрянцева Наталья Владимировна, кандидат медицинских наук, доцент кафедры клинической стоматологии и челюстно-лицевой хирургии № 1
ул. Революционная, д. 5, г. Ярославль, 150000
Рецензия
Для цитирования:
Багрянцева Н.В. Мультилокусные модели полиморфных генов и их роль в оценке риска хронического апикального периодонтита: проспективное одноцентровое исследование «случай-контроль». Кубанский научный медицинский вестник. 2025;32(5):18-31. https://doi.org/10.25207/1608-6228-2025-32-5-18-31
For citation:
Bagryantseva N.V. Multilocus models of polymorphic genes and their role in assessing the risk of chronic apical periodontitis: A prospective single-center case control study. Kuban Scientific Medical Bulletin. 2025;32(5):18-31. https://doi.org/10.25207/1608-6228-2025-32-5-18-31








































