Перейти к:
Исследование новых производных 1,4-дигидропиридина как потенциальных средств с болеутоляющей активностью в тесте орофациальной тригеминальной боли: экспериментальное доклиническое рандомизированное исследование
https://doi.org/10.25207/1608-6228-2023-30-2-64-75
Аннотация
Введение. Главной задачей современной фармакокоррекции большинства заболеваний является максимально эффективное обезболивание. Поэтому поиск и исследование новых анальгетических препаратов стали актуальным направлением в фармакологии.
Цель исследования — установить уровень болеутоляющей активности восьми новых синтезированных нами гетероциклических соединений производных 1,4-дигидропиридина в классическом тесте орофациальной тригеминальной боли в опытах на животных.
Методы. Проведено экспериментальное доклиническое рандомизированное исследование анальгетической активности производных 1,4-дигидропиридина. Эксперимент осуществлен в лаборатории кафедры фундаментальной и клинической фармакологии государственного учреждения Луганской Народной Республики «Луганский государственный медицинский университет имени Святителя Луки» на 100 белых беспородных крысах-самцах. Новые производные 1,4-дигидропиридинов предварительно исследованы в процессе виртуального биологического скрининга при помощи программ SwissTargetPrediction (Swiss Institute of Bioinformatics, Швейцария). Лабораторные животные распределялись на контрольную группу (крысам которой воспроизводился острый болевой синдром путем введения 0,1 мл 5% раствора формалина в область вибрисс без фармакокоррекции), группу сравнения (получавшую метамизол натрия (ООО «Фармстандарт») в дозе 7 мг/кг за полтора часа до моделирования острого болевого синдрома в области вибрисс) и 8 опытных групп (крысам которых за 1,5 часа до введения формалина внутригастрально вводили изучаемые новые производные 1,4-дигидропиридина в дозе 5 мг/кг). Через 10, 15 и 20 минут после моделирования острой боли подсчитывали число чесательных движений орофациальной области передними лапами за минуту. Статистическая обработка результатов проведенного эксперимента осуществлялась по методам математической статистики, характеризующим количественную изменчивость с использованием программы Statistica версии 12.5 (IBM, США).
Результаты. У животных, получавших производные 1,4-дигидропиридина d02–133 и d02–172 в условиях проводимого эксперимента, установлено существенное (в 13–21 раз) уменьшение частоты чесательных движений уже на 10-й минуте наблюдения в сравнении с показателями у контрольной группы животных. На 15-й минуте анальгетическая активность указанных производных цианотиоацетамида возрастает в 14 и 11 раз в сравнении с аналогичным показателем у животных референтной группы. Через 20 минут анальгетическая активность этих соединений в отношении угнетения ноцицептивных импульсов, в сравнении с контрольной группой, также высока, поскольку число чесательных движений в области вибрисс у животных этих опытных групп в 8–9 раз меньше, чем в контроле. Тест орофациальной тригеминальной боли позволил обнаружить наличие максимально выраженной анальгетической активности у новых производных цианотиоацетамида под лабораторными шифрами d02–139, d02–133 и d02–172, превосходящей таковую у метамизола натрия.
Заключение. Установлено, что новые оригинальные производные 1,4-дигидропиридина проявили высокую степень болеутоляющей активности.
Ключевые слова
Для цитирования:
Бибик Е.Ю., Олейник И.С., Панков А.А., Фролов К.А., Доценко В.В., Кривоколыско С.Г. Исследование новых производных 1,4-дигидропиридина как потенциальных средств с болеутоляющей активностью в тесте орофациальной тригеминальной боли: экспериментальное доклиническое рандомизированное исследование. Кубанский научный медицинский вестник. 2023;30(2):64-75. https://doi.org/10.25207/1608-6228-2023-30-2-64-75
For citation:
Bibik E.Yu., Oleynik I.S., Pankov A.A., Frolov K.A., Dotsenko V.V., Krivokolysko S.G. Novel 1,4-Dihydropyridine Derivatives as Potential Agents with Analgesic Activity IN Orofacial Trigeminal Pain Test: Experimental Preclinical Randomized Trial. Kuban Scientific Medical Bulletin. 2023;30(2):64-75. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-2-64-75
ВВЕДЕНИЕ
Чувство боли известно каждому человеку. Болевой синдром является наиболее распространенным проявлением патологии в клинической практике [1–5]. Боль характеризует себя как неприятное, мучительное состояние, свидетельствующее о сбое в работе какого-либо органа или систем органов, а также возможной травме. Болевой синдром появляется внезапно, может иметь различный характер, длительность и интенсивность. Являясь нередко первым симптомом заболевания, именно боль заставляет пациента обращаться к врачу [6][7].
Общеизвестно, что болевой синдром является отображением системного патологического процесса, состоящего из местной реакции на повреждение, ощущения и передачи болевого импульса, его психоэмоциональной оценки и ответной поведенческой и вегетативной реакции живого организма [3][7]. Одной из главных задач современной фармакокоррекции большинства заболеваний является максимально полное и быстрое обезболивание.
Согласно данным исследований [9], болевой синдром продолжительностью не менее одного дня в течение года наблюдался у 92,4% пациентов1. Исходя из этого, очевидна и крайне велика актуальность поиска новых высокоэффективных болеутоляющих препаратов с минимальным спектром побочных эффектов или вовсе их отсутствием [10].
Цианотиоацетамид однозначно можно считать легкодоступным и многофункциональным реагентом для синтеза новых органических соединений. Одним из главных направлений использования тиоамида является синтез широкого круга S, N-гетероциклических соединений, к важнейшим из которых следует отнести 3-цианопиридин-2 (1 Н)-тионы и 3-циано-1,4-дигидропиридин-2-тиолаты. Дериваты цианотиоацетамида пиридинового ряда в настоящее время можно считать весьма полезным объектом исследования для изыскания новых лекарственных средств с многочисленными фармакологическими свойствами, включая анальгетические [11–20].
Анализируя имеющиеся сведения об особенностях синтеза, докинга и потенциальных биологических свойствах производных 1,4-дигидропиридина, можно прийти к заключению о возможном присутствии в спектре их фармакологических свойств болеутоляющей и жаропонижающей активности.
Начиная с 2014 года нами был получен обширный материал о разнообразных биологических свойствах отдельных частично гидрированных пиридинов. Каждому эксперименту на лабораторных животных предшествовал проведенный виртуальный биоскрининг по общепринятым программам (Swiss Target Prediction, разработанных учеными из Swiss Institute of Bioinformatics, [http://swisstargetprediction.ch/index.php], on-line ресурсов: Online SMILES Translatorand Structure File Generator от U. S. National Cancer Institute [https://cactus.nci.nih.gov/translate/], OPSIN: Open Parser for Systematic IUPAC nomenclature от University of Cambridge, Centre for Molecular Informatics [https://opsin.ch.cam.ac.uk/]) для определения образцов с наиболее вероятными антиноцицептивными свойствами по их способности связываться с рецепторами, ионными каналами или влиять на активность ферментных систем, участвующих в процессе воспаления и передачи болевого импульса [21].
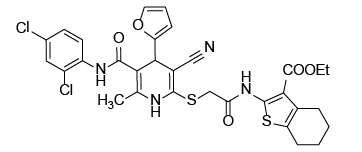
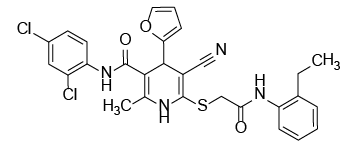
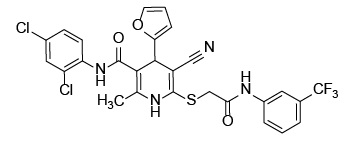
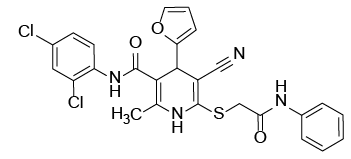
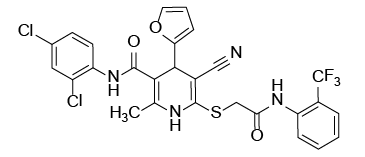
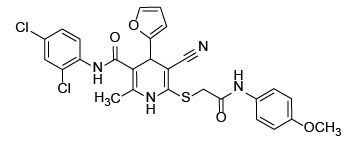
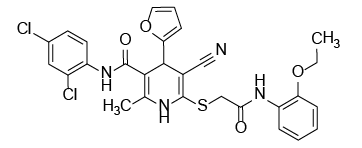
С учетом предполагаемого анальгетического эффекта на основе программного обеспечения виртуального биоскрининга нами были отобраны восемь образцов производных цианотиоацетамида. Их структура и химическое строение представлены на рисунке 1.
Указанные образцы рекомендуются для дальнейших доклинических исследований в опытах на лабораторных животных в различных тестах по изучению болеутоляющей активности.
Синтез целевых соединений
Общая схема синтеза вышеуказанных соединений представлена на рисунке 2. Изначально дикетен 1 вводился в реакцию с 2,4-дихлоранилином 2, при этом с количественным выходом получен N-(2,4-дихлорфенил)ацетоацетамид 3. Последовательное взаимодействие цианотиоацетамида 4 [22] с фурфуролом 5 и N-(2,4-дихлорфенил)ацетоацетамидом 3 в присутствии избытка N-метилморфолина (NMM) приводит к 6-метил-4-(2-фурил)-5-[(2,4-дихлорфенил)карбамоил]-3-циано-1,4-дигидропиридин-2-тиолату N-метилморфолиния 6. Реакция протекает как каскад процессов конденсации по Кнёвенагелю, присоединения по Михаэлю с последующей гетероциклизацией. S-алкилирование полученного 3-циано-1,4-дигидропиридин-2-тиолата N-метилморфолиния 6 продуктами хлорацетилирования первичных ароматических аминов, N-замещенными α-хлорацетамидами 7, протекает в водном этаноле в присутствии эквимольного количества КОН по обычному механизму нуклеофильного замещения SN2 и дает целевые продукты, 2-метил-6-[(2-оксо-2-{ариламино}этил)тио]-4-(2-фурил)-N-(2,4-дихлорфенил)-5-циано-1,4-дигидропиридин-3-карбоксамиды.
Среди основных наиболее вероятных биологических мишеней вышеприведенных избранных нами для опытов на животных образцов по результатам предикторного анализа следует указать циклооксигеназу 2 каннабиоидные рецепторы, коагуляционный фактор Х, простаноидные, аденозиновые рецепторы и ангиотензиновые рецепторы.
Цель исследования — установить уровень болеутоляющей активности восьми новых синтезированных нами гетероциклических соединений производных 1,4-дигидропиридина в классическом тесте орофациальной тригеминальной боли в опытах на животных.
МЕТОДЫ
Экспериментальные животные
100 белых беспородных крыс мужского пола в диапазоне массы 250–280 г были использованы для реализации эксперимента. Они поступили в лабораторию в зимний период из вивария государственного учреждения Луганской Народной Республики «Луганский государственный медицинский университет имени Святителя Луки» (ГУ ЛНР «ЛГМУ им. Святителя Луки»).
Размещение и содержание
Лабораторные белые крысы в период осуществления эксперимента содержались в соответствии с «Принципами надлежащей лабораторной практики» (утверждены приказом Федерального агентства по техрегулированию и метрологии № 1700-ст от 20 ноября 2014 г.) под наблюдением со свободным доступом к воде и корму при температуре окружающей среды 22–24 ºС; естественном режиме освещения и относительной влажности воздуха 40–50%.
Дизайн исследований
Дизайн проведенного нами рандомизированного контролируемого исследования представлен на рисунке 3. Опыты in vivo осуществлены в лаборатории кафедры фундаментальной и клинической фармакологии ГУ ЛНР «ЛГМУ им. Святителя Луки».
Объем выборки
В эксперименте использовались состоящие из 10 лабораторных животных группы. Крысы подразделялись на контрольную (без фармакокоррекции), референтную или группу сравнения (которым вводили метамизол натрия) и восемь опытных экспериментальных групп (которые получасли, соответственно, по одному из исследуемых повых производных цианотиоацетамида).
Критерии включения и исключения
Критерии включения
При осуществлении опытов были избраны самцы крыс без внешних признаков заболеваний и анатомических нарушений, которые прошли необходимый карантин в виварном блоке ГУ ЛНР «ЛГМУ им. Святителя Луки». В исследование включены экспериментальные животные, подвергнутые моделированию орофациальной тригеминальной боли в области вибрисс.
Критерии невключения
Лабораторные животные, вес которых отличался более чем на 50 г, для реализации эксперимента не подходили. Также в эксперимент не включались самки белых беспородных крыс.
Критерии исключения
При проведении экспериментальных исследований животные могли произвольно травмировать орофациальную зону, что явилось бы исключением из эксперимента. Кроме того, нагноение в этой области на любом этапе эксперимента стало бы причиной невключения животного в проведение дальнейшего эксперимента.
Рандомизация
Рандомное распределение по группам животных осуществлялось экспериментаторами непосредственно при получении их из вивария. Рандомизация проводилась методом «конвертов».
Обеспечение анонимности данных
Во время моделирования острой болевой реакции и наблюдения за экспериментом в различные сроки согласно методике крысы находились под наблюдением двух соавторов статьи и кружковцев кафедры фундаментальной и клинической фармакологии. Оценка результатов проводилась двумя другими соавторами. Анализ данных осуществляли два третьих соавтора.
Итоговые показатели (исходы исследования)
Установление наличия анальгетического эффекта в спектре фармакологической активности производных 1,4-дигидропиридинов, отобранных по итогам ранее осуществленного виртуального биологического скрининга. Фиксация и измерение результатов опытов на крысах в количественном отношении. Оценка результатов с показателями у животных контрольной группы и группы сравнения.
Экспериментальные процедуры
N-Арил-α-хлорацетамиды синтезировали взаимодействием 1,05 экв. хлорацетилхлорида с первичными ароматическими аминами (1,0 экв) в абсолютном толуоле при кипячении до прекращения выделения HCl с последующим удалением растворителя на ротационном испарителе. Выходы количественные.
Общая методика получения производных 1,4-дигидропиридина
Исходный 6-метил-4-(2-фурил)-5-((2,4-дихлорфенил)карбамоил)-3-циано-1,4-дигидро-пиридин-2-тиолат N-метилморфолиния 6 (1,20 г, 2,36 ммоль) суспендируют в 10 мл EtOH, добавляют при перемешивании 1,3 мл (2,5 ммоль) 10%-ного водного КОН. Полученный раствор через бумажный фильтр прикапывают к теплому (50 °С) раствору N-замещенного α-хлорацетамида 7 (2,36 ммоль) в 7 мл EtOH. Перемешивание смеси в течение 30 мин приводит к образованию осадка, который через 24 ч отфильтровывают, промывают водным EtOH и высушивают при 60 °С. Для получения аналитически чистых образцов продукты перекристаллизовывают из большого объема ацетона и высушивают при 60 °С.
Степень анальгетической активности была изучена в рекомендованном руководствами по доклиническим исследованиям новых биологических соединений тесте орофациальной тригеминальной боли. Орофациальная тригеминальная боль моделировалась подкожной инъекцией 5% раствора формалина объемом 0,1 мл в область вибрисс у подопытных животных. За полтора часа до моделирования острого болевого синдрома в области вибрисс крысам референтной группы вводили метамизол натрия через желудочный зонд в дозе 7 мг/кг. Животные восьми опытных групп также за 1,5 часа до введения формалина внутригастрально получали изучаемые новые производные 1,4-дигидропиридина в дозе 5 мг/кг. Через 10, 15 и 20 минут после моделирования острой боли подсчитывали число чесательных движений орофациальной области передними лапами за минуту.
Уход за животными и мониторинг
Наблюдение за лабораторными животными после моделирования острого болевого синдрома осуществлялось на протяжении 3 дней. Все крысы не имели ограничений в корме и воде. Чистота клеток, комфортные условия животным обеспечивались регулярно.
Статистические процедуры
Принципы расчета размера выборки
Для медицинских исследований принимаем уровень достоверности (доверительной вероятности) p = 0,95 и p = 0,98. Количество повторностей измерений n в сериях опытов, в зависимости от p = 0,95 (уровень значимости α = 0,05) и допустимой ошибки ε = ±3σ принималось равным 3, а для p = 0,98 — n = 4 согласно [23].
Необходимый объем выборки, согласно [23–25] и расчетам онлайн-калькулятора (medstatistic.ru/calculators/calcsize.html) для исследований с точностью 0,3 при p = 0,95 и доверительном коэффициенте t = 2,0 составляет не менее 44, а при p = 0,98 и доверительном коэффициенте t = 2,2 — не менее 70.
Статистические методы
Статистическая обработка полученных результатов эксперимента производилась по известным методам математической статистики, характеризующим количественную изменчивость. При обработке экспериментальных данных определялись: среднее арифметическое количества чесательных движений аср; дисперсия значений σ 2 вокруг среднего арифметического, среднеквадратическое (стандартное) отклонение σ, стандартная ошибка средней арифметической ±m. В связи с индивидуальными характеристиками животных, несмотря на их конституциональную идентичность, однородность полученных экспериментальных данных оценивалась коэффициентом вариации V. Чем больше значение коэффициента вариации, тем больше разброс и меньше выравненность исследуемых значений. Известно, что если коэффициент вариации превышает 33%, то это говорит о неоднородности информации и необходимости исключения самых больших и самых маленьких значений. Определение достоверности различий сравниваемых вариантов производилось на основе t-критерия Стьюдента (на основе онлайн-ресурса https://medstatistic.ru/calculators/averagestudent.html) при критическом значении t-критерия Стьюдента, равном 2,101, и уровне значимости α = 0,05.
Оценка значений исключаемых данных и сглаживание ряда данных производятся на основе доверительных интервалов, размер которых по опытным группам определяется в зависимости от значений aср, σ и размера выборки. С использованием программы Statistica версии 12.5 (IBM, США).
РЕЗУЛЬТАТЫ
Результаты исследований анальгетической активности восьми оригинальных вновь синтезированных производных цианотиоацетамида, в тесте орофациальной тригеминальной боли представлены в таблице 1.
Исходя из данных, представленных в таблице 1, можно сделать вывод о том, что значение коэффициента вариации во всех опытных группах менее 33%. Поэтому экспериментальные совокупности могут считаться однородными, но с повышенной колеблемостью значений. Оценка данных по доверительному интервалу не требуется. Также на основе полученных данных можно говорить о достоверности различия рассматриваемых вариантов исследуемых соединений.
В результате эксперимента по изучению анальгетической активности в тесте тригеминальной орофациальной боли установлено, что на самом раннем сроке набледения через 10 минут у крыс контрольной группы количество чесательных движений за минуту составило в среднем 90,2. Через 15 минут — 65,2, а через 20 минут — 35,2. Крысы этой группы (без фармакологической коррекции) в течение эксперимента издавали громкие звуки, были крайне беспокойными, интенсивно расчесывали лапками кожные покровы в зоне введения альгогена.
Исходя из данных таблицы 1, установлено, что крысы референтной группы, получавшие с целью предварительного обезболивания метамизол натрия за 1,5 часа до инъекции формалина в орофациальную область, через десятиминутный интервал характеризуются уменьшением числа чесательных движений на 33% в сравнении с контрольной группой. Через 15 минут количество чесательных движений меньше на 42%, а после 20-минутного интервала — на 44% в сравнении с показателями в контрольной группе.
Результаты экспериментов на крысах опытных групп показали, что однократное внутригастральное введение за полтора часа до воссоздания острого болевого синдрома новых гетероциклических соединений производных цианотиоацетамида 1,4-дигидропиридинов в различной мере снижает число чесательных движений в минуту после инъекции классического альгогена (0,1 мл 5% раствора формалина) в зону вибрисс крысам соответствующих групп.
Как показано в таблице 1, эффективность производных цианотиоацетамида в отношении усиления болеутоляющей активности возрастает от третьей до десятой строки. Производное цианотиоацетамида с лабораторным шифром d02–141 после внутрижелудочного его введения в дозе 5 мг/кг за 1,5 часа до инъекции формалина в орофациальную область уже через 10 минут показало уменьшение количества чесательных движений на 62%, через 15 минут — на 39%, а спустя 20 минут — на 3,4% при сравнении с аналогичными показателями у крыс контрольной группы. Если сопоставить болеутоляющую активность данного образца с группой сравнения, то она выше только на 10-й минуте наблюдения — на 43,5%. На 15- и 20-минутном интервале болеутоляющая активность в сравнении с анальгином снижается. Динамика анальгетической активности представлена на рисунке 4.
Исходя из данной динамики (рис. 4a–c) установлено, что болеутоляющими свойствами обладают вновь синтезированные исследуемые производные 1,4-дигидропиридина с шифрами d02-154 и d02-123. Образец d02-154 на 10-й и 20-й минутах активнее анальгина на 49 и 25% соответственно. Вещество 1,4-дигидропиридин с шифром d02-123 проявило анальгетическую активность выше метамизола натрия с 10-й по 20-ю минуту в 2,1–3,5 раза.
В экспериментальной группе животных, получавших производное 1,4-дигидропиридина с лабораторным шифром d02-149, через 10- и 15-минутные временные промежутки количество чесательных движений орофациальной области в среднем за минуту зарегистрировано на уровне 27,7 и 11,5 соответственно. А через 20 минут после моделирования острого болевого синдрома установлено достоверное снижение числа почесываний орофациальной зоны до 6,1 в сравнении с животными референтной группы.
Обезболивающую активность проявляет 1,4-дигидропиридин d02-122 в сравнении с контрольной и референтной группами. Данный образец на 10-й минуте наблюдения проявил эффективность, превышающую метамизол натрия в 2,5 раза, на 15-й минуте — в 1,9 раза, но 20-й минуте — эффективность снизилась (получено среднее арифметическое аср = 20,1), однако значение выше в сравнении с контрольной группой на 43%.
Данные, полученные в результате проведенных in vivo опытов, позволили установить тот факт, что наиболее значимой анальгетической активностью обладают образцы с шифрами d02-139, d02-133 и d02-172. Если рассмотреть зависимости на рисунке 4, то можно сделать вывод, что внутрижелудочное введение с профилактической целью соединения с лабораторным шифром d02-139 приводит к восьмикратному уменьшению частоты почесываний на сроке 10 мин. после введения 0,1 мл 5% раствора формалина. Через 15 мин. этот показатель стремится к эффективному уменьшению в 7 раз, а спустя 20 минут — в 3 раза в сравнении с таковым значением у крыс референтной группы.
Лабораторные животные опытных групп, которые внутрижелудочно получали производные 1,4-дигидропиридина с лабораторными шифрами d02-133 и d02-172 за 1,5 часа до введения альгогена, показали значительной степени выраженности достоверное 13- и 21-кратное снижение частоты чесательных движений уже на раннем сроке — через 10 минут наблюдения моделируемого острого болевого синдрома. Через 15 минут болеутоляющая активность данных производных цианотиоацетамида повышается в 14 и 11 раз в сравнении с аналогичным показателем у животных референтной группы. Через 20 минут анальгетическая активность данных соединений в плане угнетения ноцицептивных импульсов в сравнении с контрольной группой снижает число чесательных движений в области вибрисс в 8–9 раз.
Наблюдение за поведением крыс всех опытных групп в продолжение трех суток после эксперимента показало отсутствие визуальных отличий в этом отношении по сравнению с животными сравнительной и контрольной групп.

Рис. 1. Химические формулы исследуемых производных 1,4-дигидропиридина.
Примечание: рисунок выполнен авторами.
Fig. 1. Chemical formulas of 1,4-dihydropyridine derivatives under study.
Note: performed by the authors.
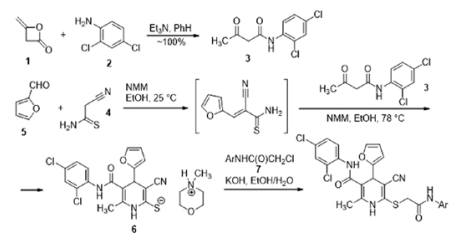
Рис. 2. Общая схема получения исследуемых производных 1,4-дигидропиридина.
Примечание: рисунок выполнен авторами.
Fig. 2. General scheme for obtaining 1,4-dihydropyridine derivatives under study.
Note: performed by the authors.
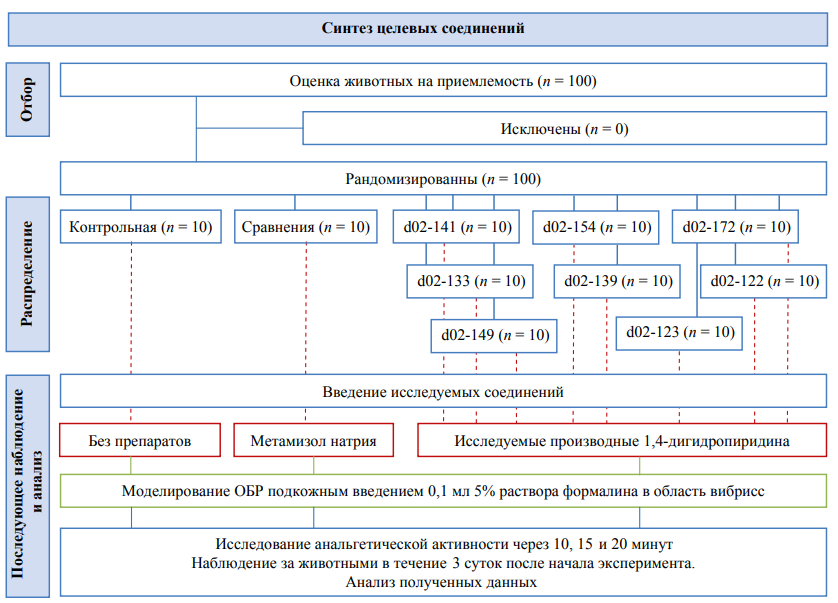
Рис. 3. Схема-дизайн исследования болеутоляющей активности исследуемых производных цианотиоацетамида.
Примечание: блок-схема выполнена авторами (согласно рекомендациям ARRIVE). Сокращения: ОБР — острая болевая реакция.
Fig. 3. Schematic diagram of the research design for analgesic activity of cyanothioacetamide derivatives under study.
Note: performed by the authors (according to ARRIVE recommendations). Abbreviations: ОБР — acute pain response.
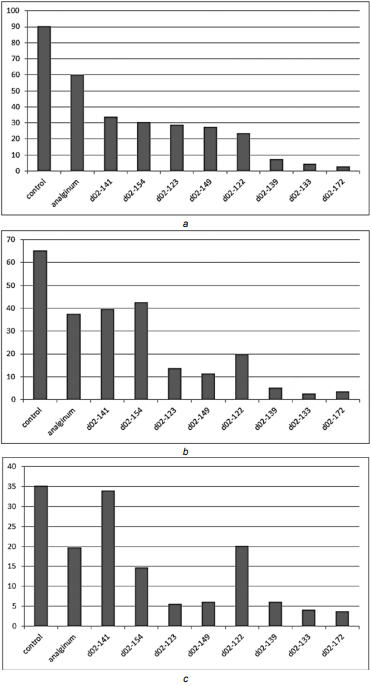
Рис. 4. Зависимость количества чесательных движений от вида образцов производных 1,4-дигидропиридина после введения альгогена в орофациальную область: a — через 10 мин.; b — через 15 мин.; c — через 20 мин.
Примечание: рисунки выполнены авторами.
Fig. 4. Dependence of the number of scratching movements on the type of 1,4-dihydropyridine derivatives samples after introduction of algogen into orofacial region: a — after 10 min; b —after 15 min; c — after 20 min.
Note: performed by the authors.
Таблица 1. Статистические характеристики анальгетической активности (темпоральная активность по количеству чесательных движений в тесте орофациальной тригеминальной боли) вновь синтезированных 1,4-дигидропиридинов
Table 1. Statistical characteristics of analgesic activity (temporal activity by the number of scratching movements in orofacial trigeminal pain test) of newly synthesized 1,4-dihydropyridines
Группа животных | Количественные показатели классического фармакологического теста орофациальной тригеминальной боли | ||
Через 10 мин. | Через 15 мин. | Через 20 мин. | |
1. Контрольная (введение 0,1 мл 5% раствора формалина в область вибрисс) | aср = 90,2; σ 2 = 96,4; σ = 9,80; m = ±3,27; V = 10,9% | aср = 65,2; σ 2 = 92,6; σ = 9,62; m = ±3,21; V = 14,8% | aср = 35,2; σ 2 = 36,0; σ = 6,00; m = ±2,00; V = 17,0% |
2. Группа сравнения (анальгин, 7 мг/кг) | aср = 60,0; σ 2 = 33,3; σ = 5,80; m = ±1,93; V = 9,6% | aср = 37,6; σ 2 = 6,50; σ = 2,50; m = ±0,83; V = 6,8% | aср = 19,7; σ 2 = 27,2; σ = 5,22; m = ±1,74; V = 26,5% |
3. d02–141 (5 мг/кг) | aср = 33,9; σ 2 = 37,7; σ = 6,14; m = ±2,05; V = 18,1%; t = 9,27 | aср = 39,6; σ 2 = 60,0; σ = 7,75; m = ±2,58; V = 19,6%; t = 0,74 | aср = 34,0; σ 2 = 112,4; σ = 10,6; m = ±3,53; V = 31,1%; t = 3,63 |
4. d02–154 (5 мг/кг) | aср = 30,5; σ 2 = 22,6; σ = 4,76; m = ±1,59; V = 15,6%; t = 11,8 | aср = 42,7; σ 2 = 55,8; σ = 7,47; m = ±2,49; V = 17,5%; t = 1,94 | aср = 14,8; σ 2 = 15,6; σ = 3,95; m = ±1,32; V = 26,7%; t = 2,24 |
5. d02–123 (5 мг/кг) | aср = 28,8; σ 2 = 28,1; σ = 5,30; m = ±1,77; V = 18,4%; t = 11,9 | aср = 13,7; σ 2 = 9,61; σ = 3,10; m = ±1,03; V = 22,6%; t = 18,07 | aср = 5,60; σ 2 = 2,30; σ = 1,52; m = ±0,51; V = 27,1%; t = 7,78 |
6. d02–149 (5 мг/кг) | aср = 27,7; σ 2 = 17,7; σ = 4,21; m = ±1,40; V = 15,2%; t = 13,6 | aср = 11,5; σ 2= 4,30; σ = 2,22; m = ±0,74; V = 19,3%; t = 23,5 | aср = 6,10; σ 2 = 2,20; σ = 1,48; m = ±0,49; V = 24,3%; t = 7,52 |
7. d02–122 (5 мг/кг) | aср = 23,7; σ 2 = 16,4; σ = 4,05; m = ±1,35; V = 17,1%; t = 15,4 | aср = 19,7; σ 2 = 19,5; σ = 4,41; m = ±1,47; V = 22,4%; t = 10,6 | aср = 20,1; σ 2 = 21,7; σ = 4,66; m = ±1,55; V = 23,2%; t = 0,17 |
8. d02–139 (5 мг/кг) | aср = 7,60; σ 2 = 2,24; m = ±0,50; V = 19,7%; t = 26,3 | aср = 5,20; σ 2 = 1,68; σ = 1,29; m = ±0,42; V = 24,9%; t = 34,8 | aср = 6,20; σ 2 = 2,89; σ = 1,70; m = ±0,57; V = 27,4%; t = 7,37 |
9. d02–133 (5 мг/кг) | aср = 4,40; σ 2 = 0,59; σ = 0,77; m = ±0,26; V = 17,5%; t = 26,8 | aср = 2,60; σ 2 = 0,25; σ = 0,50; m = ±0,17; V = 19,2%; t = 41,3 | aср = 4,20; σ 2 = 1,17; σ = 1,08; m = ±0,36; V = 25,8%; t = 8,72 |
10. d02–172 (5 мг/кг) | aср = 2,80; σ 2 = 0,16; σ = 0,40; m = ±0,13; V = 14,4%; t = 29,6 | aср = 3,50; σ 2 = 0,31; σ = 0,55; m = ±0,18; V = 15,9%; t = 40,2 | aср = 3,80; σ 2 = 1,02; σ = 1,01; m = ±0,34; V = 26,6%; t = 8,97 |
Примечание: таблица составлена авторами; аср — количество чесательных движений; σ2 — дисперсия; σ — среднеквадратическое отклонение; m — ошибка среднего арифметического; t-критерий Стьюдента; V — коэффициент вариации.
Note: compiled by the authors; аср — number of scratching movements; σ2 — variance; σ — standard deviation; m — mean deviation; t — Student’s t-test; V — coefficient of variation.
ОБСУЖДЕНИЕ
Интерпретация / научная значимость
Соединения с шифрами d02-141 и d02-154 на 10-й минуте наблюдения проявили анальгетическую активность выше в 1,8–1,9 раза по отношению к группе сравнения. Животные, получавшие образцы d02-123 и d02-149, демонстрируют возрастание анальгетической активности в 3,5 и 3,2 раза на 10-й и 15-й минутах наблюдения. Образец d02-122 проявил максимальную болеутоляющую активность на 10-й минуте наблюдения (в 2,53 раза эффективнее анальгина).
У животных, получавших производные 1,4-дигидропиридина d02-133 и d02-172 в условиях проводимого эксперимента, установлено существенное (в 13–21 раз) уменьшение частоты чесательных движений уже на 10-й минуте наблюдения в сравнении с показателями у контрольной группы животных. На 15-й минуте анальгетическая активность указанных производных цианотиоацетамида возрастает в 14 и 11 раз в сравнении с аналогичным показателем у животных референтной группы. Через 20 минут анальгетическая активность этих соединений в отношении угнетения ноцицептивных импульсов в сравнении с контрольной группой также высока, поскольку число чесательных движений в области вибрисс у животных этих опытных групп в 8–9 раз меньше, чем в контроле. Тест орофациальной тригеминальной боли позволил обнаружить наличие максимально выраженной анальгетической активности у новых производных цианотиоацетамида под лабораторными шифрами d02-139, d02-133 и d02-172, превосходящей таковую у метамизола натрия.
Исходя из результатов исследований, необходимо отметить, что выявлено максимальное отражение анальгетической активности в дозе 5 мг/кг в тесте орофациальной тригеминальной боли у трех следующих соединений: -d02-139 (5-cyano-N-(2,4-dichlorophenyl)-4-(2-furyl)-6-({2-[(4-methoxyphenyl)amino]-2-oxoethyl}thio)-2-methyl-1,4-dihydropyridine-3-carbo-xamide); -d02-133 (5-cyano-N-(2,4-dichlorophenyl)-4-(2-furyl)-2-methyl-6-({2-[(3-methylphenyl)amino]-2-oxoethyl}thio)-1,4-dihydropyridine-3-carboxamide); -d02-172 (5-cyano-N-(2,4-dichlorophenyl)-6-({2-[(2-ethoxyphenyl)amino]-2-oxoethyl}thio)-4-(2-furyl)-2-methyl-1,4-dihydropyridine-3-carboxamide).
Ограничения исследования
К ограничениям осуществленных нами опытов на белых крысах следует отнести отсутствие катамнестического наблюдения за животными более 3 дней. Поскольку это не дает возможности заключить о наличии каких-либо отдаленных эффектов применения новых синтезированных веществ. Этот момент требует дальнейшего исследования.
Обобщаемость/экстраполяция
Основными потенциальными биологическими мишенями для всех этих образцов, по данным виртуального биоскрининга, являются аденозиновые и каннабиоидные рецепторы, коагуляционный фактор Х, простаноидные рецепторы, ЦОГ-2.
Соединения с лабораторными шифрами d02-149 и d02-139 по результатам виртуального биоскрининга будут воздействовать на простаноидные рецепторы типов ЕР1 и ЕР4, каннабиоидные рецепторы типов СВ1 и СВ2, ЦОГ-2, что обуславливает их болеутоляющую активность. Также данные соединения могут проявлять антикоагулянтную активность вследствие влияния на коагуляционный фактор Х.
1,4-дигидропиридин d02-141 способен воздействовать на ангиотензиновые рецепторы 1А и 1В, коагуляционный фактор Х, ЦОГ-2, простаноидные ЕР4 рецепторы.
Образцы d02-122 и d02-133 способны воздействовать на ЦОГ-2, простаноидные ЕР1 и каннабиоидные СВ2 рецепторы, что увеличивает вероятность проявления обезболивающей активности.
Соединение с шифром d02-123 отличительно влияет на δ- и κ-опиоидные рецепторы, а также на каннабиоидные СВ1 и простаноидные ЕР1 рецепторы. Однако итоги проведенных исследований на животных в тесте орофациальной тригеминальной боли для данного образца не дали отличительно наилучших результатов по болеутоляющей активности.
Производные цианотиоацетамида d02-172 и d02-154 могут оказывать воздействие на ЦОГ-2, аденозиновые А1 и А2а рецепторы, каннабиоидные СВ1, СВ2 и простаноидные ЕР1, ЕР2 и ЕР4 рецепторы, а также на коагуляционный фактор Х.
ЗАКЛЮЧЕНИЕ
Установлена максимально выраженная болеутоляющая активность у трех из восьми новых производных 1,4-дигидропиридина, введенных однократно в дозе 5 мг/кг в тесте орофациальной тригеминальной боли. Это образцы с шифрами d02-139 (5-cyano-N-(2,4-dichlorophenyl)-4-(2-furyl)-6-({2-[(4-methoxyphenyl)amino]-2-oxoethyl}thio)-2-methyl-1,4-dihydropyridine-3-carboxamide); d02-133 (5-cyano-N-(2,4-dichlorophenyl)-4-(2-furyl)-2-methyl-6-({2-[(3-methylphenyl)amino]-2-oxoethyl}thio)-1,4-dihydropyridine-3-carboxamide); d02-172 (5-cyano-N-(2,4-dichlorophenyl)-6-({2-[(2-ethoxyphenyl)amino]-2-oxoethyl}thio)-4-(2-furyl)-2-methyl-1,4-dihydropyridine-3-carboxamide). Их анальгетическая активность выше таковой у метамизола натрия в 7,9, 9,8 и 21,4 раза, соответственно.
В перспективе планируется проведение серии опытов по подтверждению их болеутоляющих свойств в других классических фармакологических тестах, изучение антиэкссудативных эффектов данных соединений, а также вопросов исследования острой и хронической пероральной токсичности.
1 Павленко С. С. Состояние и проблемы эпидемиологических исследований болевых синдромов. Боль. 2006; 4: 2–7.
Список литературы
1. Bindu S., Mazumder S., Bandyopadhyay U. Non-steroidal antiinflammatory drugs (NSAIDs) and organ damage: A current perspective. Biochem. Pharmacol. 2020; 180: 114147. DOI: 10.1016/j. bcp.2020.114147
2. Ghosh S. Metabolomic Studies for Metabolic Alterations Induced by Non-Steroidal Anti-Inflammatory Drugs: Mini Review. Biomolecules. 2021; 11(10): 1456. DOI: 10.3390/biom11101456
3. Lucido M.J., Orlando B.J., Vecchio A.J., Malkowski M.G. Crystal Structure of Aspirin-Acetylated Human Cyclooxygenase-2: Insight into the Formation of Products with Reversed Stereochemistry. Biochemistry. 2016; 55(8): 1226–1238. DOI: 10.1021/acs.biochem.5b01378
4. Slepukhina M.A., Ivashchenko D.V., Sheina M.A., Muradian A.A., Blagovestnov D.A., Sychev D.A. Pain pharmacogenetics. Drug. Metab. Pers. Ther. 2020 Aug 10; 35(3). DOI: 10.1515/dmpt-2020-2939
5. Лесная О.А., Русанова Е.И., Прокофьева Е.Б., Фрейре Да Сильва Т. Рациональное применение НПВП в свете клинических рекомендаций и данных новых исследований. Трудный пациент. 2019; 17(10): 31–34. DOI: 10.24411/2074-1995-2019-10072
6. Dimova V., Herrnberger M.S., Escolano-Lozano F., Rittner H.L., Vlckova E., Sommer C., Maihöfner C., Birklein F. Clinical phenotypes and classification algorithm for complex regional pain syndrome. Neurology. 2020; 94(4): e357–e367. DOI: 10.1212/WNL.0000000000008736
7. Рациональное применение нестероидных противовоспалительных препаратов в клинической практике (клинические рекомендации). Часть 1. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015; 115(4): 70–82. DOI: 10.17116/jnevro20151154170-82
8. Theken K.N. Variability in analgesic response to non-steroidal anti-inflammatory drugs. Prostaglandins Other Lipid. Mediat. 2018; 139: 63– 70. DOI: 10.1016/j.prostaglandins.2018.10.005
9. Carley M.E., Chaparro L.E., Choinière M., Kehlet H., Moore R.A., Van Den Kerkhof E., Gilron I. Pharmacotherapy for the Prevention of Chronic Pain after Surgery in Adults: An Updated Systematic Review and Meta-analysis. Anesthesiology. 2021; 135(2): 304–325. DOI: 10.1097/ALN.0000000000003837
10. Костина И.Н., Огнев М.Ю. Применение нестероидных противовоспалительных препаратов (НПВП) разной химической структуры для лечения послеоперационной боли: рандомизированное проспективное клиническое исследование. Проблемы стоматологии. 2017; 13(2): 45–48. DOI: 10.18481/2077-7566-2017-13-2-45-48
11. Khan M.M., Khan S., Saigal S., Iqbal S. Recent developments in multicomponent synthesis of structurally diversified tetrahydropyridines. RSC Advances. 2016; 6(48): 42045–42061. DOI: 10.1039/c6ra06767k
12. Nisa Z.U., Akhtar T. Рara-Aminobenzoic Acid-A Substrate of Immense Significance. Mini-Reviews in Organic Chemistry. 2020; 17(6): 686– 700. DOI: 10.2174/1570193X16666190828201234
13. Mohareb R.M., Abouzied A.S., Abbas N.S. Synthesis and Biological Evaluation of Novel 4,5,6,7-Tetrahydrobenzo[b]thiazol-2-yl Derivatives Derived from Dimedone with Anti-Tumor, C-Met, Tyrosine Kinase and Pim-1 Inhibitions. Anticancer Agents Med. Chem. 2019; 19(12): 1438– 1453. DOI: 10.2174/1871520619666190416102144
14. Sayed E.M., Hassanien R., Farhan N., Aly H.F., Mahmoud K., Mohamed S.K., Mague J.T., Bakhite E.A. Nitrophenyl-Group-Containing Heterocycles. I. Synthesis, Characterization, Crystal Structure, Anticancer Activity, and Antioxidant Properties of Some New 5,6,7,8-Tetrahydroisoquinolines Bearing 3(4)-Nitrophenyl Group. ACS Omega. 2022; 7(10): 8767–8776. DOI: 10.1021/acsomega.1c06994
15. Bibik E.Yu., Saphonova A.A., Yeryomin A.V., Frolov K.A., Dotsenko V.V., Krivokolysko S.G. Study of an-aleptic activity of tetrahydropyrido [2,1-B] [1,3,5] tiadiazine derivatives. Research Result: Pharmacology and Clinical Pharmacology. 2017; 3(4): 20–25. DOI: 10.18413/2313-8971-2017-3-4-20-25
16. Бибик Е.Ю., Некраса И.А., Деменко А.В., Фролов К.А., Доценко В.В., Кривоколыско С.Г. Изучение адаптогенной активности производных тетрагидропиридо[2,1-b][1,3,5]тиадиазина. Бюллетень сибирской медицины. 2019;18(3):21-28. DOI: 10.20538/1682-0363-2019-3-21-28
17. Vasilenko D.A., Dueva E.V., Kozlovskaya L.I., Zefirov N.A., Grishin Y.K., Butov G.M., Palyulin V.A., Kuznetsova T.S., Karganova G.G., Zefirova O.N., Osolodkin D.I., Averina E.B. Tick-borne flavivirus reproduction inhibitors based on isoxazole core linked with adamantane. Bioorg. Chem. 2019; 87: 629–637. DOI: 10.1016/j.bioorg.2019.03.028
18. Kalashnik I.N., Dyachenko V.D. New Multicomponent Synthesis of Functionalized Nitriles and Esters of 6-Alkylsulfanyl-1,4- dihydronicotinic Acids. Russ. J. Gen. Chem. 2020; 90: 357–366. DOI: 10.1134/S1070363220030068
19. Krauze A., Krasnova L., Grinberga S., Sokolova E., Domracheva I., Shestakova I., Duburs G. Synthesis of 6-alkylsulfanyl-1,4- dihydropyridines as potential multidrug resistance modulators. Heterocycl. Commun. 2016; 22(3): 157–160. DOI: 10.1515/hc-2016-0034.
20. Velena A., Zarkovic N., Gall Troselj K., Bisenieks E., Krauze A., Poikans J., Duburs G. 1,4-dihydropyridine derivatives: dihydronicotinamide analogues — model compounds targeting oxidative stress. Oxid. Med. Cell. Longev. 2016: Article ID 1892412. DOI: 10.1155/2016/1892412
21. Gfeller D, Michielin O, Zoete V. Shaping the interaction landscape of bioactive molecules. Bioinformatics. 2013; 29(23): 3073–3079. DOI: 10.1093/bioinformatics/btt540
22. Dyachenko V.D., Dyachenko I.V., Nenajdenko V.G. Cyanothioacetamide: a polyfunctional reagent with broad synthetic utility. Russ. Chem. Rev. 2018; 87(1): 1–27. DOI: 10.1070/RCR4760
23. Наркевич А.Н., Виноградов К.А. Методы определения минимально необходимого объема выборки в медицинских исследованиях. Социальные аспекты здоровья населения [сетевое издание]. 2019; 65(6): 10. DOI: 10.21045/2071-50212019-65-6-10
24. Лихванцев В.В., Ядгаров М.Я., Берикашвили Л.Б., Каданцева К.К., Кузовлев А.Н. Определение объема выборки. Анестезиология и реаниматология. 2020; 6: 77–86. DOI: 10.17116/anaesthesiology202006177
25. Наркевич А.Н., Виноградов К.А. Дизайн медицинского исследования. Социальные аспекты здоровья населения [сетевое издание]. 2019; 65(5): 13. DOI: 10.21045/2071-5021-2019-65-5-13
Об авторах
Е. Ю. БибикРоссия
Бибик Елена Юрьевна — доктор медицинских наук, профессор, заведующая кафедрой фундаментальной и клинической фармакологии
кв-л 50-летия Обороны Луганска, д. 1г, г. Луганск, 291045
И. С. Олейник
Россия
Олейник Ирина Сергеевна — студентка 5-го курса фармацевтического факультета
кв-л 50-летия Обороны Луганска, д. 1г, г. Луганск, 291045
А. А. Панков
Россия
Панков Андрей Александрович — доктор технических наук, профессор кафедры транспортных технологий
кв-л Молодежный, д. 20а, г. Луганск, 291034
К. А. Фролов
Россия
Фролов Константин Александрович — доцент кафедры фармацевтической химии и фармакогнозии государственного учреждения «Луганский государственный медицинский университет имени Святителя Луки», главный инженер научно-исследовательской лаборатории «Химэкс» государственного образовательного учреждения высшего образования Луганской Народной Республики «Луганский государственный университет имени Владимира Даля»
кв-л 50-летия Обороны Луганска, д. 1г, г. Луганск, 291045,
кв-л Молодежный, д. 20а, г. Луганск, 291034
В. В. Доценко
Россия
Доценко Виктор Викторович — доктор химических наук, заведующий кафедрой органической химии и технологий федерального бюджетного образовательного учреждения высшего образования «Кубанский государственный университет», ведущий научный сотрудник НИЛ «Химэкс» государственного образовательного учреждения высшего образования Луганской Народной Республики «Луганский государственный университет имени Владимира Даля»
ул. Ставропольская, д. 149, г. Краснодар
С. Г. Кривоколыско
Россия
Кривоколыско Сергей Геннадиевич — доктор химических наук, профессор, старший научный сотрудник, заведующий кафедрой фармацевтической химии и фармакогнозии государственного учреждения «Луганский государственный медицинский университет имени Святителя Луки», научный руководитель научно-исследовательской лаборатории «Химэкс» государственного образовательного учреждения высшего образования Луганской Народной Республики «Луганский государственный университет имени Владимира Даля»
кв-л 50-летия Обороны Луганска, д. 1г, г. Луганск, 291045,
кв-л Молодежный, д. 20а, г. Луганск, 291034
Дополнительные файлы
Рецензия
Для цитирования:
Бибик Е.Ю., Олейник И.С., Панков А.А., Фролов К.А., Доценко В.В., Кривоколыско С.Г. Исследование новых производных 1,4-дигидропиридина как потенциальных средств с болеутоляющей активностью в тесте орофациальной тригеминальной боли: экспериментальное доклиническое рандомизированное исследование. Кубанский научный медицинский вестник. 2023;30(2):64-75. https://doi.org/10.25207/1608-6228-2023-30-2-64-75
For citation:
Bibik E.Yu., Oleynik I.S., Pankov A.A., Frolov K.A., Dotsenko V.V., Krivokolysko S.G. Novel 1,4-Dihydropyridine Derivatives as Potential Agents with Analgesic Activity IN Orofacial Trigeminal Pain Test: Experimental Preclinical Randomized Trial. Kuban Scientific Medical Bulletin. 2023;30(2):64-75. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-2-64-75