Перейти к:
Анализ содержания белковых маркеров в плазме крови больных с синдромом зависимости от наркотических веществ: наблюдательное клиническое исследование
https://doi.org/10.25207/1608-6228-2023-30-2-25-34
Аннотация
Введение. В наркологической практике диагностический процесс основывается на химико-токсикологическом определении субстрата интоксикации или его метаболита. Остаются нерешенными вопросы, связанные с лабораторным мониторингом и прогнозированием, которые могли бы сформировать основу вторичной профилактики. В качестве наиболее перспективных лабораторных маркеров наркопатологии рассматривают специфические белки нервной ткани.
Цель исследования — определить изменения содержания в плазме крови больных с синдромом зависимости от психоактивных веществ некоторых потенциальных биомаркеров наркопатологии белковой химической природы.
Методы. Работа выполнена по дизайну наблюдательного клинического исследования на базе государственного бюджетного учреждения здравоохранения «Наркологический диспансер» Министерства здравоохранения Краснодарского края в течение 07.2021–07.2022 гг. В основную группу (2-я группа) был включен 31 больной с диагнозом «синдром зависимости от психоактивных веществ». Параллельно была набрана контрольная группа (1-я группа, n = 15) здоровых испытуемых лиц, которые наблюдались в рамках профмедосмотров. В плазме крови определяли содержание 5 белков: мозгового и глиального нейротрофических факторов, нейронспецифической энолазы, альфа-синуклеина и кальций-связывающего белка S100B в процессе дезинтоксикационно-стабилизационного курса терапии и реабилитационного этапа. Статистический анализ данных был основан на расчете непараметрических критериев Манна — Уитни для сравнения показателей контрольной и опытной групп и критерия Вилкоксона для сравнения показателей одной группы, полученных на разных этапах наблюдения. Проведение расчетов осуществляли с помощью программ Stat Plus версия 7 (Analyst Soft Inc., США).
Результаты. В основную группу был включен 31 больной, но до конца наблюдения были доведены 18 больных с диагнозами «синдром зависимости от опиоидов» (n = 11) или «синдром зависимости от психостимуляторов» (n = 7). Больные выбывали из исследования по причине отказа от участия или прохождения реабилитационного курса, рецидива заболевания. Определение уровня нейротрофического фактора мозга в плазме крови на этапе поступления больных в стационар показало сниженное значение данного показателя на 45% ( р < 0,001), а после реабилитационного курса наблюдалось сниженное значение данного показателя в 3,9 раза ( р < 0,001). Содержание глиального нейротрофического фактора в плазме крови на этапе поступления в стационар превышало контрольные значения соответствующего параметра в 1,9 раза ( р < 0,001), однако в дальнейшем данный параметр быстро возвращался к нормальным значениям. Определение содержания нейронспецифической энолазы в плазме крови больных продемонстрировало также низкий уровень данного показателя, сниженный на 36% относительно контроля ( р < 0,001), увеличивающийся до уровня контрольных значений к концу проведения реабилитации.
Заключение. Получены данные, свидетельствующие о наличии изменений нейротрофических факторов в плазме крови больных с синдромом зависимости от опиоидов или психостимуляторов. Реабилитационный период характеризовался сравнительно быстрой нормализацией уровня нейротрофинов, однако уровень нейротрофического фактора мозга, несмотря на успешное проведение всего терапевтического курса, оставался сниженным, что может указывать на наличие изменений необратимого характера.
Ключевые слова
Для цитирования:
Быков И.М., Любченко Д.А., Попов К.А., Столярова А.Н., Попова М.А., Цымбалов О.В., Есауленко Е.Е. Анализ содержания белковых маркеров в плазме крови больных с синдромом зависимости от наркотических веществ: наблюдательное клиническое исследование. Кубанский научный медицинский вестник. 2023;30(2):25-34. https://doi.org/10.25207/1608-6228-2023-30-2-25-34
For citation:
Bykov I.M., Lubchenko D.A., Popov K.A., Stolyarova A.N., Popova M.A., Tsymbalov O.V., Esaulenko E.E. Analysis of Protein Markers in Plasma of Patients with Drug Dependence Syndrome: Observational Clinical Study. Kuban Scientific Medical Bulletin. 2023;30(2):25-34. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-2-25-34
ВВЕДЕНИЕ
Актуальной проблемой современной психиатрии и наркологии является объективизация диагностического процесса. В наркологической практике диагностический процесс прежде всего основывается на химико-токсикологическом определении субстрата интоксикации, относящегося к группе наркотических веществ, или его метаболита [1][2]. Тем не менее остаются нерешенными вопросы, связанные с лабораторным мониторингом и прогнозированием, которые могли бы сформировать основу вторичной профилактики. В качестве перспективных лабораторных маркеров наркопатологии рассматривают различные молекулы, образующиеся в организме больных в ответ на введение наркотической субстанции. Такими молекулами могут быть некоторые специфические белки нервной ткани, субстраты эндотоксикоза, нейромедиаторы и ферменты их обмена, рецепторы нейромедиаторов и антитела к ним, про- и противовоспалительные факторы, такие как цитокины, компоненты антиоксидантной системы и маркеры окислительного стресса [3–6]. Наиболее интересными ввиду более высокой специфичности являются белковые маркеры. В литературе представлен достаточно противоречивый анализ изменений содержания белков, тем не менее одними из наиболее перспективных являются такие белки, как мозговой нейротрофический фактор (BDNF, brain-derived neurotrophic factor) и нейротрофический фактор глиальной клеточной линии (GDNF, glial cell line-derived neurotrophic factor), участвующие в регуляции роста и дифференцировки различных типов нейронов [7][8]. К нейротрофическим факторам также относят белок S100B, галанин и др. Некоторые авторы рассматривают в качестве перспективных маркеров альфа-синуклеин, который значительно увеличен в сыворотке крови больных алкоголизмом, инсулиноподобный фактор роста-1, пролактин и др. [9–11]. Тем не менее литературные данные об изменениях уровня белков в крови больных с синдромом зависимости от опиоидов или психостимуляторов имеют отрывочный и противоречивый характер, что актуализирует необходимость систематизации данных и проведения комплексного сравнительного определения изменений отдельных белков [12–14].
Нейротрофические факторы (нейротрофины) представляют собой обширное семейство секретируемых белков, которые обеспечивают процессы регуляции выживаемости, пролиферации и дифференцировки клеток нервной ткани, а также имеют ведущее значение в регуляции пластичности в центральной нервной системе. Особое внимание заслуживают белки, связанные с нейромедиаторными системами, нарушения метаболизма которых во многом составляют основу формирования химических аддикций. К таким факторам прежде всего относят BDNF и GDNF, связанные преимущественно с серотонинергической (BDNF) и дофаминергической (GDNF) системами мозга [15], хотя такое деление достаточно условно. Так, известно, что в норме BDNF также имеет связь с другими нейромедиаторными системами, в частности с дофаминергической. Это подтверждается тем, что почти половина дофаминергических нейронов, экспрессирующих тирозингидроксилазу, одновременно экспрессируют BDNF [16]. С другой стороны, данный нейротрофин наиболее распространен в головном мозге, поэтому нет ничего удивительного, что он широко представлен в разных типах нейронов. Экспрессия BDNF изменяется в широких пределах в ответ на действие различных стрессорных факторов, травму, гипогликемию, ишемию, повреждения головного мозга разного этиопатогенеза [17][18].
Нарушения, связанные с экспрессией и метаболизмом BDNF, могут быть связаны с развитием химических аддикций [19–22]. Так, у больных алкоголизмом определяется изменение содержания BDNF в сыворотке крови, которое в определенной мере соответствует клинической картине заболевания — более низкий уровень наблюдается при интоксикации, однако на фоне абстинентного синдрома уровень BDNF возрастает [15][23–25]. GDNF был выделен из культуры клеток глиомы и в настоящее время получил признание как фактор, необходимый для развития, поддержания и защиты нигростриатных дофаминергических нейронов.
Формирование наркотической зависимости, абстинентного синдрома и толерантности связано с нарушением функционирования различных физиологических и биохимических систем, в особенности с изменением активности нейромедиаторных систем. Три основные системы участвуют в формировании систем подкрепления: дофаминергическая, опиоидергическая, ГАМК-ергическая [26]. Каждая группа наркотических веществ характеризуется определенными особенностями, но для всех психоактивных веществ общей молекулярной мишенью фармакологического действия является система дофаминовой нейромедиации. Одним из основных компонентов формирования пристрастия является активация церебральной системы вознаграждения, центральным звеном которой являются дофаминергические нейроны А10 вентральной области покрышки [27].
Цель исследования — определение изменений содержания в плазме крови некоторых потенциальных биомаркеров наркопатологии белковой химической природы.
МЕТОДЫ
Дизайн исследования
Работа выполнена по дизайну наблюдательного клинического исследования. В исследование включен 31 больной с диагнозом «синдром зависимости от психоактивных веществ» и 15 здоровых испытуемых лиц, наблюдавшихся в рамках профмедосмотров.
Условия проведения
Больные наблюдались на базе государственного бюджетного учреждения здравоохранения «Наркологический диспансер» Министерства здравоохранения Краснодарского края (ГБУЗ НД), относительно здоровые испытуемые лица наблюдались на базе Клиники федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО Кубгму Минздрава России). Лабораторный этап исследования выполнен на базе клинико-диагностической лаборатории ГБУЗ НД и лаборатории кафедры фундаментальной и клинической биохимии ФГБОУ ВО КубГМУ Минздрава России. Период проведения исследования: с июля 2021 по июль 2022 года.
Критерии соответствия
Критерии включения
Критерии включения в исследование для группы контроля: возраст 20–35 лет; мужской пол, отсутствие соматических патологий, состояние психического здоровья на момент обследования, наличие добровольного информируемого согласия.
Критерии включения в исследование для основных групп: возраст 20–35 лет; мужской пол; верифицированный диагноз: «синдром зависимости от опиоидов» или «синдром зависимости от психостимуляторов», наличие добровольного информируемого согласия в письменном виде.
Критерии невключения
Возраст старше 35 или моложе 20 лет; женский пол; наличие онкологических заболеваний; наличие острых или хронических болезней в фазе обострения, не относящихся к исследуемым нозологическим формам (например, декомпенсированная патология сердечно-сосудистой системы, органов дыхания, почек, ВИЧ-инфекция и прочее); неврологические и психические расстройства; неконтролируемый прием лекарственных препаратов, прием биологически активных добавок, лекарственных трав, отягощенный аллергологический анамнез, отказ от включения в исследование.
Критерии исключения
Отказ от дальнейшего наблюдения, отказ от прохождения реабилитационно-противорецидивного этапа лечения, рецидив заболевания (определение психоактивных веществ в биологических жидкостях в процессе реабилитации).
Описание критериев соответствия (диагностические критерии)
Отбор испытуемых лиц включал установление диагноза «синдром зависимости от психоактивных веществ» (опиоиды или психостимуляторы) на основании клинической диагностики в соответствии с клиническими рекомендациями [1]. Факт употребления наркотиков был подтвержден химико-токсикологическим определением наркотического вещества или его метаболита в крови и/или моче.
Подбор участников в группы
Выборка участников исследования формировалась сплошным методом. В основную группу (2-я группа) был включен 31 больной, но до конца наблюдения были доведены 18 больных с диагнозами «синдром зависимости от опиоидов» (n = 11) или «синдром зависимости от психостимуляторов» (n = 7). Параллельно была набрана контрольная группа (1-я группа, n = 15) здоровых испытуемых лиц, которые наблюдались в рамках профмедосмотров.
Целевые показатели исследования
Основной показатель исследования
В плазме крови определяли содержание 5 белков: мозгового (BDNF) и глиального (GDNF) нейротрофических факторов, нейронспецифической энолазы (NSE), альфа-синуклеина и кальций-связывающего белка S100B, которые исходя из анализа литературных данных нам представлялись наиболее перспективными маркерами для лабораторной оценки состояния больных с синдромом наркотической зависимости.
Дополнительные показатели исследования
Не предусмотрены.
Методы измерения целевых показателей
У лиц контрольной группы осуществляли однократный забор крови для проведения биохимических исследований на содержание белковых маркеров. Наблюдение за больными 2-й группы было разделено на 2 традиционных этапа: этап дезинтоксикационно-стабилизационного курса терапии (18–20 дней) и реабилитационно-противорецидивный этап (4–6 месяцев). В начале каждого этапа и по его окончанию выполняли забор крови для лабораторных исследований. Таким образом, исследования содержания белковых маркеров в плазме крови больных выполняли 4 раза (рис. 1). Проведение дезинтоксикационно-стабилизационного курса терапии основывалось на коррекции психических расстройств, инфузионной детоксикационной терапии, применении гепатопротекторов и витаминотерапии. Реабилитация проводилась в 3 традиционных этапа: адаптационный, интеграционный и стабилизационный. Все больные, отобранные для проведения исследования, имели исходный средний реабилитационный потенциал. Проведение реабилитационного курса включало психотерапевтические и физиотерапевтические мероприятия, а также медикаментозную коррекцию. В зависимости от этапа и текущего состояния больные получали лекарственные средства из группы нейролептиков, антидепрессантов, блокаторов опиатных рецепторов, гепатопротекторов, ноотропов и витаминов.
В плазме крови определяли содержание 5 белков: мозгового (BDNF) и глиального (GDNF) нейротрофических факторов, нейронспецифической энолазы (NSE), альфа-синуклеина и кальций-связывающего белка S100B, которые исходя из анализа литературных данных нам представлялись наиболее перспективными маркерами для лабораторной оценки состояния больных с синдромом наркотической зависимости. Определение концентрации белков в биологической жидкости было основано на иммуноферментном методе, реализованном в наборах реагентов Cloud-Clone Corp. (США). Выполнение лабораторного этапа исследования осуществляли на базе кафедры фундаментальной и клинической биохимии ФГБОУ ВО КубГМУ Минздрава России с использованием мультимодального планшетного ридера Fluostar Omega (BMG, Германия), вспомогательного лабораторного оборудования и программного обеспечения.
Переменные (предикторы, конфаундеры, модификаторы эффекта)
Искажающими факторами, способными самостоятельно влиять на уровень определяемых белковых маркеров в сыворотке или плазме крови, прежде всего являются заболевания психиатрического профиля, органические поражения центральной нервной системы. Данные факторы были нивелированы на этапе формирования выборок за счет внесения их в состав критериев невключения. Также косвенным свидетельством отсутствия заметного влияния органических поражений центральной нервной системы может быть низкий уровень классических периферических маркеров поражения нервной ткани — белков S100 и NSE.
Статистические процедуры
Принципы расчета размера выборки
Размер выборки предварительно не рассчитывался.
Статистические методы
Статистический анализ данных был основан на расчете непараметрических критериев Манна — Уитни для сравнения показателей контрольной и опытной групп и критерия Вилкоксона для сравнения показателей одной группы, полученных на разных этапах наблюдения. Выбор критериев был обоснован сравнительно небольшим объемом выборок и отличием распределения показателей от нормального закона. В качестве уровня статистически значимой степени различий между группами была принята вероятность ошибки гипотезы не более 5%. Проведение расчетов осуществляли с помощью программ StatPlus версия 7 (AnalystSoft Inc., США). В иллюстративном материале статьи данные представлены в виде медианного значения показателей, 1-го и 3-го квартилей.
РЕЗУЛЬТАТЫ
Формирование выборки исследования
Для проведения исследования были сформированы две группы (рис. 1). В основную группу (2-я группа) был включен 31 больной, но до конца наблюдения были доведены 18 больных с диагнозами «синдром зависимости от опиоидов» (n = 11) или «синдром зависимости от психостимуляторов» (n = 7). Больные выбывали из исследования по причине отказа от участия или отказа от прохождения реабилитационного курса, а также по причине рецидива заболевания, подтвержденного обнаружением психоактивных веществ в биологических жидкостях. Параллельно была набрана контрольная группа (1-я группа, n = 15) здоровых испытуемых лиц, которые наблюдались в рамках профмедосмотров (рис. 1).
Характеристики выборки (групп) исследования
Испытуемые лица, включенные в контрольную и опытную группы, были сопоставимы по полу (все мужчины) и возрасту. Возраст мужчин 1-й группы составлял 29 (25–32) лет, 2-й группы — 29 (26–32) лет.
Основные результаты исследования
Проведенные исследования позволили выявить статистически значимые изменения трех белковых маркеров из пяти изученных на разных этапах наблюдения больных с синдромом зависимости от психостимуляторов и опиоидов относительно контрольных показателей, полученных при исследовании относительно здоровых добровольцев. Определение уровня мозгового нейротрофического фактора в плазме крови на этапе поступления больных 2-й группы в стационар показало сниженное значение данного показателя на 45% (рис. 2). Проведение курсов дезинтоксикационной и психофармакологической терапии способствовало поддержанию в крови более высокого уровня анализируемого нейротрофического фактора, соответствующего контрольным значениям показателя. Однако к окончанию реабилитационного курса наблюдалось снижение уровня данного показателя в 3,9 раза ниже контрольного показателя.
Определение содержания нейротрофического фактора глиальной клеточной линии показало противоположные описанным выше результатам для BDNF. Так, уже на этапе поступления в стационар в фазе обострения синдрома зависимости от опиоидов или психостимуляторов содержание GDNF в плазме крови превышало контрольные значения соответствующего параметра в 1,9 раза (рис. 3). Проведение курса лечения и реабилитации способствовало постепенному снижению уровня анализируемого белкового маркера до контрольных цифр уже к началу реабилитации с сохранением данной тенденции на протяжении всего периода наблюдений.
Определение содержания нейронспецифической энолазы в плазме крови больных 2-й группы продемонстрировало низкий уровень данного показателя, сниженный на 36% относительно контроля, а также отсутствие ответа на проведение дезинтоксикационно-стабилизационного курса лечения (рис. 4). Тем не менее к концу проведения реабилитационных мероприятий содержание нейронспецифической энолазы увеличивалось до уровня контрольных значений аналогичного параметра.
Определение в плазме крови больных 2-й группы содержания альфа-синуклеина и кальций-связывающего белка S100B не выявило каких-либо статистически значимых различий от значений соответствующих параметров контрольной группы (14,0 (13,9–14,8) нг/мл S100B; 4,6 (4,3–4,9) нг/мл альфа-синуклеина). При этом не было выявлено каких-либо изменений ни в фазе обострения синдрома зависимости от наркотических веществ, ни в процессе проведения лечебных и реабилитационных мероприятий. Отсутствие резко увеличенного содержания в плазме крови белков S100B и NSE свидетельствует о низкой вероятности или выраженности цитолитического синдрома, характеризующегося разрушением клеток ЦНС.
Дополнительные результаты исследования
Дополнительные результаты в ходе исследования не получены.
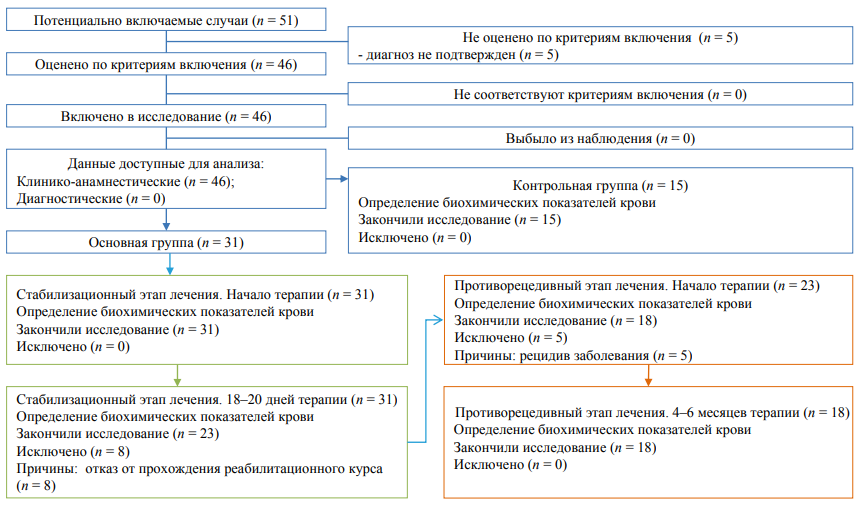
Рис. 1. Блок-схема проведенного исследования.
Примечание: блок-схема выполнена авторами (согласно рекомендациям STROBE).
Fig 1. Schematic diagram of the scientific layout.
Note: performed by the authors (according to STROBE recommendations).
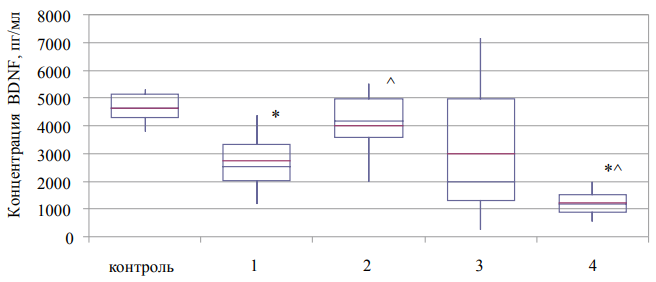
Рис. 2. Содержание мозгового нейротрофического фактора в плазме крови больных с синдромом зависимости от наркотических веществ (Ме (Q1–Q3)).
Примечание: рисунок выполнен авторами; * — статистически значимые различия между показателями контрольной и основной группы; ^ — статистически значимые различия от показателя предыдущего этапа наблюдения. Сокращения: BDNF — нейротрофический фактор мозга (brain-derived neurotrophic factor).
Fig. 2. Brain-derived neurotrophic factor in plasma of patients with drug dependence syndrome (Me (Q1–Q3)).
Note: performed by the authors; * — statistically significant differences between indicators of the control and main group; ^ — statistically significant differences from indicator of previous stage of observation. Abbreviations: BDNF is a brain-derived neurotrophic factor.
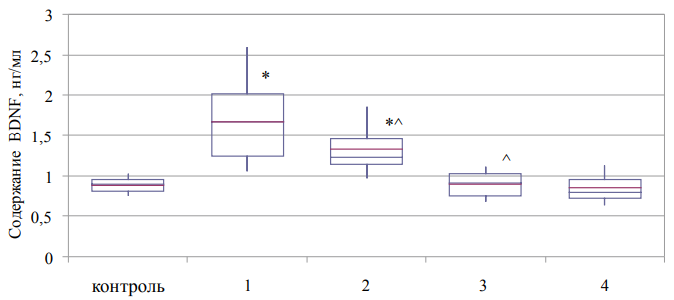
Рис. 3. Содержание глиального нейротрофического фактора в плазме крови больных с синдромом зависимости от наркотических веществ (Ме (Q1–Q3)).
Примечание: рисунок выполнен авторами; * — статистически значимые различия между показателями контрольной и основной группы; ^ — статистически значимые различия от показателя предыдущего этапа наблюдения. Сокращения: BDNF — нейротрофический фактор мозга (brain-derived neurotrophic factor).
Fig. 3. Glial-derived neurotrophic factor in plasma of patients with drug dependence syndrome (Me (Q1–Q3)).
Note: performed by the authors; * — statistically significant differences between indicators of the control and main group; ^ — statistically significant differences from indicator of previous stage of observation. Abbreviations: BDNF is a brain-derived neurotrophic factor.
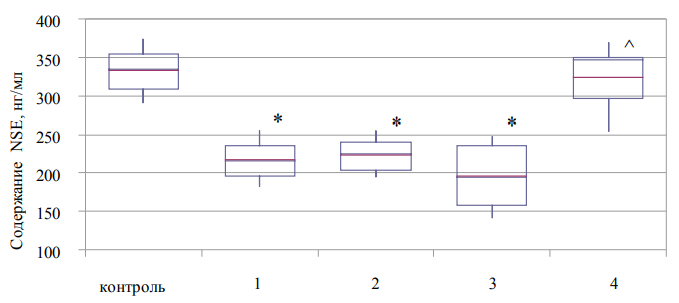
Рис. 4. Содержание нейронспецифической энолазы в плазме крови больных с синдромом зависимости от наркотических веществ (Ме (Q1–Q3)).
Примечание: рисунок выполнен авторами; * — статистически значимые различия между показателями контрольной и основной группы; ^ — статистически значимые различия от показателя предыдущего этапа наблюдения. Сокращения: NSE — нейронспецифическая энолаза (neuron-specific enolase).
Fig. 4. Neuron-specific enolase in plasma of patients with drug dependence syndrome (Me (Q1–Q3)).
Note: performed by the authors; * — statistically significant differences between indicators of the control and main group; ^ — statistically significant differences from indicator of the previous stage of observation. Abbreviations: NSE is a neuron-specific enolase.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Определение уровня BDNF и NSE в плазме крови на этапе поступления больных 2-й группы в стационар показало сниженное значение данного показателя на 45 и 36% соответственно, а после реабилитационного курса наблюдалось сниженное значение уровня BDNF в 3,9 раза, но увеличение уровня энолазы до контрольных значений. Содержание GDNF в плазме крови на этапе поступления в стационар превышало контрольные значения соответствующего параметра в 1,9 раза, однако в дальнейшем данный параметр быстро возвращался к нормальным значениям.
Ограничения исследования
Результаты настоящего исследования были получены на небольших выборках пациентов. Для дальнейшего развития выполненной работы необходимо проведение исследования с бóльшим объемом выборки, большей продолжительностью и возможным разделением основной группы на подгруппы в зависимости от типа употребляемого психоактивного вещества.
Интерпретация результатов исследования
Разнонаправленный характер изменений уровня нейротрофических факторов в плазме крови может свидетельствовать о специфическом влиянии наркотических веществ на метаболизм клеток нервной ткани. Более низкий уровень мозгового нейротрофического фактора и нейронспецифической энолазы может косвенно указывать на наличие дистрофических процессов, а также уменьшение общего количества и активности нейронов в ЦНС [28]. Уровень экспрессии и синтеза мозгового нейротрофического фактора связан с процессами нейрогенеза и нейропластичности [14]. В пользу предположения о снижении общего количества клеток также свидетельствует сохранение низкого содержания BDNF даже после полноценного реабилитационного периода, длительность которого составляла более 6 месяцев. Снижение содержания мозгового, на фоне увеличенного уровня глиального нейротрофического фактора можно также рассматривать как функциональные изменения, связанные с особенностями влияния наркотиков на нейромедиаторный обмен.
Считается, что BDNF связан с серотонинергической нейромедиаторной системой, тогда как GDNF считается преимущественно дофаминергическим [13]. Эти две нейромедиаторные системы находятся в антагонистических отношениях, что может характеризоваться разнонаправленными изменениями связанных с ними нейротрофических факторов. Нарушения медиаторного обмена, в частности усиление синтеза и секреции дофамина, снижение скорости его инактивации на ранних стадиях или адаптивное снижение образования катехоламинов, снижение количества их рецепторов в более поздние сроки, являются ведущими патобиохимическими механизмами формирования синдрома зависимости от наркотических веществ [27]. Активация системы вознаграждения сопровождается увеличением синтеза дофамина, снижение выброса дофамина характерно для развития абстинентного синдрома. Так, действие психоактивных веществ приводит к секреции дополнительных порций дофамина из крупных пузырьков синапса, некоторые наркотические вещества непосредственно стимулируют постсинаптические дофаминовые рецепторы. Это действие может сопровождаться положительно окрашенными эмоциональными переживаниями и развитием галлюцинаций. Свободный дофамин быстро инактивируется по одному из механизмов, включая работу моноаминооксидазы, или возвращается в депо. На фоне увеличения выброса дофамина развивается компенсаторное снижение чувствительности рецепторного аппарата.
Регулярное поступление наркотиков в организм человека приводит истощению запасов нейромедиатора, что на фоне стимуляции «нормальной» интенсивности сопровождается недостаточной реакцией системы подкрепления. Это сопровождается ухудшением настроения, ощущением слабости, утомляемости, эмоциональным дискомфортом, депрессивными расстройствами. Возникает желание приема очередной дозы наркотического вещества для купирования вышеописанных расстройств. Действительно, введение в этих условиях наркотика стимулирует выброс дофамина из депо, что временно нивелирует его относительный дефицит в синаптической щели и нормализует деятельность лимбических структур мозга. Формируется «порочный круг», который лежит в основе развития психической зависимости от психоактивных веществ. Определение уровня дофамина в сыворотке крови может дать ценную диагностическую информацию [16]. Увеличенные значения концентрации дофамина характерны для абстинентного синдрома, а также для начального периода ремиссии. Прогрессирование ремиссии, однако, характеризуется снижением уровня дофамина в крови. Поддержание в головном мозге низкой концентрации дофамина может быть основой сохранения патологического влечения к наркотикам и формирования в последующем рецидивов заболевания [27].
Полученные в исследовании данные изменения уровня мозгового нейротрофического фактора, особенно в конце реабилитационного периода, в целом согласуются с описанными в литературе изменениями уровня дофамина в периоде ремиссии. Это также косвенно подтверждает предположения о причинах разнонаправленных изменений белков BDNF и GDNF. Однако в лабораторной диагностике предпочтительнее может оказаться определение более стабильных белковых маркеров, чем быстро инактивируемых биогенных аминов. Также полученные данные подтверждают, что даже после полноценного реабилитационного курса сохраняется высокий риск формирования рецидивов, обусловленный относительно низкой активностью дофаминергической системы, что было опосредовано низким уровнем BDNF.
ЗАКЛЮЧЕНИЕ
Таким образом, были получены данные, свидетельствующие о наличии изменений некоторых белковых маркеров (BDNF, GDNF, NSE) в плазме крови больных с синдромом зависимости от опиоидов или психостимуляторов как в фазе обострения, так и в процессе лечения и реабилитации. Реабилитационный период характеризовался сравнительно быстрой нормализацией уровня GDNF и NSE, однако уровень BDNF, несмотря на успешное проведение всего терапевтического курса, в течение минимум 6 месяцев оставался сниженным, что может указывать на наличие изменений необратимого характера в ЦНС больных, злоупотребляющих веществами, относящимися к группе наркотиков. Кроме того, учитывая известную связь BDNF с дофаминергической нейромедиаторной системой, низкий уровень анализируемого белка может свидетельствовать о сохранении дефицита дофамина даже по окончании реабилитационного периода и существовании высокого риска рецидивов заболевания. Определение данных белковых маркеров может потенциально использоваться для лабораторного мониторинга эффективности терапевтических и реабилитационных мероприятий наркопатологии.
Список литературы
1. Брюн Е.А., Агибалова Т.В., Бедина И.А., Бузик О.Ж., Винникова М.А., Кошкина Е.А., Михайлов М.А., Надеждин А.В., Поплевченков К.Н., Тетенова Е.Ю. Психические и поведенческие расстройства, вызванные употреблением психоактивных веществ. Синдром зависимости от психоактивных веществ. Клинические рекомендации. Проект. Наркология. 2019; 18(2): 3–59. DOI: 10.25557/1682-8313.2019.01.03.3-59
2. Винникова М.А., Ежкова Е.В., Булатова Р.А. Терапевтические стратегии модификационной профилактики при синдроме зависимости, вызванном сочетанным употреблением психоактивных веществ: обзор данных литературы. Профилактическая медицина. 2018; 21(2): 61–67. DOI: 10.17116/profmed201821261-67
3. Ветрова М.В., Палаткин В.Я., Проценко Е.А., Боровская В.Г., Ирхина М.Д., Белова О.Г., Тюсова О.В., Блохина Е.А., Бушара Н.М., Ярославцева Т.С., Холодная А.Н., Лиознов Д.А., Крупицкий Е.М., Звартау Э.Э. Гормональные биомаркеры стресса и когнитивные функции больных ВИЧ-инфекцией с опиоидной зависимостью. Инфекционные болезни: новости, мнения, обучение. 2022; 11(3): 112–119. DOI: 10.33029/2305-3496-2022-11-3-112-119
4. Crist R.C., Reiner B.C., Berrettini W.H. A review of opioid addiction genetics. Curr. Opin. Psychol. 2019; 27: 31–35. DOI: 10.1016/j.copsyc.2018.07.014
5. Svidlov A., Drobotenko M., Basov A., Gerasimenko E., Malyshko V., Elkina A., Baryshev M., Dzhimak S. DNA Dynamics under Periodic Force Effects. Int. J. Mol. Sci. 2021 Jul 23; 22(15): 7873. DOI: 10.3390/ijms22157873. PMID: 34360636; PMCID: PMC8345943
6. Zhang Z., Wu H., Peng Q., Xie Z., Chen F., Ma Y., Zhang Y., Zhou Y., Yang J., Chen C., Li S., Zhang Y., Tian W., Wang Y., Xu Y., Luo H., Zhu M., Kuang Y.Q., Yu J., Wang K. Integration of Molecular Inflammatory Interactome Analyses Reveals Dynamics of Circulating Cytokines and Extracellular Vesicle Long Non-Coding RNAs and mRNAs in Heroin Addicts During Acute and Protracted Withdrawal. Front. Immunol. 2021; 12: 730300. DOI: 10.3389/fimmu.2021.730300
7. Levchenko A., Malov S., Antonik A., Protsvetkina A., Rybakova K.V., Kanapin A., Yakovlev A.N., Nenasteva A.Y., Nikolishin A.E., Cherkasov N., Chuprova N.A., Blagonravova A.S., Sergeeva A.V., Zhilyaeva T.V., Denisenko M.K., Gainetdinov R.R., Kibitov A.O., Krupitsky E.M. A Genome-Wide Association Study Reveals a BDNFCentered Molecular Network Associated with Alcohol Dependence and Related Clinical Measures. Biomedicines. 2022; 10(12): 3007. DOI: 10.3390/biomedicines10123007
8. Xu X., Ji H., Liu G., Wang Q., Liu H., Shen W., Li L., Xie X., Zhou W., Duan S. A significant association between BDNF promoter methylation and the risk of drug addiction. Gene. 2016; 584(1): 54–59. DOI: 10.1016/j.gene.2016.03.010
9. Bakhtazad A., Vousooghi N., Garmabi B., Zarrindast M.R. Evaluation of CART peptide level in rat plasma and CSF: Possible role as a biomarker in opioid addiction. Peptides. 2016; 84: 1–6. DOI: 10.1016/j.peptides.2016.06.010
10. Moeini M., Esmaeil N., Mokhtari H.R., Eskandari N., Banafshe H.R. Neuro-Immuno-Endocrine Interactions in Early Life Stress and Heroin Withdrawal Timeline. Eur. Addict. Res. 2020; 26(1): 28–39. DOI: 10.1159/000503880
11. Gupta R., Qaiser B., He L., Hiekkalinna T.S., Zheutlin A.B., Therman S., Ollikainen M., Ripatti S., Perola M., Salomaa V., Milani L., Cannon T.D., Madden PAF, Korhonen T., Kaprio J., Loukola A. Neuregulin signaling pathway in smoking behavior. Transl. Psychiatry. 2017; 7(8): e1212. DOI: 10.1038/tp.2017.183
12. Быков И.М., Попов К.А., Любченко Д.А., Попова М.А., Сафронова Е.Е., Сторожук А.П., Федотова Е.Е. Изменение содержания белковых маркеров поражения нервной ткани у больных с синдромом зависимости от психоактивных веществ. Медицинский вестник Северного Кавказа. 2021; 16(3): 277–280. DOI: 10.14300/mnnc.2021.16065
13. Clergue-Duval V., Vrillon A., Jeanblanc J., Questel F., Azuar J., Fouquet G., Mouton-Liger F., Rollet D., Hispard E., Bouaziz-Amar E., Bloch V., Dereux A., Cognat E., Marie-Claire C., Laplanche J.L., Bellivier F., Paquet C., Naassila M., Vorspan F. Plasma tau, NfL, GFAP and UCHL1 as candidate biomarkers of alcohol withdrawal-associated brain damage: A pilot study. Addict. Biol. 2022; 27(6): e13232. DOI: 10.1111/adb.13232
14. Zhang J., Zhang X., Su H., Tao J., Xie Y., Han B., Lu Y., Wei Y., Sun H., Wang Y., Wu W., Zou S., Liang H., Zoghbi A.W., Tang W., He J.. Increased serum brain-derived neurotrophic factor levels during opiate withdrawal. Neurosci. Lett. 2014; 571: 61–65. DOI: 10.1016/j.neulet.2014.04.048
15. Попова Н.К., Ильчибаева Т.В., Науменко В.С. Нейротрофические факторы (BDNF, GDNF) и серотонинергическая система мозга. Биохимия. 2017; 82(3): 449–459. DOI: 10.1134/S0006297917030099
16. Douma E.H., de Kloet E.R.. Stress-induced plasticity and functioning of ventral tegmental dopamine neurons. Neurosci. Biobehav. Rev. 2020; 108: 48–77. DOI: 10.1016/j.neubiorev.2019.10.015
17. Поплевченков К.Н., Агибалова Т.В., Застрожин М.С., Бузик О.Ж. Полиморфизм гена нейротрофического фактора головного мозга (BDNF) у пациентов с зависимостью от психостимуляторов. Наркология. 2021; 20(1): 32–38. DOI: 10.25557/1682-8313.2021.01.32-38
18. Liu D., Tang Q.Q., Yin C., Song Y., Liu Y., Yang J.X., Liu H., Zhang Y.M., Wu S.Y., Song Y., Juarez B., Ding H.L., Han M.H., Zhang H., Cao J.L. Brain-derived neurotrophic factor-mediated projectionspecific regulation of depressive-like and nociceptive behaviors in the mesolimbic reward circuitry. Pain. 2018; 159(1): 175. DOI: 10.1097/j.pain.0000000000001083
19. Швайковская А.А., Жанаева С.Я., Евсюкова А.В., Тихонова М.А., Даниленко К.В., Афтанас Л.И. Нейротрофический фактор мозга (BDNF) и его диагностическая значимость при измерении в крови: аналитический обзор. Якутский медицинский журнал. 2020; 3(71): 105–110. DOI: 10.25789/YMJ.2020.71.27
20. Li X., Wolf M.E. Multiple faces of BDNF in cocaine addiction. Behav. Brain. Res. 2015; 279: 240–254. DOI: 10.1016/j.bbr.2014.11.018
21. Pitts E.G., Taylor J.R., Gourley S.L. Prefrontal cortical BDNF: A regulatory key in cocaine- and food-reinforced behaviors. Neurobiol. Dis. 2016; 91: 326–335. DOI: 10.1016/j.nbd.2016.02.021
22. Ornell F., Hansen F., Schuch F.B., Pezzini Rebelatto F., Tavares A.L., Scherer J.N., Valerio A.G., Pechansky F., Paim Kessler F.H., von Diemen L. Brain-derived neurotrophic factor in substance use disorders: A systematic review and meta-analysis. Drug. Alcohol. Depend. 2018; 193: 91–103. DOI: 10.1016/j.drugalcdep.2018.08.036
23. Girard M., Carrier P., Loustaud-Ratti V., Nubukpo P. BDNF levels and liver stiffness in subjects with alcohol use disorder: Evaluation after alcohol withdrawal. Am. J. Drug. Alcohol. Abuse. 2021; 47(2): 191–198. DOI: 10.1080/00952990.2020.1833211
24. Köhler S., Klimke S., Hellweg R., Lang U.E. Serum brain-derived neurotrophic factor and nerve growth factor concentrations change after alcohol withdrawal: preliminary data of a case-control comparison. Eur. Addict. Res. 2013;19(2): 98–104. DOI: 10.1159/000342334
25. Ren W., Tao J., Wei Y., Su H., Zhang J., Xie Y., Guo J., Zhang X., Zhang H., He J. Time-Dependent Serum Brain-Derived Neurotrophic Factor Decline During Methamphetamine Withdrawal. Medicine (Baltimore). 2016; 95(5): e2604. DOI: 10.1097/MD.0000000000002604
26. Абрамец И.И., Кузнецов Ю.В., Евдокимов Д.В., Зайка Т.О. Анализ нейрофизиологических и нейрохимических механизмов субсиндромов поведенческого депрессивного синдрома. Университетская клиника. 2019; 2(31): 66–79. DOI: 10.26435/UC.V0I2(31).303
27. Uhl G.R., Koob G.F., Cable J. The neurobiology of addiction. Ann. NY Acad. Sci. 2019; 1451(1): 5–28. DOI: 10.1111/nyas.13989
28. Geoffroy H., Noble F. BDNF During Withdrawal. Vitam. Horm. 2017; 104: 475–496. DOI: 10.1016/bs.vh.2016.10.009
Об авторах
И. М. БыковРоссия
Быков Илья Михайлович — доктор медицинских наук, профессор; заведующий кафедрой фундаментальной и клинической биохимии
ул. им. Митрофана Седина, д. 4, 350063, г. Краснодар
Д. А. Любченко
Россия
Любченко Дмитрий Александрович — кандидат медицинских наук; доцент кафедры фундаментальной и клинической биохимии
ул. им. Митрофана Седина, д. 4, 350063, г. Краснодар
К. А. Попов
Россия
Попов Константин Андреевич — кандидат медицинских наук, доцент кафедры фундаментальной и клинической биохимии
ул. им. Митрофана Седина, д. 4, 350063, г. Краснодар
А. Н. Столярова
Россия
Столярова Анжела Николаевна — ассистент кафедры фундаментальной и клинической биохимии
ул. им. Митрофана Седина, д. 4, 350063, г. Краснодар
М. А. Попова
Россия
Попова Муня Андреевна — врач психиатр-нарколог диспансерно-поликлинического отделения № 1
ул. Тюляева, д. 16, г. Краснодар, 350080
О. В. Цымбалов
Россия
Цымбалов Олег Владимирович — доктор медицинских наук, профессор, профессор кафедры хирургической стоматологии и челюстно-лицевой хирургии
ул. им. Митрофана Седина, д. 4, 350063, г. Краснодар
Е. Е. Есауленко
Россия
Есауленко Елена Евгеньевна — доктор биологических наук, доцент кафедры фундаментальной и клинической биохимии
ул. им. Митрофана Седина, д. 4, 350063, г. Краснодар
Дополнительные файлы
Рецензия
Для цитирования:
Быков И.М., Любченко Д.А., Попов К.А., Столярова А.Н., Попова М.А., Цымбалов О.В., Есауленко Е.Е. Анализ содержания белковых маркеров в плазме крови больных с синдромом зависимости от наркотических веществ: наблюдательное клиническое исследование. Кубанский научный медицинский вестник. 2023;30(2):25-34. https://doi.org/10.25207/1608-6228-2023-30-2-25-34
For citation:
Bykov I.M., Lubchenko D.A., Popov K.A., Stolyarova A.N., Popova M.A., Tsymbalov O.V., Esaulenko E.E. Analysis of Protein Markers in Plasma of Patients with Drug Dependence Syndrome: Observational Clinical Study. Kuban Scientific Medical Bulletin. 2023;30(2):25-34. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-2-25-34
JATS XML








































