Перейти к:
Эффективность этиотропной терапии у пациентов с хроническим рецидивирующим течением орального кандидоза: рандомизированное контролируемое клиническое исследование
https://doi.org/10.25207/1608-6228-2023-30-4-48-60
Аннотация
Введение. Задача эффективного лечения орального кандидоза приобретает особую актуальность в связи с увеличением количества больных с рецидивирующим течением грибкового поражения полости рта вследствие роста числа штаммов Candida spp., рефрактерных к антимикотическим препаратам. В настоящем исследовании представлены результаты изучения клинической эффективности этиотропной терапии у пациентов с хроническим рецидивирующим течением орального кандидоза.
Цель исследования — определить эффективность этиотропной терапии у пациентов с хроническим рецидивирующим течением орального кандидоза.
Методы. Проведено рандомизированное контролируемое клиническое исследование у 56 больных с хроническим рецидивирующим течением орального кандидоза в возрасте от 45 до 74 лет. Обследование и лечение пациентов проводилось на кафедре стоматологии Института непрерывного медицинского и фармацевтического образования федерального государственного бюджетного образовательного учреждения высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации и в государственном автономном учреждении здравоохранения «Волгоградская областная клиническая стоматологическая поликлиника». Сроки проведения исследования: сентябрь 2020 г. — ноябрь 2022 г. Пациенты были распределены на 2 группы в зависимости от применяемого антимикотического препарата: в основной пациенты получали вориконазол, в контрольной — флуконазол. Помимо этиотропной терапии, пациентам обеих групп было назначено комплексное лечение по схеме, направленной на стимуляцию иммунологической защиты организма, восстановление витаминно-минеральной недостаточности, коррекцию дисбаланса экосистемы полости рта. Больным проводилась местная симптоматическая терапия: антисептическая обработка 0,06 % раствором хлоргексидина биглюконата, обезболивание 15 % гелем лидокаина, для стимуляции эпителизации — 3,44 % масляный раствор ретинола. В качестве устранения предикторов кандидозного стоматита пациентам рекомендовалась санация полости рта и профессиональная гигиена. С целью восстановления функции жевания больные направлялись на ортопедическое лечение. Основной опорной точкой исследования явилось установление эффективности проводимой терапии, определяемой как по клиническим критериям, так и по оценке данных бактериологического посева с целью регистрации количественного, видового и чувствительного профиля штаммов Candida spp. спустя 3 недели, 6 и 12 месяцев после окончания лечения. Анализ и статистическую обработку полученных данных проводили с использованием программы Excel к программной операционной системе MS Windows 10 (Microsoft Corp., США).
Результаты. Наиболее распространенным возбудителем хронических рецидивирующих форм орального кандидоза является C. albicans (69,6 %), затем следуют виды C. non-albicans — C. krusei (10,7 %), C. tropicalis (10,7 %) и C. glabrata (8,9 %). Анализ количественной характеристики Candida spp. по данным бакпосева показывает, что до лечения в большинстве клинических изолятов выявлено высокое и умеренное количество КОЕ Candida spp., после лечения у пациентов основной группы не было зафиксировано таких случаев. Изучение характеристики восприимчивости дрожжевых грибов к флуконазолу и итраконазолу показало наличие изолятов с дозозависимой чувствительностью, выявлена резистентность отдельных образцов C. krusei (16,7 %) и C. glabrata (60 %) к флуконазолу и итраконазолу (33,3 и 100 % соответственно). Все изоляты Candida spp. оказались высокочувствительными к вориконазолу. Эффективность комбинированной схемы лечения отдельного эпизода вориконазолом составляет 95,4 %. Продолжение терапии вориконазолом в супрессивном режиме позволяет добиться профилактики рецидивов у 98,3 % пациентов. Этиотропная терапия вориконазолом обеспечила стойкий клинический эффект (92,7 %) через год наблюдения.
Заключение. Результаты исследования подтверждают эффективность этиотропной терапии хронического орального кандидоза, осложненного рецидивирующим течением, вориконазолом, особенно при выявлении C. non-albicans или не чувствительных к флуконазолу и итраконазолу C. albicans, а также в отсутствие возможности идентификации возбудителя.
Для цитирования:
Македонова Ю.А., Гаврикова Л.М., Дьяченко С.В., Дьяченко Д.Ю. Эффективность этиотропной терапии у пациентов с хроническим рецидивирующим течением орального кандидоза: рандомизированное контролируемое клиническое исследование. Кубанский научный медицинский вестник. 2023;30(4):48-60. https://doi.org/10.25207/1608-6228-2023-30-4-48-60
For citation:
Makedonova Yu.A., Gavrikova L.M., Dyachenko S.V., Dyachenko D.Yu. Effiectiveness of Etiotropic Therapy in Patients with Chronic Recurrent Oral Candidiasis: a Randomized Controlled Clinical Trial. Kuban Scientific Medical Bulletin. 2023;30(4):48-60. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-4-48-60
ВВЕДЕНИЕ
Ранняя диагностика и эффективное лечение орального кандидоза является одной из актуальных проблем мирового здравоохранения, что объясняется высокой распространенностью грибковых инфекций. Согласно современным эпидемиологическим глобальным оценкам многие десятки миллионов человек страдают кандидозом слизистых оболочек, при этом ежегодно наблюдается прирост около 2 000 000 случаев кандидоза полости рта. В последнее время увеличилось количество больных с рецидивирующими микотическими поражениями полости рта вследствие эскалации инфекции, вызываемой мутациями коронавируса SARS-CoV-2 и пандемии COVID-19 [1–3].
Кроме того, предикторами развития рецидивов кандидозного стоматита могут выступать плохо контролируемый сахарный диабет, состояния иммунодефицита, использование антибиотиков, лечение глюкокортикоидами, заместительная гормональная терапия, генетическая предрасположенность, а также отсутствие санации зубов и низкий уровень гигиены полости рта. Возрастная группа пожилых пациентов представляет собой важный фактор риска в плане возникновения повторных эпизодов оральной кандидозной инфекции, распространенность которой у них составляет 10%. Дополнительными триггерами у пожилых пациентов являются некачественные ортопедические конструкции в полости рта, ношение полных съемных протезов [4–7].
Рецидивы кандидозного стоматита можно объяснить и неэффективностью проводимой ранее противогрибковой терапии вследствие назначения антифунгального препарата, к которому возбудитель проявляет устойчивость, что можно было бы выявить на основе результатов бакпосева с определением чувствительности грибковой флоры к антимикотикам.
Candida albicans признается основным этиологическим видом грибов рода Candida, связанным с оральным кандидозом [8][9]. Однако проблема заключается в том, что наблюдается постоянный рост числа других видов Candida, таких как C. glabrata, C. tropicalis, C. crusei, которые все чаще идентифицируются в качестве важных агентов инфекций ротовой полости человека [10–12]. Исследователи предполагают, что эти виды с большей вероятностью будут рефрактерны к противогрибковым препаратам и могут вызывать рецидивы заболевания [13][14]. Особенно клиницистов беспокоит повышение устойчивости грибов рода Candida к флуконазолу — наиболее часто используемому противогрибковому препарату для профилактики и лечения кандидозных инфекций [15][16].
Таким образом, идентификация и определение чувствительности к противогрибковым препаратам необходимы для выбора эффективной этиотропной терапии и профилактики рецидивов орального кандидоза.
Цель исследования — определить эффективность этиотропной терапии у пациентов с хроническим рецидивирующим течением орального кандидоза.
МЕТОДЫ
Дизайн исследования
Проведено рандомизированное контролируемое клиническое исследование 56 пациентов в рамках консультативного совета по заболеваниям слизистой оболочки рта на базе кафедры стоматологии Института непрерывного медицинского и фармацевтического образования федерального государственного бюджетного образовательного учреждения «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО ВолгГМУ Минздрава России) в условиях ГАУЗ «Волгоградская областная клиническая стоматологическая поликлиника».
Критерии соответствия
Критерии включения
Верификация диагнозов «В37.02 Хронический гиперпластический кандидозный стоматит» и «В37.03 Хронический эритематозный (атрофический) кандидозный стоматит» при развитии рецидивирующего течения, при этом количество рецидивов кандидозного стоматита не менее 4 в год; отсутствие эффекта от предыдущего лечения; количество Candida spp., выявленных в результате бакпосева более 10³ КОЕ/мг; возраст от 45 до 74 лет; информированное добровольное согласие на участие в исследовании.
Критерии невключения
Наличие острых инфекционных заболеваний; декомпенсированные формы хронических заболеваний; возраст менее 45 и более 74 лет; первичный эпизод орального кандидоза; острые клинические формы кандидозного стоматита; количество Candida spp. в клинических изолятах менее 10³ КОЕ/мг; общие противопоказания к назначению терапии азолами; отказ от информированного согласия.
Критерии исключения
Несоблюдение пациентом рекомендаций по профилактике и лечению, непереносимость назначаемых лекарственных средств; выявленная в ходе исследования, отказ пациента от дальнейшего участия в исследовании.
Условия проведения
Обследование и отбор пациентов проводились на базе кафедры стоматологии Института непрерывного медицинского и фармацевтического образования федерального государственного бюджетного образовательного учреждения «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО ВолгГМУ Минздрава России) и ГАУЗ «Волгоградская областная клиническая стоматологическая поликлиника».
Продолжительность исследования
Обследование, лечение и анализ полученных данных проводились в период с сентября 2020 по ноябрь 2022 г.
Медицинские вмешательства
После предварительного обследования пациенты получали дифференцированную этиотропную фунгицидную терапию, направленную на ликвидацию инфекционного агента, с применением препаратов из группы триазолов. Больные группы сравнения принимали флуконазол (антимикотик из группы триазолов I поколения) по схеме: по 150 мг 1 раз в день перорально трижды с интервалами в 72 часа, а затем в качестве поддерживающей терапии в течение 6 месяцев — 150 мг перорально 1 раз в неделю. Пациентам основной группы назначался вориконазол (триазол II поколения). Алгоритм лечения: вориконазол перорально по 200 мг 2 раза в день в течение 3 дней, затем местно 2 раза в день в виде аппликаций 1% раствора вориконазола, приготовленного ex tempore, путем разведения порошка 19 мл воды для инъекций до получения раствора, содержащего 10 мг/мл вориконазола объемом 20 мл. Супрессивная терапия — вориконазол по 200 мг 1 раз в неделю в течение 6 месяцев.
Помимо этиотропной терапии, пациентам обеих групп было назначено комплексное лечение по схеме, направленной на стимуляцию иммунологической защиты организма (сублингвальный прием смеси лизата бактерий по 1 таблетке 8 раз в сутки), восстановление витаминно-минеральной недостаточности (препараты железа в комбинации с витаминами группы В, С, РР и корнем солодки — по 1 ч. л. 3 р/д после еды), коррекцию дисбаланса экосистемы полости рта (конкурентные пробиотики по 1 капсуле 3 раза в день во время еды).
Кроме того, больным проводилась местная симптоматическая терапия: антисептическая обработка 0,06% раствором хлоргексидина биглюконата, обезболивание 15% гелем лидокаина, для стимуляции эпителизации — 3,44% масляный раствор ретинола. В качестве устранения предикторов кандидозного стоматита пациентам рекомендовалась санация полости рта и профессиональная гигиена. С целью восстановления функции жевания больные направлялись на ортопедическое лечение.
Далее состояние пациентов оценивали с учетом динамики жалоб, клинической картины и лабораторных показателей повторного бактериологического посева материала спустя 3 недели, 6 и 12 месяцев после окончания лечения и отдаленной реколонизации экосистемы.
Исходы исследования
Основной исход исследования
Критериями основного исхода исследования являлись регрессия клинических проявлений орального кандидоза, уменьшение числа Candida spp. ниже порогового уровня 10³ КОЕ до их полного исчезновения.
Дополнительные исходы исследования
Исследованием не предусмотрены.
Методы регистрации исходов
Верификация диагнозов «В37.02 Хронический гиперпластический кандидозный стоматит» и «В37.03 Хронический эритематозный (атрофический) кандидозный стоматит» осуществлялась по совокупности клинических и лабораторных критериев.
Клинические методы — обследование пациентов включало выяснение жалоб, сбор анамнеза для выявления факторов риска, особенностей течения и частоты развития рецидивов орального кандидоза. Регистрацию клинико-дифференциального типа изменений слизистой оболочки рта проводили с учетом цвета, влажности, локализации, формы и размеров элементов поражения. В клиническую часть исследования входила оценка состояния зубов с помощью индекса КПУ, определение уровня гигиены полости рта с помощью индекса Грина — Вермильона (OHI-S), выявление наличия и качества ортопедических конструкций. Кроме того, все пациенты проходили комплексное обследование у смежных специалистов с целью выявления триггерных факторов развития повторных эпизодов орального кандидоза.
Лабораторная диагностика орального кандидоза проводилась с целью идентификации возбудителя путем анализа данных бактериологического посева на питательную среду Сабуро (Sabouraudagar) материала, удаленного с патологических участков слизистой оболочки рта с учетом количества грибов Candida, выраженного в колониеобразующих единицах (КОЕ/мг). Для микробиологической верификации кандидоза использовали следующую градацию количественной грибковой характеристики (КОЕ/мг): минимальное количество — 10² и ниже (не является достаточным основанием для постановки диагноза), пороговое — 10³ (является численным диагностическим индикатором кандидозного поражения), умеренное — более 10⁴, высокое — выше 10⁵. Было протестировано 224 клинических изолята штаммов Candida spp. (56 — первоначально с целью идентификации возбудителя и 168 — для контроля лечения и выявления рецидивов в течение года). Определение чувствительности выявленных видов Candida проводили к флуконазолу, итраконазолу, вориконазолу.
Рандомизация
Рандомизация методом «генерации случайных чисел» 56 пациентов с хроническим рецидивирующим течением орального кандидоза осуществлялась в 2 группы с сопоставимыми половозрастными характеристиками и клиническими формами кандидоза слизистой оболочки рта: основную (n = 28) и группу сравнения (n = 28). Критерием разделения пациентов на группы служили различные схемы этиотропной терапии.
Обеспечение анонимности данных
Сокрытие данных рандомизации было проведено методом присвоения уникального номера, сгенерированного случайным порядком каждому пациенту до начала лечения, и распределение их по группам автоматической компьютерной системой при участии всех авторов. Привлечение сторонних специалистов к проведению исследования и анализа результатов не требовалось и не осуществлялось.
Статистический анализ
Принципы расчета статистической выборки
Предварительный расчет выборки не проводился.
Методы статистического анализа данных
Использовали метод вариационной статистики с определением средней величины (М), среднего квадратичного отклонения (σ), ошибки репрезентативности (m), оценки достоверности различий по группам с помощью критерия Стьюдента (t); различие между сравниваемыми показателями считалось достоверным при p < 0,05. Данные обрабатывали в программе Microsoft Excel к программной операционной системе MS Windows 10 (Microsoft Corp., США) в соответствии с общепринятыми методами медицинской статистики.
РЕЗУЛЬТАТЫ
Формирование выборки исследования
Формирование выборки исследования проведено согласно критериям включения и невключения в рандомизированное контролируемое клиническое исследование, медицинских карт пациентов с хроническим рецидивирующим оральным кандидозом. Распределение больных по группам следующее: основная (n = 28) и группа сравнения (n = 28).
Блок-схема дизайна исследования представлена на рисунке 1.
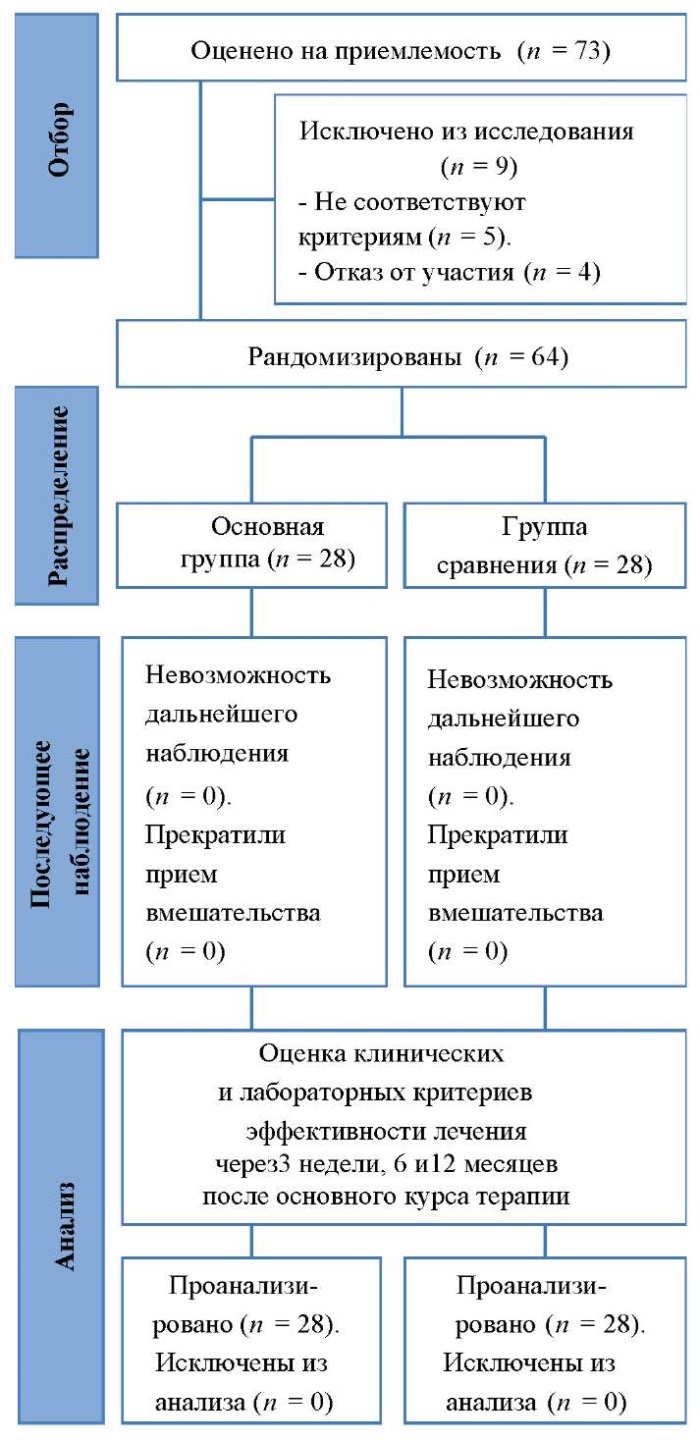
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами
(согласно рекомендациям CONSORT).
Fig. 1. Schematic diagram of the research design
Note: performed by the authors
(according to CONSORT recommendations).
Характеристика групп исследования
Основная группа и группа сравнения характеризовались сопоставимостью по половозрастным критериям и клиническим формам кандидоза слизистой оболочки рта (табл. 1).
Таблица 1. Характеристика групп исследования
Table 1. Characteristics of study groups
|
Критерии |
Группы пациентов |
р |
||
|
Основная группа n = 28 |
Группа сравнения n = 28 |
|||
|
Пол |
Мужской, n (%) |
10 (35,7) |
10 (35,7) |
р1 = 0,0438 р2 = 0,0497 р3 = 0,0358 |
|
Женский, n (%) |
18 (64,3) |
18 (64,3) |
||
|
Возраст, лет |
45–59, n (%) |
11 (39,3) |
11 (39,3) |
р1 = 0,0393 р2 = 0,0497 р3 = 0,0312 |
|
60–74, n (%) |
17 (60,7) |
17 (60,7) |
||
|
Диагноз |
ХЭ(А)КС, n (%) |
9 (32,2) |
9 (32,2) |
р1 = 0, 938 р2 = 0,0417 р3 = 0,0389 |
|
ХГКС, n (%) |
19 (67,8) |
19 (67,8) |
||
Примечания: таблица составлена авторами;
р1 — различия между основной группой и группой сравнения;
р2 — различия внутри основной группы;
р3 — различия внутри группы сравнения.
Сокращения: ХГКС — хронический гиперпластический кандидозный стоматит;
ХЭ(А)КС — хронический эритематозный (атрофический) кандидозный стоматит.
Notes: compiled by the authors;
р1 — differences between the main group and the comparison group;
р2 — differences within the main group;
р3 — differences within the comparison group.
Abbreviations: ХГКС — chronic hyperplastic candidiasis;
ХЭ(А)КС — chronic erythematous (atrophic) candidiasis.
Основные результаты исследования
В ходе исследования было выявлено, что всех пациентов беспокоило чувство жжения в полости рта, особенно в языке, резко усиливающееся при приеме пищи, у 21,2 ± 0,8% больных — жжение усугублялось даже при разговоре. Кроме того, больные жаловались на постоянную сухость во рту, появление которой они четко связывали с рецидивом грибкового стоматита. Пациенты обеих групп отмечали неприятный запах изо рта, наличие налета на языке, появление трещин в углах губ, что вызывало у них трудности при приеме пищи и общении.
Все больные находились в постоянном стрессе из-за того, что назначаемое ранее лечение не приводило к выздоровлению, они испытывали тревогу и эмоциональный дискомфорт. Типичными жалобами были апатия, повышенная утомляемость, хроническая усталость. У части больных (32,3 ± 2,2%) была выражена канцерофобия, особенно в случаях частых рецидивов микотических поражений слизистой полости рта.
При сборе анамнеза выяснилось, что у большинства больных (88,2 ± 3,2%) количество рецидивов орального кандидоза определялось как минимум 4 в год, остальные сообщили о перманентном течении. Эпизоды кандидозного стоматита у 14,2% пациентов были вызваны приемом антибиотиков, у 39,3% — местными или системными кортикостероидами, у 17,8% — средствами, подавляющими иммунитет — иммунодепрессантами, цитостатиками, у 16,1% — препаратами заместительной гормональной терапии. В анамнезе 3 пациентов предрасполагающий лекарственный фактор не был идентифицирован. Все пациенты сообщили о неэффективности проводимой ранее терапии, у 15 пациентов (26,7%) было достигнуто незначительное, но кратковременное улучшение, остальные отметили отсутствие лечебного эффекта.
По результатам консультативных заключений смежных специалистов у всех пациентов была подтверждена сопутствующая соматическая патология, как правило, сочетанная: хронические заболевания желудочно-кишечного тракта отмечались у 86,5 ± 3,2% больных, сахарный диабет II типа — у 41,2 ± 2,1% обследуемых, онкологическая патология — у 8 человек, железодефицитные состояния — у 7 пациентов, нарушениями гормонального фона страдали 9 человек.
Все наблюдаемые пациенты имели неблагоприятный стоматологический статус. Неудовлетворительная гигиена полости рта наблюдалась у всех больных (OHI-S — 3,82 ± 0,13). Интенсивность кариеса — КПУ -11,6 ± 0, 6.
При осмотре полости рта у 33 пациентов с хроническим гиперпластическим кандидозным стоматитом выявлялся обильный желто-коричневый налет на языке, настолько плотно прикрепленный к слизистой оболочке, что удалить механически его было невозможно. Поверхность языка сухая и грубая, болезненная при прикосновении к зубам и при пальпации (рис. 2).
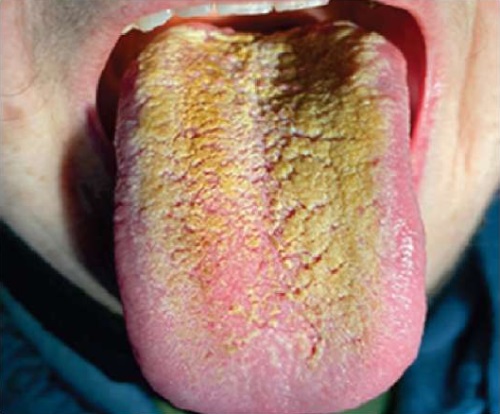
Рис. 2. Пациент М., 52 года.
Хронический гиперпластический кандидозный стоматит.
Плотный налет на языке окрашен в коричневый цвет
в результате многолетнего курения
Примечание: фотография выполнена авторами.
Fig. 2. Patient M., male, 52 years old.
Chronic hyperplastic candidiasis.
The dense plaque on the tongue colored brown
as a result of years of smoking
Note: photo taken by the authors.
У 5 пациентов с хроническим гиперпластическим кандидозным стоматитом грибковый процесс принял осложненный характер — плотный грубый налет выступал над поверхностью языка в виде грубых желтоватых бляшек, окруженных серо-белыми плотными пленками, прочно соединенными между собой и со слизистой оболочкой языка. При малейшем травмировании образовывались длительно не заживающие болезненные эрозии, что приводило к развитию рецидивирующего течения процесса. Патологические очаги на языке имеют внешнее сходство с лейкоплакией, поэтому такие изменения относятся к псевдолейкоплакическим проявлениям орального кандидоза (рис. 3).
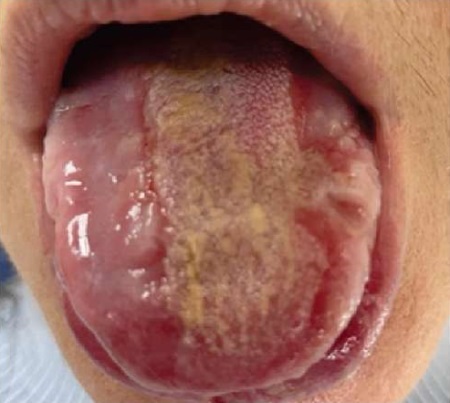
Рис. 3. Пациентка Н., 63 года.
Осложненная псевдолейкоплакическая форма
хронического гиперпластического кандидозного стоматита
Примечание: фотография выполнена авторами.
Fig. 3. Patient N., female, 63 years old.
Complicated pseudoleukoplakic form of chronic hyperplastic candidiasis
Note: photo taken by the authors
При осмотре 11 больных с хроническим атрофическим кандидозным стоматитом, имеющих съемные протезы в полости рта, отмечались отечность и гиперемия слизистой оболочки неба с четкими границами протезного ложа — протезный стоматит (рис. 4).
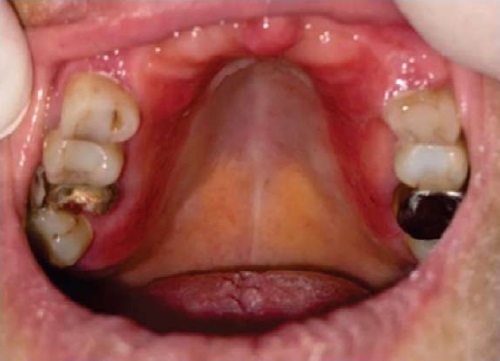
Рис. 4. Пациентка О., 70 лет. Протезный стоматит
Примечание: фотография выполнена авторами.
Fig. 4. Patient O., female, 70 years old. Prosthetic stomatitis
Note: photo taken by the authors.
При осмотре у 7 пациентов с хроническим атрофическим кандидозным стоматитом были выявлены грибковые поражения языка в виде сплошной атрофии лингвального эпителия с характерным видом — «лакированный» язык. Спинка языка сухая, резко гиперемированная, болезненная при любом прикосновении (рис. 5).
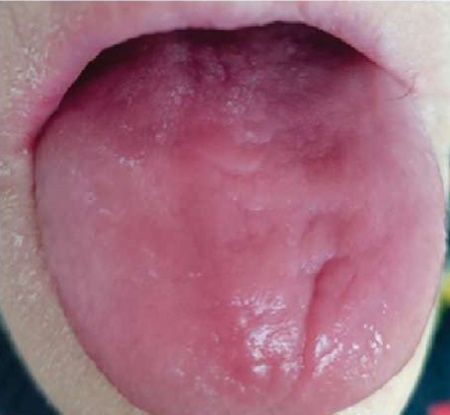
Рис. 5. Пациентка В., 73 года.
Лакированный язык при хроническом атрофическом кандидозном глоссите
Примечание: фотография выполнена авторами.
Fig. 5. Patient B., female, 73 years old.
Smooth tongue in chronic atrophic candidal glossitis
Note: photo taken by the authors.
Значимой задачей, решаемой с помощью лабораторной диагностики, является идентификация возбудителя грибкового поражения полости рта. Результаты исследования бактериологического посева на питательные среды материала, забранного с патологических участков слизистой оболочки рта с целью идентификации возбудителя, представлены на рисунке 6.
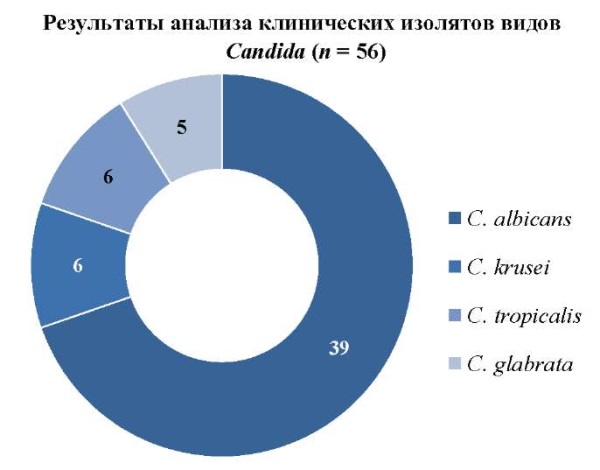
Рис. 6. Результаты видового распределения Candida spp
Примечание: рисунок выполнен авторами.
Fig. 6. Candidaspp. species distribution
Note: performed by the authors.
Результаты тестирования клинических изолятов Candida spp. показали, что наиболее распространенным возбудителем хронических рецидивирующих форм орального кандидоза является C. albicans (69,6%), затем следуют виды C. non-albicans — C. krusei (10,7%), C. tropicalis (10,7%) и C. glabrata (8,9%).
Одним из критериев выбора эффективного препарата для этиотропной терапии является определение чувствительности различных штаммов Candida spp. к антимикотикам. Паттерн восприимчивости Candida spp. определяется в следующих границах: высокая чувствительность, дозозависимая чувствительность, резистентность. Профиль чувствительности Candida spp. к флуконазолу, итраконазолу и вориконазолу представлен в таблице 2.
Таблица 2. Профиль чувствительности Candida spp. к противогрибковым препаратам
Table 2. Candida spp. susceptibility to antifungal drugs
|
Возбудитель |
Антимикотики |
Паттерн восприимчивости |
||
|
S |
SDD |
R |
||
|
C. albicans (n = 39) |
Флуконазол |
34 (87,2%) |
5 (12,8%) |
- |
|
Итраконазол |
32 (82,1%) |
7 (17,9%) |
- |
|
|
Вориконазол |
39 (100%) |
- |
- |
|
|
C. krusei (n = 6) |
Флуконазол |
- |
5 (83,3%) |
1(16,7%) |
|
Итраконазол |
- |
4 (66,7%) |
2 (33,3%) |
|
|
Вориконазол |
6 (100%) |
- |
- |
|
|
C. tropicalis (n = 6) |
Флуконазол |
4 (66,7%) |
2 (33,3%) |
- |
|
Итраконазол |
3 (50%) |
1(16,7%) |
2 (33,3%) |
|
|
Вориконазол |
6 (100%) |
- |
- |
|
|
C. glabrata (n = 5) |
Флуконазол |
- |
2 (40%) |
3 (60%) |
|
Итраконазол |
- |
- |
5 (100%) |
|
|
Вориконазол |
5 (100%) |
- |
- |
|
Примечание: таблица составлена авторами.
Сокращения: R — резистентность; S — высокая чувствительность;
SDD — чувствительность дозозависимая.
Note: compiled by the authors.
Abbreviations: R — resistance; S — high susceptibility;
SDD — dose-dependent susceptibility.
Исследование изолятов C. albicans на чувствительность к антифунгальным препаратам не выявило случаев полной резистентности. Однако, несмотря на преобладающее число образцов с высокой чувствительностью к флуконазолу (87,2%), встречаются изоляты с дозозависимой чувствительностью (12,8%). Восприимчивость к итраконазолу у изолятов C. albicans снижается до 82,1% против увеличения количества образцов с дозозависимой чувствительностью до 17,9%.
Изучение изолятов C. krusei показало только дозозависимую восприимчивость к флуконазолу и итраконазолу (83,3 и 66,7% соответственно) при полном отсутствии высокой чувствительности к данным антимикотикам. Выявлена резистентность отдельных образцов C. krusei к флуконазолу и итраконазолу.
Клинические изоляты C. tropicalis проявляют рефрактерность к итраконазолу, сопоставимую с таковой у C. krusei, в 33,3% случаев. Необходимо учитывать, что треть образцов C. tropicalis показали дозозависимую восприимчивость к флуконазолу.
Все пять изолятов C. glabrata были устойчивы к итраконазолу, среди которых три изолята также были полностью резистентны к флуконазолу, а 40% — проявляли чувствительность в зависимости от дозы антимикотика.
Изучение характеристики восприимчивости дрожжевых грибов к флуконазолу и итраконазолу показало, в принципе, схожие результаты, но с меньшей эффективностью итраконазола. Поэтому в алгоритм этиотропной терапии итраконазол не включался, учитывая более высокие показатели восприимчивости грибов к флуконазолу. В то же время анализ профиля чувствительности Candida spp. к противогрибковым препаратам показывает, что все изоляты Candida оказались высокочувствительными к вориконазолу. Таким образом, вориконазол может служить эффективной альтернативой для лечения осложненного рецидивирующего кандидоза полости рта.
Оценка эффективности лечения осуществлялась на основании следующих критериев: регрессия клинических проявлений заболевания, уменьшение числа Candida spp. ниже порогового уровня 10³ КОЕ до их полного исчезновения. Регрессия клинических признаков орального кандидоза у пациентов основной группы и группы сравнения в динамике после лечения представлена в таблице 3.
Таблица 3. Регрессия клинических признаков орального кандидоза
у пациентов в динамике после лечения (M ± m)
Table 3. Regression of clinical signs of oral candidiasis
in patients in dynamics after treatment (M ± m)
|
Группы пациентов |
Регрессия клинических признаков после лечения, % |
||
|
Через 21 день |
Через 6 месяцев |
Через 12 месяцев |
|
|
Основная группа |
95,4 ± 3,1* |
98,3 ± 1,2* |
92,7 ± 3,3* |
|
Группа сравнения |
71,3 ± 2,1 |
80,8 ± 2,2 |
53,0 ±,12,2 |
Примечания: таблица составлена авторами;
* p < 0,05 по сравнению с группой сравнения.
Notes: compiled by the authors;
*p < 0.05 vs. comparison group.
Как видно из таблицы 3, в краткосрочной перспективе (через 3 недели) после проведенного лечения наблюдалась регрессия клинических признаков заболевания в основной группе в 95,4 ± 3,1% случаев, в группе сравнения — 71,3 ± 2,1% пациентов. По окончании курса супрессивной терапии, которая рекомендовалась в течение 6 месяцев, в основной группе было зарегистрировано отсутствие эпизодов орального кандидоза в 98,3 ± 1,2% случаев. В группе сравнения во время полугодовой поддерживающей терапии флуконазолом удавалось контролировать количественный и культуральный состав Candida spp. в 80,8 ± 2,2% наблюдений.
Через год ремиссия кандидозного стоматита продолжалась у 92,7 ± 3,3% пациентов основной группы, что объясняется паттерном полной восприимчивости различных штаммов Candida spp. к вориконазолу. Напротив, число пациентов с отсутствием рецидивов орального кандидоза снизилось в группе сравнения практически наполовину, что можно объяснить отсутствием противогрибкового эффекта флуконазола в отношении резистентных и дозозависимых к нему штаммов Candida spp.
Таким образом, этиотропная терапия вориконазолом обеспечила стойкий клинический эффект без рецидивов в течение года наблюдения. Эффективность лечения отдельного эпизода составляет 95,4%. Продолжение терапии в супрессивном режиме позволяет добиться профилактики рецидивов у 98,3% пациентов, что статистически значимо выше по сравнению с лечением флуконазолом.
Клиническую результативность этиотропной терапии подтверждают лабораторные данные количественного профиля Candida spp. при бактериологическом исследовании материала до и после лечения (табл. 4).
Таблица 4. Количественный профиль Candida spp..
до и после лечения в динамике (M ± m)
Table 4. Quantitative profile of Candida spp..
before and after treatment in dynamics (M ± m)
|
Число Candida spp., КОЕ |
До лечения, % |
После лечения, % |
|||||
|
Группа сравнения |
Основная группа |
||||||
|
21 день |
6 мес. |
12 мес. |
21 день |
6 мес. |
12 мес. |
||
|
Отсутствие грибов |
- |
30,8 ± 0,8 р = 0,02* |
40,6 ± 1,2 р = 0,02* р2 = 0,025* |
27,6 ± 1,1 р = 0,02* р2 = 0,928 р3 = 0,021* |
49,2 ± 1,7 р = 0,02* р1= 0,001 |
88,3 ± 2,6 р = 0,021* р1 = 0,03* р2 = 0,033* |
84,1 ± 2,2 р = 0,025* р1 = 0,02 р2= 0,03 р3 = 0,948 |
|
Минимальное ≤10² |
- |
32,3 ± 0,7 р = 0,011* |
30,2 ± 1,1 р= 0,034* р2 = 0,039 |
40,1 ± 1,3 р = 0,02* р2 = 0,021* р3 = 0,041* |
46,2 ± 1,4 р= 0,011* р1= 0,017* |
11,7 ± 0,3 р = 0,001* р1 = 0,001* р2 = 0,001* |
13,4 ± 0,3 р = 0,001* р1= 0,021 р1= 0,022 р3 = 0,038 |
|
Пороговое -10³ |
14,2± 0,6 |
13,5 ± 0,6 р = 0,0314 |
17,2 ± 0,8 р = 0,028 р2 = 0,034 |
19,8 ± 0,6 р = 0,036 р2 = 0,036 р3 = 0,039 |
4,6 ± 0,8 р = 0,021* р1= 0,031 |
4,2 ± 0,3 р= 0,031* р1= 0,021* р2 = 0,038 |
3,5 ± 0,4 р = 0,022* р1= 0,032 р2 = 0,042 р3 = 0,046 |
|
Умеренное ≥10⁴ |
37,5 ± 2,5 |
9,2 ± 0,6 р = 0,024* |
8,4 ± 0,4 р = 0,027* р2 = 0,033 |
15,6 ± 1,4 р = 0,01* р2 = 0,031* р3= 0,02 |
0 |
0 |
0 |
|
Высокое ≥10⁵ |
48,3 ± 2,6 |
0 |
0 |
3,5±0,4 р < 0,001* р2< 0,01* р3< 0,01* |
0 |
0 |
0 |
Примечания: таблица составлена авторами;
p — достоверность результатов по отношению к данным до лечения;
p1 — достоверность результатов по отношению к данным группы сравнения;
p2 — достоверность результатов по отношению к данным
через 21 день после лечения;
p3 — достоверность результатов по отношению к данным
через 6 месяцев после лечения;
* — статистически значимые различия при p < 0,05.
Notes: compiled by the authors;
p — reliability of the results in relation to the data before treatment;
p1 — reliability of the results in relation to the data of the comparison group;
p2 — reliability of the results in relation to the data in 21 days after treatment;
p3 — reliability of the results in relation to the data in 6 months after treatment;
* — statistically significant differences at p<0.05.
Анализ количественной характеристики Candida spp. по данным бакпосева показывает, что в большинстве клинических изолятов (85,8%) до лечения выявлено высокое и умеренное количество Candida spp. (КОЕ/мг), что подтверждает осложненное течение орального кандидоза в виде перманентного развития рецидивов кандидозного стоматита.
Лабораторные данные демонстрируют статистически значимое преобладание количества пациентов с отсутствием (49,2 ± 1,7) и минимальным (46,2 ± 1,4%) содержанием грибов в клинических изолятах основной группы через 3 недели после окончания основного курса лечения по сравнению с показателями больных группы сравнения (30,8 ± 0,8 и 32,3 ± 0,7% соответственно). В течение периода наблюдения у пациентов основной группы не было зафиксировано случаев с умеренным (>10⁴) и высоким (>10⁵) содержанием КОЕ Candida spp., что свидетельствует об эффективности лечения. Напротив, в 2,1 раза увеличилось число пациентов основной группы с отсутствием грибов в клинических изолятах по окончании поддерживающей терапии, в то время как в группе сравнения этот показатель вырос всего на 10%. Разница же между отсутствием Candida spp. и их минимальным содержанием в клинических изолятах больных основной группы по отношению к группе сравнения через 12 месяцев после окончания лечения была еще выше и составила 3,1. Такая дифференцировка показателей подтверждает актуальность критерия выбора высокочувствительного антимикотического препарата для достижения длительного периода ремиссии заболевания.
Дополнительные результаты исследования
Дополнительные результаты исследования в ходе исследования не получены.
Нежелательные явления
В ходе исследования не было зафиксировано нежелательных явлений.
ОБСУЖДЕНИЕ
Ограничения исследования
Небольшой объем выборки исследования не может способствовать переносу полученных результатов на генеральную совокупность.
Экстраполяция
Результаты испытания могут быть применены в практической стоматологии, при наблюдении и лечении пациентов с оральным кандидозом, после проведения дифференциально-диагностических исследований. Кроме того, результаты настоящего исследования могут быть использованы при наблюдении пациентов с заболеваниями слизистой оболочки рта с позиции профилактической направленности.
Резюме основного результата исследования
Результаты исследования подтверждают эффективность применения вориконазола в качестве препарата для этиотропной терапии у пациентов с хроническим рецидивирующим течением орального кандидоза.
Обсуждение основного результата исследования
В настоящее время растет число пациентов с хроническими рецидивирующими формами орального кандидоза, одной из причин является неэффективность назначаемой терапии в результате использования лекарственного средства, к которому возбудители невосприимчивы. Учитывая этот факт, лабораторная диагностика грибковых изолятов, позволяющая определить видовую принадлежность грибов, их количество и чувствительность к антимикотическим средствам, приобретает первостепенное значение.
Несмотря на широкую видовую распространенность Candida spp., с кандидозом полости рта чаще всего связывают C. albicans и некоторые виды C. non-albicans: C. glabrata, C. tropicalis, C. krusei [17][18], идентификация которых активизировалась последними исследованиями грибковых поражений ротовой полости человека во время пандемии COVID-19 [19][20].
Для возбудителей орального кандидоза переход от безвредного комменсала к патогену зависит от различной экспрессии факторов вирулентности грибов [21]. Поскольку пусковым механизмом развития орального кандидоза является инвазия грибов в поверхностный слой эпителия полости рта, то огромное значение имеет адгезивная способность различных штаммов к клеткам эпителия полости рта. По данным литературы, максимальную способность адгезии к клеткам эпителия полости рта проявляют C. Tropicalis (63,7%) и C. glabrata (60,2%) [22]. Кроме того, виды C. non-albicans обладают высокой скоростью формирования биопленки, которая снижает иммунную защиту полости рта и является резервуаром инфекционных и сенсибилизирующих агентов. Матрикс биопленки служит барьером для проникновения антимикотического препарата в грибковую клетку [23], обеспечивая рефрактерность к терапии, приводящую к неполной эрадикации возбудителя. В связи с этим наблюдается хронизация и рецидивирование грибкового процесса, причиной которых служит тот же штамм [24].
Поэтому, несмотря на меньшую частоту идентификации видов C. non-albicans по сравнению с C. albicans, клиницисту надо понимать, что они обладают максимальной экспрессией вирулентных факторов и именно они в большей степени отвечают за развитие рецидивов кандидозного стоматита. Принимая во внимание этот факт, при ведении пациентов с хроническим осложненным течением орального кандидоза актуальной является задача профилактики развития рецидивов кандидозного стоматита, решить которую возможно с помощью эффективной этиотропной терапии. Проблема выбора антимикотического препарата базируется на двух постулатах: взаимодействие лекарственного средства с грибковой клеткой, выступающей в качестве мишени, и отсутствие природной или приобретенной резистентности штаммов Candida spp. к назначенному препарату.
Среди множества лекарственных средств, применяемых при лечении кандидоза полости рта, чаще всего применяются триазолы I поколения (флуконазол и итраконазол), к которым всегда были высокочувствительны C. albicans, играющие ведущую роль в этиологии кандидозного стоматита. Выбор флуконазола в качестве агента для этиотропной терапии у пациентов контрольной группы объясняется тем, что он обладает высокой активностью против С. albicans, хорошо переносится, безопасен при системном применении, проникает в ротовую жидкость и находится в ней в концентрации, сопоставимой с таковой в плазме крови.
Однако в последние годы наблюдается тенденция к росту рефрактерности к азолам возбудителей, которые ранее были к ним чувствительны, что можно объяснить мутациями отдельных штаммов Candida spp. в результате предыдущего лечения. Чаще всего это происходит на фоне эмпирического применения противогрибковых препаратов вследствие нарушения их дозировки и сроков терапии. В докладе ВОЗ (2014), рассматривающем вопросы резистентности микроорганизмов на глобальном уровне, отмечены случаи резистентности Candida spp. (включая С. non-albicans) к флуконазолу, зафиксированные во всем мире [25].
Поэтому в плане дифференцированного выбора противогрибкового средства все больше внимания специалистов привлекают триазолы II поколения, например вориконазол. Рецидивы орального кандидоза служат основанием к изменению алгоритма этиотропной терапии, что нашло отражение при ведении пациентов основной группы, где препаратом первой линии выступает вориконазол. Вориконазол проявляет противогрибковую активность широкого спектра действия против дрожжевых грибов, включая штаммы Candida spp. (С. albicans, резистентные к флуконазолу и итраконазолу), С. glabrata и С. krusei,C. tropicalis, которые обычно не реагируют на терапию азольными лекарственными средствами или показывают перекрестную резистентность.
Системное применение антимикотических препаратов было выбрано, учитывая неэффективность ранее проводимой местной терапии и частое рецидивирование кандидозного стоматита, что оценивалось нами как дополнительный фактор риска развития осложнений.
Проблема ведения пациентов с хроническим кандидозным стоматитом, осложненным частыми рецидивами, заключается в том, что врачи-стоматологи назначают этиотропную терапию согласно алгоритму лечения неосложненного кандидозного стоматита, вызванного C. albicans, не учитывая клинических и микробиологических особенностей верификации рецидивирующего течения. Но поскольку это рецидивы, не имеет смысла применять схемы лечения, назначаемые при остром течении или первичном эпизоде орального кандидоза. Если назначается флуконазол, то необходимо повышать его суточную дозу или применять так называемую пульс-терапию для преодоления развивающейся рефрактерности и создания насыщающей дозы, особенно это актуально при дозозависимой чувствительности штаммов Candida spp.
Хронический кандидозный стоматит, осложненный рецидивирующим течением, вызванным C. non-albicans, которые являются более устойчивыми к флуконазолу, требует применения альтернативных противогрибковых препаратов. Если назначается вориконазол, то необходимо краткосрочное системное применение, а дальше воздействие на возбудителей кандидозного стоматита осуществляется на этапе супрессивной терапии в виде местного применения 1% вориконазола. Такая схема лечения позволяет избежать побочных эффектов при системном приеме вориконазола и в то же время воздействовать на штаммы Candida spp., не обладающие восприимчивостью к флуконазолу.
Таким образом, алгоритм лечения больных с хроническим рецидивирующим кандидозом полости рта должен включать несколько этапов: прежде всего купирование рецидива, направленное на достижение клинического выздоровления, подтверждаемого положительным микробиологическим результатом, а затем поддерживающая терапия в течение 6 месяцев с использованием антимикотиков и антисептиков в форме полосканий или аппликаций.
Кроме курсов этиотропного лечения рекомендуется проводить профилактические мероприятия с целью повышения иммунитета, регуляции микробиоценоза кишечника, коррекции метаболических процессов в организме, санации полости рта и рационального протезирования. После успешного лечения пациента с хроническим кандидозным стоматитом осуществляется динамическое наблюдение.
ЗАКЛЮЧЕНИЕ
За последнее десятилетие динамика эпидемиологии орального кандидоза претерпела значительные изменения в результате естественного отбора менее чувствительных штаммов на фоне увеличения использования антибиотиков широкого спектра действия и эмпирического применения противогрибковых препаратов [9][13]. Следовательно, выбор тактики ведения пациентов с рецидивирующим течением орального кандидоза должен быть дифференцированным с учетом количества, видового распределения дрожжевых грибов и характеристики противогрибковой чувствительности Candida spp.
При выявлении C. non-albicans или не чувствительных к флуконазолу и итраконазолу C. albicans, а также в отсутствие возможности идентификации возбудителя при выборе противогрибковых средств для лечения хронического орального кандидоза, осложненного рецидивирующим течением, следует отдавать предпочтение триазолу II поколения — вориконазолу. Вид и сроки лечения определяются с учетом персонализированного подхода и зависят от таких факторов, как тяжесть грибкового процесса, количество рецидивов, наличие кандидозного поражения различных локализаций и индивидуальных особенностей пациента (иммунный статус, соматическая патология, прием кортикостероидов, возраст).
Список литературы
1. Македонова Ю.А., Поройский С.В., Гаврикова Л.М., Афанасьева О.Ю. Проявление заболеваний слизистой полости рта у больных, перенесших COVID-19. Вестник Волгоградского государственного медицинского университета. 2021;1(77):110–115. https://doi.org/10.19163/1994-9480-2021-1(77)-110-115
2. Сатыго Е.А., Бакулин И.Г. Клинические и микробиологические признаки кандидоза полости рта у пациентов с COVID-19, получающих различную патогенетическую терапию и имеющих разный уровень гигиены полости рта. Пародонтология. 2021;26(1):4–8. https://doi.org/10.33925/1683-3759-2021-26-1-4-8
3. Katz J. Prevalence of candidiasis and oral candidiasis in COVID-19 patients: a cross-sectional pilot study from the patients’ registry in a large health center. Quintessence. Int. 2021;52(8):714–718. https://doi.org/10.3290/j.qi.b1491959
4. Линченко И.В. Оптимизация лечения пациентов с грибковым стоматитом под базисом съемного пластиночного протеза при полном отсутствии зубов. Международный научно-исследовательский журнал. 2020;6-2(96):122–124. https://doi.org/10.23670/IRJ.2020.96.6.062
5. Černáková L, Líšková A, Lengyelová L, Rodrigues CF. Prevalence and Antifungal Susceptibility Profile of Oral Candida spp. Isolates from a Hospital in Slovakia. Medicina (Kaunas). 2022;58(5):576. https://doi.org/10.3390/medicina58050576
6. Bongomin F, Gago S, Oladele RO, Denning DW. Global and Multi-National Prevalence of Fungal Diseases-Estimate Precision. J. Fungi. (Basel). 2017;3(4):57. https://doi.org/10.3390/jof3040057
7. Pisano M, Romano A, Di Palo MP, Baroni A, Serpico R, Contaldo M. Oral Candidiasis in Adult and Pediatric Patients with COVID-19. Biomedicines. 2023;11(3):846. https://doi.org/10.3390/biomedicines11030846
8. Salehi B, Kregiel D, Mahady G, Sharifi-Rad J, Martins N, Rodrigues CF. Management of Streptococcus mutans-Candida spp. Oral Biofilms’ Infections: Paving the Way for Effective Clinical Interventions. J. Clin. Med. 2020;9(2):517. https://doi.org/10.3390/jcm9020517
9. Rodrigues CF, Rodrigues ME, Henriques M. Candida sp. Infections in Patients with Diabetes Mellitus. J. Clin. Med. 2019;8(1):76. https://doi.org/10.3390/jcm8010076
10. Moorhouse AJ, Moreno-Lopez R, Gow NAR, Hijazi K. Clonal evolution of Candida albicans, Candida glabrata and Candida dubliniensis at oral niche level in health and disease.J. Oral. Microbiol. 2021;13(1):1894047. https://doi.org/10.1080/20002297.2021.1894047
11. Xiao JL, Xu GC, de Hoog S, Qiao JJ, Fang H, Li YL. Oral Prevalence of Candida Species in Patients Undergoing Systemic Glucocorticoid Therapy and the Antifungal Sensitivity of the Isolates. Infect. Drug. Resist. 2020;13:2601–2607. https://doi.org/10.2147/IDR.S262311
12. de la Rosa-García E, Olalde-Hernández MJ, Irigoyen-Camacho ME, Mondragón-Padilla A, Mendoza-Juache A, Sánchez-Vargas LO. Antifungal susceptibility of oral isolates of Candida species from chronic kidney disease patients on chronic dialysis. J. Mycol. Med. 2020;30(3):101009. https://doi.org/10.1016/j.mycmed.2020.101009
13. Panariello BHD, de Araújo Costa CAG, Pavarina AC, Santiago SL, Duarte S. Advances and Challenges in Oral Biofilm Control. Curr.Oral Health. Rep. 2017;4(1):29–33. https://doi.org/10.1007/s40496-017-0120-8
14. Rodrigues CF, Gonçalves B, Rodrigues ME, Silva S, Azeredo J, Henriques M. The Effectiveness of Voriconazole in Therapy of Candida glabrata’s Biofilms Oral Infections and Its Influence on the Matrix Composition and Gene Expression. Mycopathologia. 2017;182(7–8):653–664. https://doi.org/10.1007/s11046-017-0135-7
15. Aitken-Saavedra J, Lund RG, González J, Huenchunao R, Perez-Vallespir I, Morales-Bozo I, Urzúa B, Tarquinio SC, Maturana-Ramírez A, Martos J, Fernandez-Ramires R, Molina-Berríos A. Diversity, frequency and antifungal resistance of Candida species in patients with type 2 diabetes mellitus. Acta.Odontol. Scand. 2018;76(8):580–586. https://doi.org/10.1080/00016357.2018.1484154
16. Rodrigues CF, Rodrigues ME, Henriques M. Candida sp. Infections in Patients with Diabetes Mellitus. J. Clin. Med. 2019;8(1):76. https://doi.org/10.3390/jcm8010076. PMID: 30634716; PMCID: PMC6352194
17. Крихели Н.И., Позднякова Т.И., Пустовойт Е.В., Аракелян И.Р., Журавлева Е.Г. Особенности клиники и лечения пациентов с кандидозом слизистой оболочки рта. Стоматология. 2021;100(6-2):43–47. https://doi.org/10.17116/stomat202110006243
18. Černáková L, Rodrigues CF. Microbial interactions and immunity response in oral Candida species. Future.Microbiol. 2020;15:1653–1677. https://doi.org/10.2217/fmb-2020-0113
19. Rodrigues CF, Henriques M. Oral mucositis caused by Candida glabrata biofilms: failure of the concomitant use of fluconazole and ascorbic acid. Ther. Adv. Infect. Dis. 2017;4(1):10–17. https://doi.org/10.1177/2049936116684477
20. Andrade JC, Kumar S, Kumar A, Černáková L, Rodrigues CF. Application of probiotics in candidiasis management. Crit. Rev. Food. Sci. Nutr. 2022;62(30):8249–8264. https://doi.org/10.1080/10408398.2021.1926905
21. Ramos-Pardo A, Castro-Álvarez R, Quindós G, Eraso E, Sevillano E, Kaberdin VR. Assessing pH-dependent activities of virulence factors secreted by Candida albicans. Microbiologyopen. 2023;12(1):e1342. https://doi.org/10.1002/mbo3.1342
22. Černáková L, Light C, Salehi B, Rogel-Castillo C, Victoriano M, Martorell M, Sharifi-Rad J, Martins N, Rodrigues CF. Novel Therapies for Biofilm-Based Candida spp. Infections. Adv. Exp. Med. Biol. 2019;1214:93–123. https://doi.org/10.1007/5584_2019_400. PMID: 31321751
23. Rodrigues CF, Rodrigues ME, Henriques MCR. Promising Alternative Therapeutics for Oral Candidiasis. Curr. Med. Chem. 2019;26(14):2515– 2528. https://doi.org/10.2174/0929867325666180601102333
24. Соколова Т.В., Малярчук А.П. Ошибки врачей в выборе тактики обследования и лечения больных с поверхностным кандидозом кожи и слизистых оболочек. Клиническая дерматология и венерология. 2020;19(3):343–354. https://doi.org/10.17116/klinderma202019031343
25. Lewis MAO, Williams DW. Diagnosis and management of oral candidosis. Br. Dent. J. 2017;223(9):675–681. https://doi.org/10.1038/sj.bdj.2017.886. PMID: 29123282
Об авторах
Ю. А. МакедоноваРоссия
Македонова Юлия Алексеевна — доктор медицинских наук, доцент; заведующая кафедрой стоматологии Института непрерывного медицинского и фармакологического образования; старший научный сотрудник
пл. Павших борцов, здание 1, г. Волгоград, 400131
Л. М. Гаврикова
Россия
Гаврикова Людмила Михайловна — кандидат медицинских наук, доцент; доцент кафедры стоматологии Института непрерывного медицинского и фармакологического образования
пл. Павших борцов, здание 1, г. Волгоград, 400131
С. В. Дьяченко
Россия
Дьяченко Светлана Владимировна — кандидат медицинских наук; ассистент кафедры стоматологии Института непрерывного медицинского и фармакологического образования
пл. Павших борцов, здание 1, г. Волгоград, 400131
Д. Ю. Дьяченко
Россия
Дьяченко Денис Юрьевич— кандидат медицинских наук; доцент кафедры стоматологии Института непрерывного медицинского и фармакологического образования
пл. Павших борцов, здание 1, г. Волгоград, 400131
Дополнительные файлы
Рецензия
Для цитирования:
Македонова Ю.А., Гаврикова Л.М., Дьяченко С.В., Дьяченко Д.Ю. Эффективность этиотропной терапии у пациентов с хроническим рецидивирующим течением орального кандидоза: рандомизированное контролируемое клиническое исследование. Кубанский научный медицинский вестник. 2023;30(4):48-60. https://doi.org/10.25207/1608-6228-2023-30-4-48-60
For citation:
Makedonova Yu.A., Gavrikova L.M., Dyachenko S.V., Dyachenko D.Yu. Effiectiveness of Etiotropic Therapy in Patients with Chronic Recurrent Oral Candidiasis: a Randomized Controlled Clinical Trial. Kuban Scientific Medical Bulletin. 2023;30(4):48-60. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-4-48-60








































