Перейти к:
Исследование эффективности различных схем назначения защищенных пенициллинов у пациентов после проведенной дентальной имплантации по иммуноспецифическим белкам смешанной слюны: рандомизированное неконтролируемое исследование
https://doi.org/10.25207/1608-6228-2023-30-4-28-36
Аннотация
Введение. Имеющиеся сравнительные исследования, рассматривающие вопрос выбора схемы назначения антибиотика при дентальной имплантации, зачастую носят исключительно наблюдательный характер, заключающийся в описании тех признаков в послеоперационном периоде, которые врач может увидеть. Безусловно, для более объективной оценки течения послеоперационного периода и сравнения подходов требуются лабораторные исследования. Одним из доступных на стоматологическом приеме методов исследования является изучение биохимических свойств слюны.
Цель исследования — сравнительная оценка однократной и пролонгированной схем приема амоксициллина/клавуланата после дентальной имплантации по показателям неспецифического иммунитета в смешанной слюне.
Методы. Проведено рандомизированное неконтролируемое исследование 30 пациентов с диагнозом частичной адентии. Клинический этап исследования выполнен на базе кафедры пропедевтики хирургической стоматологии федерального государственного бюджетного образовательного учреждения высшего образования «Московский государственный медико-стоматологический университет имени А. И. Евдокимова» Министерства здравоохранения Российской Федерации, лабораторный этап — на кафедрах фармакологии и биологической химии в той же организации, в 2021–2022 гг. В исследование включали пациентов в возрасте от 18 до 75 лет при условии благоприятных анатомических условий для установки дентального имплантата. До исследования не были допущены пациенты с соматическими заболеваниями в стадии декомпенсации. Пациентов случайным образом распределили в 2 группы. 1-й группе было показано за 30 минут до операции принять таблетированную форму амоксициллина/клавуланата 875+125 мг. 2-й группе за 30 минут до операции было показано принять амоксициллин/клавуланат 875+125 мг, а затем в течение 7 дней после операции принимать по 1 таблетке амоксициллина/клавуланата 500+125 мг 2 раза в день. Для оценки эффективности применяемой схемы антибиотикотерапии у всех пациентов натощак производился сбор нестимулированной смешанной слюны не менее 1 мл до операции и на 3-и сутки после операции. В образцах слюны спектрофотометрическим методом определяли количество иммуноглобулинов классов G, M, А (мг/л) и активность α-амилазы (МЕ/л). Статистическая обработка лабораторных данных проводилась с использованием t-критерия Стьюдента с поправкой Уэлча с использованием программы Statistica для Windows 10 Pro (StatSoft, США). Межгрупповые и внутригрупповые отличия считали достоверными при р ≤ 0,05.
Результаты. Среди изученных белков слюны наиболее выраженная разница между группами пациентов была получена по показателю IgA. По другим исследованным показателям слюны достоверная разница между группами не была получена на 3-и сутки после операции. При этом, несмотря на отсутствие статистической разницы, по всем показателям отмечается тенденция к более сильному росту количества IgА, G, IgM, активности амилазы слюны, а также отмечена высокая корреляционная взаимосвязь между иммуноглобулинами классов A, G; классов G, M, а также классов A, M.
Заключение. У пациентов пролонгированной схемы приема такие показатели слюны, как иммуноглобулины G и M, активность слюнной α-амилазы, не показали достоверных различий между группами, однако показали тенденцию к более сильному увеличению указанных иммуноглобулинов в слюне пациентов 1-й группы. Наиболее значимая разница была получена по показателю в слюне иммуноглобулина A, количество которого значимо меньше было в группе пролонгированного приема антибиотика (p < 0,05).
Ключевые слова
Для цитирования:
Габидуллина В.Р., Цициашвили А.М., Заборовский А.В., Островская И.Г., Гуревич К.Г. Исследование эффективности различных схем назначения защищенных пенициллинов у пациентов после проведенной дентальной имплантации по иммуноспецифическим белкам смешанной слюны: рандомизированное неконтролируемое исследование. Кубанский научный медицинский вестник. 2023;30(4):28-36. https://doi.org/10.25207/1608-6228-2023-30-4-28-36
For citation:
Gabidullina V.R., Tsitsiashvili A.M., Zaborovsky A.V., Ostrovskaya I.G., Gurevich K.G. Efficacy of Various Regimens of Inhibitor-Protected Penicillins on the Basis of Immunospecific Mixed Saliva Proteins in Patients after Dental Implantation: a Randomized Uncontrolled Trial. Kuban Scientific Medical Bulletin. 2023;30(4):28-36. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-4-28-36
ВВЕДЕНИЕ
Дентальная имплантация получила широкое распространение, как наиболее физиологичный способ восстановления жевательной эффективности при частичном или полном отсутствии зубов [1–3]. Одной из проблем, неразрывно связанной с дентальной имплантацией, остается профилактика и лечение гнойно-воспалительных осложнений [4]. Любая операция состоит из трех основополагающих этапов: создание доступа, выполнение операции, завершение операции. Первый этап напрямую связан с направленным нарушением целостности барьеров человека — слизистой оболочки, кожи и других, что создает естественные условия для попадания микроорганизмов во внутреннюю среду [6]. Среди имеющихся в полости рта микроорганизмов есть большое количество микробов, которые, попадая в благоприятные для себя условия существования, приобретают свойства патогенности и могут становиться причиной развития гнойно-воспалительных осложнений [7][8]. Использование при дентальной имплантации инородного биологически инертного материала — титанового имплантата — является своего рода фактором риска, так как инородный объект, не имея сосудов и кровоснабжения или иных биологических свойств, не может отвечать на микробную инвазию и становится субстратом, вокруг или на поверхности которого могут размножаться микроорганизмы [9–11]. В связи с необходимостью минимизации осложнений при дентальной имплантации предпринимается ряд профилактических мер — пародонтологическая, терапевтическая подготовка пациента, строгое соблюдение комплекса мер асептики и антисептики, использование в предоперационном периоде антисептиков для полости рта с целью снижения количества микроорганизмов, использование в профилактических целях антибиотиков [12–14]. Среди перечисленных мер наиболее дискутабельной остается использование антибиотиков. Сегодня имеется множество схем антибиотикопрофилактики. Если обобщить имеющиеся подходы, то можно выделить три наиболее часто встречающихся: отсутствие антибиотиков при строгом выполнении мер асептики, антисептики, санация пациента до хирургического вмешательства, местное использование антисептиков до и после операции; однократное профилактическое назначение антибиотика перед операцией при тщательном соблюдении описанных выше правил подготовки пациента; периоперационная антибиотикопрофилактика, начинаемая перед операцией и продолжающаяся от 3 до 7 дней в зависимости от группы выбранного препарата [15–17].
Как правило, раневой процесс в послеоперационном периоде оценивается врачами по клиническим проявлениям, например степень отека или интенсивность гиперемии и боли. При этом данная оценка может носить неточный, субъективный характер и может быть оценена разными клиницистами по-разному. В рамках исследовательской работы с целью более объективного и глубокого изучения и обобщения особенностей послеоперационного периода дентальной имплантации в зависимости от вида антибиотикопрофилактики возможно использование лабораторных методов исследования. Одним из самых доступных для врача-стоматолога материалов является смешанная слюна [18]. Известно, что количество иммуноглобулинов слюны может увеличиваться при развитии воспаления. Преобладающим иммуноглобулином слизистых оболочек является иммуноглобулин А (IgA), который является основным специфическим защитным гликопротеином для тканей ротовой полости [19][20]. Антитела класса IgG, IgM (иммуноглобулины G, M) обладают провоспалительными свойствами и могут приобретать иммунопатологическую роль, когда невозможна элиминация антигена [21]. Альфа-амилаза (α-амилаза) слюны является маркером стресса клеток и тканей на фоне воспалительной реакции, активность которой может увеличиваться при патологических состояниях в полости рта [22–24]. Таким образом, изучение количества антител иммуноглобулинов слюны полости рта после дентальной имплантации у пациентов, принимающих антибиотики по различным схемам, может иметь определенный научно-практический интерес, что и определило актуальность исследования.
Цель исследования — оценить эффективность однократной профилактической и пролонгированной схемы антимикробной химиопрофилактики защищенными пенициллинами в послеоперационном периоде после установки дентальных имплантатов по показателям неспецифического иммунитета в смешанной слюне.
МЕТОДЫ
Дизайн исследования
Работа выполнена по дизайну клинического экспериментального рандомизированного неконтролируемого исследования. В исследование включен 31 пациент с диагнозом частичной адентии, которые были случайным последовательным образом разделены на 2 группы.
Критерии соответствия
Критерии включения
Возраст старше 18 лет, отсутствие соматических патологий в стадии декомпенсации, отсутствие любых соматических заболеваний, требующих приема иммуносупрессивных препаратов, включенный или концевой дефект зубного ряда протяженностью от 1 до 3 единиц, благоприятные анатомические условия для установки дентального имплантата, наличие добровольного информированного согласия.
Критерии невключения
Возраст до 18 лет, наличие онкологических заболеваний, заболеваний в стадии декомпенсации, заболеваний, требующих приема иммуносупрессивных лекарственных средств, неврологические и психиатрические заболевания, отягощенный аллергологический анамнез, в том числе в отношении местных анестетиков, антибиотиков, нестероидных противовоспалительных препаратов, неконтролируемый прием лекарственных препаратов, курение более 3 сигарет в день, дефект зубного ряда более 3 единиц, пародонтологически компрометированные пациенты, необходимость проведения костной аугментации как этапа подготовки пациента к дентальной имплантации, отказ от участия в исследовании.
Критерии исключения
Отказ от дальнейшего участия в исследовании, отказ от выполнения врачебных рекомендаций, беременность.
Условия проведения исследования
Пациенты наблюдались на базе отделения хирургической стоматологии № 1 федерального государственного бюджетного образовательного учреждения высшего образования «Московский государственный медико-стоматологический университет имени А. И. Евдокимова» Министерства здравоохранения Российской Федерации (ФГБОУ МГМСУ им. А. И. Евдокимова). Лабораторный этап исследования выполнен на базе кафедры биологической химии и кафедры фармакологии МГМСУ им. А. И. Евдокимова Минздрава России.
Продолжительность исследования
С ноября 2021 по ноябрь 2022 года.
Медицинские вмешательства
Всем пациентам выполнялся осмотр полости рта врачом-стоматологом, сбор анамнеза для исключения противопоказаний со стороны общего здоровья для дентальной имплантации. Всем пациентам было рекомендовано сдать общий анализ крови. Выполнялось рентгенологическое исследование — конусно-лучевая компьютерная томография для определения объема костной ткани и определения возможности установки имплантата в имеющийся костный объем без проведения аугментации.
Операцию дентальной имплантации проводили в анатомически благоприятных условиях в объеме от 1 до 3 дентальных имплантатов в одном сегменте челюсти под местной анестезией 4 % раствором артикаина в соотношении 1:100 000 с эпинефрином. Протокол дентальной имплантации включал в себя проведение линейного разреза слизистой оболочки по альвеолярному гребню в области отсутствующего зуба/зубов и скелетирование альвеолярного отростка верхней челюсти/альвеолярной части нижней челюсти. Далее проводили последовательное формирование ложа дентального имплантата в области отсутствующего зуба/зубов с использованием пилотной и формирующих фрез из имплантационного хирургического набора фирмы-производителя дентальных имплантатов при скорости 800 об/мин под внешним охлаждением 0,9 % раствором NaCl с помощью хирургического имплантологического наконечника 20:1 и физиодиспенсера. После формирования ложа дентального имплантата с использованием ручного или машинного имплантатовода проводили непосредственно установку дентального имплантата в сформированное ложе с усилием 35 N/cm 3, шахту дентального имплантата закрывали винтом-заглушкой дентального имплантата. Слизисто-надкостничный лоскут укладывали на место и края фиксировали узловыми швами синтетическим рассасывающимся плетеным шовным материалом диаметром 5–0. Осмотр пациентов проводили на 1, 3, 7-е сутки после операции. Периоперационные назначения включали полоскание рта 0,05 % раствором хлоргексидина биглюконата в течение 1-й минуты до операции и 3 раза в день в течение 14 дней после операции, ибупрофен 200 мг по 1 таблетке при боли. Снятие швов проводили на 7-е сутки.
Пациентам группы 1 было показано за 30 минут до операции принять таблетированную форму защищенных пенициллинов амоксициллина/клавуланата 875+125 мг, послеоперационный период проходил без приема антибиотика. Пациенты 2-й группы, по аналогии с 1-й группой, за 30 минут до операции приняли амоксициллин/клавуланат 875+125 мг, а затем в течение 7 дней после операции принимали по 1 таблетке амоксициллина/клавуланата 500+125 мг 2 раза в день.
У всех пациентов обеих групп проводился двукратный сбор нестимулированной смешанной слюны для определения белковых молекул — до операции дентальной имплантации, а также на 3-и сутки после. Наблюдение за пациентами в рамках данного исследования проводилось до операции и на 3-и сутки после операции. Слюна собиралась в стерильные пробирки путем сплевывания в течение 5 минут утром с 8.00 до 9.00 натощак. Предварительно все пробирки были промаркированы индивидуальным номером пациента и порядковым номером взятого у данного пациента образца. Все образцы замораживались при температуре –18 °C в холодильной камере.
Исходы исследования
Основной исход исследования
Оценка эффективности однократной профилактической и пролонгированной схемы антимикробной химиопрофилактики защищенными пенициллинами у пациентов после установки дентальных имплантатов по показателям неспецифического иммунитета в нестимулированной смешанной слюне, полученной натощак, в которой изучали содержание 4 белков, иммуноглобулинов классов A (IgA), G (IgG), M (IgM), а также активность слюнной альфа-амилазы.
Дополнительные исходы исследования
Не предусмотрены.
Методы регистрации исходов
Эффективность однократной профилактической и пролонгированной схемы антимикробной химиопрофилактики защищенными пенициллинами у пациентов после установки дентальных имплантатов оценивали по показателям неспецифического иммунитета в нестимулированной смешанной слюне, полученной натощак. Изучали содержание иммуноглобулинов классов A (IgA), G (IgG), M (IgM), а также активность слюнной альфа-амилазы. При подготовке к лабораторному исследованию образцы слюны медленно размораживались при комнатной температуре +25 °C. В образцах слюны спектрофотометрическим методом определяли количество IgG, IgM, IgA в мг/л и активность α-амилазы в МЕ/л (АО «Вектор-Бест», Россия).
Искажающими факторами, способными самостоятельно влиять на уровень определяемых иммуноглобулинов и активность амилазы в смешанной слюне, являются особенности амбулаторного приема пациента, когда врач не может проконтролировать ответственность приема антибактериального препарата, а также использования антисептиков и качество индивидуальной гигиены полости рта пациентами в послеоперационном периоде.
Рандомизация
Выборка пациента для исследования формировалась последовательным методом. Каждому пациенту при включении его в исследование присваивался номер в соответствии с тем, каким по счету он обратился за медицинской помощью. Все пациенты с нечетными номерами (1, 3, 5 и т. д.) были определены в группу 1 (n = 16, возраст от 25 до 68 лет, 4 мужчин, 12 женщин). Все четные пациенты были определены в группу 2 (n = 14, возраст от 26 до 66 лет, 5 мужчин, 9 женщин). Отличие в количестве пациентов связано с тем, что на этапе исследования один из пациентов 2-й группы был исключен в связи с невыполнением рекомендаций, а следующий нечетный номер определил следующего пациента в группу 1.
Обеспечение анонимности данных
Среди участников исследования анонимность данных не обеспечивалась. Распределение пациентов на группы и анализ результатов проводился авторами без привлечения сторонних лиц.
Статистические процедуры
Принципы расчета статистической выборки
Размер выборки предварительно не рассчитывался.
Методы статистического анализа данных
Статистическая обработка лабораторных данных проводилась с использованием t-критерия Стьюдента с поправкой Уэлча, учитывая сравнение зависимых выборок (до операции и на 3-и сутки) и независимых выборок (первая и вторая группы). Проверку на нормальный характер распределений проводили с помощью критерия Шапиро — Уилка. Вычисление коэффициентов корреляции исследуемых лабораторных показателей между собой проводили методом Пирсона. Числовые значения параметров представлены через среднее значение (М) и стандартное отклонение (SD), а именно в виде (М ± SD). Все расчеты были выполнены с использованием программы Statistica для Windows 10 Pro (StatSoft, США). Межгрупповые и внутригрупповые отличия считали значимыми при р ≤ 0,05.
РЕЗУЛЬТАТЫ
Формирование выборки исследования
Для проведения исследования были сформированы 2 группы. В 1-ю группу вошли 16 пациентов, все дошли до конца наблюдения. Во 2-ю группу вошли 15 пациентов, один из которых был исключен. Исключение было связано с невыполнением предписанных врачом рекомендаций (рис.).
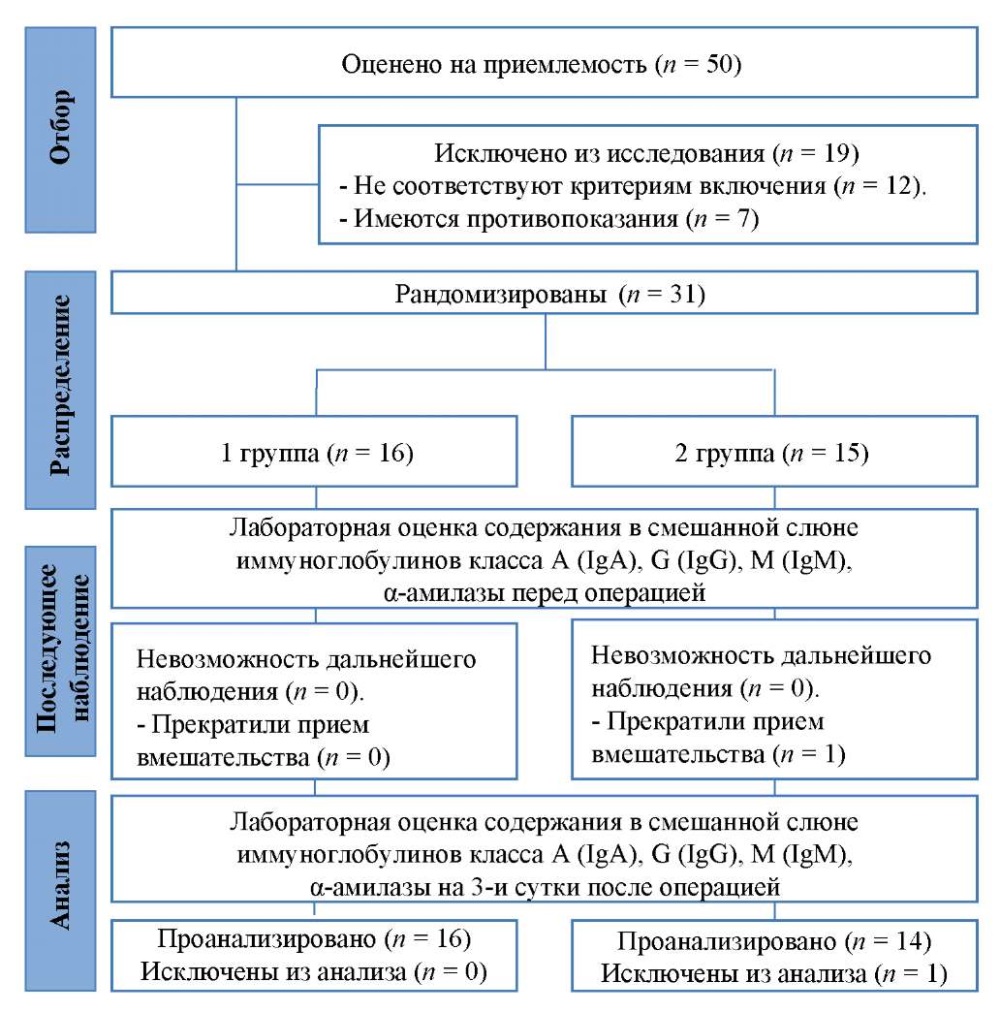
Рис. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами
(согласно рекомендациям CONSORT).
Fig. Schematic diagram of the research design
Note: performed by the authors
(according to CONSORT recommendations).
Характеристики выборки (групп) исследования
Участники исследования обеих групп были сопоставимы по полу и возрасту. Возраст пациентов 1-й группы составил от 25 до 68 лет, средний возраст 47,4 ± 14,2 года. Возраст пациентов 2-й группы составил от 26 до 66 лет, средний возраст 50,2 ± 12,4 года. По критерию Шапиро — Уилка гипотеза, по которой числовые распределения возрастов обеих групп относятся к нормальным распределениям, не отклоняется (р > 0,05). Разница по возрасту между группами не является статистически значимой по критерию Стьюдента при р = 0,455.
Было произведено разделение пациентов по возрастному признаку на следующие группы: до 40 лет, от 40 до 60 лет, старше 60 лет. При проведении статистического анализа методом ANOVA за нулевую гипотезу принимали равенство средних величин по показателю возраста. Не было выявлено статистически значимого (p > 0,05) влияния возрастного признака на анализируемые биохимические показатели. В связи с этим разделения пациентов по возрастному признаку не проводили.
Анализ четырехпольных таблиц сопряженности для гендерного состава сравниваемых групп показал сопоставимость групп, доля мужчин в первой группе, равная 25,0 %, и доля мужчин во второй группе, равная 35,7 %, по критерию хи-квадрат с поправкой Йейтса (р = 0,811) статистически не отличаются.
Из этого следует, что и по возрасту, и по гендерному признаку группы были одинаковы.
Основной результат исследования
Статистическая обработка полученных лабораторных данных проводилась с использованием t-критерия Стьюдента с поправкой Уэлча. Соответствие выборки нормальному закону распределения проверяли с помощью критерия Шапиро — Уилка. Далее по тексту все лабораторные данные представлены в виде среднего значения и стандартных отклонений.
Среди изученных белков слюны наиболее выраженная разница между группами пациентов была получена по показателю IgA (табл.).
Таблица. Средние значения концентрации IgA, IgG, IgM (M ± SD)
и активности α-амилазы в слюне (M ± SD) пациентов до операции
и на 3-и сутки после операции в группах 1 и 2
Table. Mean values of IgA, IgG, IgM concentration (M ± SD)
and б-amylase activity in saliva (M ± SD) of patients before surgery
and on the third day after surgery in groups 1 and 2
|
Показатели слюны |
Группа 1 (n = 16) |
Группа 2 (n = 14) |
||
|
до операции |
на 3 сутки после операции |
до операции |
на 3 сутки после операции |
|
|
IgA (мг/л) |
139,4 ± 103,9 |
287,6 ± 98,9 |
208,4 ± 148,4 |
217,7 ± 133,0 |
|
IgG (мг/л) |
73,0 ± 69,5 |
112,1 ± 80,1 |
76,2 ± 80,3 |
82,9 ± 80,8 |
|
IgM (мг/л) |
132,3 ± 164,0 |
202,8 ± 129,2 |
264,2 ± 154,1 |
302, 6 ± 183,8 |
|
Активность α-амилазы слюнной (МЕ/л) |
268,1 ± 424,6 |
682,8 ± 557,5 |
481,9 ± 369,5 |
495,9 ± 429,0 |
Примечание: таблица выполнена авторами.
Сокращения: IgG — иммуноглобулин A;
IgG — иммуноглобулин G;
IgМ — иммуноглобулин М.
Note: table made by the authors.
Abbreviations: IgG — immunoglobulin A;
IgG — immunoglobulin G;
IgM — immunoglobulin M.
Среднее количество IgA в начале исследования, до приема антибиотика, обработки полости рта раствором антисептика, для 1-й группы составило 139,4 ± 103,9 мг/л. Этот же показатель для 2-й группы составил 208,4 ± 148,4 мг/л (p > 0,05). К 3-м суткам после операции произошел рост количества IgA в обеих группах, однако важно отметить, что количество данного иммуноглобулина в значительно большей степени выросло в группе пациентов, принимавших однократную профилактическую дозу антибиотика — 287,6 ± 98,9 мг/л (р < 0,01). Во 2-й группе также был отмечен рост иммуноглобулина А, но значительно меньше, чем в первой группе пациентов — до 217,7 ± 133,0 мг/л (различие с исходным значением статистически незначимо, p > 0,05). Подобная разница между группами на 3-и сутки может косвенно указывать на более надежную профилактику воспалительных осложнений при приеме пролонгированной схемы защищенных пенициллинов.
По другим исследованным показателям слюны достоверная разница между группами не была получена на 3-и сутки после операции. При этом, несмотря на отсутствие статистической разницы, по всем показателям отмечается тенденция к более сильному росту количества IgG, IgM, активности амилазы слюны (табл.).
Также был проведен корреляционный анализ методом Пирсона, нами была отмечена высокая положительная прямая корреляционная связь на 3-и сутки после операции между иммуноглобулинами классов A, G (r = 0,7 и r = 0,7 для групп 1 и 2 соответственно); между иммуноглобулинами классов G, M (r = 0,7 и r = 0,8 для групп 1 и 2 соответственно), а также иммуноглобулинами классов A, M (r = 0,6 и r = 0,8 для групп 1 и 2 соответственно).
У пациентов 1-й группы среднее значение количества иммуноглобулина G до операции составило 73,0 ± 69,5 мг/л, на 3-и сутки хотя и увеличилось до 112,1 ± 80,1 мг/л, но статистически незначимо (р = 0,111). Аналогично и для пациентов 2-й группы до операции было получено значение 76,2 ± 80,3 мг/л, а затем рост данного показателя до 82,9 ± 80,8 мг/л, но также статистически незначимо (р = 0,657).
Среднее значение уровня IgM у пациентов 1-й группы до операции составило 132,3 ± 164,0 мг/л, после чего к 3-м суткам увеличилось до 202,8 ± 129,2 мг/л, но значимого различия не выявлено (р = 0,490). У пациентов 2-й группы данный показатель до операции составил 264,2 ± 154.1 мг/л и увеличился до 302,6 ± 183,8 мг/л к 3-м суткам, что также не указывает на значимое различие (р = 0,812).
Активность α-амилазы у пациентов 1-й группы в среднем изменилась с 268,1 ± 424,6 до 682,8 ± 557,5 МЕ/л к 3-м суткам, такое различие статистически значимо (р < 0,05). Во 2-й группе динамика изменения была намного менее выражена и составила от 481,9 ± 369,5 до 495,9 ± 429,0 МЕ/л к 3-м суткам при р = 0,912, т. е. различие не значимо, что также свидетельствует в пользу высокой эффективности пролонгированной схемы приема антибиотика (табл. 2).
Дополнительные результаты исследования
Дополнительные результаты в ходе исследования не получены.
Нежелательные явления
Нежелательные явления в ходе исследования не отмечены.
ОБСУЖДЕНИЕ
Ограничения исследования
Результаты настоящего исследования были получены на небольших выборках пациентов. Для дальнейшего развития выполненной работы требуется проведение исследования с бóльшим объемом выборки и с бóльшим объемом изучаемых явлений, а также их возможной взаимосвязи.
Экстраполяция
Измерение количества иммуноглобулинов и активности слюнной α-амилазы возможно экстраполировать на другие задачи, имеющие цель оценить степень выраженности воспалительных явлений после операционных вмешательств в полости рта.
Резюме основного результата исследования
Определение иммуноглобулинов классов A, G, M, активности альфа-амилазы в смешанной слюне может быть использовано на этапах проведения исследовательских работ как способ объективной оценки развития местных воспалительных явлений в полости рта. Определение количества IgA показало разницу между средними до операции на 3-и сутки после операции (р < 0,01). Количество данного иммуноглобулина преобладало в группе 1, что говорит о более выраженном воспалительном ответе в сравнении с пациентами группы 2. Также была получена тенденция в сторону более сильного увеличения активности слюнной альфа-амилазы в группе 1, получена статистически значимая разница (р < 0,05).
Обсуждение основного результата исследования
В нашем исследовании получен результат, что при дентальной имплантации уровень иммуноглобулина А значимо повышается у пациентов группы 1 — однократного приема амоксициллина/клавуланата. Уровень активности слюнной α-амилазы в рамках нашего исследования не носит статистически значимого увеличения, однако имеет заметную тенденцию к увеличению в группе однократного приема антибиотика. Возможно, при использовании большего количества исследуемых пациентов было бы получено более убедительное отличие между группами по данному показателю.
Имеющиеся исследования по вопросу сравнения схем назначения антибактериальных препаратов носят клинический характер, т. е. для оценки результата используется метод визуальной оценки течения раневого процесса. Кроме того, несмотря на обилие данных исследований, результаты систематического обзора А. Kim et аl. показывают, что можно уверенно говорить лишь о том, что антибактериальная профилактика снижает риски осложнений в послеоперационном периоде, но нельзя с уверенностью сказать, какой именно протокол имеет большие преимущества [25]. Мы видим, что уровни иммуноглобулинов в слюне и активности слюнной α-амилазы в меньшей степени меняются в группе пролонгированного приема антибиотика. Но на данный момент нельзя однозначно сказать, является ли это значимым результатом и влияет ли на снижение рисков ранних послеоперационных осложнений.
Camps-Font et al. отметили, что среди докторов имеется явная тенденция к назначению пролонгированной схемы приема антибиотиков после дентальной имплантации, поскольку данный подход дает докторам больше уверенности, что риски воспалительных осложнений сведены к минимуму [26]. K.J Suda et al. также утверждают, что имеющиеся данные не позволяют судить о преимуществе пролонгированного или однократного приема антибиотика [27].
С другой стороны, Е. Torof и его команда приходят к выводу, что использование местных антисептиков и предоперационное назначение антибиотика оказывают достаточный эффект для профилактики ранних послеоперационных осложнений, и использование пролонгированной схемы антибиотика не является необходимым [28].
Поскольку вопрос назначения антибиотиков после дентальной имплантации остается открытым, очевидно, требуются объективные методы исследования, которые бы позволили сравнить изучаемые схемы между собой. В силу ограниченности доступных рандомизированных клинических исследований и практически полного отсутствия в них лабораторных исследований, которые бы могли увеличить степень объективности, требуются не только дальнейшие исследования по данному вопросу, но и расширение списка используемых методов оценки эффективности или не эффективности подходов.
Использование для косвенной оценки воспалительного статуса иммуноглобулинов и активности слюнной α-амилазы говорит о том, что пролонгированная схема приема антибиотика может способствовать снижению выраженности воспалительных явлений в послеоперационном периоде. Однако стоит отметить, что не до конца понятны референсные значения для показателей слюны, по которым можно было бы уверенно говорить, что при увеличении биохимического показателя до определенного значения пациент попадает в группу высокого риска развития осложнений, и наоборот, при низких значениях указанных иммуноглобулинов или активности амилазы пациент не может получить осложнение.
Обобщая полученные по биохимическим показателям слюны данные, можно отметить, что, вне зависимости от назначаемой схемы приема антибактериального препарата, происходит сдвиг количества иммуноглобулинов и активности α-амилазы в большую сторону. Несмотря на то что разница между группами была получена только по IgA, на 3-и сутки после операции имеет место сильная корреляционная взаимосвязь данного показателя с иммуноглобулинами классов G, M.
Таким образом, по нашим данным можно сказать, что у пациентов пролонгированной схемы приема такие показатели слюны, как IgG и IgM, не показали тенденцию к более сильному увеличению указанных иммуноглобулинов в слюне пациентов 1-й группы. Также была получена разница по показателю IgA в слюне, количество которого заметно меньше было в группе пролонгированного приема антибиотика (р < 0,01).
ЗАКЛЮЧЕНИЕ
Таким образом, полученные в ходе нашего исследования данные лабораторных исследований не стимулированной смешанной слюны пациентов, проходящих лечение с использованием дентальных имплантатов при различных схемах антибиотикопрофилактики препаратом амоксициллина/клавуланата 875+125 мг, позволяют предположить, что использование показателей иммуноглобулинов смешанной слюны, таких как IgG, IgА, IgМ, а также альфа-амилазы слюны, может быть вариантом объективной оценки послеоперационного периода у пациентов после дентальной имплантации. Имеющиеся данные научной литературы неоднозначны в вопросе выбора схем антибактериальной профилактики в практике дентальной имплантации. По нашим данным, если рассматривать послеоперационной период в ключе выраженности воспалительных явлений, наибольшими преимуществами на данном этапе обладает пролонгированная схема приема антибиотика, поскольку она позволяет поддерживать необходимую концентрацию действующего вещества в крови в течение наиболее критичного после операции времени и с большей степенью вероятности позволяет предотвратить бактериальные осложнения. Подтверждение этому мы видим в меньшем количестве основного провоспалительного иммуноглобулина класса A в группе пролонгированного приема препарата (группа 2), меньший рост активности амилазы с 0 по 3-и сутки в этой же группе.
Список литературы
1. Block MS. Dental Implants: The Last 100 Years. J Oral Maxillofac Surg. 2018;76(1):11–26. https://doi.org/10.1016/j.joms.2017.08.045
2. Elani HW, Starr JR, Da Silva JD, Gallucci GO. Trends in Dental Implant Use in the U.S., 1999-2016, and Projections to 2026. J Dent Res. 2018;97(13):1424–1430. https://doi.org/10.1177/0022034518792567
3. Alghamdi HS, Jansen JA. The development and future of dental implants. Dent Mater J. 2020;39(2):167–172. https://doi.org/10.4012/dmj.2019-140
4. Carr AB, Arwani N, Lohse CM, Gonzalez RLV, Muller OM, Salinas TJ. Early Implant Failure Associated With Patient Factors, Surgical Manipulations, and Systemic Conditions. J Prosthodont. 2019;28(6):623–633. https://doi.org/10.1111/jopr.12978
5. Schmalz G, Reuschel F, Bartl M, Schmidt L, Runge J, Haak R, Goralski S, Roth A, Ziebolz D. One Third of Patients before Endoprosthesis Implantation Show an Oral Focus as Potential Source of Infectious Complication-The Value of Pre-Operative Dental Risk Stratification in a German Cohort. J Clin Med. 2022;11(13):3686. https://doi.org/10.3390/jcm11133686
6. Thoma DS, Gil A, Hämmerle CHF, Jung RE. Management and prevention of soft tissue complications in implant dentistry. Periodontol 2000. 2022;88(1):116–129. https://doi.org/10.1111/prd.12415
7. Duan XB, Wu TX, Guo YC, Zhou XD, Lei YL, Xu X, Mo AC, Wang YY, Yuan Q. Marginal bone loss around non-submerged implants is associated with salivary microbiome during bone healing. Int J Oral Sci. 2017;9(2):95–103. https://doi.org/10.1038/ijos.2017.18
8. Aldahlawi S, Demeter A, Irinakis T. The effect of implant placement torque on crestal bone remodeling after 1 year of loading. Clin Cosmet Investig Dent. 2018;10:203–209. https://doi.org/10.2147/CCIDE.S174895
9. Khatoon Z, McTiernan CD, Suuronen EJ, Mah TF, Alarcon EI. Bacterial biofilm formation on implantable devices and approaches to its treatment and prevention. Heliyon. 2018;4(12):e01067. https://doi.org/10.1016/j.heliyon.2018.e01067
10. Belibasakis GN, Manoil D. Microbial Community-Driven Etiopathogenesis of Peri-Implantitis. J Dent Res. 2021;100(1):21–28. https://doi.org/10.1177/0022034520949851
11. Kumar PS, Mason MR, Brooker MR, O’Brien K. Pyrosequencing reveals unique microbial signatures associated with healthy and failing dental implants. J Clin Periodontol. 2012;39(5):425–433. https://doi.org/10.1111/j.1600-051X.2012.01856.x
12. Xu L, Wang Y, Nguyen VT, Chen J. Effects of Topical Antibiotic Prophylaxis on Wound Healing After Flapless Implant Surgery: A Pilot Study. J Periodontol. 2016;87(3):275–280. https://doi.org/10.1902/jop.2015.150464
13. Romandini M, De Tullio I, Congedi F, Kalemaj Z, D’Ambrosio M, Laforí A, Quaranta C, Buti J, Perfetti G. Antibiotic prophylaxis at dental implant placement: Which is the best protocol? A systematic review and network meta-analysis. J Clin Periodontol. 2019;46(3):382–395. https://doi.org/10.1111/jcpe.13080
14. Momand P, Becktor JP, Naimi-Akbar A, Tobin G, Götrick B. Effect of antibiotic prophylaxis in dental implant surgery: A multicenter placebo-controlled double-blinded randomized clinical trial. Clin Implant Dent Relat Res. 2022 Feb;24(1):116–124. https://doi.org/10.1111/cid.13068
15. Surapaneni H, Yalamanchili PS, Basha MH, Potluri S, Elisetti N, Kiran Kumar MV. Antibiotics in dental implants: A review of literature. J Pharm Bioallied Sci. 2016;8(Suppl 1):S28–S31. https://doi.org/10.4103/0975-7406.191961
16. Bernabeu-Mira JC, Peñarrocha-Diago M, Peñarrocha-Oltra D. Prescription of Antibiotic Prophylaxis for Dental Implant Surgery in Healthy Patients: A Systematic Review of Survey-Based Studies. Front Pharmacol. 2021;11:588333. https://doi.org/10.3389/fphar.2020.588333
17. Rodríguez Sánchez F, Arteagoitia I, Rodríguez Andrés C, Bruers J. Antibiotic prophylaxis prescribing habits in oral implant surgery in the Netherlands: a cross-sectional survey. BMC Oral Health. 2019;19(1):281. https://doi.org/10.1186/s12903-019-0981-4
18. Martina E, Campanati A, Diotallevi F, Offidani A. Saliva and Oral Diseases. J Clin Med. 2020;9(2):466. https://doi.org/10.3390/jcm9020466. PMID: 32046271; PMCID: PMC7074457
19. Ptasiewicz M, Bębnowska D, Małkowska P, Sierawska O, Poniewierska-Baran A, Hrynkiewicz R, Niedźwiedzka-Rystwej P, Grywalska E, Chałas R. Immunoglobulin Disorders and the Oral Cavity: A Narrative Review. J Clin Med. 2022;11(16):4873. https://doi.org/10.3390/jcm11164873
20. Al-Ibraheem J, Zyara Y, Al-Quraine N, Abdulridha WM. Correlation between salivary immunoglobulin A and interleukin-1beta in smokers with dental caries. F1000Res. 2023;12:175. https://doi.org/10.12688/f1000research.129649.2
21. Riis JL, Bryce CI, Stebbins JL, Granger DA. Salivary total Immunoglobulin G as a surrogate marker of oral immune activity in salivary bioscience research. Brain Behav Immun Health. 2020 Jan;1:100014. https://doi.org/10.1016/j.bbih.2019.100014
22. Grönblad EA. Concentration of immunoglobulins in human whole saliva: effect of physiological stimulation. Acta Odontol Scand. 1982;40(2):87–95. https://doi.org/10.3109/00016358209041120
23. Broche N Jr, Takeshita RSC, Mouri K, Bercovitch FB, Huffman MA. Salivary alpha-amylase enzyme is a non-invasive biomarker of acute stress in Japanese macaques (Macaca fuscata). Primates. 2019;60(6):547–558. https://doi.org/10.1007/s10329-019-00757-6
24. Christidis N, Baghernejad P, Deyhim A, Jasim H. Salivary Alpha-Amylase in Experimentally-Induced Muscle Pain. Diagnostics (Basel). 2020;10(9):722. https://doi.org/10.3390/diagnostics10090722
25. Kim AS, Abdelhay N, Levin L, Walters JD, Gibson MP. Antibiotic prophylaxis for implant placement: a systematic review of effects on reduction of implant failure. Br Dent J. 2020;228(12):943–951. https://doi.org/10.1038/s41415-020-1649-9
26. Camps-Font O, Viaplana-Gutiérrez M, Mir-Mari J, Figueiredo R, Gay-Escoda C, Valmaseda-Castellón E. Antibiotic prescription for the prevention and treatment of postoperative complications after routine dental implant placement. A cross-sectional study performed in Spain. J Clin Exp Dent. 2018;10(3):e264–e270. https://doi.org/10.4317/jced.54637
27. Suda KJ, Henschel H, Patel U, Fitzpatrick MA, Evans CT. Use of Antibiotic Prophylaxis for Tooth Extractions, Dental Implants, and Periodontal Surgical Procedures. Open Forum Infect Dis. 2017;5(1):ofx250. https://doi.org/10.1093/ofid/ofx250
28. Torof E, Morrissey H, Ball PA. Antibiotic Use in Dental Implant Procedures: A Systematic Review and Meta-Analysis. Medicina (Kaunas). 2023;59(4):713. https://doi.org/10.3390/medicina59040713
Об авторах
В. Р. ГабидуллинаГабидуллина Варвара Ренатовна — аспирант кафедры пропедевтики хирургической стоматологии
ул. Делегатская, д. 20, стр. 1, г. Москва, 127473
А. М. Цициашвили
Россия
Цициашвили Александр Михайлович — доктор медицинских наук, доцент, профессор кафедры пропедевтики хирургической стоматологии
ул. Делегатская, д. 20, стр. 1, г. Москва, 127473
А. В. Заборовский
Заборовский Андрей Владимирович — доктор медицинских наук, доцент, заведующий кафедрой фармакологии
ул. Делегатская, д. 20, стр. 1, г. Москва, 127473
И. Г. Островская
Островская Ирина Геннадьевна — доктор медицинских наук, профессор; профессор кафедры биологической химии
ул. Делегатская, д. 20, стр. 1, г. Москва, 127473
К. Г. Гуревич
Гуревич Константин Георгиевич — доктор медицинских наук, профессор, профессор Российской академии наук; заведующий кафедрой «Здоровый образ жизни — залог успешного развития»
ул. Делегатская, д. 20, стр. 1, г. Москва, 127473
Дополнительные файлы
Рецензия
Для цитирования:
Габидуллина В.Р., Цициашвили А.М., Заборовский А.В., Островская И.Г., Гуревич К.Г. Исследование эффективности различных схем назначения защищенных пенициллинов у пациентов после проведенной дентальной имплантации по иммуноспецифическим белкам смешанной слюны: рандомизированное неконтролируемое исследование. Кубанский научный медицинский вестник. 2023;30(4):28-36. https://doi.org/10.25207/1608-6228-2023-30-4-28-36
For citation:
Gabidullina V.R., Tsitsiashvili A.M., Zaborovsky A.V., Ostrovskaya I.G., Gurevich K.G. Efficacy of Various Regimens of Inhibitor-Protected Penicillins on the Basis of Immunospecific Mixed Saliva Proteins in Patients after Dental Implantation: a Randomized Uncontrolled Trial. Kuban Scientific Medical Bulletin. 2023;30(4):28-36. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-4-28-36
JATS XML








































