Перейти к:
Иммунопатогенез и иммунотерапия склерозирующего варианта течения склеротического лихена вульвы: проспективное когортное исследование
https://doi.org/10.25207/1608-6228-2023-30-5-41-53
Аннотация
Введение. Сегодня отсутствует единая клиническая классификация склеротического лихена вульвы. Выделение патогенетически и клинически различных вариантов его течения может позволить разработать новые подходы к терапии заболевания. Цель исследования — разработка патогенетической терапии склерозирующего варианта течения склеротического лихена вульвы с учетом его клинико-иммунологических характеристик. Методы. Проспективное когортное исследование проводилось с 2018 по 2022 год на базе государственного бюджетного учреждения здравоохранения «Краевая клиническая больница № 2» Министерства здравоохранения Краснодарского края. Из 292 пациенток в возрасте от 20 до 70 лет с гистологически подтвержденным диагнозом «Склеротический лихен вульвы» после проведения клинического обследования с применением «Шкалы оценки субъективных и объективных клинических признаков склеротического лихена вульвы» были отобраны 154 больные со склерозирующим вариантом течения заболевания. Группу контроля составили 30 женщин той же возрастной категории без склеротического лихена вульвы, с учетом критериев исключения. Проводилась клиническая оценка (в баллах) объективных и субъективных критериев, характерных для данного варианта склеротического лихена вульвы, а также оценка уровня цитокинов (интерлейкин-20, интерлейкин-23, интерлейкин-10, фактор некроза опухоли α, интерферон-γ) в периферической крови исследуемых из основной и контрольной групп. Через 1 месяц после проведения иммунотерапии дезоксирибонуклеатом натрия оценивалась ее клиническая (с помощью Числовой рейтинговой шкалы для боли (вульводинии) и балльной оценки выраженности зуда вульвы) и иммунологическая (повторная оценка уровня исследуемых цитокинов) эффективность. Анализ и статистическая обработка полученных данных проводились с использованием программы «Graph Pad Prism version 6.0» (GraphPad Software, Inc., San Diego, CA). Результаты. Для больных со склерозирующим вариантом склеротического лихена вульвы более характерна депигментация кожи вульвы на фоне ее склероза и утолщения в сравнении с атрофией вульвы. При этом стеноз преддверия влагалища либо отсутствует (51,3 %), либо преимущественно соответствует I степени и менее характерен, чем депигментация и даже атрофия кожи. Из субъективных признаков характерен выраженный зуд вульвы при отсутствии либо умеренно выраженной (у 68,1 %) вульводинии. Иммунологическое исследование показало статистически значимое увеличение уровня интерлейкина-20 (p < 0,0001), интерлейкина-23 (p < 0,0001), интерферона-γ (p < 0,03), фактора некроза опухоли α (p < 0,009) относительно группы контроля у пациенток с максимальным склерозом в тканях, наряду со статистически значимым (p < 0,01) снижением уровня противовоспалительного интерлейкина-10. Иммунологическая эффективность дезоксирибонуклеата натрия подтверждена статистически значимым, относительно исходных показателей, снижением уровня интерлейкина-20 (p < 0,0001), интерферона-γ и фактора некроза опухоли α (p < 0,002), интерлейкина-23 (p < 0,012) с отсутствием после лечения статистических различий с показателями контрольной группы (за исключением интерлейкина-23, уровень которого после терапии хоть и снизился, но остался статистически выше (p < 0,01) показателя контрольной группы). Клиническая эффективность иммунотерапии подтверждена статистически значимым (p < 0,001) снижением выраженности вульводинии и зуда вульвы после проведенного лечения. Заключение. Полученные данные указывают на наличие характерных клинических особенностей и иммунологических отличий относительно нормы у женщин со склерозирующим вариантом склеротического лихена вульвы, что обосновывает применение при данном варианте дезоксирибонуклеата натрия, клинико-иммунологическая эффективность которого была подтверждена результатами проведенного исследования.
Ключевые слова
Для цитирования:
Колесникова Е.В., Жаров А.В., Пенжоян М.А., Дуплеева Д.И. Иммунопатогенез и иммунотерапия склерозирующего варианта течения склеротического лихена вульвы: проспективное когортное исследование. Кубанский научный медицинский вестник. 2023;30(5):41-53. https://doi.org/10.25207/1608-6228-2023-30-5-41-53
For citation:
Kolesnikova E.V., Zharov A.V., Penzhoyan M.A., Dupleeva D.I. Immune pathogenesis and immune therapy of a sclerosing variant of vulvar lichen sclerosus: a prospective cohort study. Kuban Scientific Medical Bulletin. 2023;30(5):41-53. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-5-41-53
ВВЕДЕНИЕ
Склеротический лихен вульвы (СЛВ) рассматривается как хроническое воспалительное аутоиммунное генетически детерминированное заболевание с эпизодами ремиссий и обострений [1]. Основными клиническими проявлениями заболевания являются прогрессирующая атрофия наружных половых органов с фиброзированием и склерозированием тканей, приводящих к функциональным нарушениям и развитию сексуальной дисфункции, значительно снижающих качество жизни пациенток1 [2][3]. Кроме того, в 5 % случаев на фоне СЛВ может развиться плоскоклеточный рак вульвы [4]. При этом СЛВ остается одной из наименее изученных междисциплинарных проблем современной медицины [1]. Так, на сегодня отсутствует общепринятая классификация СЛВ, что подчеркивается в Клинических рекомендациях Министерства здравоохранения Российской Федерации от 2020 г. «Лишай склеротический и атрофический». Стандартная терапия назначается всем пациенткам, независимо от особенностей клинического течения заболевания и без учета иммунных нарушений, лежащих в основе заболевания [5–7], что во многом обуславливает недостаточную ее эффективность [8–10] и зачастую разнонаправленные результаты предлагаемых методов лечения [11][12]. Несмотря на то что некоторые авторы не исключают возможную роль инфекционных, нейрогенных и других факторов развития заболевания [13][14], лидирующими остаются иммунная (аутоиммунная) и генетическая теории [15][16]. Это указывает на необходимость более углубленного изучения иммунопатогенеза заболевания, а также на перспективу применения при данной патологии иммунотерапии.
В связи с отсутствием единой клинической классификации СЛВ наряду с имеющимися различиями в клинической картине заболевания на основании разработанной ранее Шкалы оценки субъективных и объективных клинических признаков СЛ вульвы [17] нами было предложено выделять 3 клинических варианта СЛ вульвы (склерозирующий, склероатрофический и атрофический). В данной статье представлены особенности иммунопатогенеза склерозирующего варианта СЛВ и возможности иммунокоррекции указанного варианта заболевания.
Цель исследования — разработка патогенетической терапии склерозирующего варианта течения склеротического лихена вульвы с учетом его клинико-иммунологических характеристик.
МЕТОДЫ
Дизайн исследования
Дизайн работы построен в виде проспективного когортного исследования 292 больных склеротическим лихеном вульвы в возрасте от 20 до 70 лет и 30 условно здоровых женщин того же возраста (группа контроля).
Условия проведения исследования
Прием и обследование пациенток проводились в женской консультации роддома № 5 (Перинатального центра государственного бюджетного учреждения здравоохранения «Краевая клиническая больница № 2» Министерства здравоохранения Краснодарского края) и клинике общества с ограниченной ответственностью «Окси-центр», лабораторные исследования выполнены в научно-исследовательской лаборатории государственного бюджетного учреждения здравоохранения «Краевая клиническая больница № 1 им. С. В. Очаповского» Министерства здравоохранения Краснодарского края в период с 2018 по 2022 г. Анализ полученных результатов проводился на базе кафедры акушерства, гинекологии и перинатологии факультета повышения квалификации и профессиональной переподготовки специалистов федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
Критерии соответствия
Критерии включения
Возраст от 20 до 70 лет, склерозирующий вариант течения СЛВ, отсутствие в анамнезе иммунотерапии в течение года.
Критерии невключения
Наличие вирусных инфекций (папилломавирусной и герпетической инфекции урогенитального тракта), инфекций, передаваемых половым путем: острый вульвовагинит; онкологические заболевания; тяжелая экстрагенитальная патология; беременность.
Описание критериев соответствия (диагностические критерии)
Критериями соответствия приняты подтвержденные при клиническом и морфологическом исследовании признаки СЛВ. Склерозирующий вариант течения СЛВ определяли на основании разработанной Шкалы оценки субъективных и объективных клинических признаков СЛВ [17]. Критерии невключения подтверждены лабораторными исследованиями.
Подбор участников в группы
Подбор участников в группы проводился на основании клинико-анамнестических данных пациенток, результатов оценки по шкале субъективных и объективных клинических признаков СЛВ, а также результатов лабораторных и морфологических исследований. На основании проведенных исследований, с учетом критериев включения и исключения, была отобрана основная исследуемая группа больных со склерозирующим вариантом течения СЛВ (n = 154). В ходе проводимого иммунологического исследования (определение уровней цитокинов интерлейкина-20 (IL-20), интерлейкина-23 (IL-23), интерлейкина-10 (IL-10), фактора некроза опухоли α (TNF-α), интерферона γ (IFN-γ) в периферической крови исследуемых) ввиду четкой зависимости величин исследуемых показателей от степени выраженности склеротических изменений тканей вульвы (в результате клинической оценки) возникла необходимость ранжирования больных основной исследуемой группы на две подгруппы: А — склерозирующий вариант СЛВ с минимальными склеротическими признаками, n = 59 (клинически имелись незначительное утолщение (до 3 мм) и склероз тканей вульвы без распространения на промежность), и В — склерозирующий вариант СЛВ с выраженными склеротическими признаками, n = 95 (клинически — кожа вульвы утолщена до 3–5 мм и больше, с грубыми склеротическими изменениями от 80 до 100 % площади вульвы, с переходом на кожу промежности и перианальной области). Исследуемые цитокины были выбраны в связи с их участием в развитии патологических процессов в коже2 [18–20], в том числе в аутоиммунных процессах [21–24].
Несмотря на то что цитокины исходно регулируют защитные воспалительные реакции на локальном уровне, при длительном прогрессирующем течении воспалительного процесса они поступают в системный кровоток, где также реализуют свои эффекты. Последнее обуславливает возможность определения уровня цитокинов в периферической крови для оценки локальных патологических процессов [25], что было подтверждено многочисленными исследованиями уровня цитокинов в сыворотке крови у больных с патологическими процессами в коже, в том числе и у больных СЛВ [26–28]. После проведения иммунологического исследования в основной и контрольной группах, с учетом полученных результатов, всем пациенткам из основной группы был проведен курс иммунотерапии препаратом ДНК эукариот (МНО: дезоксирибонуклеат натрия). Препарат применяли внутримышечно по 1 ампуле (15 мг/мл) 1 раз в день с интервалом в 48 часов, всего на курс — 10 инъекций. Через 1 месяц после иммунотерапии проводилось повторное исследование содержания цитокинов в плазме крови больных из основной исследуемой группы.
Целевые показатели исследования
Основной показатель исследования
Основным показателем исследования являлось выявление и подробная характеристика клинических и иммунологических характеристик склерозирующего варианта СЛВ с последующей оценкой клинико-иммунологической эффективности иммунотерапии, определяемой по степени снижения или отсутствия основных клинических симптомов заболевания (зуд вульвы и поверхностная вульводиния), а также по степени изменений цитокинового профиля в крови больных после проведенного лечения.
Дополнительные показатели исследования
Дополнительные показатели исследования получить не предполагалось.
Методы измерения целевых показателей
Оценка выраженности поверхностной вульводинии проводилась с помощью Числовой рейтинговой шкалы для боли (Visual Analog Scale for pain, VAS) [28], представленной горизонтальной линией с отмеченными на ней цифрами от 0 до 10, где 0 — «отсутствие боли», 5 — «умеренная боль» и 10 — «сильнейшая боль, какую только можно представить». Критериям тяжести зуда вульвы присваивался соответствующий балл (для проведения статистической обработки): отсутствие зуда вульвы (0 баллов); легкий зуд (1 балл) — незначительный зуд в передней и, реже, задней половине вульвы, не усиливающийся ночью и самостоятельно проходящий; умеренный зуд (2 балла) — затрагивает все отделы вульвы, а также промежность и перианальную область, может усиливаться ночью, однако применение эмолентов и выполнение гигиенических рекомендаций позволяют добиться хорошего лечебного эффекта; тяжелый зуд (3 балла) — затрагивает вульву, промежность, перианальную область, нередко переходит на генито-феморальные и паховые складки, крайне интенсивный и днем, и ночью, часто сопровождается возникновением экскориаций с их инфицированием. Другим объективным клиническим критериям (стеноз преддверия влагалища, депигментация, атрофия вульвы) также присваивались баллы от 0 (отсутствие признака) до 3 (максимальная выраженность признака). Исследование содержания цитокинов в сыворотке крови проводилось методом иммуноферментного анализа с применением фотометра Multiscan FC (производство Финляндия), а также тест-систем «R&D Systems» (США) и «Bender Medsystems» (Австрия). Полученные данные фиксировались в электронных журналах и специальных картах больных.
Переменные (предикторы, конфаундеры, модификаторы эффекта)
В задачи данного исследования не входило определение клинико-анамнестических предикторов возникновения склерозирующего варианта течения СЛВ. Факторы, которые могли бы исказить результаты иммунологического исследования (инфекционные процессы, аутоиммунные заболевания, тяжелая соматическая патология, беременность, ранее проводимая иммунотерапия) исходно были отнесены к критериям исключения и отсутствовали у исследуемых пациенток.
Статистические процедуры
Принципы расчета размера выборки
Размер выборки предварительно не рассчитывали.
Статистические методы
Анализ и статистическая обработка полученных данных проводились с использованием программы «Graph Pad Prism version 6.0» (GraphPad Software, Inc., Сан-Диего, США). Оценку на нормальность распределения количественных признаков проводили с помощью критерия Шапиро — Уилка. С учетом ненормального распределения выборки мерой центральной тенденции для описания распределения количественных признаков была выбрана медиана (Me), а интервальная оценка представлялась в виде интерквартильного размаха (25-й и 75-й процентили). Результаты представлены в виде Me (Q25 и Q75). Качественные показатели представлены в абсолютных и относительных величинах (%). Для описания данных использовалось среднее арифметическое и стандартное отклонение (M ± SD). Для сравнения групп по количественным признакам использовались непараметрические U-критерий Манна — Уитни (при сравнении исследуемой и контрольной группы) и Т-критерий Вилкоксона. Различия определяли значимыми при p < 0,05; незначимыми — при р > 0,15; в промежуточных случаях (0,05 < р ≤ 0,15) обнаруженные эффекты обсуждали как тенденции.
РЕЗУЛЬТАТЫ
Формирование выборки исследования
Формирование выборки исследуемых проводилось на основании клинико-анамнестических данных больных СЛВ с учетом критериев включения и исключения, а также на основе применения Шкалы оценки субъективных и объективных клинических признаков СЛВ [17], позволяющей клинически определить вариант течения заболевания. В результате из 292 больных СЛВ были отобраны 154 пациентки со склерозирующим вариантом его течения с целью оценки характерных клинических особенностей, а также цитокинового статуса пациенток в сравнении с группой контроля (30 условно здоровых женщин той же возрастной категории). Исключены из данного исследования были пациентки с атрофическим (n = 101) и склеро-атрофическим (n = 37) вариантами течения СЛВ. Дизайн исследования представлен на рисунке 1.
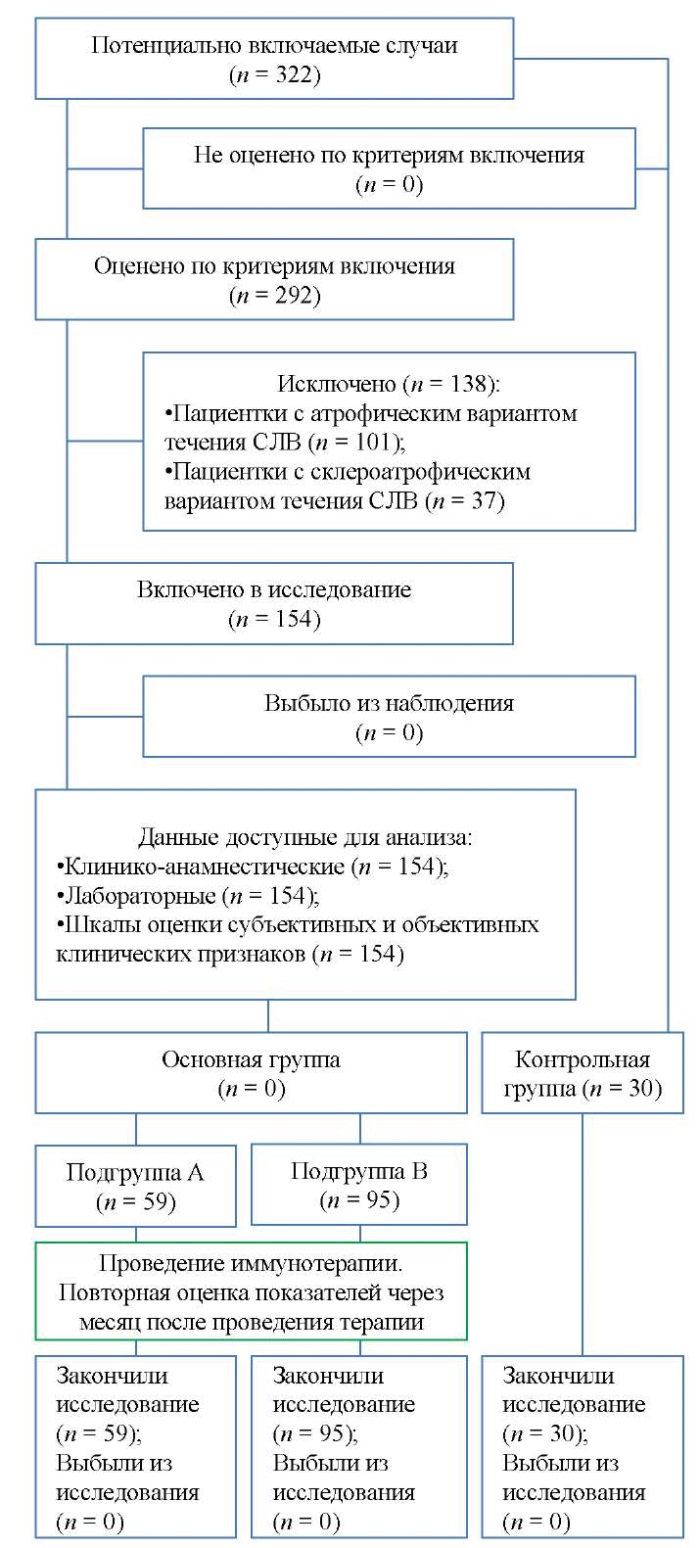
Рис. 1. Блок-схема дизайна исследования.
Примечание: блок-схема выполнена авторами
(согласно рекомендациям STROBE).
Сокращение: СЛВ — склеротический лихен вульвы.
Fig. 1. Schematic diagram of the research design
Note: performed by the authors
(according to STROBE recommendations).
Abbreviation: СЛВ — vulvar lichen sclerosus
Характеристики выборки групп исследования
Медиана (Ме (Q25–Q75)) возраста пациенток в подгруппах А, В и контрольной группе составила, соответственно, 57,50 (46,25–61,75), 50,50 (43,75–58,25) и 44,00 (35,00–58,50) года. При этом различия по возрасту между подгруппами А, В и группой контроля были статистически не значимы (p > 0,05).
Основные результаты исследования
Результаты опроса больных со склерозирующим вариантом СЛВ с применением Числовой рейтинговой шкалы для боли в отношении выраженности поверхностной вульводинии представлены в таблице 1.
Таблица 1. Выраженность поверхностной вульводинии у пациенток
со склерозирующим вариантом течения склеротического лихена вульвы
Table 1. Severity of superficial vulvodynia in patients
with a sclerosing variant of vulvar lichen sclerosus
|
Балл |
Вульводиния (количество пациенток, n (%)) |
|
«0» — отсутствие боли |
25 (16,2 %) |
|
«1» |
0 |
|
«2» |
0 |
|
«3» |
10 (6,5 %) |
|
«4» |
0 |
|
«5» — умеренная боль |
105 (68,1 %) |
|
«6» |
0 |
|
«7» |
9 (5,8 %) |
|
«8» |
0 |
|
«9» |
0 |
|
«10» — сильнейшая боль |
5 (3,2 %) |
|
Всего |
154 |
|
Мe (Q0,25–Q0,75) |
2,00 (0,00–5,00) |
Примечание: таблица составлена авторами.
Note: compiled by the authors.
Как видно из представленной таблицы, поверхностная вульводиния полностью отсутствовала у 16,2 % пациенток, бóльшая часть больных склерозирующим вариантом СЛВ отмечала умеренную выраженность симптома, и лишь 5 пациенток (3,2 %) охарактеризовали вульводинию, как сильнейшую.
В то же время при оценке выраженности зуда вульвы у пациенток с данным вариантом течения СЛВ отмечалась противоположная тенденция (табл. 2).
Таблица 2. Распределение объективных клинических проявлений
и степени их тяжести у пациенток со склерозирующим вариантом
течения склеротического лихена вульвы
Table 2. Distribution of objective clinical signs and their severity
in patients with a sclerosing variant of vulvar lichen sclerosus
|
Проявления (баллы) |
Количество пациенток, n (%) |
|
Зуд вульвы |
|
|
Отсутствует (0) |
0 |
|
Легкий зуд (1 балл) |
39 (25,3 %) |
|
Умеренный зуд (2) |
103 (66,9 %) |
|
Тяжелый зуд (3) |
12 (7,8 %) |
|
Мe (Q0,25–Q0,75) |
2,00 (1,25–2,00) |
|
Всего |
154 |
|
Депигментация |
|
|
Отсутствует (0) |
0 % |
|
Слабо выраженная (1) |
59 (38,3 %) |
|
Умеренно выраженная (2) |
67 (43,5 %) |
|
Ярко выраженная (3) |
28 (18,2 %) |
|
Мe (Q0,25–Q0,75) |
2,00 (1,00–2,00) |
|
Всего |
154 |
|
Атрофия вульвы |
|
|
Отсутствует (0) |
27 (17,5 %) |
|
Начальная атрофия (1) |
59 (38,3 %) |
|
Промежуточная атрофия (2) |
48 (31,2 %) |
|
Окончательная атрофия (3) |
20 (13,0 %) |
|
Мe (Q0,25–Q0,75) |
1,00 (1,00–2,00) |
|
Всего |
154 |
|
Стеноз преддверия влагалища |
|
|
Стеноза нет (0.) |
79 (51,3 %) |
|
Стеноз I степени (1) |
59 (38,3 %) |
|
Стеноз II степени (2) |
12 (7,8 %) |
|
Стеноз III степени (3) |
4 (2,6 %) |
|
Мe (Q0,25–Q0,75) |
0,00 (0,00–1,00) |
|
Всего |
154 |
Примечания: таблица составлена авторами;
различия между показателем атрофии и депигментации,
а также атрофии и стеноза преддверия статистически значимы (p < 0,001);
различия между показателем депигментации
и стеноза статистически значимы (р < 0,001);
различия между показателем депигментации
и зуда вульвы статистически не значимы (р > 0,3).
Notes: compiled by the authors;
differences between atrophy and depigmentation,
as well as atrophy and stenosis of the vaginal vestibule
are statistically significant (p<0.001);
differences between depigmentation and stenosis
are statistically significant (p<0.001);
differences between depigmentation and vulvar pruritus
are statistically insignificant (р > 0.3).
Как видно из таблицы 2, полное отсутствие зуда не отметила ни одна пациентка со склерозирующим вариантом течения СЛВ, в то время как больше 2/3 исследуемых указали на наличие умеренного зуда, а 12 женщин имели тяжелый, нестерпимый зуд вульвы, значительно снижающий качество их жизни. Результаты оценки основных объективных симптомов склерозирующего варианта течения СЛВ, представленные в таблице 2, свидетельствуют о том, что депигментация кожи вульвы и промежности в той или иной степени отмечалась у всех 154 исследуемых пациенток, причем наиболее часто (почти в половине случаев) имела место умеренно выраженная депигментация, в то время как для атрофического варианта течения СЛВ данный признак не является характерным [29][30].
В то же время характерные для атрофического варианта гипоплазия/аплазия малых половых губ и клитора имели место лишь у 13 % больных с длительным течением заболевания. Атрофия же кожи вульвы почти в половине случаев склеротического варианта СЛВ имелась только в начальной стадии.
Что касается стеноза преддверия влагалища, то, как видно из таблицы 2, III степень имели только 4 пациентки из 154, в то время как у половины пациенток со склерозирующим вариантом течения СЛВ вовсе отсутствовали признаки стеноза влагалища. При этом показатель зуда вульвы при склерозирующем варианте СЛВ имеет тенденции к увеличению (p < 0,15) в сравнении с показателем атрофии вульвы и стеноза преддверия влагалища, в то время как показатель депигментации тканей вульвы статистически значимо (р < 0,001) выше показателей атрофии вульвы и стеноза.
На рисунке 2 представлены фотоизображения тканей вульвы больных со склерозирующим вариантом течения СЛВ с характерными изменениями тканей вульвы.
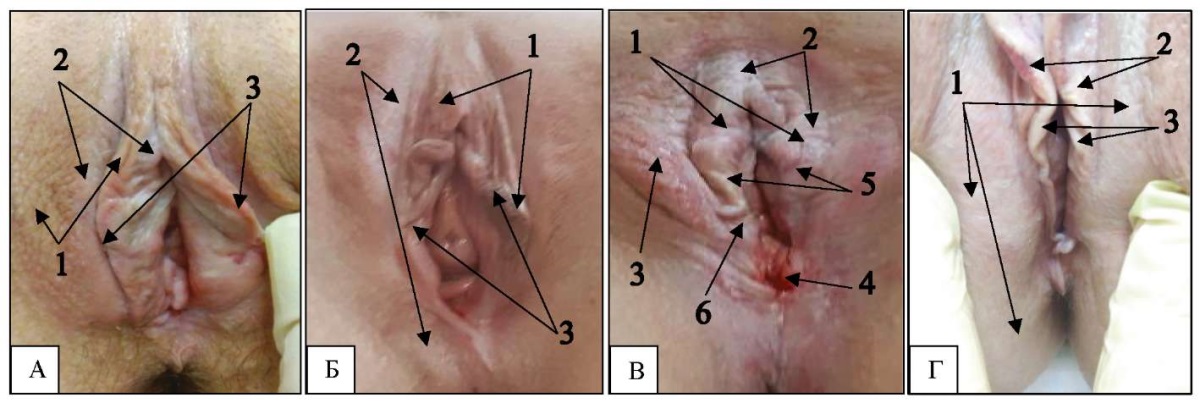
Рис. 2. Фотоизображения тканей вульвы
больных со склерозирующим вариантом течения склеротического лихена вульвы
со сходными клиническими признаками в виде депигментации,
утолщения и склероза тканей вульвы при сохранении малых половых губ
и отсутствии выраженных атрофических изменений:
А — 34 года, длительность заболевания 3 года,
умеренное утолщение и склероз кожи (1),
умеренная депигментация (2)
при отсутствии атрофии кожи и гипоплазии половых губ (3);
Б — 37 лет, длительность процесса 2 года,
незначительное утолщение (1) и депигментация (2) кожи
при отсутствии атрофии кожи и небольшой гипоплазии половых губ (3);
В — 59 лет, длительность заболевания 21 год,
выраженные склероз (1) и депигментация (2) кожи
с изменениями по типу «шагреневой» (3),
с кровоточащей трещиной кожи в области задней спайки (4),
истончения (атрофии) кожи нет,
но имеется выраженная гипоплазия малых половых губ и клитора (5)
вследствие длительности процесса
и выраженных склеротических изменений в тканях,
а также стеноз преддверия влагалища II степени (6);
Г — 35 лет, длительность процесса 8 лет,
выраженная депигментация с переходом на промежность
и перианальную область (1), утолщение и склероз кожи (2)
при отсутствии атрофии кожи
и небольшой гипоплазии малых половых губ (3)
Примечание: фотографии выполнены авторами.
Fig. 2. Photos of vulvar tissues
of patients with a sclerosing variant of vulvar lichen sclerosus
with similar clinical signs in the form of depigmentation, thickening
and sclerosis of vulvar tissues with preserved labia minora
and without marked atrophic changes:
A: 34 years old, duration of the disease — 3 years,
moderate thickening and sclerosis of the skin (1),
moderate depigmentation (2) in the absence of skin atrophy and labial hypoplasia (3);
Б: 37 years old, duration of the disease — 2 years,
slight thickening (1) and depigmentation (2) of the skin
in the absence of skin atrophy and slight labial hypoplasia (3);
B: 59 years old, duration of the disease — 21 years,
marked sclerosis (1) and depigmentation (2) of the skin with “shagreen” type changes (3),
with bleeding skin fissure in the area of the posterior commissure (4),
without thinning (atrophy) of the skin
but with marked hypoplasia of the labia minora and clitoris (5)
due to the duration of the process and pronounced sclerotic changes in the tissues,
as well as stenosis of the vaginal vestibule, grade II (6);
Г: 35 years old, duration of the disease — 8 years,
marked depigmentation with transition to the perineum and perianal area (1),
thickening and sclerosis of the skin (2)
in the absence of skin atrophy and slight hypoplasia of the labia minora (3)
Note: photos taken by the authors.
Что касается оценки уровней исследуемых цитокинов, то при склерозирующем варианте СЛВ отмечено статистически значимое отклонение показателей исследуемых цитокинов от контрольного уровня в виде значительного увеличения IL-20 (в 3,9 раза, p < 0,0001), IL-23 (в 2,1 раза, p < 0,001), TNF-α (в 2,8 раза, p < 0,009) и IFN-γ (в 1,7 раза, p < 0,01) наряду со снижением противовоспалительного IL-10 (в 2,4 раза, p < 0,01) в подгруппе В с выраженными склеротическими изменениями в тканях вульвы. В то же время уровни большинства исследуемых провоспалительных цитокинов в подгруппе А лишь имели тенденцию к увеличению, как и тенденцию к снижению противовоспалительного IL-10, однако и в этой подгруппе отмечено увеличение содержания TNF-α (в 1,4 раза, p < 0,003) относительно показателей контрольной группы (табл. 3).
Таблица 3. Содержание цитокинов в плазме крови пациенток
со склерозирующим вариантом течения склеротического лихена вульвы,
Мe (Q0,25–Q0,75)
Table 3. Cytokine content in blood plasma of patients
with a sclerosing variant of vulvar lichen sclerosus, Me (Q0.25-Q0.75)
|
Показатель |
Контрольная группа, n = 30 |
Склерозирующий вариант течения СЛВ, n = 154 |
|
|
А. Минимальные склеротические признаки, n = 59 |
В. Максимальные склеротические признаки, n = 95 |
||
|
IL-20, пкг/мл |
7,66 (1,71–20,60) |
12,46 (10,86–12,91) |
29,83 (26,68–55,43) p < 0,0001* |
|
IL-10, пкг/мл |
3,41 (3,03–3,65) |
2,875 (2,28–2,99) |
1,40 (1,22–1,60) p < 0,01 |
|
TNF-α, пкг/мл |
1,830 (1,61–1,95) |
2,65 (2,22–3,15) p < 0,03* |
5,11 (4,95–6,15) p < 0,009* |
|
IL-23, пкг/мл |
16,6 (12,98–20,71) |
16,35 (15,00–19,30) |
34,70 (27,00–58,40) p < 0,001* |
|
IFN-γ, пкг/мл |
18,17 (17,71–19,00) |
19,34 (18,62–19,91) |
30,11* (29,85–31,75) p < 0,01 |
Примечания: таблица составлена авторами;
* — статистическая значимость различий по сравнению с контролем.
Сокращения:
IL-10 — интерлейкин 10;
IL-20 — интерлейкин 20;
IL-23 — интерлейкин 23;
TNF-α — фактор некроза опухоли α;
IFN-γ — интерферон γ;
СВЛ — склеротический лихен вульвы.
Notes: compiled by the authors;
* — statistical significance of differences compared to the control group.
Abbreviations:
IL-10 — Interleukin 10;
IL-20 — Interleukin 20;
IL-23 — Interleukin 23;
TNF-α — Tumor necrosis factor α;
IFN-γ — Interferon gamma;
СЛВ — vulvar lichen sclerosus
На рисунке 3 представлены установленные в результате проведенного исследования цитокиновые биомаркеры склерозирующего варианта течения СЛВ с учетом выраженности склеротических изменений.
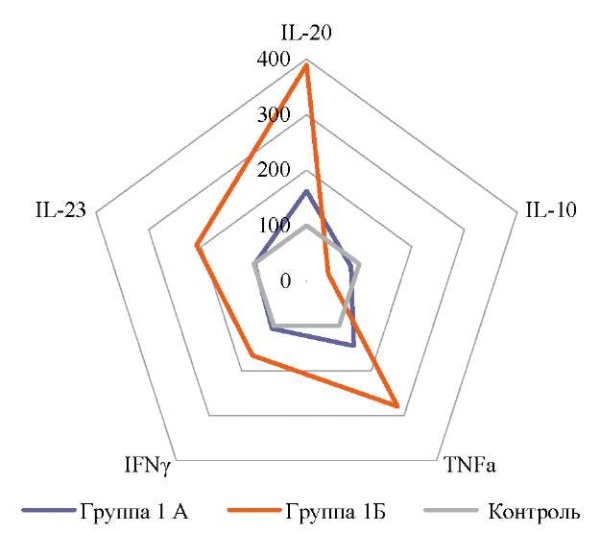
Рис. 3. Нормированные по отношению к показателю контрольной группы
(для контроля принято 100 %) цитокиновые биомаркеры
склерозирующего варианта течения склеротического лихена вульвы.
Примечание: рисунок выполнен авторами.
Сокращения:
IL-10 — интерлейкин 10;
IL-20 — интерлейкин 20;
IL-23 — интерлейкин 23;
TNF-α — фактор некроза опухоли α;
IFN-γ — интерферон γ.
Fig. 3. Cytokine biomarkers of a sclerosing variant of vulvar lichen sclerosus
normalized in relation to the control group (100% was taken for control)
Note: performed by the authors.
Abbreviations:
IL-10 — Interleukin 10;
IL-20 — Interleukin 20;
IL-23 — Interleukin 23;
TNF-α — Tumor necrosis factor α;
IFN-γ — Interferon gamma
Выбор в качестве препарата для иммунотерапии дезоксирибонуклеата натрия обоснован его иммунорегуляторной способностью3 [31], выраженными репаративными свойствами [32–34], а также отсутствием, согласно официальной инструкции, противопоказаний в виде аутоиммунных заболеваний. Через 1 месяц после проведенной иммунотерапии проводилось повторное исследование содержания цитокинов в плазме крови с целью оценки ее иммунологической эффективности (табл. 4).
Таблица 4. Иммунологическая эффективность дезоксирибонуклеата натрия
у пациенток со склерозирующим вариантом течения склеротического лихена вульвы,
Мe (Q0,25–Q0,75)
Table 4. Immunological efficacy of sodium deoxyribonucleate
in patients with a sclerosing variant of vulvar lichen sclerosus, Me (Q0.25–Q0.7)
|
Показатель |
Контроль n = 30 |
Склерозирующий вариант СЛВ, n = 154 |
|
|
А. Минимальные склеротические признаки, n = 59 |
В. Максимальные склеротические признаки, n = 95 |
||
|
IL-20, пкг/мл |
7,66 (1,71–20,60) |
До лечения |
|
|
12,46 (10,86–12,91) |
29,83 (26,68–55,43) p < 0,0001* |
||
|
После лечения |
|||
|
8,02 (5,43–10,65) p < 0,012**; p > 0,05*** |
10,53 (6,47–13,22) p < 0,0001**; p > 0,05*** |
||
|
IL-10, пкг/мл |
3,41 (3,03–3,65) |
До лечения |
|
|
2,875 (2,28–2,99) |
1,40 (1,22–1,60) p < 0,01* |
||
|
После лечения |
|||
|
3,63 (3,23–3,77) p > 0,05*** |
3,95 (3,55–4,87) p < 0,002**; p > 0,05*** |
||
|
TNF-α, пкг/мл |
1,830 (1,61–1,95) |
До лечения |
|
|
2,65 (2,22–3,15) p < 0,03* |
5,11 (4,95–6,15) p < 0,009* |
||
|
После лечения |
|||
|
1,795 (1,478–2,060) p > 0,05*** |
2,0 (1,85–3,06) p < 0,002**; p > 0,05*** |
||
|
IL-23, пкг/мл |
16,6 (12,98–20,71) |
До лечения |
|
|
16,35 (15,00–19,30) |
34,70 (27,0–58,4) p < 0,001*; |
||
|
После лечения |
|||
|
16,74 (12,00–19,70) p > 0,05*** |
20,30 (15,0–31,2) p < 0,012**; p < 0,01* |
||
|
IFN-γ, пкг/мл |
18,17 (17,71–19,00) |
До лечения |
|
|
19,34 (18,62–19,91) |
30,11 (29,85–31,75) p < 0,01* |
||
|
После лечения |
|||
|
19,08 (17,66–19,24) p > 0,05*** |
17,95 (17,06–19,10) p < 0,002**; p > 0,05*** |
||
Примечание: таблица составлена авторами;
* — статистическая значимость различий по сравнению с контролем;
** — статистическая значимость различий
по сравнению с уровнем цитокинов до лечения;
*** отсутствие статистической значимости по сравнению с контролем.
Сокращения:
IL-10 — интерлейкин 10;
IL-20 — интерлейкин 20;
IL-23 — интерлейкин 23;
TNF-α — фактор некроза опухоли α;
IFN-γ — интерферон γ;
СВЛ — склеротический лихен вульвы.
Note: compiled by the authors;
* — statistical significance of differences compared to the control;
** — statistical significance of differences
compared to the level of cytokines before treatment;
*** — lack of statistical significance compared to the control.
Abbreviations:
IL-10 — Interleukin 10;
IL-20 — Interleukin 20;
IL-23 — Interleukin 23;
TNF-α — Tumor necrosis factor α;
IFN-γ — Interferon gamma;
СЛВ — vulvar lichen sclerosus
Из таблицы 4 видно, что после проведенной иммунотерапии у больных склерозирующим вариантом СЛВ установлено снижение относительно исходных показателей уровня IL-20 в 2,8 раза (p < 0,0001), TNF-α в 2,5 раза (p < 0,002), IL-23 в 1,7 раза (p < 0,012) и IFN-γ в 1,6 раза (p < 0,002) в подгруппе А с максимально выраженными склеротическими изменениями тканей вульвы, а также значимое снижение уровня IL-20 в 1,5 раза (p < 0,012) и TNF-α в 1,5 раза (p < 0,03) в подгруппе В с минимально выраженными склеротическими изменениями. В то же время отмечено значимое увеличение содержания противовоспалительного IL-10 в 2,5 раза (p < 0,002) в подгруппе А и тенденция к увеличению данного противовоспалительного цитокина в подгруппе В относительно исходных показателей до иммунотерапии. При этом статистически значимых различий между уровнем IL-20, IL-10, TNF-α и IFN-γ в группе больных со склерозирующим вариантом СЛВ (обе подгруппы) после иммунотерапии и в группе контроля установлено не было (р > 0,05), что свидетельствует о вхождении данных показателей в пределы референсных значений после проведенной иммунотерапии. Что же касается провоспалительного IL-23, уровень которого до лечения имел выраженную тенденцию к увеличению в подгруппе с выраженными склеротическими изменениями (в 1,7 раза, p < 0,012), то после проведенной иммунотерапии, несмотря на тенденцию к снижению (p < 0,012), уровень цитокина все же остался значимо более высоким относительно группы контроля (p < 0,01).
Кроме иммунологической оценки, проводилась также оценка клинической эффективности иммунотерапии в отношении зуда вульвы и поверхностной вульводинии (табл. 5 и 6).
Таблица 5. Распределение наличия и тяжести зуда вульвы у больных
со склерозирующим вариантом течения склеротического лихена вульвы
до и после иммунотерапии
Table 5. Distribution of presence and severity of vulvar pruritus in patients
with a sclerosing variant of vulvar lichen sclerosus before and after immune therapy
|
Характеристика зуда вульвы |
Количество больных склерозирующим вариантом СЛВ, n (%) |
|
До лечения |
|
|
Легкий зуд (0 баллов) |
39 (25,3 %) |
|
Умеренный зуд (1 б.) |
103 (66,9 %) |
|
Тяжелый зуд (2 б.) |
12 (7,8 %) |
|
Нет зуда (3 б.) |
0 |
|
Всего |
154 |
|
Мe (Q0,25–Q0,75) |
2,00 (1,25–2,00) |
|
После лечения |
|
|
Легкий зуд |
21 (13,6 %) |
|
Умеренный зуд |
7 (4,5 %) |
|
Тяжелый зуд |
0 (0) |
|
Нет зуда |
126 (81,8 %) |
|
Всего |
154 |
|
Мe (Q0,25–Q0,75) |
0,00 (0,00–0,00) (р < 0,001) |
Примечание: таблица составлена авторами.
Сокращение: СВЛ — склеротический лихен вульвы.
Note: compiled by the authors.
Abbreviation: СЛВ — vulvar lichen sclerosus
Таблица 6. Результаты оценки выраженности поверхностной вульводинии
у пациенток со склерозирующим вариантом течения склеротического лихена вульвы
до и после иммунотерапии
Table 6. Results of assessing the severity of superficial vulvodynia
in patients with a sclerosing variant of vulvar lichen sclerosus
before and after immune therapy
|
Выраженность вульводинии (в баллах) |
Количество больных склерозирующим вариантом СЛВ, n (%) |
|
До лечения |
|
|
«0» — нет боли |
58 (37,7 %) |
|
«1–3» |
45 (29,2 %) |
|
«4–7» |
19 (12,3 %) |
|
«8–10» |
32 (20,8 %) |
|
Мe (Q0,25–Q0,75) |
2,00 (0,00–5,00) |
|
После лечения |
|
|
«0» — нет боли |
137 (88,9 %) |
|
«1–3» |
15 (9,7± %) |
|
«4–7» |
2 (1,3 %) |
|
«8–10» |
0 (0 %) |
|
Мe (Q0,25–Q0,75) |
0,00 (0,00–0,00) (р = 0,001) |
|
Всего |
154 |
Примечание: таблица составлена авторами.
Сокращение: СВЛ — склеротический лихен вульвы.
Note: compiled by the authors. Abbreviation:
СЛВ — vulvar lichen sclerosus
Как видно из таблицы 5, у больных склерозирующим вариантом СЛВ после проведенной иммунотерапии отмечено статистически значимое (p < 0,001) снижение количества жалоб на зуд вульвы в сравнении с исходными показателями. При этом важно отметить отсутствие зуда вульвы после иммунотерапии у 81,8 % пациенток со склерозирующим вариантом СЛВ, в то время как до лечения не было ни одной больной без подобной жалобы. Причем после лечения критериев тяжелого зуда также не отметила ни одна пациентка, а количество больных с умеренным зудом снизилось в 14,7 раза.
Что же касается поверхностной вульводинии, то в отношении данного симптома заболевания также была отмечена значимая клиническая эффективность проведенной иммунотерапии в виде снижения выраженности вульводинии у больных склерозирующим вариантом СЛВ (табл. 6).
Дополнительные результаты исследования
Дополнительных результатов в ходе исследования выявлено не было.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Для больных со склерозирующим вариантом течения склеротического лихена вульвы более характерна выраженная депигментация на фоне склероза и утолщения кожи вульвы и промежности в сравнении с атрофией кожи вульвы. В то же время стеноз преддверия влагалища у больных склерозирующим вариантом СЛВ либо отсутствует (51,3 %), либо преимущественно соответствует I степени и менее характерен, чем депигментация и даже атрофия кожи. Из субъективных признаков — наиболее характерен выраженный зуд вульвы при отсутствии либо умеренно выраженной (68,1 %) вульводинии (в отличие от атрофического варианта СЛВ) [29].
Полученные отклонения в цитокиновом статусе во многом объясняют особенности клинического течения склерозирующего варианта СЛВ. Так, иммунологическое исследование показало статистически значимое увеличение уровня провоспалительных цитокинов — IL-20 (p < 0,0001), IL-23 (p < 0,0001), IFN-γ (p < 0,03), TNF-α (p < 0,009) относительно группы контроля у пациенток с максимальными склеротическими изменениями в тканях наряду со статистически значимым (p < 0,01) снижением уровня противовоспалительного IL-10. У больных с минимальными склеротическими изменениями статистически значимое увеличение относительно контрольной группы отмечено только в отношении TNF-α (p < 0,03), в то время как остальные противовоспалительные цитокины лишь имели тенденцию к увеличению.
Обращает на себя внимание статистически значимое (p < 0,0001) увеличение IL-20, принимающего непосредственное участие в репарации эпителия при воспалительных процессах, при значительных склеротических процессах в тканях вульвы, что можно объяснить известной способностью данного цитокина при его гиперэкспрессии подавлять ангиогенез, индуцировать гиперпролиферацию кератиноцитов с нарушением их эпидермальной дифференцировки и поддерживать аутоиммунное воспаление [20]. Статистически значимое (в 2,7 раза, p < 0,0001) возрастание концентрации IL-23 в подгруппе В также свидетельствует о его влиянии на выраженность склероза вульвы и подтверждает высокую активность аутоиммунного воспаления [21]. В литературе имеются сведения о низком уровне содержания IL-10 при СЛВ [5], однако в нашем исследовании уточняется клинический вариант (склерозирующий), сопровождающийся данными изменениями IL-10, снижение которого максимально при выраженных склеротических процессах в тканях вульвы.
Иммунологическая эффективность дезоксирибонуклеата натрия подтверждена статистически значимым относительно исходных показателей снижением уровня IL-20 (p < 0,0001), IFN-γ и TNF-α (p < 0,002), IL-23 (p < 0,012) с отсутствием после лечения статистических различий с показателями контрольной группы (за исключением IL-23, уровень которого после терапии хоть снизился, но остался статистически выше (p < 0,01) показателя контрольной группы). Клиническая эффективность иммунотерапии подтверждена статистически значимым (p < 0,001) снижением выраженности вульводинии и зуда вульвы после проведенного лечения.
Ограничения исследования
Не выявлены.
Интерпретация результатов исследования
Отсутствие общепринятой классификации СЛВ, как и неоднозначность его номенклатурной принадлежности, а также назначение терапии заболевания без учета особенностей его клинического течения и иммунных нарушений, лежащих в основе патологических процессов, обуславливают недостаточную его диагностику и эффективность лечения [1][4]. Современные сведения о состоянии цитокинового статуса у больных СЛВ весьма ограничены и не учитывают особенности его клинического течения, в то время как довольно большое количество научных работ подтверждают значимость цитокинового баланса в развитии таких аутоиммунных заболеваний кожи, как псориаз, склеродермия и др. [5][35][36]. Полученные в ходе исследования результаты указывают на рациональность выделения клинических вариантов течения СЛВ, отличающихся не только наличием и выраженностью объективных и субъективных признаков (в случае со склерозирующим вариантом СЛВ — преобладание зуда вульвы, склероза и депигментации кожи вульвы над вульводинией, атрофией и гипоплазией вульвы), но и особенностями показателей ряда цитокинов, активно участвующих в процессах репарации и иммунного воспаления (IFN-γ, IL-23, IL-20, TNF-α, IL-10).
Так, установлено, что при склерозирующем варианте СЛВ ключевую роль в возникновении и прогрессии аутоиммунного воспаления и склеротических изменений кожи вульвы и промежности могут играть IL-23 и IL-20, способные в высоких концентрациях вызывать гиперпролиферацию кератиноцитов и поддерживать активность аутоиммунного воспалительного процесса СЛВ [20][21]. Учитывая собственные и общеизвестные данные о том, что выраженность склероза тканей вульвы зачастую определяется длительностью заболевания [1][4][37], можно объяснить отсутствие или лишь тенденцию к увеличению содержания относительно контроля изучаемых провоспалительных цитокинов в крови больных с минимальными (начальными) проявлениями склероза тканей, в то время как при выраженном склерозе имеется статистически значимое увеличение провоспалительных цитокинов наряду со снижением содержания противовоспалительного IL-10, что способствует поддержанию и прогрессии аутоиммунного воспаления, гипепролиферации и склероза тканей вульвы. Данные клинико-иммунологические особенности склерозирующего варианта СЛВ обосновывают применение у больных дезоксирибонуклеата натрия, обладающего иммунорегуляторной активностью [31], что было подтверждено результатами проводимого исследования в виде отсутствия через месяц иммунотерапии статистически значимых различий между уровнями цитокинов у больных СЛВ и женщин из контрольной группы (за исключением IL-23, исходно значимо высокого в подгруппе с выраженными склеротическими изменениями, уровень которого после иммунотерапии снизился, но остался более высоким относительно группы контроля (p < 0,01)). Не менее важным позитивным результатом иммунотерапии явилось статистически значимое клиническое улучшение в отношении зуда вульвы и поверхностной вульводинии у больных со склерозирующим вариантом СЛВ.
ЗАКЛЮЧЕНИЕ
Таким образом, для склерозирующего варианта течения СЛВ статистически значимо (p < 0,001) более характерна выраженная депигментация кожи с ее склерозом и утолщением в сравнении с атрофией вульвы, что отличает его от других вариантов течения (атрофического и склероатрофического). При этом стеноз преддверия влагалища либо отсутствует (51,3 %), либо преимущественно (38,8 %) соответствует I степени и менее характерен, чем депигментация и даже атрофия кожи. Среди субъективных симптомов характерен выраженный зуд вульвы при отсутствии либо умеренно выраженной (68,1 %) вульводинии. Отклонения в цитокиновом статусе при данном варианте течения СЛВ указывают на статистически значимое увеличение уровня провоспалительных цитокинов IL-20 (p < 0,0001), IL-23 (p < 0,0001), IFN-γ (p < 0,03), TNF-α (p < 0,009) относительно группы контроля у больных с максимальными склеротическими изменениями в тканях наряду со статистически значимым (p < 0,01) снижением уровня противовоспалительного IL-10, что подтверждает участие цитокинов в развитии и прогрессе фиброза и склероза тканей вульвы больных с данным вариантом течения лихена, а также обосновывает проведение иммунотерапии, направленной на нормализацию показателей цитокинового статуса.
Полученные данные подтверждают клинико-иммунологическую эффективность иммунотерапии обострения склерозирующего варианта течения СЛВ с применением дезоксирибонуклеата натрия, кроме того, углубленное изучение иммунопатогенеза заболевания не только расширяет понимание патологических процессов, происходящих в тканях вульвы при СЛВ, но и во многом объясняет причины эффективности либо неэффективности стандартного противовоспалительного лечения, позволяет наметить новые терапевтические мишени и открывает перспективу в отношении оптимизации доступных методов диагностики и лечения СЛВ, в том числе, основанных на сочетании традиционных терапевтических методов с использованием элементов иммунокоррекции.
1. Chamli A, Souissi A. Lichen Sclerosus. 2023. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023.
2. Симбирцев А.С. Цитокины в патогенезе инфекционных и неинфекционных заболеваний человека. Медицинский академический журнал. 2013;1(3):18–41.
3. Филатов О.Ю., Кашаева О.В., Бугримов Д.Ю., Климович А.А. Морфофизиологические принципы иммунологического действия ДНК эукариот. Российский иммунологический журнал. 2013;7(4):385–390.
Список литературы
1. Lewis FM, Tatnall FM, Velangi SS, Bunker CB, Kumar A, Brackenbury F, Mohd Mustapa MF, Exton LS. British Association of Dermatologists guidelines for the management of lichen sclerosus, 2018. Br J Dermatol. 2018;178(4):839–853. https://doi.org/10.1111/bjd.16241
2. Vittrup G, Mørup L, Heilesen T, Jensen D, Westmark S, Melgaard D. Quality of life and sexuality in women with lichen sclerosus: a cross-sectional study. Clin Exp Dermatol. 2022;47(2):343–350. https://doi.org/10.1111/ced.14893
3. Солопова А.Г., Ачкасов Е.Е., Макацария А.Д., Москвичева В.С., Иванов А.Е. Психоэмоциональный портрет пациенток со склерозирующим лихеном вульвы. Акушерство, Гинекология и Репродукция. 2020;14(2):203–210. https://doi.org/10.17749/2313-7347/ob.gyn.rep.2020.106
4. Pérez-López FR, Vieira-Baptista P. Lichen sclerosus in women: a review. Climacteric. 2017;20(4):339–347. https://doi.org/10.1080/13697137.2017.1343295
5. Tran DA, Tan X, Macri CJ, Goldstein AT, Fu SW. Lichen Sclerosus: An autoimmunopathogenic and genomic enigma with emerging genetic and immune targets. Int J Biol Sci. 2019;15(7):1429–1439. https://doi.org/10.7150/ijbs.34613
6. Campanati A, Martina E, Offidani A. The Challenge Arising from New Knowledge about Immune and Inflammatory Skin Diseases: Where We Are Today and Where We Are Going. Biomedicines. 2022;10(5):950. https://doi.org/10.3390/biomedicines10050950
7. Oyama N, Hasegawa M. Lichen Sclerosus: A Current Landscape of Autoimmune and Genetic Interplay. Diagnostics (Basel). 2022;12(12):3070. https://doi.org/10.3390/diagnostics12123070
8. Marfatia Y, Surani A, Baxi R. Genital lichen sclerosus et atrophicus in females: An update. Indian J Sex Transm Dis AIDS. 2019;40(1):6–12. https://doi.org/10.4103/ijstd.IJSTD_23_19
9. Haefner HK, Welch KC, Rolston AM, Koeppe ES, Stoffel EM, Kiel MJ, Berger MB. Genomic Profiling of Vulvar Lichen Sclerosus Patients Shows Possible Pathogenetic Disease Mechanisms. J Low Genit Tract Dis. 2019;23(3):214–219. https://doi.org/10.1097/LGT.0000000000000482
10. Guarneri F, Giuffrida R, Di Bari F, Cannavò SP, Benvenga S. Thyroid Autoimmunity and Lichen. Front Endocrinol (Lausanne). 2017;8:146. https://doi.org/10.3389/fendo.2017.00146
11. van der Meijden WI, Boffa MJ, Ter Harmsel WA, Kirtschig G, Lewis FM, Moyal-Barracco M, Tiplica GS, Sherrard J. 2016 European guideline for the management of vulval conditions. J Eur Acad Dermatol Venereol. 2017;31(6):925–941. https://doi.org/10.1111/jdv.14096
12. Krapf JM, Mitchell L, Holton MA, Goldstein AT. Vulvar Lichen Sclerosus: Current Perspectives. Int J Womens Health. 2020;12:11–20. https://doi.org/10.2147/IJWH.S191200
13. Doulaveri G, Armira K, Kouris A, Karypidis D, Potouridou I. Genital vulvar lichen sclerosus in monozygotic twin women: a case report and review of the literature. Case Rep Dermatol. 2013;5(3):321–325. https://doi.org/10.1159/000356775
14. Magro CM, Kalomeris TA, Mo JH, Rice M, Nuovo G. Lichen sclerosus: A C5B-9 mediated chronic microvascular injury syndrome potentially reflective of common adult comorbidities. Ann Diagn Pathol. 2023;63:152098. https://doi.org/10.1016/j.anndiagpath.2022.152098
15. Khan Mohammad Beigi P. The Immunogenetics of Morphea and Lichen Sclerosus. Adv Exp Med Biol. 2022;1367:155–172. https://doi.org/10.1007/978-3-030-92616-8_7
16. Terlou A, Santegoets LA, van der Meijden WI, Heijmans-Antonissen C, Swagemakers SM, van der Spek PJ, Ewing PC, van Beurden M, Helmerhorst TJ, Blok LJ. An autoimmune phenotype in vulvar lichen sclerosus and lichen planus: a Th1 response and high levels of microRNA-155. J Invest Dermatol. 2012;132(3 Pt 1):658–666. https://doi.org/10.1038/jid.2011.369
17. Жаров А.В., Колесникова Е.В., Пенжоян Г.А., Аникина Г.А. Варианты клинического течения склеротического лишая наружных половых органов у женщин. Российский вестник акушера-гинеколога. 2022;22(5):92–99. https://doi.org/10.17116/rosakush20222205192
18. Rutz S, Wang X, Ouyang W. The IL-20 subfamily of cytokines--from host defence to tissue homeostasis. Nat Rev Immunol. 2014;14(12):783–795. https://doi.org/10.1038/nri3766
19. Hanakawa S, Kitoh A, Shibuya R, Dainichi T, Nomura T, Honda T, Egawa G, Otsuka A, Nakajima S, Fujita M, Kabashima K. Percutaneous sensitization is limited by in situ inhibition of cutaneous dendritic cell migration through skin-resident regulatory T cells. J Allergy Clin Immunol. 2019;144(5):1343–1353.e8. https://doi.org/10.1016/j.jaci.2019.05.033
20. Xu X, Prens E, Florencia E, Leenen P, Boon L, Asmawidjaja P, Mus AM, Lubberts E. Interleukin-17A Drives IL-19 and IL-24 Expression in Skin Stromal Cells Regulating Keratinocyte Proliferation. Front Immunol. 2021;12:719562. https://doi.org/10.3389/fimmu.2021.719562
21. Yoon J, Leyva-Castillo JM, Wang G, Galand C, Oyoshi MK, Kumar L, Hoff S, He R, Chervonsky A, Oppenheim JJ, Kuchroo VK, van den Brink MR, Malefyt Rde W, Tessier PA, Fuhlbrigge R, Rosenstiel P, Terhorst C, Murphy G, Geha RS. IL-23 induced in keratinocytes by endogenous TLR4 ligands polarizes dendritic cells to drive IL-22 responses to skin immunization. J Exp Med. 2016;213(10):2147–2166. https://doi.org/10.1084/jem.20150376
22. Wang P, Chan WK, Wang J, Yang Z, Wang Y. Role of IL-22 in intestinal microenvironment and potential targeted therapy through diet. Immunol Res. 2023;71(2):121–129. https://doi.org/10.1007/s12026-022-09325-5
23. Christodoulou C, Choy EH. Joint inflammation and cytokine inhibition in rheumatoid arthritis. Clin Exp Med. 2006;6(1):13–19. https://doi.org/10.1007/s10238-006-0088-5. PMID: 16550339
24. Fröhlich E, Wahl R. Thyroid Autoimmunity: Role of Anti-thyroid Antibodies in Thyroid and Extra-Thyroidal Diseases. Front Immunol. 2017;8:521. https://doi.org/10.3389/fimmu.2017.00521
25. Федоренко Т.В., Колесникова Н.В., Пашкова И.А. Ранние цитокиновые предикторы острого отторжения трансплантата почки. Российский иммунологический журнал. 2019;13(22):590–592. https://doi.org/10.31857/S102872210006984-7
26. Konrad RJ, Higgs RE, Rodgers GH, Ming W, Qian YW, Bivi N, Mack JK, Siegel RW, Nickoloff BJ. Assessment and Clinical Relevance of Serum IL-19 Levels in Psoriasis and Atopic Dermatitis Using a Sensitive and Specific Novel Immunoassay. Sci Rep. 2019;9(1):5211. https://doi.org/10.1038/s41598-019-41609-z
27. Патрушев А.В., Самцов А.В., Сухарев А.В. Особенности цитокинового профиля и результативность санации очагов хронической инфекции у больных псориазом. Вестник дерматологии и венерологии. 2021;97(2):32–40. https://doi.org/10.25208/vdv1200
28. Euasobhon P, Atisook R, Bumrungchatudom K, Zinboonyahgoon N, Saisavoey N, Jensen MP. Reliability and responsivity of pain intensity scales in individuals with chronic pain. Pain. 2022;163(12):e1184–e1191. https://doi.org/10.1097/j.pain.0000000000002692
29. Колесникова Е.В., Жаров А.В., Пенжоян Г.А., Мингалева Н.В. Подходы к ведению пациенток с атрофическим вариантом течения склеротического лихена вульвы. Гинекология. 2022;24(5):362–368. https://doi.org/10.26442/20795696.2022.5.201898
30. Mashayekhi S, Flohr C, Lewis FM. The treatment of vulval lichen sclerosus in prepubertal girls: a critically appraised topic. Br J Dermatol. 2017;176(2):307–316. https://doi.org/10.1111/bjd.15202
31. Русинова Т.В., Чудилова Г.А., Колесникова Н.В. Сравнительная оценка иммунотропных эффектов in vitro дерината и синтетического агониста tlr9 на рецепторную функцию нейтрофильных гранулоцитов и моноцитов в норме и при инфекционном процессе. Кубанский научный медицинский вестник. 2016;(5):94–97. https://doi.org/10.25207/1608-6228-2016-5-94-97
32. Носик Д.Н., Калнина Л.Б., Лобач О.А., Чатаева М.С., Бережная Е.В., Бочкова М.С., Киселева И.А., Селимова Л.М., Носик Н.Н. Противовирусная и вирулицидная активность дезоксирибонуклеата натрия и его комплекса с железом в отношении вирусов разных царств и семейств. Вопросы вирусологии. 2022;67(6):506–515. https://doi.org/10.36233/0507-4088-148
33. Hsu WL, Lu JH, Noda M, Wu CY, Liu JD, Sakakibara M, Tsai MH, Yu HS, Lin MW, Huang YB, Yan SJ, Yoshioka T. Derinat Protects Skin against Ultraviolet-B (UVB)-Induced Cellular Damage. Molecules. 2015;20(11):20297–20311. https://doi.org/10.3390/molecules201119693
34. Zhou X, Chen Y, Cui L, Shi Y, Guo C. Advances in the pathogenesis of psoriasis: from keratinocyte perspective. Cell Death Dis. 2022;13(1):81. https://doi.org/10.1038/s41419-022-04523-3
35. Kang SY, Um JY, Chung BY, Lee SY, Park JS, Kim JC, Park CW, Kim HO. Moisturizer in Patients with Inflammatory Skin Diseases. Medicina (Kaunas). 2022;58(7):888. https://doi.org/10.3390/medicina58070888
36. Соколова А.В., Аполихина И.А., Зайцев Н.В., Чернуха Л.В. Клинико-морфологические стадии склерозирующего лихена вульвы. Гинекология. 2020;22(4):22–27. https://doi.org/10.26442/20795696.2020.4.200278
Об авторах
Е. В. КолесниковаРоссия
Колесникова Екатерина Викторовна— кандидат медицинских наук, доцент кафедры акушерства, гинекологии и перинатологии факультета повышения квалификации и профессиональной переподготовки специалистов
ул. им. Митрофана Седина, д. 4, г. Краснодар, 350055
А. В. Жаров
Россия
Жаров Александр Владимирович — доктор медицинских наук, профессор, профессор кафедры акушерства, гинекологии и перинатологии факультета повышения квалификации и профессиональной переподготовки специалистов федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации; врач-онколог отделения оперативной гинекологии государственного бюджетного учреждения здравоохранения «Краевая клиническая больница № 2» Министерства здравоохранения Краснодарского края
ул. им. Митрофана Седина, д. 4, г. Краснодар, 350055
ул. Красных Партизан, д. 6, к. 2, г. Краснодар, 350012
М. А. Пенжоян
Россия
Пенжоян Милена Александровна — кандидат медицинских наук, ассистент кафедры акушерства, гинекологии и перинатологии факультета повышения квалификации и профессиональной переподготовки специалистов
ул. им. Митрофана Седина, д. 4, г. Краснодар, 350055
Д. И. Дуплеева
Россия
Дуплеева Дарья Игоревна — врач-терапевт
ул. Красных Партизан, д. 555, 350012, г. Краснодар
Дополнительные файлы
Рецензия
Для цитирования:
Колесникова Е.В., Жаров А.В., Пенжоян М.А., Дуплеева Д.И. Иммунопатогенез и иммунотерапия склерозирующего варианта течения склеротического лихена вульвы: проспективное когортное исследование. Кубанский научный медицинский вестник. 2023;30(5):41-53. https://doi.org/10.25207/1608-6228-2023-30-5-41-53
For citation:
Kolesnikova E.V., Zharov A.V., Penzhoyan M.A., Dupleeva D.I. Immune pathogenesis and immune therapy of a sclerosing variant of vulvar lichen sclerosus: a prospective cohort study. Kuban Scientific Medical Bulletin. 2023;30(5):41-53. (In Russ.) https://doi.org/10.25207/1608-6228-2023-30-5-41-53








































