Перейти к:
Морфологическая оценка экспрессии факторов ангиогенеза в опухоли и микроокружении при фиброаденоме и протоковой карциноме молочной железы: наблюдательное когортное исследование
https://doi.org/10.25207/1608-6228-2024-31-5-26-40
Аннотация
Введение. Ангиогенезу принадлежит решающая роль в прогрессировании рака молочной железы. Определение и изучение ключевых звеньев этого процесса представляет большой интерес в понимании биологии опухоли, поскольку исследования нацелены не только на ее фенотип, но и на особенности ее микроокружения. Исследования динамики экспрессии факторов, участвующих в ангиогенезе, иммуногистохимическими методами представляют ценность как для оценки традиционных химиотерапевтических возможностей, так и для определения новых мишеней в таргетной терапии рака молочной железы. Цель исследования — изучить ангиогенез при протоковой карциноме молочной железы путем оценки экспрессии сосудистого эндотелиального фактора роста, ангиопоэтина 2 и фактора гипоксии альфа на фоне различных терапевтических стратегий. Методы. Проведено наблюдательное когортное исследование биопсийного материала пациенток с верифицированным диагнозом «фиоброаденома» и «протоковая карцинома молочной железы», жительниц Республики Крым, обратившихся в онкологические стационары г. Симферополя за период с января 2021 по январь 2023 года. Исследованы срезы опухолевого материала, ткани молочной железы 68 пациенток с верифицированными диагнозами «протоковая карцинома» и «фиброаденома» (средний возраст пациенток составил 65 ± 5 лет). Были сформированы следующие группы: контрольная — пациентки с фиброаденомой молочной железы (n = 20); пациенток с протоковой карциномой молочной железы (n = 48) разделили на 2 группы. Группа I — пациентки с протоковой карциномой молочной железы, не получавшие химиотерапию (n = 23). Группа II — пациентки с протоковой карциномой молочной железы, прооперированные после одного или нескольких курсов химиотерапии (n = 25). Исследовали срезы опухолевого материала, полученного из парафиновых блоков, оценивали экспрессию маркеров ангиогенеза методом иммуногистохимии с использованием первичных антител к сосудистому эндотелиальному фактору роста, ангиопоэтину 2 и фактору гипоксии альфа. Статистический анализ выполнен с помощью программы Statistica версии 10.0 (StatSoft, США). Значимыми считали отличия при вероятности ошибки р ≤ 0,05. Значение р < 0,05 считали статистически значимым для всех видов анализа. Результаты. Экспрессия факторов гипоксии и сосудистого роста достоверно отличается в обеих группах с протоковой карциномой молочной железы, а также есть отличия от контрольной группы. В группе контроля с доброкачественным процессом фактор гипоксии имеет цитоплазматическую локализацию, а в группах с протоковой карциномой молочной железы отмечена ядерная экспрессия. Установлены достоверные различия в ядерной экспрессии фактора гипоксии в группах пациенток с верифицированным протоковой карциномой молочной железы: во II группе, получавшей химиотерапию, в строме опухоли, в строме участков без опухоли. В зоне демаркации экспрессия фактора гипоксии значимо выше, чем в образцах прооперированных женщин I группы (р = 0,033; p = 0,034, p < 0,001 соответственно). В эпителии опухоли у пациенток с протоковой карциномой молочной железы сосудистый фактор роста экспрессируется достоверно интенсивнее в группе без химиотерапии, чем в группе после применения химиотерапии (p < 0,001), а в опухолевой строме, напротив: ангиопоэтин достоверно выше экспрессируется у пациенток, получавших курсы химиотерапии, чем у пациенток без лечения, как в опухолевых участках за счет эндотелия сосудов (р = 0,004), так и в условно здоровых участках молочной железы (p < 0,001). В контрольной группе, представленной фиброаденомой, экспрессия исследуемых факторов более выражена, чем в группах с протоковой карциномой молочной железы. Заключение. Полученные данные указывают на активацию процессов ангиогенеза в группе пациенток после проведенных курсов химиотерапии, о чем свидетельствует повышенная экспрессия фактора гипоксии, сосудистого эндотелиального фактора роста и ангиопоэтина. Такой результат связан с высокой распространенностью резистентных форм протоковой карциномы молочной железы в группе II нашей выборки. Изучение сигнальных путей ангиогенеза и его звеньев представляет собой ценную информацию в расширении представлений о механизмах возникновения и путях преодоления устойчивости к химиотерапии при протоковой карциноме молочной железы.
Ключевые слова
Для цитирования:
Алиев К.А., Асанова Э.Р., Макалиш Т.П., Зяблицкая Е.Ю. Морфологическая оценка экспрессии факторов ангиогенеза в опухоли и микроокружении при фиброаденоме и протоковой карциноме молочной железы: наблюдательное когортное исследование. Кубанский научный медицинский вестник. 2024;31(5):26-40. https://doi.org/10.25207/1608-6228-2024-31-5-26-40
For citation:
Aliyev K.A., Asanova E.R., Makalish T.P., Zyablitskaya E.Yu. Morphological assessment of angiogenesis factor expression in tumor and microenvironment of breast fibroadenoma and ductal carcinoma: An observational cohort study. Kuban Scientific Medical Bulletin. 2024;31(5):26-40. (In Russ.) https://doi.org/10.25207/1608-6228-2024-31-5-26-40
ВВЕДЕНИЕ
Рак молочной железы (РМЖ) признан наиболее распространенным в структуре женской онкопатологии. Согласно оценке GLOBOCAN (Global Cancer Observatory, World Health Organization), в 2022 году показатели распространенности и смертности при РМЖ продолжали занимать лидирующие позиции1 [1]. Химиотерапия, проводимая в неоадъювантном или адъювантном режиме, считается одной из основных терапевтических стратегией при РМЖ. Однако главной причиной недостаточной эффективности такого подхода является существование резистентных форм, не поддающихся терапии. В связи с этим выявление биологических характеристик и связанных с ними механизмов устойчивости опухоли — необходимое условие оптимального клинического ведения пациенток с данной патологией2 [2].
Общепризнана роль ангиогенеза как важного события в росте, развитии, прогрессировании и метастазировании опухолей. Высокое потребление раковыми клетками кислорода и питательных веществ неизбежно приводит к их дефициту, результатом чего является гипоксия [3]. Известно, что злокачественные опухоли молочной железы содержат гетерогенно распределенные гипоксические области со средним напряжением кислорода 23–28 мм рт. ст.3, что значительно ниже, чем в нормальных тканях молочной железы. Гипоксическое микроокружение, в свою очередь, ведет к формированию «ангиогеннного фенотипа» опухоли [4]. Таким образом, опухолевое микроокружение можно охарактеризовать, как зону дефицита, где недостаток кислорода и питательных веществ запускают адаптационные процессы, ответственные за появление резистентных клеточных клонов. В процессах ангиогенеза опухоли задействовано множество факторов: регуляторных, ростовых и пр. Эти факторы могут продуцироваться как самой опухолью, так и клетками микроокружения с целью улучшения перфузии. Изучение сложных клеточных и молекулярных взаимодействий между опухолью и ее микроокружением под действием различных химиотерапевтических агентов важно для оценки эффективности проводимого лечения. А поскольку научные данные в этой теме пока фрагментарны, необходимы дальнейшие исследования таких взаимодействий на уровне различных звеньев.
Основным регуляторным белком в ответе ткани на гипоксию как ключевого стимула к ангиогенезу является фактор индуцированный гипоксией HIF-1α, который запускает действие других сосудистых факторов, среди которых фактор роста эндотелия сосудов (VEGF) и ангиопоэтин 2 (ANGР2). Таким образом, оценка экспрессии маркеров ангиогенеза в гистологическом материале при РМЖ является крайне актуальной [5]. Особый интерес представляет сравнение факторов ангиогенеза в опухолевой ткани при злокачественном и доброкачественном процессах.
Цель исследования — изучить ангиогенез при фиброаденоме и протоковой карциноме молочной железы путем оценки экспрессии сосудистого эндотелиального фактора роста, ангиопоэтина 2 и фактора гипоксии альфа на фоне различных терапевтических стратегий.
МЕТОДЫ
Дизайн исследования
Проведено наблюдательное когортное ретроспективное исследование с участием 68 женщин с верифицированным диагнозом «фиброаденома» и «протоковая карцинома молочной железы», проходивших терапию, наблюдение и обследование в специализированном медицинском учреждении.

Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами (согласно рекомендациям STROBE).
Fig. 1. Schematic diagram of the research design
Note: performed by the authors (according to STROBE recommendations).
Условия проведения исследования
Исследование было выполнено на архивном материале парафиновых блоков пациенток, проходивших лечение за период 2022–2023 гг. на базе Клинического медицинского многопрофильного центра Святителя Луки, общества с ограниченной ответственностью «Генезис» и государственного бюджетного учреждения здравоохранения Республики Крым «Крымский республиканский онкологический клинический диспансер имени В. М. Ефетова», г. Симферополь. Аналитическая часть работы проводилась на базе Центральной научно-исследовательской лаборатории ордена Трудового Красного Знамени Медицинского института имени С. И. Георгиевского федерального государственного автономного образовательного учреждения высшего образования «Крымский федеральный университет имени В. И. Вернадского».
Критерии соответствия
Критерии включения
Возраст от 36 до 75 лет, верифицированный диагноз «протоковая карцинома молочной железы» для основных групп и верифицированный диагноз «фиброаденома молочной железы» для контрольной группы; информированное добровольное согласие на участие в исследовании.
Критерии невключения
Отказ от подписания информированного согласия пациента, соматические заболевания тяжелой и средней степени в стадии декомпенсации, инфекционная патология, психические заболевания, прием блокаторов ангиогенеза.
Критерии исключения
Отказ пациента от дальнейшего участия в исследовании.
Описание критериев соответствия (диагностические критерии)
Для женщин с фиброаденомой и протоковой карциномой молочной железы — наличие верификации диагноза по данным истории болезни на основании патогистологического заключения, классы по МКБ-10 «Злокачественное новообразование молочной железы» С50 (С50.1, С50.2, С50.3, С50.4, С50.5., С50.6) и «доброкачественное новообразование молочной железы» D.24.
Подбор участников в группы
Подбор участниц исследуемых групп осуществлялся с соблюдением критериев включения. В контрольную группу вошли пациентки с фиброаденомой молочной железы (n = 20). Среди пациенток с протоковой карциномой молочной железы разделение на группы проведено на основании того, проводилась или не проводилась химиотерапия перед оперативным вмешательством. Группу I составили пациентки с протоковой карциномой молочной железы, не получавшие химиотерапию перед оперативным вмешательством (n = 23). Группа II представлена пациентками с протоковой карциномой молочной железы, которые были прооперированы после одного или нескольких курсов химиотерапии (n =25).
Пациенткам II группы была проведена химиотерапия в неоадъювантном режиме по одной из следующих схем: доцетаксел 75–100 мг/м² в 1-й день + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в 1-й день + пертузумаб 420 мг (нагрузочная доза 840 мг) в 1-й день; цикл 21 день (sh0070); гемцитабин 1000 мг/м² в 1-й, 8-й дни + цисплатин 75 мг/м² в 1-й день + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в 1-й день; цикл 21 день (sh0306.1); метотрексат 30–40 мг/м² в 1-й день; цикл 7 дней (sh0582); паклитаксел 90 мг/м² в/в в 1-й, 8-й, 15-й дни + бевацизумаб 15 мг/кг в/в в 1-й день; цикл 21 день (sh1032; sh1032.1); трастузумаб эмтанзин 3,6 мг/кг в 1-й день; цикл 21 день (sh0181); трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в 1-й день + пертузумаб 420 мг (нагрузочная доза 840 мг) в 1-й день; цикл 21 день (sh0533); паклитаксел 80 мг/м² в 1-й, 8-й, 15-й дни + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) в 1-й день + пертузумаб 420 мг (нагрузочная доза 840 мг) в 1-й день; цикл 21 день (sh0576.1).
Целевые показатели исследования
Основной показатель исследования
Иммуногистохимическая оценка уровней экспрессии факторов ангиогенеза: HIF-1α, VEGF и ANGР2 в тканях молочных желез у пациенток с протоковой карциномой молочной железы и фиброаденомой.
Дополнительные показатели исследования
Дополнительные исследования в данной работе не предусмотрены и не проводились.
Методы измерения целевых показателей
Операционный материал удаленных молочных желез фиксировали в забуференном формалине, осуществляли стандартную проводку с этапами обезвоживания, пропитки парафином и изготовления парафиновых блоков на оборудовании: процессор гистологический гибридный LOGOS (Millestone, Италия) и модульный центр для заливки Leica EG 1150 (Германия). Для анализа экспрессии исследуемых факторов из парафиновых блоков, содержащих фрагменты опухолевой ткани молочных желез, изготавливали срезы толщиной 4 мкм. Здоровая ткань железы была представлена на гистологических препаратах как внутренний контроль кнаружи от зоны демаркации. Верификацию репрезентативных участков на срезах выполняли при окраске гематоксилином и эозином, после чего на серийных срезах выполняли реакцию ИГХ (иммуногистохимическое исследование). После депарафинизации и высокотемпературной демаскировки антигена в буферных растворах материал инкубировали с первичными антителами, а затем детектировали с помощью полимерной системы детекции на основе диаминбенздина и пероксидазы хрена. Окрашивание проводили в автоматическом иммуногистостейнере BOND-MAX (Leica, Австралия). Использовали концентрированные первичные антитела к сосудистому эндотелиальному фактору роста — VEGF (Thermo Scientific, клон RB-9031-P1, разведение 1/100), ангиопоетину 2 — Angiopoetin2 (Abcam, лот 8452, разведение 1/100) и фактору гипоксии альфа — HIF-1α (Epitomics, клон ЕР118, разведение 1/100).
Окрашенные препараты сканировали на приборе AperioCS2 (Leica, Германия) и анализировали с помощью программного обеспечения Aperio Image Scope (Leica, Германия). В каждом препарате на увеличении ×40 в 10 полях зрения оценивали интенсивность реакции ИГХ в эпителиальных клетках, клетках стромы и эндотелиоцитах сосудов в участке опухоли, прилежащей к условно здоровой ткани и зоне демаркации. Оценку экспрессии VEGF и ANGP2 проводили в баллах по Allred Score [6], а для HIF-1α подсчитывали количество клеток с положительной цитоплазматической или ядерной реакцией в одном поле зрения. Шкала Allred Score применяется в клинике для определения гормонального статуса опухоли молочной железы, однако применена нами для оценки других маркеров, поскольку учитывает интенсивность окрашивания клеток и их количество. Шкала позволила оценить интенсивность окрашивания (IS) всех клеток по трехбалльной шкале от 0 до 3 баллов: 0 баллов (не окрашено), 1 балл (слабо окрашено), 2 балла (окрашено средне интенсивно) 3 балла (ярко окрашено), а также количество окрашенных клеток в процентах (PS) от общего числа клеток с градацией по шкале от 0 до 5 баллов: 0–1 % — 1 балл, 2–10 % — 2 балла, 11–30 % — 3 балла, 31–60 % — 4 балла, 61–100 % — 5 баллов. Проводилась оценка каждого участка в отдельности с последующим дифференцированным сравнением. Комплексная оценка проводилась при суммировании баллов интенсивности и числа окрашенных клеток.
Переменные (предикторы, конфаундеры, модификаторы эффекта)
Искажающим фактором, способным самостоятельно влиять на результат исследования, мог являться прием пациентками блокаторов ангиогенеза. Данный фактор был нивелирован на этапе формирования выборок за счет внесения их в состав критериев невключения.
Статистические процедуры
Принципы расчета размера выборки
Размер выборки предварительно не рассчитывали.
Статистические методы
Статистический анализ полученных результатов проведен с использованием пакета статистических программ Statistica 10.0 (StatSoft, Inc., США). Проверку на нормальность распределения признаков выполняли по методу Шапиро — Уилка. Количественные переменные представлены в виде медианы и интерквартильного размаха Me [ Q1; Q3], качественные переменные — в виде частоты встречаемости и/или процентного отношения. Межгрупповое сравнение показателей производили по критерию Манна — Уитни. Значимыми считали отличия при вероятности ошибки р ≤ 0,05. Значение р < 0,05 считали статистически значимым для всех видов анализа.
РЕЗУЛЬТАТЫ
Формирование выборки исследования
Выборка формировалась на основании наличия/отсутствия верифицированного диагноза протоковой карциномы и фиброаденомы молочной железы, а также наличия/отсутствия проведенных курсов химиотерапии у пациенток с протоковой карциномой молочной железы. Отказавшихся от участия в исследовании пациенток не было ни в одной группе.
Характеристики выборки (групп) исследования
Средний возраст пациенток всех групп составил 65 ± 5 лет. Гендерный состав представлен только женским полом (100 %).
В данной работе мы постарались оценить все участки представленного биологического материала, включая опухолевые клетки с окружающей их стромой, зону демаркации, ограничивающую опухоль, и участки условно здоровой ткани, граничащие с опухолью.
В таблице 1 приведены данные морфологической и биологической характеристик обследуемых пациенток с протоковой карциномой молочной железы4: анамнез заболевания и статус опухоли у обследуемых пациенток. Гистологически все опухоли представлены протоковой карциномой молочной железы (ПКМЖ). В группе I преобладали пациентки с опухолью, по размеру и распространению соответствующей стадии Т2 без или с метастатическим поражением лимфатических узлов (преимущественно N0-N2), что соответствует IIA–IIIA стадиям заболевания. Для трансформированных клеток чаще характерна реверсия дифференцировки степени G3 с отрицательным рецепторным статусом для ER, PR, HER2. У пациенток II группы Т2 стадия также была преобладающей внутри выборки, однако для этой группы свойственна большая вариативность в размере и распространении первичного опухолевого очага, что может быть связано с разной чувствительностью к химиотерапии. По остальным показателям (лимфогенное метастазирование, стадия болезни и степень злокачественности, рецепторный статус) группы относительно однородны.
Таблица 1. Морфологическая характеристика обследуемых пациенток с протоковой карциномой молочной железы, абс. (%)
Table 1. Morphological characteristics of the examined patients with ductal carcinoma of the breast, abs. (%)
|
Параметры |
I группа (n = 23) |
II группа (n = 25) |
||
|
абс. |
% |
абс. |
% |
|
|
Размер опухоли (по TNM) |
||||
|
T1 |
2 |
8,7 |
5 |
20,0 |
|
T2 |
18 |
78,3 |
11 |
44,0 |
|
T3 |
1 |
4,3 |
4 |
16,0 |
|
Tx |
2 |
8,7 |
5 |
20,0 |
|
Наличие регионарных метастазов (по TNM) |
||||
|
N0 |
6 |
26,1 |
5 |
20,0 |
|
N1 |
9 |
39,1 |
1 |
40,0 |
|
N2 |
7 |
30,4 |
8 |
32,0 |
|
N3 |
1 |
4,4 |
2 |
8,0 |
|
Стадия заболевания |
||||
|
IIA |
8 |
34,8 |
5 |
20,0 |
|
IIB |
7 |
30,4 |
9 |
36,0 |
|
IIIA |
7 |
30,4 |
9 |
36,0 |
|
IIIC |
1 |
4,4 |
2 |
8,0 |
|
Степень злокачественности (G) |
||||
|
G2 |
3 |
13,0 |
7 |
28,0 |
|
G3 |
20 |
87,0 |
18 |
72,0 |
|
Экспрессия рецепторов к эстрогенам (ER) |
||||
|
ER (+) |
6 |
26,1 |
6 |
24,0 |
|
ER (–) |
17 |
73,9 |
19 |
76,0 |
|
Экспрессия рецепторов к прогестерону (PR) |
||||
|
PR (+) |
5 |
78,3 |
9 |
36,0 |
|
PR (–) |
18 |
21,7 |
16 |
64,0 |
|
Рецепторы HER2 |
||||
|
HER2 (+) |
6 |
26,1 |
6 |
24,0 |
|
HER2 (–) |
17 |
73,9 |
19 |
76,0 |
Примечание: таблица выполнена авторами. Сокращения: TNM — Classification of Malignant Tumors tumor, nodus, metastasis; Т0 — нет признаков первичной опухоли; Т1 — максимальный размер опухоли не более 20 мм в наибольшем измерении; Т2 — размер опухоли более 20 мм, но менее 50 мм в наибольшем измерении; Т3 — размер опухоли более 50 мм в наибольшем измерении; Тх — данных для оценки опухоли недостаточно; N0 — нет признаков поражения метастазами регионарных лимфатических узлов; N1 — метастазы в смещаемых подмышечных лимфатических узлах (на стороне поражения); N2 — метастазы в подмышечных лимфатических узлах на стороне поражения, спаянные между собой или фиксированные либо клинически определяемые метастазы во внутренних маммарных (парастернальных) лимфатических узлах при отсутствии клинически явного поражения подмышечных лимфатических узлов; N3 — метастазы в подключичных лимфатических узлах на стороне поражения, либо клинически определяемые метастазы во внутренних маммарных (парастернальных) лимфатических узлах при наличии клинически явного поражения подмышечных лимфатических узлов, либо метастазы в надключичных лимфатических узлах на стороне поражения (независимо от состояния подмышечных и внутренних маммарных лимфатических узлов); М0 — нет признаков отдаленных метастазов; степень IIA — T0, T1, T2, N0, N1, M0; степень IIB — T2, T3, N0, N1, M0; степень IIIA — T0, T1, T2, T3, N1, N2, M0; степень IIIC — любая Т, N3, M0; G2 — умеренная степень дифференцировки ткани, 6–7 баллов по шкале SBR; G3 — низкая степень дифференцировки ткани, 8–9 баллов по шкале SBR (Scarff—Bloom—Richardson, Ноттингемская модификация); ER — рецептор к эстрогенам (estrogen receptor); PR — рецепторы к прогестерону (progesterone receptor); HER2 — human epidermal growth factor receptor 2.
Notes: the table was compiled by the authors. Abbreviations: TNM — Classification of Malignant Tumors tumor, nodus, metastasis; Т0 — no evidence of primary tumor; Т1 — maximum tumor size not exceeding 20 mm in greatest dimension; Т2 — tumor size more than 20 mm but less than 50 mm in greatest dimension; Т3 — tumor size more than 50 mm in greatest dimension; Тх — insufficient data for tumor assessment; N0 — no evidence of metastatic involvement of regional lymph nodes; N1 — metastases in movable axillary lymph nodes (on the affected side); N2 — metastases in the axillary lymph nodes on the affected side, which are either fused together or fixed, or clinically detectable metastases in the internal mammary (parasternally) lymph nodes in the absence of clinically evident involvement of the axillary lymph nodes; N3 — metastases in the supraclavicular lymph nodes on the affected side, or clinically detectable metastases in the internal mammary (parasternally) lymph nodes in the presence of clinically evident involvement of the axillary lymph nodes, or metastases in the supraclavicular lymph nodes on the affected side (regardless of the state of the axillary and internal mammary lymph nodes); М0 — no signs of distant metastases; stage IIA — T0, T1, T2, N0, N1, M0; stage IIB — T2, T3, N0, N1, M0; stage IIIA — T0, T1, T2, T3, N1, N2, M0; stage IIIC — any T, N3, M0; G2 — moderate tissue differentiation, 6–7 points on the SBR scale; G3 — poor tissue differentiation, 8–9 points on the SBR scale (Nottingham a modified, Bloom — Richardson grade); ER — estrogen receptor; PR — progesterone receptor; HER2 — human epidermal growth factor receptor 2.
Основные результаты исследования
При проведении ИГХ-исследования на образцах ткани молочной железы были получены результаты, представленные в таблицах 2–4.
Таблица 2. Экспрессия фактора HIF-1α в образцах ткани молочной железы, Mе [ Q1; Q3]
Table 2. HIF-1α expression in breast tissue samples, Me [ Q1; Q3]
|
Показатели |
Группы |
р-уровень значимости* |
||
|
контрольная (n = 20) |
I группа (n = 23) |
II группа (n = 25) |
||
|
Количество эпителиоцитов в опухоли, шт. |
- |
1,00 [ 0,00; 3,00] |
1,12 [ 0,00; 3,75] |
pII–I = 0,657 |
|
Количество клеток в строме опухоли, шт. |
- |
2,00 [ 0,00; 2,00] |
2,00 [ 1,00; 4,00] |
pII–I = 0,033 |
|
Количество эпителиоцитов в здоровой ткани, шт. |
0,00 [ 0,00; 1,75] |
0,00 [ 0,00; 1,00] |
0,00 |
pI-к = 0,453 pII–I = 0,453 |
|
Количество клеток в здоровой строме, шт. |
7,50 [ 3,25; 15,25] |
1,00 [ 0,00; 2,00] |
2,00 [ 0,00; 3,00] |
pI-к < 0,001 pII-к = 0,009 pII–I = 0,009 |
|
Количество макрофагов в зоне демаркации, шт. |
- |
0,00 [ 0,00; 1,00] |
3,50 [ 0,00; 6,75] |
pII–I< 0,001 |
Примечания: p I-к для сравнения группы I с контролем, pII-к для сравнения группы II с контролем, pII–I для сравнения I и II групп, * — по критерию Манна — Уитни.
Notes: pI-k for comparison of group I with a control, pII-k for comparison of group II with a control, pII–I for comparison of groups I and II, * — according to the Mann — Whitney test.
Фактор гипоксии HIF-1α в контрольной группе экспрессируется преимущественно в цитоплазме стромальных клеток (рис. 2 В). В группах с протоковой карциномой молочной железы он принимает ядерную локализацию. В группе I (без химиотерапии) он экспрессируется в опухолевых клетках, в строме опухолевого очага и в строме прилежащей к опухоли ткани и практически не встречается в макрофагах зоны демаркации. Во II группе пациенток (после химиотерапии) HIF-1α имеет преимущественную локализацию в ядрах клеток опухолевого микроокружения, особенно в макрофагах демаркационной зоны. Установлены достоверные различия в ядерной экспрессии HIF-1α в группах пациенток с верифицированной протоковой карциномой молочной железы: в строме опухоли и строме здоровой ткани образцов II группы (рис. 2 Б) экспрессия фактора гипоксии выше, чем в образцах I группы (рис. 2 А) (р = 0,033 и p = 0,034 соответственно), в зоне демаркации количество макрофагов с ядерной реакцией значимо выше во II группе (p < 0,001). По сравнению с контрольной группой (фиброаденома) в клетках стромы здоровой ткани экспрессия HIF-1α меньше в группах I (p < 0,001) и II (p = 0,009).
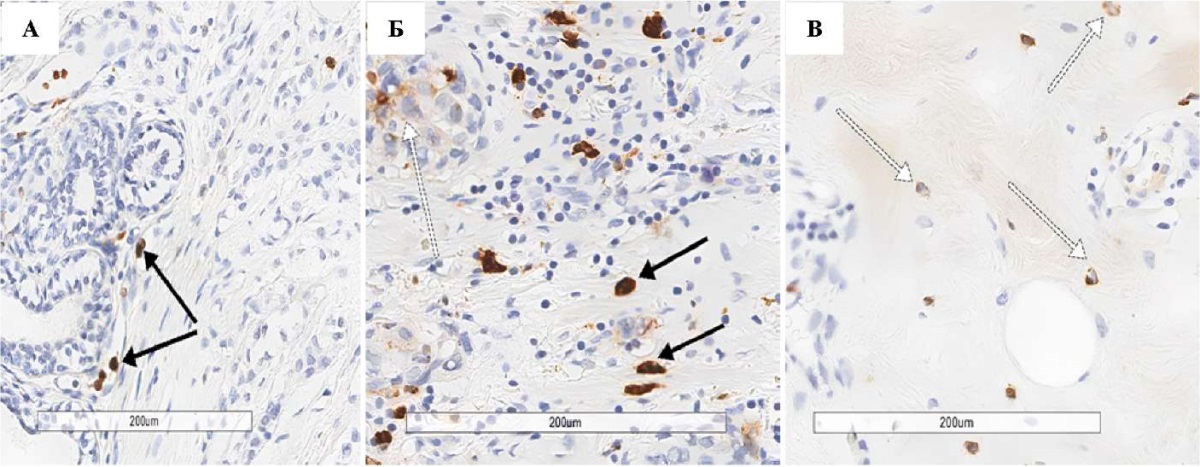
Рис. 2. Фрагменты протоковой карциномы и ткани фиброаденомы молочной железы, ИГХ-реакция с HIF-1α: А — пациентки I группы, увеличение ×200; Б — пациентки II группы, увеличение ×200; В — пациентки контрольной группы, увеличение ×200. Черная стрелка — выраженная ядерная экспрессия HIF-1α в лимфоцитах опухоли. Белая стрелка — цитоплазматическая экспрессия HIF-1α
Примечание: фотографии выполнены авторами.
Fig. 2. Fragments of ductal carcinoma and fibroadenoma tissue of the breast, IHC reaction with HIF-1α: A — patients of group I, ×200; Б — patients of group II, ×200; В — patients of the control group, ×200. Black arrow — pronounced nuclear expression of HIF-1α in tumor lymphocytes. White arrow — cytoplasmic expression of HIF-1α
Note: the photos were taken by the authors.
В целом, при сравнении исследуемых нами групп с протоковой карциномой молочной железы экспрессия HIF-1α оказалась выше в группе пациенток, получавших курсы химиотерапии, чем в группе без лечения. Однако стоит отметить, что эти различия преимущественно обусловлены наличием HIF-1α-позитивно окрашенных клеток в строме условно здоровых (неопухолевых) участков ткани молочной железы и HIF-1α-экспрессирующих макрофагов в зоне демаркации опухоли у пациенток с химиотерапией (рис. 2).
Анализ экспрессии сосудистого фактора VEGF показал статистически значимые различия как в группах с протоковой карциномой молочной железы, так и в сравнении с контрольной группой (табл. 3).
Таблица 3. Медианные значения показателей экспрессии фактора VEGF в образцах ткани молочной железы, Mе [ Q1; Q3]
Table 3. Median values of VEGF expression levels in breast tissue samples, Mе [ Q1; Q3]
|
Показатели |
Группы |
р-уровень значимости* |
||
|
контрольная (n = 20) |
I группа (n = 23) |
II группа (n = 25) |
||
|
Эпителий опухоли PS (баллы) |
- |
5,00 [ 5,00; 5,00] |
5,00 [ 1,00; 5,00] |
pII–I < 0,001 |
|
Эпителий опухоли IS (баллы) |
- |
2,00 [ 2,00; 3,00] |
1,00 [ 1,00; 1,00] |
pII–I < 0,001 |
|
Эпителий опухоли TS (баллы) |
- |
7,00 [ 7,00; 8,00] |
6,00 [ 2,00; 7,00] |
pII–I < 0,001 |
|
Эпителий здоровый PS (баллы) |
5,00 [ 5,00; 5,00] |
5,00 [ 5,00; 5,00] |
5,00 [ 4,00; 5,00] |
pII-к < 0,067 pII–I < 0,067 |
|
Эпителий здоровый IS (баллы) |
3,00 [ 3,00; 3,00] |
2,00 [ 2,00; 2,00] |
2,00 [ 2,00; 3,00] |
pI-к = 0,001 pII-к = 0,002 pII–I = 0,002 |
|
Эпителий здоровый TS (баллы) |
8,00 [ 8,00; 8,00] |
7,00 [ 6,00; 7,00] |
7,00 [ 6,00; 8,00] |
pI-к = 0,004 pII-к = 0,004 pII–I = 0,004 |
|
Количество клеток в строме опухоли, шт. |
- |
15,00 [ 9,00; 22,00] |
15,00 [ 2,00; 76,25] |
pII–I = 0,972 |
|
Количество эндотелиоцитов в сосудах опухоли, шт. |
- |
2,00 [ 0,00; 3,00] |
2,00 [ 0,00; 4,00] |
pII–I = 0,298 |
|
Cуммарно в строме опухоли (количество клеток) |
- |
16,00 [ 10,00; 26,00] |
18,00 [ 2,00; 81,00] |
pII–I = 0,916 |
|
Количество клеток в строме здоровой ткани, шт. |
17,50 [ 12,25; 18,75] |
10,00 [ 6,00; 14,00] |
12,00 [ 5,25; 19,00] |
pI-к = 0,040 pII-к = 0,044 |
|
Количество эндотелиоцитов в сосудах здоровой ткани, шт. |
5,00 [ 1,75; 8,00] |
0,00 [ 0,00; 1,00] |
1,00 [ 0,00; 6,75] |
pI-к = 0,002 pII-к = 0,001 pII–I = 0,001 |
|
Суммарно в строме здоровой ткани (кол-во клеток) |
22,00 [ 16,50; 27,50] |
11,00 [ 6,00; 15,00] |
17,00 [ 5,00; 22,00] |
pI-к = 0,008 pII-к = 0,008 pII–I = 0,008 |
Примечания: таблица составлена авторами; pI-к для сравнения группы I с контролем, pII-к для сравнения группы II с контролем, pII–I для сравнения I и II групп; * — по критерию Манна — Уитни. Сокращения: PS — процент окрашенных клеток, IS — интенсивность окрашивания, TS — суммарный показатель PS и IS по шкале Аllred Score в баллах от 0 до 8.
Notes: the table was compiled by the authors; pI-k for comparison of groupI with the control, pII-k for comparison of groupII with the control, pII–I for comparison of groups I and II; * — according to the Mann — Whitney test. Abbreviations: PS — percentage of stained cells, IS — staining intensity, TS — total score of PS and IS on the Allred Score scale, ranging from 0 to 8 points.
Сосудистый фактор роста VEGF в контрольной группе активно экспрессируется как в эпителиальных клетках паренхимы молочной железы, так и в эндотелиоцитах, но преимущественная его локализация характерна для стромальных клеток. При сравнении с контрольной группой (рис. 3 В) интенсивность экспрессии VEGF в строме здоровой ткани пациенток с протоковой карциномой молочной железы существенно ниже как в I, так и во II группе. В I группе этот маркер экспрессируется в железистом эпителии на 50 % меньше (по интенсивности реакции ИГХ), чем в ткани железы пациенток группы контроля (р = 0,001). В клетках стромы его экспрессия по сравнению с контролем также существенно меньше (р = 0,040) и практически отсутствует в эндотелиоцитах сосудов (р = 0,002) здоровой ткани. В неопухолевой ткани II группы интенсивность реакции с VEGF ниже как в железистом эпителии (р = 0,002), так и в строме (р = 0,044) и эндотелии сосудов (р = 0,001).
В эпителии опухоли у пациенток с протоковой карциномой молочной железы сосудистый фактор VEGF экспрессируется достоверно интенсивнее в группе без лекарственного лечения (рис. 3 А), чем в группе после применения химиотерапии (p < 0,001) (рис. 3 Б), а в эпителии здоровой ткани, наоборот, — ниже, чем в группе после химиотерапии (р = 0,004). Также в группе с протоковой карциномой молочной железы после химиотерапии количество эндотелиоцитов в сосудах здоровой ткани, экспрессирующих VEGF, значимо выше, чем в группе с протоковой карциномой молочной железы без химиотерапии (р = 0,017).
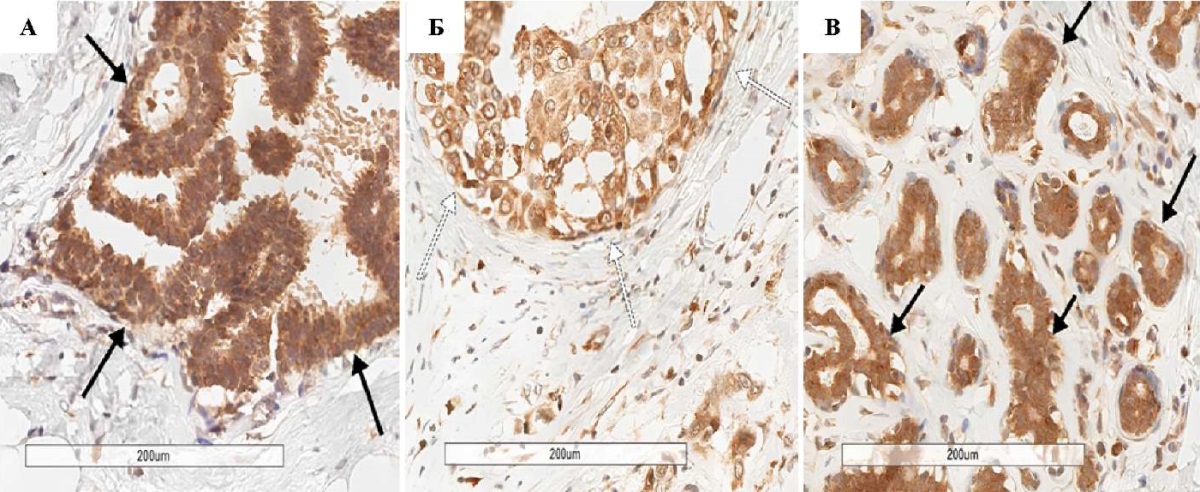
Рис. 3. Фрагменты протоковой карциномы и ткани фиброаденомы молочной железы, ИГХ-реакция с VEGF: А — пациентки I группы, увеличение ×200; Б — пациентки II группы, увеличение ×200; В — пациентки контрольной группы, увеличение ×200. Черная стрелка — высокая экспрессия VEGF в эпителиоцитах, белая стрелка — сниженная экспрессия VEGF в эпителиоцитах.
Примечание: фотографии выполнены авторами.
Fig. 3. Fragments of ductal carcinoma and fibroadenoma tissue of the breast, IHC reaction with VEGF: A — patients of group I, ×200; Б — patients of group II, ×200; В — patients of the control group, ×200. Black arrow — high expression of VEGF in epithelial cells, white arrow — reduced expression of VEGF in epithelial cells
Note: the photos were taken by the authors.
Экспрессия сосудистого фактора ANGP2 имеет статистически значимые различия в исследуемых группах (табл. 4).
Таблица 4. Медианные значения показателей экспрессии фактора ANGP2 в образцах ткани молочной железы, Mе [ Q1; Q3]
Table 4. Median values of ANGP2 expression levels in breast tissue samples, Mе [ Q1; Q3]
|
Показатели |
Группы |
р-уровень значимости* |
||
|
контрольная (n = 20) |
I группа (n = 23) |
II группа (n = 25) |
||
|
Эпителий опухоли PS (баллы) |
- |
5,00 [ 5,00; 5,00] |
5,00 [ 4,00; 5,00] |
pII–I = 0,200 |
|
Эпителий опухоли IS (баллы) |
- |
2,00 [ 1,00; 2,00] |
2,00 [ 2,00; 3,00] |
pII–I = 0,176 |
|
Эпителий опухоли TS (баллы) |
- |
7,00 [ 6,00; 7,00] |
7,00 [ 5,00; 8,00] |
pII–I = 0,017 |
|
Эпителий здоровый PS (баллы) |
5,00 [ 5,00; 5,00] |
5,00 [ 5,00; 5,00] |
4,00 [ 4,00; 5,00] |
pII-к = 0,044 pII–I = 0,044 |
|
Эпителий здоровый IS (баллы) |
3,00 [ 3,00; 3,00] |
2,00 [ 1,00; 2,00] |
2,00 [ 1,00; 2,00] |
pI-к < 0,001 pII-к < 0,001 |
|
Эпителий здоровый TS (баллы) |
8,00 [ 8,00; 8,00] |
6,00 [ 6,00; 7,00] |
6,00 [ 5,00; 7,00] |
pI-к < 0,001 pII-к < 0,001 |
|
Количество клеток в строме опухоли, шт. |
- |
18,50 [ 13,00; 27,25] |
31,00 [ 9,25; 44,25] |
pII–I = 0,202 |
|
Количество эндотелиоцитов в сосудах опухоли, шт. |
- |
3,00 [ 0,00; 10,00] |
13,00 [ 2,50; 28,50] |
pII–I = 0,004 |
|
Суммарно в строме опухоли (кол-во клеток) |
- |
23,50 [ 15,00; 34,25] |
53,00 [ 13,25; 70,75] |
pII–I = 0,031 |
|
Количество клеток в строме здоровой ткани, шт |
34,00 [ 26,25; 39,50] |
15,50 [ 11,75; 20,00] |
38,00 [ 22,75; 48,75] |
pI-к < 0,001 pII–I < 0,001 |
|
Количество эндотелиоцитов в сосудах здоровой ткани, шт. |
3,00 [ 2,00; 4,00] |
2,50 [ 0,00; 9,25] |
20,50 [ 11,50; 34,50] |
pII-к < 0,001 pII–I < 0,001 |
|
Суммарно в строме здоровой ткани (количество клеток) |
38,50 [ 27,25; 41,75] |
19,50 [ 14,50; 27,50] |
58,00 [ 33,50; 99,75] |
pI-к = 0,004 pII-к < 0,001 pII–I < 0,001 |
Примечания: p I-к для сравнения группы I с контролем, p II-к для сравнения группы II с контролем, p II–I для сравнения I и II групп; * — по критерию Манна — Уитни. Сокращения: PS — процент окрашенных клеток, IS — интенсивность окрашивания, TS — суммарный показатель PS и IS по шкале Аllred Score в баллах от 0 до 8.
Notes: pI-k for comparison of group I with a control, p II-k for comparison of group II with a control, pII–I for comparison of groups I and II, * — according to the Mann — Whitney test. Abbreviations: PS — percentage of stained cells, IS — staining intensity, TS — total score of PS and IS on the Allred Score scale, ranging from 0 to 8 points
Экспрессия сосудистого фактора ANGP2 преобладает в группе контроля в клетках стромы железы, при этом маркер экспрессируется и в эпителиальных клетках паренхимы и эндотелиоцитах сосудов, но существенно меньше. В I группе пациенток с протоковой карциномой молочной железы интенсивность экспрессии ANGP2 снижена по сравнению с контрольной группой в эпителии железы (p < 0,001), и более чем в 2 раза снижается количество стромальных клеток вне опухолевого очага (p < 0,001), экспрессирующих данный фактор роста. В группе пациенток с протоковой карциномой молочной железы после химиотерапевтического лечения экспрессия ANGP2 достоверно повышена как в строме опухоли (p < 0,001) и клетках неопухолевой стромы, так и в эндотелиоцитах здоровой ткани при сравнении с контрольной группой (p < 0,001) и группой без лечения (p = 0,004); в здоровом эпителии, напротив, показатель снижен по сравнению с контролем (p < 0,001).
В группе пациенток, которым не проводилась химиотерапия, ANGP2 экспрессируется в целом существенно меньше (рис. 4 А), чем в группе с проведенной химиотерапией (рис. 4 Б), как в строме опухоли за счет эндотелия, так и в строме и сосудах здоровых участков ткани.
Нами обнаружена достоверно бóльшая интенсивность экспрессии VEGF в эпителии опухоли в группе без лечения, чем в группе после применения химиотерапии, что свидетельствует о некотором супрессивном эффекте химиотерапии на раковые клетки. Однако в опухолевой строме количество VEGF-позитивных клеток (в т. ч. эндотелиоцитов) значимо больше в группе после химиотерапии, что является признаком «активной стромы», обеспечивающей выживание раковых клеток (рис. 4).
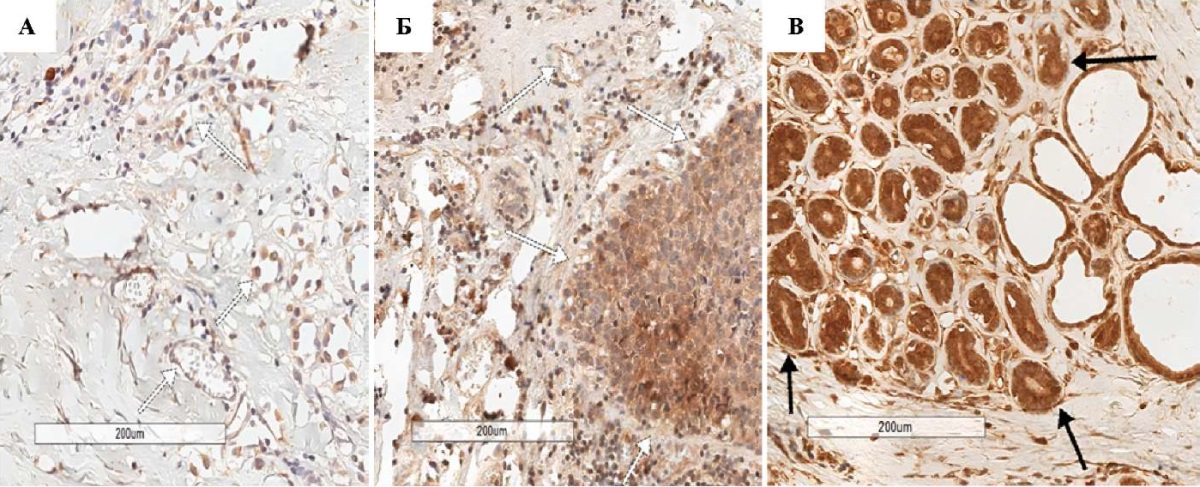
Рис. 4. Фрагменты протоковой карциномы и ткани фиброаденомы молочной железы, ИГХ-реакция с ANGP2: А — пациентки I группы, увеличение ×200; Б — пациентки II группы, увеличение ×200; В — пациентки контрольной группы, увеличение ×200. Черная стрелка — высокая экспрессия ANGP2 в эпителиоцитах, белая стрелка — сниженная экспрессия ANGP2 в эпителиоцитах.
Примечание: фотографии выполнены авторами.
Fig. 4. Fragments of ductal carcinoma and fibroadenoma tissue of the breast, IHC reaction with ANGP2: A — patients of group I, ×200; Б — patients of group II, ×200; В — patients of the control group, ×200. Black arrow — high expression of ANGP2 in epithelial cells, white arrow — reduced expression of ANGP2 in epithelial cells
Note: the photos were taken by the authors.
Проведение корреляционного анализа показало устойчивые связи между степенью экспрессии исследуемых маркеров. Так, количество позитивно окрашенных на VEGF клеток стромы опухоли имеет средние и сильные положительные связи с экспрессией HIF-1α в опухолевых клетках (r = 1,728), строме опухоли (r = 0,587) и макрофагах зоны демаркации (r = 0,511). Экспрессия HIF-1α в зоне демаркации сильно положительно коррелирует с экспрессией ANGP2 в строме и эндотелии сосудов. Для опухолевой ткани эти показатели составили, соответственно, r = 0,676 и r = 0,703, а для здоровых участков r = 0,520 и r = 0,624. Экспрессия VEGF и ANGP2 имеет сильную положительную корреляцию как по интенсивности, так и по числу окрашенных клеток в эпителии опухоли (r = 0,828) и строме опухоли (r = 0,521).
В представленной выборке экспрессия фактора VEGF при фиброаденоме достоверно выше, чем в группах с протоковой карциномой молочной железы, а HIF-1α в материале фиброаденомы экспрессируется преимущественно в строме значимо больше, чем при протоковой карциноме молочной железы, и имеет цитоплазматическую локализацию. Следует отметить, что HIF-1α в большинстве случаев экспрессируется в строме фиброаденомы очагово вокруг эпителия, что, скорее всего, связано с локальной гипоксией. ANGP2 также отличается более интенсивной экспрессией в эпителии контрольной группы (по сравнению с группами I и II) и строме (по сравнению с группой II). Таким образом, нами обнаружены выраженные корреляционные связи между степенью экспрессии основных белковых факторов, отражающих ангиогенные процессы в ткани (HIF-1α, VEGF и ANGP2) при протоковой карциноме молочной железы с химиотерапией и без нее в сравнении с аналогичными тканями без злокачественного роста. В группе пациенток, получавших курсы химиотерапии, экспрессия исследуемых сосудистых факторов достоверно выше, чем в группе без химиотерапии, а фактор гипоксии HIF-1α имеет иную локализацию. Так, ткань фиброаденомы характеризуется очаговой цитоплазматической экспрессией в клетках стромы, а при протоковой карциноме молочной железы HIF-1α экспрессируется в ядрах клеток.
Дополнительные результаты исследования
Дополнительные результаты целью исследования не предусмотрены.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
В группе пациенток, получавших курсы химиотерапии, экспрессия исследуемых сосудистых факторов достоверно выше, чем в группе без химиотерапии, фактор гипоксии HIF-1α имеет ядерную локализацию. Ткань фиброаденомы характеризуется очаговой цитоплазматической экспрессией в клетках стромы.
Ограничения исследования
Данное исследование имеет следующие ограничения: небольшой размер выборки и, следовательно, небольшая статистическая мощность; небольшое количество исследуемых сосудистых факторов, что дает ограниченные представления о процессах ангиогенеза; отсутствие данных о безрецидивной выживаемости пациенток ограничивает возможность прогностической оценки.
Интерпретация результатов исследования
Проанализировав литературу, мы обнаружили дефицит сведений о динамике экспрессии факторов ангиогенеза в опухолевой ткани под влиянием химиотерапии при РМЖ. Существуют сведения о снижении концентраций исследуемых нами факторов у пациенток во время и после химиотерапии, но эти данные преимущественно основаны на определении их уровня в крови [7–9]. В связи с этим представляет интерес изучение особенностей экспрессии сосудистых маркеров непосредственно в опухолевой ткани и ее микроокружении.
Известно, что в процессах неоваскуляризации важная роль принадлежит оси HIF/VEGF. Основным стимулом для запуска ангиогенеза является гипоксия, в результате которой стимулируется выработка множества факторов, обеспечивающих адаптацию ткани к недостатку кислорода. Ключевым регулятором клеточных ответов на гипоксию является гетеродимерный фактор транскрипции HIF-1, состоящий из двух субъединиц: кислородзависимой HIF-1α и конститутивно экспрессируемой HIF-1β. Индуцируемый гипоксией HIF-1α через взаимодействие с промоторами различных генов увеличивает продукцию белков, обеспечивающих адаптацию, в том числе ферментов гликолиза, эритропоэтина, а также факторов роста [5]. В нашем исследовании HIF-1α имеет ядерную локализацию в группах с протоковой карциномой молочной железы, а в контрольной группе, представленной фиброаденомой, данный фактор экспрессируется цитоплазматически. Такие особенности локализации связаны с тем, что в условиях гипоксии HIF-1α избегает протеосомной деградации и транслоцируется в ядро, где гетеродимеризуется с HIF-1β, тогда как при нормальных уровнях кислорода субъединица HIF-1α быстро разрушается убиквитин-протеасомной системой. Образование гетеродимера HIF-1α/HIF-1β приводит к включению биологических механизмов метаболизма, ангиогенеза, апоптоза, пролиферации и выживания клеток [10].
Существуют также исследования, в которых сообщается, что повышенная экспрессия HIF-1α связана с химиорезистентностью, а также с высоким уровнем смертности [11–13]. Так, показано, что гипоксическое микроокружение опухоли стимулирует HIF-1α-зависимую экспрессию генов, подавляющих клеточную дифференцировку, что может приводить к появлению стволовых раковых клеток, ответственных за появление устойчивого клеточного клона [14][15]. Считается, что инфильтрирующие опухоли цитотоксические Т-клетки cекретируют HIF-1α в условиях адаптации к гипоксии, обеспечивая опухолевый иммунитет [16]. Как видно из разных проанализированных литературных источников, фактор гипоксии благоприятствует адаптации и развитию опухоли.
Таким образом, наблюдаемая в нашем исследовании очаговая ядерная экспрессия HIF-1α в клетках опухоли и стромы некоторых пациенток в группе II может свидетельствовать о проявлениях резистентности к проведенной химиотерапии. Интересными являются сведения о накоплении опухоль-ассоциированных макрофагов в строме вокруг сосудов после химиотерапии, что приводит к реваскуляризации опухоли, частично за счет участия VEGF [17]. В исследованном материале присутствие активированных HIF-1α-положительных макрофагов в зоне демаркации как важных регуляторов ангиогенеза может указывать на запуск адаптационных реакций опухоли. Открытым остается вопрос о том, является ли переключение экспрессии HIF-1α в не пораженные опухолью участки проявлением механизмов «побега» опухоли от воздействия химиотерапевтических агентов. Заслуживает внимания исследование, в котором сообщается о более частой индукции ангиогенеза в здоровых областях молочной железы, прилегающих к опухоли, чем в самой опухолевой ткани [18]. Согласно этому исследованию ангиогенный переход может предшествовать морфологическим изменениям, т. е. опухолевой трансформации.
Существует и другое мнение, согласно которому стабилизация HIF-1 может оказывать защитное действие и даже снижать агрессивность опухолевых клеток, однако пути реализации такого эффекта до конца не ясны [19]. Исследований по изучению корреляции между экспрессией HIF-1α и эффективностью химиотерапии на основе таксанов (паклитаксел и доцетаксел) при РМЖ недостаточно. Однако имеются единичные данные о связи высоких уровней экспрессии HIF-1α с худшим ответом после проведенной химиотерапии на основе паклитаксела [20]. В рамках исследуемой выборки нами не выявлено явного антигипоксического эффекта при терапевтическом подходе в группе пациенток, получавших курсы химиотерапии, о чем свидетельствует стабильность HIF-1α как в опухолевых, так и в здоровых участках представленного материала.
Основным фактором, участвующим в образовании новых кровеносных и лимфатических сосудов, особенно на этапе инициации ангиогенеза, является VEGF. Опухолевые клетки, эндотелиоциты, макрофаги способны секретировать VEGF, тем самым обеспечивая рост новых сосудов в гипоксических областях опухолевой ткани для улучшения перфузии и устранения дефицита кислорода и других необходимых элементов [21]. VEGF индуцирует в эндотелиоцитах процессы пролиферации и миграции, повышает проницаемость сосудов через взаимодействие с соответствующими рецепторами на поверхности эндотелиальных клеток (VEGFR), тем самым способствуя, наряду с гипоксией и иммунной супрессией, формированию преметастатической ниши и распространению опухоли [22]. Известны некоторые данные о повышении уровня VEGF во время химиотерапии у пациенток с РМЖ и различном влиянии режимов терапии на уровни циркулирующего VEGF, но они основаны на мультиплексном иммуноанализе плазмы крови, а не на иммуногистохимическом исследовании [23]. Как видим, мнение ученых сходится на роли VEGF как инициатора неопластического ангиогенеза, связанного с неблагоприятным прогнозом.
ANGP2 считается антиангиогенным фактором, при участии которого сосуды подвергаются регрессии. Однако именно экспрессия VEGF определяет его роль в ангиогенезе. Так, низкие уровни VEGF опосредуют ANGP2-индуцированный запуск инволюции сосудов путем апоптоза, а высокие концентрации — созревание сосудов в условиях гипоперфузии [24]. ANGР2 может активироваться в результате гипоксии и запускать ангиогенез через аутокринную петлю в эндотелиальных клетках, экспрессирующих рецепторы ANGР2 и TIE2 [25]. Известно, что ANGP2 усиливает эффекты VEGF, вследствие чего контакты между эндотелиальными клетками и перицитами становятся слабее, эндотелиальные клетки приобретают способность к миграции. Многие исследования показали, что ANGP2 имеет высокий уровень экспрессии в различных опухолях и может стимулировать инвазию раковых клеток при РМЖ [26][27]. В нашей выборке экспрессия ANGР2 была наибольшей в группе пациенток, прошедших курсы химиотерапии, причем как в стромальном, так и эпителиальном компонентах, что в сочетании с высокой экспрессией VEGF в опухолевой строме свидетельствует о формировании проангиогенного фенотипа клеток микроокружения.
Поскольку контрольная группа представлена фиброаденомой и мы не можем оценивать ее как здоровую ткань, необходимо учитывать особенности ангиогенеза при фиброзных процессах. Имеется лишь небольшое количество работ, в которых оценивался уровень факторов, участвующих в ангиогенезе при фиброаденоме молочной железы, разными методами [28–30]. В этих исследованиях сообщается либо об отсутствии различий, либо о сравнительно низких уровнях HIF-1α и VEGF при фиброаденоме по сравнению с РМЖ, что указывает на меньшую выраженность гипоксии при доброкачественном заболевании молочной железы, чем при раке. Мы предполагаем, что различия между нашими данными и данными других работ могут быть связаны с неоднородной структурой «молодых» и «старых» фиброаденом, которые представлены, соответственно, преобладающим растущим эпителиальным либо фиброзным компонентом. Следовательно, эти расхождения в работах требуют проведения аналогичных исследований на большей выборке с учетом клинических характеристик опухолей и определения доли эпителиального и стромального компонентов.
Существуют исследования, в которых показаны статистически значимые связи между уровнями экспрессии факторов HIF-1α, VEGF и ANGP2 [31][32]. Мы также обнаружили сильную положительную корреляцию между экспрессией сосудистых маркеров VEGF и ANGP2. Как упоминалось выше, запуск ангиогенеза по оси ANGР2-TIE2 опосредован проангиогенными факторами, а именно VEGF. В нашем исследовании подтвердилась тесная взаимосвязь между сосудистыми факторами: в I группе более высокие уровни экспрессии VEGF в строме опухоли сопровождались, соответственно, большей экспрессией ANGР2, во II группе наблюдалась такая же зависимость, только с меньшей экспрессией. Нами получены данные, что экспрессия VEGF в клетках стромы опухоли коррелирует с экспрессией HIF-1α в опухолевых клетках и ее строме, а также в макрофагах зоны демаркации. Таким образом, мы пришли к выводу, что наблюдаемая активность микроокружения опухоли в виде экспрессии факторов ангиогенеза может свидетельствовать о формировании благоприятной ниши для развития и прогрессирования опухоли.
Схема химиотерапии, которая применялась в группе II, нацелена, в основном, на торможение пролиферации опухоли, подавление митотической активности и синтетических процессов в клетках опухоли. На основании полученных данных мы предполагаем, что после проведенной химиотерапии процессы неоваскуляризации могут быть связаны с «побегом» опухоли от повреждающего действия путем включения ангиогенных стимуляторов. Таким образом, повышенная экспрессия HIF-1α, VEGF и ANGP2 в группе пациенток после проведенной химиотерапии может быть обусловлена высокой долей резистентных пациенток в нашей выборке.
ЗАКЛЮЧЕНИЕ
Повышенная экспрессия исследуемых факторов в микроокружении опухоли у пациенток после курсов химиотерапии свидетельствует о запуске межклеточных взаимодействий, ответственных за формирование ангиогенного фенотипа эффекторных клеток, которыми в данном случае выступают клетки стромы и эндотелиоциты. Мы обнаружили четкие взаимосвязи между паттерном экспрессии целевых молекул, которые имеют направленность по оси HIF-1α-VEGF-ANGP2. Эту ось можно представить в виде следующей последовательности событий: клеточный ответ на гипоксию — проангиогенная стимуляция — сосудистая дестабилизация. Исследованные сосудистые маркеры являются важной частью множества сигнальных механизмов опухолевого ангиогенеза. На сегодняшний день, благодаря пласту накопившихся знаний, развитие получила антиангиогенная терапия, которая имеет свои недостатки и нуждается в более усовершенствованных подходах. Таким образом, изучение процессов и сигнальных путей, связанных с формированием резистентности при РМЖ, вносит неоспоримый вклад в расширение представлений о механизмах возникновения и путях преодоления устойчивости к химиотерапии.
1. World Health Organization; Global Cancer Observatory. Cancer today. Russian Federation. 2022. Available: https://gco.iarc.who.int/media/globocan/factsheets/populations/643-russian-federation-fact-sheet.pdf
2. Ставровская А. А., Генс Г. П. Новое в изучении множественной лекарственной устойчивости клеток рака молочной железы. Успехи молекулярной онкологии. 2015;1:39–51
3. Панов А. В., Рагинов И. С., Бурмистров М. В., Бердников А. В., Миндубаев Э. Ю., Манненков П. М., Габитова С. Е. Гипоксия опухолей. Поволжский онкологический вестник. 2013;1:19–22
4. Ассоциация онкологов России; Общероссийская общественная организация «Российское общество клинической онкологии»; Общероссийская общественная организация «Российское общество онкомаммологов». Рак молочной железы. Клинические рекомендации. 2023. Available: https://oncology.ru/specialist/treatment/references/actual/379.pdf
Российское общество онкомаммологов. «Золотой Стандарт» диагностики и лечения рака молочной железы. 2021. 176 с.
Список литературы
1. Bray F, Laversanne M, Sung H, Ferlay J, Siegel RL, Soerjomataram I, Jemal A. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74(3):229–263. https://doi.org/10.3322/caac.21834
2. Koual M, Tomkiewicz C, Cano-Sancho G, Antignac JP, Bats AS, Coumoul X. Environmental chemicals, breast cancer progression and drug resistance. Environ Health. 2020;19(1):117. https://doi.org/10.1186/s12940-020-00670-2
3. Wei X, Chen Y, Jiang X, Peng M, Liu Y, Mo Y, Ren D, Hua Y, Yu B, Zhou Y, Liao Q, Wang H, Xiang B, Zhou M, Li X, Li G, Li Y, Xiong W, Zeng Z. Mechanisms of vasculogenic mimicry in hypoxic tumor microenvironments. Mol Cancer. 2021;20(1):7. https://doi.org/10.1186/s12943-020-01288-1
4. Li Y, Yu H, Han X, Pan Y. Analyses of hypoxia-related risk factors and clinical relevance in breast cancer. Front Oncol. 2024;14:1350426. https://doi.org/10.3389/fonc.2024.1350426
5. Plastino F, Pesce NA, André H. MicroRNAs and the HIF/VEGF axis in ocular neovascular diseases. Acta Ophthalmol. 2021;99(8):e1255–e1262. https://doi.org/10.1111/aos.14845
6. Палтуев Р.М. Биологическое обоснование персонализации лечения рака молочной железы. Анализ новых данных используемых в рутинной практике маркеров рака молочной железы. Опухоли женской репродуктивной системы. 2019;15(4):30–49. https://doi.org/10.17650/1994-4098-2019-15-4-30-49
7. Beleva EA, Deneva TI, Stoencheva SS, Grudeva-Popova ZG. Longitudinal Dynamics of Coagulation and Angiogenesis Markers in Cancer Patients During and After Chemotherapy. Clin Appl Thromb Hemost. 2021;27:10760296211056637. https://doi.org/10.1177/10760296211056637
8. Kümmel S, Eggemann H, Lüftner D, Thomas A, Jeschke S, Zerfel N, Heilmann V, Emons G, Zeiser T, Ulm K, Kobl M, Korlach S, Schmid P, Sehouli J, Elling D, Blohmer JU. Changes in the circulating plasma levels of VEGF and VEGF-D after adjuvant chemotherapy in patients with breast cancer and 1 to 3 positive lymph nodes. Anticancer Res. 2006;26(2C):1719–1726.
9. El-Arab LR, Swellam M, El Mahdy MM. Metronomic chemotherapy in metastatic breast cancer: impact on VEGF. J Egypt Natl Canc Inst. 2012;24(1):15–22. https://doi.org/10.1016/j.jnci.2011.12.002
10. Semenza GL. Hypoxia-inducible factors in physiology and medicine. Cell. 2012;148(3):399–408. https://doi.org/10.1016/j.cell.2012.01.021
11. Semenza GL. Targeting HIF-1 for cancer therapy. Nat Rev Cancer. 2003;3(10):721–732. https://doi.org/10.1038/nrc1187
12. de Heer EC, Jalving M, Harris AL. HIFs, angiogenesis, and metabolism: elusive enemies in breast cancer. J Clin Invest. 2020;130(10):5074–5087. https://doi.org/10.1172/JCI137552
13. Wang W, He YF, Sun QK, Wang Y, Han XH, Peng DF, Yao YW, Ji CS, Hu B. Hypoxia-inducible factor 1α in breast cancer prognosis. Clin Chim Acta. 2014;428:32–37. https://doi.org/10.1016/j.cca.2013.10.018
14. Peng G, Liu Y. Hypoxia-inducible factors in cancer stem cells and inflammation. Trends Pharmacol Sci. 2015;36(6):374–383. https://doi.org/10.1016/j.tips.2015.03.003
15. Xiang L, Semenza GL. Hypoxia-inducible factors promote breast cancer stem cell specification and maintenance in response to hypoxia or cytotoxic chemotherapy. Adv Cancer Res. 2019;141:175–212. https://doi.org/10.1016/bs.acr.2018.11.001
16. Palazon A, Tyrakis PA, Macias D, Veliça P, Rundqvist H, Fitzpatrick S, Vojnovic N, Phan AT, Loman N, Hedenfalk I, Hatschek T, Lövrot J, Foukakis T, Goldrath AW, Bergh J, Johnson RS. An HIF-1α/VEGF-A Axis in Cytotoxic T Cells Regulates Tumor Progression. Cancer Cell. 2017;32(5):669–683.e5. https://doi.org/10.1016/j.ccell.2017.10.003
17. Hughes R, Qian BZ, Rowan C, Muthana M, Keklikoglou I, Olson OC, Tazzyman S, Danson S, Addison C, Clemons M, Gonzalez-Angulo AM, Joyce JA, De Palma M, Pollard JW, Lewis CE. Perivascular M2 Macrophages Stimulate Tumor Relapse after Chemotherapy. Cancer Res. 2015;75(17):3479–3491. https://doi.org/10.1158/0008-5472.CAN-14-3587
18. Fox SB, Generali DG, Harris AL. Breast tumour angiogenesis. Breast Cancer Res. 2007;9(6):216. https://doi.org/10.1186/bcr1796
19. Kachamakova-Trojanowska N, Podkalicka P, Bogacz T, Barwacz S, Józkowicz A, Dulak J, Łoboda A. HIF-1 stabilization exerts anticancer effects in breast cancer cells in vitro and in vivo. Biochem Pharmacol. 2020;175:113922. https://doi.org/10.1016/j.bcp.2020.113922
20. Dai H, Sheng X, Wang Y, Zhou L, Lin Y, Du Y, Yang F, Sha R, Peng J, Yao L, Yin W, Lu J. HIF1α Regulates IL17 Signaling Pathway Influencing Sensitivity of Taxane-Based Chemotherapy for Breast Cancer. Front Cell Dev Biol. 2021;9:729965. https://doi.org/10.3389/fcell.2021.729965
21. Zhang PC, Liu X, Li MM, Ma YY, Sun HT, Tian XY, Wang Y, Liu M, Fu LS, Wang YF, Chen HY, Liu Z. AT-533, a novel Hsp90 inhibitor, inhibits breast cancer growth and HIF-1α/VEGF/VEGFR-2-mediated angiogenesis in vitro and in vivo. Biochem Pharmacol. 2020;172:113771. https://doi.org/10.1016/j.bcp.2019.113771. Epub 2019 Dec 18. PMID: 31863779.
22. Нефедова Н.А., Давыдова С.Ю. Роль сосудистого эндотелиального фактора роста (VEGF) и гипоксия-индуцибельного фактора (HIF) в опухолевом ангиогенезе. Современные проблемы науки и образования. 2015;3:220–223.
23. Ng T, Phey XY, Yeo HL, Shwe M, Gan YX, Ng R, Ho HK, Chan A. Impact of Adjuvant Anthracycline-Based and Taxane-Based Chemotherapy on Plasma VEGF Levels and Cognitive Function in Breast Cancer Patients: A Longitudinal Study. Clin Breast Cancer. 2018;18(5):e927–e937. https://doi.org/10.1016/j.clbc.2018.03.016
24. Иванов А.Н., Чаббаров Ю.Р. Механизмы физиологического ангиогенеза. Российский физиологический журнал им. И.М. Сеченова. 2023;109(6):703–722. http://dx.doi.org/10.31857/S0869813923060043
25. Morse MA, Sun W, Kim R, He AR, Abada PB, Mynderse M, Finn RS. The Role of Angiogenesis in Hepatocellular Carcinoma. Clin Cancer Res. 2019;25(3):912–920. https://doi.org/10.1158/1078-0432.CCR-18-1254
26. Akwii RG, Sajib MS, Zahra FT, Mikelis CM. Role of Angiopoietin-2 in Vascular Physiology and Pathophysiology. Cells. 2019;8(5):471. https://doi.org/10.3390/cells8050471
27. Шамитова Е.Н., Матьков К.Г., Шихранова Д.Д., Абдуллин Р.Р. Нейтрализация ангиопоэтина-2 и фактора роста эндотелия сосудов (VEGF) с терапевтической целью. Acta Medica Eurasica. 2021;2:64–71. https://doi.org/10.47026/2413-4864-2021-2-64-79
28. Hao LS, Wang G, Qian K, Luo T, Li XJ, Wu XT. [HIF-1alpha expression and relationship involving tumor cell proliferation and angiogenesis in human breast carcinoma]. Sichuan Da Xue Xue Bao Yi Xue Ban. 2007;38(1):60–63.
29. Ali Khadem Z, Abdul Wadood Al-Shammaree S. Prognostic Value of Intracellular Transcription of Factors HIF-1α and p53 and Their Relation to Estradiol and TNM Parameters of Breast Cancer Tissues in Women with Invasive Ductal Carcinoma in Thi-Qar Province, Iraq. Arch Razi Inst. 2022 Aug 31;77(4):1341–1348. https://doi.org/10.22092/ARI.2022.357640.2080
30. Tan L, Qin H, Piao Y, Liu Z, Han Y, Song F, Xie X. [Expression and clinical significance of MTDH and VEGF in triple-negative breast cancer]. Zhonghua Zhong Liu Za Zhi. 2015;37(11):827–832. Chinese
31. Bos R, Zhong H, Hanrahan CF, Mommers EC, Semenza GL, Pinedo HM, Abeloff MD, Simons JW, van Diest PJ, van der Wall E. Levels of hypoxia-inducible factor-1 alpha during breast carcinogenesis. J Natl Cancer Inst. 2001;93(4):309–314. https://doi.org/10.1093/jnci/93.4.309. PMID: 11181778
32. Mazzieri R, Pucci F, Moi D, Zonari E, Ranghetti A, Berti A, Politi LS, Gentner B, Brown JL, Naldini L, De Palma M. Targeting the ANG2/TIE2 axis inhibits tumor growth and metastasis by impairing angiogenesis and disabling rebounds of proangiogenic myeloid cells. Cancer Cell. 2011;19(4):512–526. https://doi.org/10.1016/j.ccr.2011.02.005
Об авторах
К. А. АлиевРоссия
Алиев Казим Алиевич — кандидат медицинских наук, доцент кафедры онкологии.
бульвар Ленина, д. 5/7, Симферополь, 7295051
Э. Р. Асанова
Россия
Асанова Эльвина Рефатовна — младший научный сотрудник Центральной научно-исследовательской лаборатории.
бульвар Ленина, д. 5/7, Симферополь, 7295051
Т. П. Макалиш
Россия
Макалиш Татьяна Павловна — кандидат биологических наук, ведущий научный сотрудник Центральной научно-исследовательской лаборатории.
бульвар Ленина, д. 5/7, Симферополь, 7295051
Е. Ю. Зяблицкая
Россия
Зяблицкая Евгения Юрьевна — доктор медицинских наук, ведущий научный сотрудник Центральной научно-исследовательской лаборатории.
бульвар Ленина, д. 5/7, Симферополь, 7295051
Дополнительные файлы
Рецензия
Для цитирования:
Алиев К.А., Асанова Э.Р., Макалиш Т.П., Зяблицкая Е.Ю. Морфологическая оценка экспрессии факторов ангиогенеза в опухоли и микроокружении при фиброаденоме и протоковой карциноме молочной железы: наблюдательное когортное исследование. Кубанский научный медицинский вестник. 2024;31(5):26-40. https://doi.org/10.25207/1608-6228-2024-31-5-26-40
For citation:
Aliyev K.A., Asanova E.R., Makalish T.P., Zyablitskaya E.Yu. Morphological assessment of angiogenesis factor expression in tumor and microenvironment of breast fibroadenoma and ductal carcinoma: An observational cohort study. Kuban Scientific Medical Bulletin. 2024;31(5):26-40. (In Russ.) https://doi.org/10.25207/1608-6228-2024-31-5-26-40








































