Перейти к:
Клинические особенности синдрома Стивенса — Джонсона и токсического эпидермального некролиза: обсервационное когортное ретроспективное исследование
https://doi.org/10.25207/1608-6228-2025-32-4-49-61
Аннотация
Введение. Синдром Стивенса — Джонсона и токсический эпидермальный некролиз являются тяжелыми заболеваниями с дистинктивным поражением слизистых оболочек и кожного покрова, характеризующимися возможным летальным исходом. Чаще всего возникновение и развитие этих заболеваний провоцируют разного рода инфекции и лекарственные средства. К наиболее частым лекарственным средствам, применение которых вызывает синдром Стивенса — Джонсона и токсический эпидермальный некролиз, относят нестероидные противовоспалительные средства, антибактериальные препараты, витамины группы В, противоэпилептические препараты и другие. Быстрая диагностика имеет важное значение для немедленного прекращения приема индуцирующего агента и начала лечения.
Цель исследования: изучить этиологические факторы, степень тяжести и летальность у госпитализированных пациентов с синдром Стивенса — Джонсона и токсическим эпидермальным некролизом.
Методы. Проведено обсервационное когортное ретроспективное исследование на основе анализа историй болезни 229 пациентов с синдромом Стивенса — Джонсона и токсическим эпидермальным некролизом, госпитализированных в аллергологическое отделение государственного бюджетного учреждения здравоохранения Республики Башкортостан «Городская клиническая больница № 21 г. Уфа» в 2014–2023 гг. Диагноз «синдром Стивенса — Джонсона» и «токсический эпидермальный некролиз» устанавливался на основании комплекса исследований. Клиническими критериями синдрома Стивенса — Джонсона являлись острые состояния, характеризующиеся эрозиями слизистых оболочек и поражениями кожи (атипичные мишеневидные поражения, буллы и/или эрозии) с максимальным отслоением эпидермиса менее 10% от общей площади поверхности тела; для токсического эпидермального некролиза — максимальное отслоение эпидермиса более 30% от общей площади поверхности тела в дополнение к указанным выше симптомам. Случаи с максимальным отслоением эпидермиса 10–30% от общей площади поверхности тела были классифицированы как перекрытие синдрома Стивенса — Джонсона и токсического эпидермального некролиза. В группу исследования включены 229 пациентов, из них 44,1% мужчин и 55,9% женщин, в возрасте 45 (34; 61) лет. Пациенты были разделены на три группы: группа 1 (n = 83/229, 36%) — имели синдром Стивенса — Джонсона, группа 2 (n = 41/229; 18%) — сочетание синдрома Стивенса — Джонсона и токсического эпидермального некролиза, группа 3 (n = 105/229; 46%) — токсический эпидермальный некролиз. В рамках исследования у пациентов проанализированы следующие данные: демографическая информация (возраст и пол), анамнез болезни и сопутствующие состояния, предшествующее использование лекарств, оценивалось время между первым приемом причинного препарата и появлением симптомов всех исследуемых групп заболеваний. Для оценки тяжести течения и прогноза у больных с токсическим эпидермальным некролизом использовалась шкала SCORTEN (Score of Toxic Epidermal Necrosis). В данной группе больных также изучалась госпитальная летальность. Считали, что различия значимы, если р‑уровень отклонения нулевой гипотезы об их отсутствии не превышал 0,05.
Результаты. Основными причинами развития заболеваний были лекарственные препараты — 127/229 (55%), среди которых превалировали антибиотики — 52/127 (41%), нестероидные противовоспалительные средства — 31/127 (24,4%), противосудорожные и антиретровирусные препараты, витамины группы В — по 6/127 (4,7%). Вторым по частоте регистрации триггером были вирусные инфекции — 34/229 (14,8%): вирусы простого герпеса 1-го и 2-го типов, иммунодефицита человека, Эпштейна — Барр и гепатитов. Не удалось установить этиологический фактор почти у трети пациентов — 66/229 (28,8%). Сроки манифестации симптомов зависели от типа реакции: токсический эпидермальный некролиз чаще развивался в первую неделю, синдром Стивенса — Джонсона манифестировал преимущественно на четвертой неделе. Большинство пациентов столкнулись с заболеваниями впервые, повторные проявления были зарегистрированы только у 21/229 (9,2%) больного. Клиническая картина включала поражения кожи — 229/229 (100%), гипертермию — 155/229 (67,7%,), эрозии слизистых рта — 201/229 (87,8%) и гениталий — 142/229 (62%), конъюнктивит — 162/229 (70,7%). Токсический эпидермальный некролиз ассоциировался с более тяжелым течением. Расчетная летальность для 105 пациентов с токсическим эпидермальным некролизом по шкале SCORTEN составила 21,38% (22 случая). Средний балл SCORTEN — 2,39 ± 0,59. Однако умерли 4 пациента (уровень летальности 4%). Все пациенты с летальным исходом имели оценку по шкале SCORTEN 4 балла.
Заключение. Воздействие лекарственных средств и вирусная инфекция были более частой причиной развития токсического эпидермального некролиза, чем синдрома Стивенса — Джонсона и сочетания синдрома Стивенса — Джонсона с токсическим эпидермальным некролизом. При токсическом эпидермальном некролизе симптомы чаще развивались на 1‑й неделе после приема лекарственного препарата. Однако летальность пациентов составила 4% и была намного ниже расчетной (21,38%) согласно системе оценки SCORTEN, что может быть обусловлено быстрой диагностикой заболевания и своевременным оказанием медицинской помощи в условиях стационара.
Ключевые слова
Для цитирования:
Нуртдинова Г.М., Галимова Е.С., Кучер О.И., Газизова Д.Д., Галяутдинов А.Ф., Хисматуллина З.Р., Загидуллин Н.Ш. Клинические особенности синдрома Стивенса — Джонсона и токсического эпидермального некролиза: обсервационное когортное ретроспективное исследование. Кубанский научный медицинский вестник. 2025;32(4):49-61. https://doi.org/10.25207/1608-6228-2025-32-4-49-61
For citation:
Nurtdinova G.M., Galimova E.S., Kucher O.I., Gazizova D.D., Galyautdinov A.F., Khismatullina Z.R., Zagidullin N.Sh. Clinical features of Stevens — Johnson syndrome and toxic epidermal necrolysis: An observational cohort retrospective study. Kuban Scientific Medical Bulletin. 2025;32(4):49-61. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-4-49-61
ВВЕДЕНИЕ
Синдром Стивенса — Джонсона (ССД) и токсический эпидермальный некролиз (ТЭН) являются тяжелыми заболеваниями, характеризующимися широко распространенной многоформной эритемой, поражением слизистых оболочек, гипертермией и атипичными мишеневидными поражениями кожи, с потенциально летальным исходом [1][2]. Оба эти состояния часто сопровождаются осложнениями со стороны других органов и систем, что затрудняет лечение и иногда определяет продолжительность выздоровления. ССД и ТЭН считаются заболеваниями одной группы, но с разной степенью тяжести. При ССД, менее тяжелом из двух состояний, доля участка с отслоением эпидермального слоя от общей площади поверхности тела (ППТ) составляет до 10 %, в то время как диагноз ТЭН выставляется при захвате участка >30 % ППТ. При поражениях 10–30 % ППТ используется термин ССД/ТЭН. Частота встречаемости ССД и ТЭН оценивается как 1–6 случаев на миллион человек в год [3][4].
По данным литературы, основными этиологическими факторами считаются лекарственные средства и инфекции [5–8]. К наиболее частым ЛС, применение которых вызывает ССД/ТЭН, относят нестероидные противовоспалительные средства (НПВС), в состав которых входит невирапин, оксикам и сульфасалазин; антибактериальные препараты: аминопенициллины, сульфаниламиды, доксициклин, цефалоспорин, фторхинолон, ципрофлоксацин, ванкомицин и эритромицин, а также витамины группы В, ламотриджин, карбамазепин и др. [5][6]. При ССД и ТЭН интервал между воздействием препарата и началом кожной реакции обычно составляет 4–28 дней [9].
ССД и ТЭН — это полиорганные опасные для жизни заболевания, которые требуют многопрофильного подхода к лечению. Быстрая диагностика имеет важное значение для немедленного прекращения приема индуцирующего препарата и начала соответствующего лечения, которое может спасти жизнь [10]. Лечебные мероприятия включают в себя отмену провоцирующего лекарственного средства и противоинфекционную терапию в сочетании с системными иммуномодулирующими препаратами (глюкокортикостероиды, циклоспорин, циклофосфамид), плазмаферез [11][12].
Тяжесть заболевания ТЭН оценивают по шкале SCORTEN (Score of Toxic Epidermal Necrosis), эта прогностическая система оценки должна выполняться в течение первых 24 часов с момента госпитализации пациента в стационар. Неблагоприятные прогностические факторы течения ССД: быстро прогрессирующее течение, возраст старше 40 лет, гипергликемия более 14 ммоль/л, тахикардия с частотой сердечных сокращений (ЧСС) более 120 уд/мин., начальная площадь участка отслоения эпидермиса >10 %. Также по шкале SCORTEN можно прогнозировать вероятность летального исхода [13][14]. Смертность в общей популяции варьируется в зависимости от тяжести заболевания и по данным литературы составляет 5 % при ССД, 10–15 % при ССД/ТЭН и 30–35 % при ТЭН [15].
Цель исследования: изучить этиологические факторы, степень тяжести и летальность у госпитализированных пациентов с синдром Стивенса — Джонсона и токсическим эпидермальным некролизом.
МЕТОДЫ
Дизайн исследования
Проведено обсервационное когортное ретроспективное исследование на основе анализа медицинской документации 229 пациентов с ССД и ТЭН, госпитализированных в стационар г. Уфы.
Условия проведения исследования
Отбор и наблюдение за пациентами осуществлялось в отделении аллергологии государственного бюджетного учреждения здравоохранения Республики Башкортостан «Городская клиническая больница № 21 г. Уфа» (ГБУЗ РБ ГКБ № 21 г. Уфа), из числа пациентов, госпитализированных в период 2014–2023 гг. для оказания специализированной медицинской помощи по лечению ССД и ТЭН. Период госпитализации пациентов составлял 14–21 день.
Критерии соответствия
Критерии включения
Пациенты мужского и женского пола в возрасте старше 18 лет; диагноз по Международной классификации болезней (МКБ-10) «синдром Стивенса — Джонсона» — L51.1 или «токсический эпидермальный некролиз» — L51.2. Наличие у пациента клинических симптомов: а) поражения кожи: распространенные полиморфные высыпания в виде бордовых пятен с цианотичным оттенком, узелков, пузырьков, мишенеподобные очаги. После чего на местах данных высыпаний образуются одиночные и слившиеся пузыри различного диаметра — до размера ладони взрослого и больше. Данные пузыри характеризуются относительно легко разрушающимися покрышками (положительный симптом Никольского). После схождения покрышки, на месте пузыря образуются обширные ярко-красные эрозированные мокнущие поверхности, окаймленные обрывками покрышек пузырей; б) поражение слизистых оболочек двух и более органов; в) острое начало заболевания с возможным наличием лихорадки; г) экстренная госпитализация.
Критерии невключения
Подозрение на другие аллергические заболевания лекарственной этиологии без характерных поражений кожных покровов и слизистой; декомпенсация других соматических заболеваний.
Критерии исключения
Отказ от участия в исследовании на любом из его этапов.
Описание критериев соответствия (диагностические критерии)
Диагноз ССД/ТЭН устанавливался на основании комплекса исследований1, которые включали в себя сбор анамнеза, объективный осмотр. Клиническими критериями ССД являлись острые состояния, характеризующиеся эрозиями слизистых оболочек и поражениями кожи (атипичные мишеневидные поражения, буллы и/или эрозии) с максимальным отслоением эпидермиса менее 10 % от общей площади поверхности тела (ППТ); для ТЭН — максимальное отслоение эпидермиса более 30 % ППТ в дополнение к указанным выше симптомам. Случаи с максимальным отслоением эпидермиса от 10 до 30 % от ППТ были классифицированы как перекрытие ССД/TЭН. Лабораторные и инструментальные методы обследования (общий анализ крови, биохимический анализ крови, общий анализ мочи, электрокардиография, рентген органов грудной клетки, ультразвуковое исследование органов брюшной полости), консультация офтальмолога при поражении слизистых глаз.
Подбор участников в группы
В исследуемые группы пациенты подбирались в соответствии с критериями включения. Группы сформированы из когорты пациентов, обратившихся за медицинской помощью самостоятельно или направленных из поликлинических отделений города Уфы. В соответствии с долей поражения общей ППТ: при ССД до 10 %, ССД/ТЭН — 10–30 % и ТЭН при захвате участка >30 % были сформированы три группы пациентов: группа 1 — пациенты с ССД — 83 человека, группа 2 — с ССД/ТЭН — 41 человек и группа 2 — с ТЭН — 105 человек.
Целевые показатели исследования
Основной показатель исследования
В рамках исследования у пациентов проанализированы следующие данные: демографическая информация (возраст и пол), соответствующий анамнез болезни и сопутствующие состояния, предшествующее использование лекарств, оценивалось время между первым приемом причинного препарата и появлением симптомов всех исследуемых групп заболеваний.
Дополнительные показатели исследования
Для больных с ТЭН оценивались летальность в стационаре в зависимости от площади поражения тела и в зависимости от степени тяжести по шкале SCORTEN.
Методы измерения целевых показателей
Оценка этиологии ССД и ТЭН осуществлялась на основе анализа медицинской документации больного (учетная форма № 003/у), учитывались следующие данные: возраст (лет), пол, сопутствующие заболевания; предшествующее использование лекарств (время между первым приемом препарата и проявлением симптомов всех исследуемых групп заболеваний (дни)), наличие или отсутствие вирусной этиологии, клинические симптомы. Причинные препараты определялись с учетом истории приема лекарственных средств.
Для диагностики вирусной этиологии ССД и ТЭН был проведен серологический иммуноферментный анализ (ИФА) на выявление вирусных антител классов IgG (иммуноголобуллин, англ. Immunoglobulin), IgM в сыворотке крови к вирусу простого герпеса (ВПГ), цитомегаловирусу (ЦМВ) и вирусу Эпштейна — Барр (ВЭБ). Забор венозной крови осуществляли в утренние часы натощак. Определяли антитела к антигенам ВЭБ: анти-ЕА (Epstein-Barr Virus Antibody to Early D Antigen) IgG (<10 ед/мл — отрицательно), анти-VCA (Anti-Epstein-Barr viral capsid antigens) IgM (<20 ед/мл — отрицательно). Антитела к антигенам ВПГ: анти-ВПГ-1,2 IgM (≤0,8 КП — отрицательно), анти-ВПГ-1,2 IgG (<1,0 КП — отрицательно). Антитела к антигенам ЦМВ: Анти-ЦМВ IgM (<0,7 КП — отрицательно), анти-ЦМВ IgG (<0,5 АЕ/мл — отрицательно).
На выявление методом ИФА специфических антител (IgG, IgM) к ВПГ, ЦМВ, ВЭБ использовались коммерческие наборы для ИФА (ЗАО «Вектор-Бест», Новосибирск). ИФА выполняли в соответствии с прилагаемыми инструкциями производителя. Оценку оптической плотности контрольного и тестируемых образцов осуществляли при длине волны 450 нм в соответствии с рекомендациями производителя (https://vector-best.ru) с помощью спектрофотометра INFITEK SP-LUV1910–1920 (INFITEK, Китай).
Для оценки тяжести течения и прогноза у больных с ТЭН (группа 3) использовалась шкала SCORTEN (табл. 1). Шкала SCORTEN, состоящая из 7 клинических значений, была предложена S. Bastuji-Garin et al. в 2000 году и в настоящее время широко принята в качестве стандартного прогностического инструмента для расчета возможного уровня смертности у пациентов с ТЭН [13]. Оценка тяжести заболевания по шкале SCORTEN проводилась в течение первых 24 часов с момента поступления пациента в стационар [13][14].
Табл. 1. Шкала оценки степени тяжести токсического эпидермального некролиза (SCORTEN)
Table 1. Severity rating scale of toxic epidermal necrolysis (SCORTEN)
|
Фактор риска* |
Баллы |
|
|
0 |
1 |
|
|
Возраст |
<40 лет |
≥40 лет |
|
Онкологические заболевания |
Нет |
Да |
|
Частота сердечных сокращений (ударов в минуту) |
<120 |
≥120 |
|
Концентрация азота мочевины крови в сыворотке крови |
≤28 мг/дл (10 ммоль/л) |
>28 мг/дл (10 ммоль/л) |
|
Площадь поражения тела в первый день осмотра |
<10 % |
≥10 % |
|
Содержание бикарбоната в сыворотке крови |
≥20 мЭкв/л (≥20 ммоль/л) |
<20 мЭкв/л (<20 ммоль/л) |
|
Глюкоза сыворотки крови |
≤250 мг/дл (≤13,88 ммоль/л) |
>250 мг/дл (>13,88 ммоль/л) |
Примечания: таблица приведена по «SCORTEN: a severity-of-illness score for toxic epidermal necrolysis» (2000); * другие факторы риска могут указывать на более высокие баллы и более высокий уровень смертности; интерпретация результатов оценки: 0–1 = 3,2 % (ДИ: от 0,1 до 16,7); 2 = 12,1 % (ДИ: от 5,4 до 22,5); 3 = 35,3 % (ДИ: от 19,8 до 53,5); 4 = 58,3 % (ДИ: от 36,6 до 77,9); ≥5 = >90 % (ДИ: от 55,5 до 99,8)2. Сокращение: ДИ — доверительный интервал.
Notes: the table is from “SCORTEN: A severity-of-illness score for toxic epidermal necrolysis” (2000); * other risk factors may indicate higher scores and higher mortality rates; score interpretation: 0–1 = 3.2 % (CI: 0.1 to 16.7); 2 = 12.1 % (CI: 5.4 to 22.5); 3 = 35.3 % (CI: 19.8 to 53.5); 4 = 58.3 % (CI: 36.6 to 77.9); ≥ 5 = > 90 % (CI: 55.5 to 99.8)2. Abbreviation: CI — confidence interval.
Переменные (предикторы, конфаундеры, модификаторы эффекта)
В исследовании конфаундерами могли выступить: другие формы кожных проявлений аллергии лекарственной этиологии в виде крапивницы и дерматитов. Для снижения модифицирующего эффекта данные факторы были нивелированы на этапе формирования выборок за счет внесения их в состав критерий невключения.
Статистические процедуры
Принципы расчета размера выборки
Перед началом исследования объем выборки не рассчитывался.
Статистические методы
Анализ и обоснование полученных результатов осуществлялась с использованием прикладных программ GraphPad Prism 8.0.1 (Insight Venture Management, США), Microsoft Excel 2013 (Microsoft, США). Нормальность распределения определяли с помощью тестов Д’Агостино — Пирсона, Андерсона — Дарлинга, Шапиро — Вилка и Колмогорова — Смирнова. Для представления категориальных переменных использовали абсолютные и относительные частоты, выражающие количество и долю (%) случаев наступления события в рамках анализируемой группы. Количественные переменные, демонстрирующие распределение, близкое к нормальному, характеризовались средним арифметическим и стандартным отклонением (M ± SD). В случае когда распределение количественных переменных отличалось от нормального, применяли медиану, а также первый (Q1) и третий (Q3) квартили — Me [Q1; Q3]. Для оценки различий в характеристиках применяли χ2-критерий для частот встречаемости (в том числе с поправкой Йейтса в случае, если в одной из групп сравнения признак наблюдали редко, т. е. менее 5 %, или вовсе не наблюдали) и t-критерий Стьюдента. Считали, что различия значимы, если р-уровень отклонения нулевой гипотезы об их отсутствии не превышал 0,05.
РЕЗУЛЬТАТЫ
Формирование выборки исследования
В исследование включены данные медицинской документации 229 пациентов, госпитализированных в аллергологическое отделение ГБУЗ РБ ГКБ № 21 г. Уфа, за период с 2014 по 2023 годы, с диагнозом ССД и ТЭН. Учитывая пораженную площадь поверхности тела, пациенты были разделены на три группы: группа 1 (n = 83/229; 37 %) — с ССД (участки отслоения эпидермального слоя занимают менее 10 % от общей ППТ); группа 2 (n = 41/229; 18 %) — с сочетанием ССД/ТЭН (участки отслоения эпидермального слоя в пределах 10–30 % от общей ППТ); группа 3 (n = 105/229; 46 %) — с диагнозом ТЭН (отслоением эпидермиса >30 % от общей ППТ). Учитывались все демографические клинико-анамнестические данные. Для пациентов группы 3 на основании данных медицинской документации осуществлена оценка тяжести течения заболевания по шкале SCORTEN и летальность в зависимости от тяжести течения заболевания.
Характеристики выборки (групп) исследования
Среди всех исследуемых пациентов распределение по полу: 101/229 (44,1 %) мужчина и 128/229 (55,9 %) женщин, имели медианное значение возраста, равное 45 (34; 61) годам.
Пациенты группы 1 (с ССД) были в возрасте от 18 до 76 лет (36 [ 28; 41,5] лет), включали 31/83 (37,3 %) мужчину и 52/83 (62,7 %) женщины. Пациенты группы 2 (с ССД/ТЭН) в возрасте от 21 до 73 лет (40 [ 32; 53] лет), 18/41 (43,9 %) мужчин и 23/41 (56,1 %) женщины. Пациенты группы 3 (с TЭН) были в возрасте от 19 до 86 лет (60 [ 49; 67] лет), включая 52/105 (49,5 %) мужчин и 53/105 (50,5 %) женщины. Различия в количестве мужчин и женщин в группах сравнения по критерию хи-квадрат для произвольных таблиц и четырехпольных таблиц не соответствовали статистически значимым различиям, для произвольных таблиц (для трех групп сразу) р = 0,249, при попарном сравнении р1–2 = 0,483; p1–3 = 0,096; p2–3 = 0,542. Пациенты в группе ССД были моложе других (р1–2 = 0,0128; p1–3 = 0,0001; p2–3 < 0,0001).
Основные результаты исследования
Причиной развития заболеваний чаще всего были лекарственные препараты, вирусная инфекция, продукты питания (2 случая: на травяной кисель и суп из морепродуктов с соусом) и в 66/229 (28,8 %) случаях этиологию установить не удалось (табл. 2).
В группе 1 у пациентов с ССД в 40/83 (48,2 %) случаях заболевание считалось вызванным неблагоприятной реакцией на лекарства, в 32/83 (38,6 %) случаях этиологию установить не удалось. При развитии ССД/ТЭН в группе 2 в 20/41 (48,8 %) случаев причиной были лекарственные препараты и также в 20/41 (48,8 %) случаях этиология осталась неясной. Этиологическим фактором развития ТЭН в группе 3 в основном были лекарства (67/105 (63,8 %)) и в 24/105 (22,9 %) случаях вирусная инфекция. ЛС и вирусная инфекция были этиологически более значимы для пациентов с ТЭН, чем для пациентов с ССД (p1–3 = 0,032; p1–3 = 0,007). Напротив, у пациентов с более легкой формой патологии, с меньшим процентом площади поражения тела чаще причину заболевания установить не удавалось при ССД (p1–3 < 0,001) и ССД/ТЭН (p2–3 < 0,001).
Причиной развития заболевания у 55 % (127/229) пациентов были лекарственные средства, преимущественно антибиотики — 52/127 (41 %) пациента; из них амоксициллин в сочетании с клавулановой кислотой — 17/52 (32,7 %), цефалоспорины — 14/52 (26,9 %), пенициллины — 11/52 (21,2 %), макролиды — 7/52 (13,5 %), фторхинолоны — 3/52 (5,7 %). Причиной развития ССД и ТЭН также послужили: нестероидные противовоспалительные препараты — 31/127 (24,4 %); по 6/127 (4,7 %) пациентов среагировали на противосудорожные средства, антиретровирусные препараты, витамины группы В; по 4/127 (3 %) пациента — на антидепрессанты, антиоксиданты (этилметилгидроксипиридин сукцинат), местные анестетики; по 2/127 (1,6 %) пациента — на парацетамол, метотрексат, адеметионин, аллопуринол, толперизон, тербинафин; по 1/127 (0,8 %) пациенту — на периневу и индол.
Интервалы проявления симптомов всех исследуемых групп заболеваний в зависимости от приема лекарственных препаратов были изучены у пациентов в группе 1 — 40/83 (48,2 %), в группе 2 — 20/41 (48,8 %) и в группе 3 — 67/105 (63,8 %). Средние показатели составили 18,0 ± 7,8 дня при ССД, 14,5 ± 7,9 дня при ССД/ТЭН и 9,8 ± 8,6 дня при ТЭН. Распределение долей различных значений интервалов между первым приемом ЛС и появлением симптомов всех исследуемых групп заболеваний представлено на рисунке 2.
Значимо отличались показатели интервала между приемом препарата и появлением симптомов в группах ССД и ТЭН в первые 7 дней (p1–3 = 0,001), в то же время есть достоверные отличия в проявлениях заболевания от начала приема лекарственного препарата на 4-й неделе в группах ССД и ССД/ТЭН: ССД чаще начинается на четвертой неделе, чем ССД/ТЭН (р1–2 = 0,03). Значительно реже начинают проявляться симптомы ТЭН после 28 дней от начала приема препарата (р1–3 = 0,01; р2–3 = 0,01), в другие временные интервалы достоверных отличий не выявлено. При ТЭН симптомы чаще развивались в течение первой недели после первого приема лекарственного препарата; таким образом, ТЭН, вероятнее, развивался раньше после приема препарата, чем ССД.
При возникновении ССД/ТЭН основными клиническими симптомами были: поражения кожи — распространенные полиморфные высыпания в виде карминных пятен с цианотичным оттенком, узелков, пузырьков и одиночные и/или слившиеся пузыри различного размера в 229/229 (100 %) случаях; гипертермия (с максимальным повышением температуры до 39,7 °C) — 155/229 (67,7 %); поражения слизистых оболочек полости рта — 201/229 (87,8 %), поражение слизистых гениталий — 142/229 (62 %); конъюнктивит — 162/229 (70,7 %); боль при глотании — 178/229 (77,7 %); боль при мочеиспускании — 142/229 (62 %) и дефекации — 73/229 (31,9 %). Кроме того, у некоторых пациентов наблюдались другие симптомы, такие как миалгия, боли в суставах, общая слабость и отсутствие аппетита. Распределение клинических симптомов по тяжести течения в группах пациентов с ССД, ССД/ТЭН или ТЭН показано в таблице 3.
Во всех группах пациентов в 100 % было поражение кожных покровов (табл. 3). Степень максимального отслоения эпидермиса при ССД и ТЭН широко варьировала. Диапазон поражения в группах 1–3 составил 10–90 % от площади поверхности тела, а среднее значение составило 38,19 ± 29,26 % от площади поверхности тела. У трети пациентов группы 3 с TЭН наблюдалось отслоение эпидермиса более 50 % от площади поверхности тела, а в 7 случаях из 105 (6,7 %) — более 80 % от площади поверхности тела. Гипертермия наблюдалась чаще в группе пациентов с ТЭН, чем с ССД и ССД/ТЭН (p < 0,001). Что касается поражений слизистых оболочек глаз, кератоконъюнктивит встречался чаще у пациентов с ТЭН, чем в группе больных с ССД (p1–3 = 0,005). Кератоконъюнктивит включал такие клинические признаки, как инъецированность склер, эрозивный и псевдомембранозный конъюнктивит, болезненность и слезотечение. Болезненные эрозии губ и полости рта также больше наблюдались у пациентов с ТЭН, чем ССД (p < 0,001). Поражения слизистой гениталий, в основном проявляющиеся болью при мочеиспускании, были чаще в группе пациентов с ТЭН, чем у больных с ССД и ССД/ТЭН (p2–3 = 0,008, p1–3 < 0,001). Частота болей при акте дефекации в группах не различалась (р > 0,05).
Дополнительные результаты исследования
Оценка степени тяжести по шкале SCORTEN была рассчитана у всех 105 пациентов с ТЭН (группа 3). В результате от 0 до 1 балла не определялись ни у кого, 2 балла — 70/105 (66,7 %) человек, 3 балла — 29/105 (27,65 %), 4 балла — 6/105 (5,7 %), 5 баллов — 0. Баллы SCORTEN варьировались от 2 до 4, а среднее значение составило 2,39 ± 0,59 балла. Чем больше определяется факторов риска, тем выше совокупность баллов SCORTEN и, соответственно, выше прогнозируемая вероятность летального исхода у пациента. Вероятность летального исхода определяется следующим образом: 0–1 балл (3 %), 2 балла (12 %), 3 балла (36 %), 4 балла (58 %), >5 баллов (90 %) [13]. При оценке 105 пациентов с TЭН со средним баллом SCORTEN 2,39 ± 0,59 расчетная летальность составила 21,38 % (22 случая), в итоге умерли 4 пациента; таким образом, уровень летальности составил 3,8 %, что, вероятнее всего, объясняется, с одной стороны, быстрой диагностикой заболевания — всем пациентам диагноз был выставлен в кротчайшие сроки, в течение трех-пяти дней от начала манифестации заболевания, все пациенты были госпитализированы в стационар и получали комплексное лечение, с другой — осуществлено срочное определение причинно значимого препарата и его отмена. Все пациенты с летальным исходом имели оценку по шкале SCORTEN 4 балла.
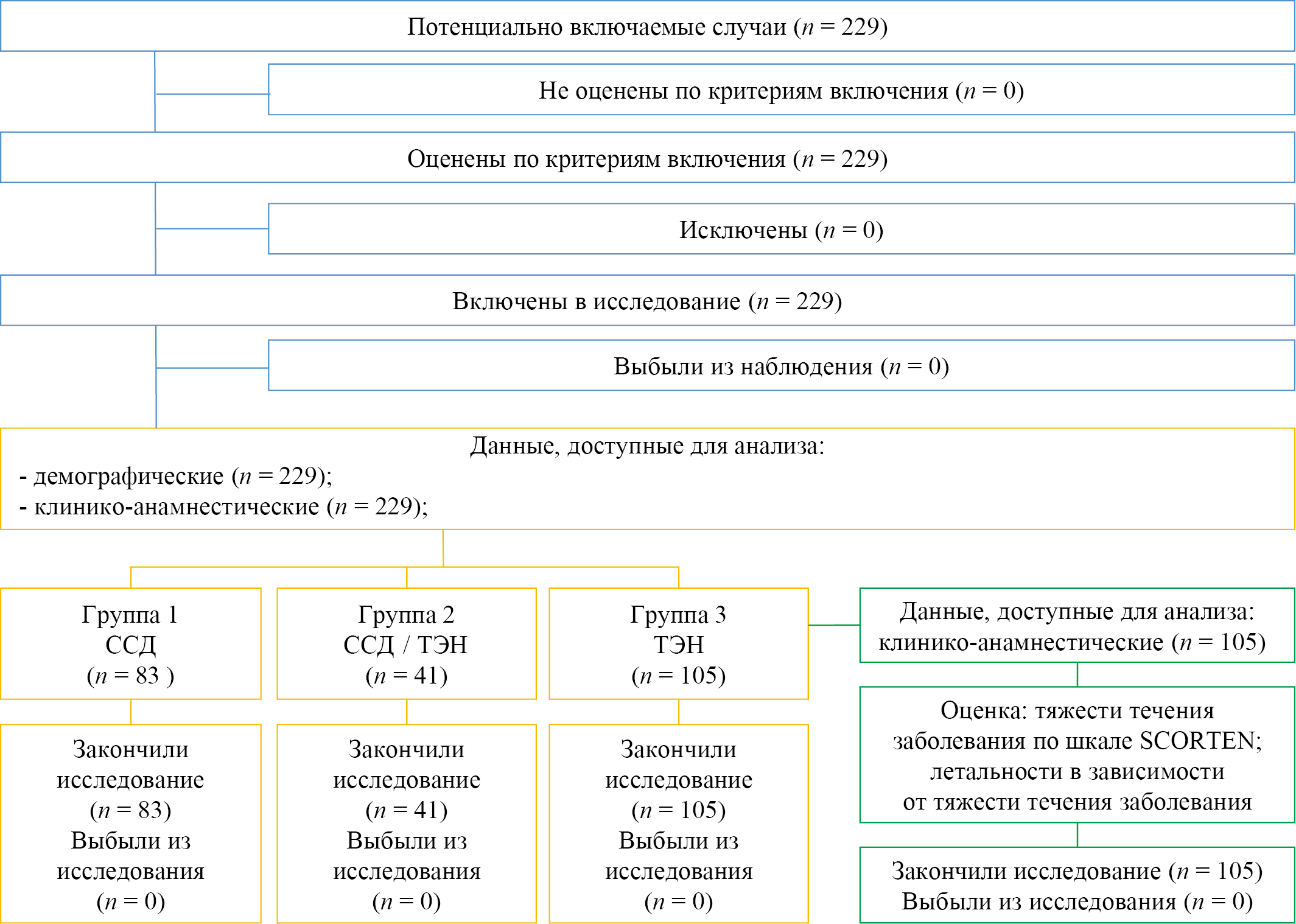
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами (согласно рекомендациям STROBE). Сокращения: ССД — синдром Стивенса — Джонсона; ТЭН — токсический эпидермальный некролиз; SCORTEN (Score of Toxic Epidermal Necrosis) — шкала оценки тяжести заболевания при токсическом эпидермальном некролизе.
Fig. 1. Block diagram of the study design
Note: the block diagram was created by the authors (according to STROBE recommendations). Abbreviations: ССД — Stevens-Johnson syndrome; ТЭН — toxic epidermal necrolysis; SCORTEN — Score of Toxic Epidermal Necrosis.
Табл. 2. Этиологические факторы риска развития синдрома Стивенса — Джонсона и токсического эпидермального некролиза
Table 2. Etiologic risk factors for the development of Stevens — Johnson syndrome and toxic epidermal necrolysis
|
Этиологические факторы |
Группа 1 n = 83 |
Группа 2 n = 41 |
Группа 3 n = 105 |
р* — уровень статистической значимости |
|
Лекарственные средства |
40 (48,2 %) |
20 (48,8 %) |
67 (63,8 %) |
p1–2 = 0,951 p2–3 = 0,097 p1–3 = 0,032 |
|
Вирусной этиологии |
9 (10,8 %) |
1 (2,4 %) |
24 (22,9 %) |
p1–2 = 0,206 p2–3 = 0,032 p1–3 = 0,007 |
|
Пищевой этиологии |
2 (2,4 %) |
0 |
0 |
p1–2 = 0,807 p1–3 = 0,378 |
|
Неясной этиологии |
32 (38,6 %) |
20 (48,8 %) |
14 (13,3 %) |
p1–2 = 0,278 p2–3 <0,001 p1–3 <0,001 |
Примечание: таблица составлена авторами.
Note: the table was compiled by the authors.

Рис. 2. Доля пациентов в исследуемой группе с различным временным интервалом между первым приемом причинно-значимого лекарственного препарата и появлением симптомов синдрома Стивенса — Джонсона и токсического эпидермального некролиза
Примечание: рисунок выполнен авторами.
Fig. 2. Share of patients in the study group with different time interval between the first intake of a causative drug and the appearance of symptoms of Stevens — Johnson syndrome and toxic epidermal necrolysis
Note: the figure is created by the authors.
Табл. 3. Клинические проявления синдрома Стивенса — Джонсона и токсического эпидермального некролиза
Table 3. Clinical manifestations of Stevens — Johnson syndrome and toxic epidermal necrolysis
|
Клинические проявления |
Группа 1 n = 83 |
Группа 2 n = 41 |
Группа 3 n = 105 |
р — уровень статистической значимости |
|
Поражения кожи |
83 (100 %) |
41 (100 %) |
105 (100 %) |
- |
|
Гипертермия |
36 (43,4 %) |
25 (61,0 %) |
94 (89,5 %) |
p1–2 = 0,065 p2–3 < 0,001 p1–3 < 0,001 |
|
Поражения слизистых оболочек полости рта |
65 (78,3 %) |
37 (90,2 %) |
99 (94,3 %) |
p1–2 = 0,102 p2–3 = 0,385 p1–3 < 0,001 |
|
Поражения слизистых оболочек гениталий |
37 (44,6 %) |
23 (56,1 %) |
82 (78,1 %) |
p1–2 = 0,227 p2–3 = 0,008 p1–3 < 0,001 |
|
Конъюнктивит |
49 (59,0 %) |
31 (75,6 %) |
82 (78,1 %) |
p1–2 = 0,070 p2–3 = 0,747 p1–3 = 0,005 |
|
Боль при глотании |
52 (62,7 %) |
32 (78,0 %) |
94 (89,5 %) |
p1–2 = 0,084 p2–3 = 0,070 p1–3 < 0,001 |
|
Боль при мочеиспускании |
37 (44,6 %) |
23 (56,1 %) |
82 (78,1 %) |
p1–2 = 0,227 p2–3 = 0,008 p1–3 < 0,001 |
|
Боль при дефекации |
22 (26,5 %) |
10 (24,4 %) |
41 (39,0 %) |
p1–2 = 0,800 p2–3 = 0,095 p1–3 = 0,070 |
Примечание: таблица составлена авторами.
Note: the table was compiled by the authors.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Основной причиной развития ССД и ТЭН оказались ЛС, при этом преобладающей группой были антибактериальные препараты (чаще амоксициллин с клавулановой кислотой, цефалоспорины и пенициллины). Другими значимыми лекарственными триггерами выступали НПВС, противосудорожные и антиретровирусные препараты, витамины группы В. Следующей по частоте встречаемости причиной заболеваний являлись вирусные инфекции (ВПГ-1 и ВПГ-2, ВИЧ, ВЭБ, вирусы гепатитов). Не был установлен этиологический фактор почти у трети пациентов (66/229; 28,8 %).
У всех пациентов наблюдались характерные кожные проявления. Степень отслоения эпидермиса варьировала от 10 до 90 %, а у трети пациентов с ТЭН превышала 50 %. Сопутствующим значимым симптомом была гипертермия, которая регистрировалась чаще в группе пациентов с ТЭН, чем с ССД и ССД/ТЭН. Также у больных ТЭН чаще, чем при ССД, наблюдались кератоконъюнктивит (p = 0,005), эрозии губ и полости рта (p < 0,001), поражения гениталий с болезненным мочеиспусканием (p2–3 = 0,008, p1–3 < 0,001). Анализ динамики симптомов у пациентов с различными формами лекарственно индуцированных дерматозов выявил зависимость сроков манифестации от типа реакции. Статистически значимые различия выявлены между группами ССД и ТЭН в первые 7 дней (p = 0,001), а также на 4-й неделе между ССД и ССД/ТЭН (p = 0,03). В первую неделю, как правило, развивался ТЭН, тогда как ССД манифестировал преимущественно на четвертой неделе. Большинство пациентов с ССД и ТЭН столкнулись с заболеванием впервые, при этом повторные эпизоды в основном возникали при наличии вирусных инфекций. Летальность у пациентов, согласно системе оценки SCORTEN, была намного ниже расчетной. Из 105 пациентов с токсическим эпидермальным некролизом со средним баллом SCORTEN 2,39 ± 0,59 умерли 4 пациента, которые имели 4 балла по шкале SCORTEN (уровень летальности 3,8 %) при расчетной летальности 22 случая (21,38 %).
Ограничения исследования
Ограничениями были: одноцентровое исследование, небольшой объем выборки, отсутствие специфических диагностических методов, отсутствие лабораторного подтверждения лекарственной этиологии заболевания и неконтролируемый дизайн исследования.
Интерпретация результатов исследования
ССД и TЭН являются редкими, но опасными для жизни заболеваниями, чаще всего лекарственной или вирусной этиологии. Заболевание быстро прогрессирует, и диффузный некроз кератиноцитов приводит к дермоэпидермальному и слизисто-кожному расслоению. Быстрая диагностика имеет решающее значение для немедленного прекращения приема причинно-значимого препарата и начала соответствующего лечения, которое поможет избежать летального исхода [9][16]. Выявлены следующие факторы риска: наличие медленного ацетиляторного генотипа, наличие иммуносупрессии, прием противосудорожных препаратов одновременно с лучевой терапией и наличие специфических аллелей человеческого лейкоцитарного антигена (HLA), таких как HLA-B × 15: 02, HLA-A × 31: 01, HLA-B × 58: 01 [10][17]. Однако патогенез заболеваний до сих пор полностью не изучен [15]. По литературным данным, уровень смертности от этих состояний составляет 34 % в год для ССД/TЭН в Европе [18] и 3 и 19 % для ССД и ТЭН соответственно в Японии. Поэтому важным диагностическим этапом является выявление факторов риска развития ССД/ТЭН и раннее терапевтическое вмешательство.
В работе были изучены эпидемиологические данные, клинико-этиологические факторы, причинно-значимые лекарственные препараты, интервал между воздействием препарата и началом кожной реакции и показатели смертности пациентов с ССД/TЭН.
К наиболее распространенным препаратам, ответственным за ССД/ТЭН, относят: НПВС, в состав которых входит невирапин и сульфасалазин; антибактериальные препараты: аминопенициллин, сульфаниламиды, доксициклин, цефалоспорин, фторхинолон, ципрофлоксацин, ванкомицин и эритромицин, а также ламотриджин, карбамазепин и др. [5][6].
В данном исследовании лекарственные препараты стали причиной заболевания в 127 (55,4 %) случаях, из них на первом месте были антибиотики — у 41 % пациентов. В других исследованиях этот показатель был зарегистрирован в пределах от 39 до 56,7 % [19–22]. Противоэпилептические препараты (ПЭП) занимали второе место в четырех исследованиях [19–21][23], тогда как авторы выявили только 6 пациентов, прием ПЭП у которых был связан с развитием ССД/ТЭН. Согласно данным B. F. Firoz и соавторов [24], установлена высокая частота развития ТЭН у пациентов, принимавших аллопуринол, равно как и летальность у них была выше, чем в случаях, когда ТЭН был вызван другими препаратами. В изучаемой выборке было 2 пациента, подозреваемым препаратом которых был аллопуринол, оба выписались из стационара с улучшением состояния. Таким образом, основными этиологическими препаратами были антибиотики, противосудорожные препараты, НПВП. Преобладание этих препаратов в возникновении заболеваний, по-видимому, не изменилось с тех пор, как было проанализировано 269 случаев ССД и 287 случаев ТЭН, зарегистрированных с 1981 по 1997 год в Японии [24].
Терапия пациентов ССД и ТЭН лекарственной этиологии включает прежде всего отмену причинно-значимого препарата, вызвавшего заболевание, а при вирусной этиологии — назначение противовирусной терапии. Лечение пациентов было комплексным и включало: системные глюкокортикостероиды (ГКС), плазмаферез; активную инфузионную поддержку; при возникновении инфекционных осложнений — антибактериальную терапию; для обработки слизистых оболочек снаружи использовали изотонический раствор натрия хлорида и антисептические средства — мирамистин и хлоргексидин; для обработки эрозивных дефектов на коже — анилиновые красители: метиленовый синий и бриллиантовый зеленый, а также фукорцин, мази с ГКС; при поражении глаз — капли с антибактериальными ЛС, препараты искусственной слезы. Местное лечение включало назначение анестетиков, НПВС и кератопластических средств.
В клинической картине, как правило, наблюдаются неспецифические симптомы, такие как слабость и головная боль, боль в горле, жжение в глазах, ринит и кашель [5][6]. Кожные проявления обычно начинаются с туловища, лица и проксимальных отделов конечностей. Первоначально они являются атипичными поражениями в виде багряно-пурпурных пятен. Симптом Никольского, индикатор эпидермального некроза, может быть положительным [15][16].
В настоящем исследовании у пациентов в 100 % случаев были поражения кожных покровов, представленные множественными полиморфными высыпаниями в виде карминовых пятен с цианотичным оттенком, узелков, пузырьков и гигантских пузырей, эрозий и булл с вялыми покрышками. По данным проведенного анализа медицинской документации у 142/229 (62 %) пациентов были симптомы поражения мочеполовой системы. Несмотря на то что поражения мочеполовой системы развиваются у большинства пациентов, существует относительно мало исследований, которые изучали частоту поражений мочеполовой системы, оптимальные стратегии лечения, рекомендации по последующему наблюдению и отдаленные исходы у этих пациентов. Однако есть обзорные публикации по вовлеченности и стратегии лечения поражения мочеполовой системы у детей и женщин. Ван Батавия и др. провели ретроспективный обзор детей с ССД и ТЭН [19]. Их результаты включали 31 ребенка, из которых 22 (71 %) имели генитальное поражение, что согласуется с выводами данного исследования. Что касается поражений слизистых полости рта и глаз, то они встречались чаще и были тяжелее у пациентов с ТЭН, чем у пациентов с ССД (соответственно: поражение слизистых оболочек — 99/105 (94,3 %) и 65/83 (78,3 %), р1–3 < 0,001; конъюнктивит — 82/105 (78,1 %) и 49/83 (59,0 %), р1–3 < 0,001), что согласуется с данными других авторов [19].
При ССД и ТЭН интервал между воздействием препарата и началом кожной реакции обычно составляет 4–28 дней [9]. При изучении интервала между воздействием препарата и началом кожной реакции при ТЭН симптомы чаще развивались в течение первой недели после первого приема лекарственного препарата, чем при ССД (p1–3 = 0,0001), что указывает на необходимость многопрофильного подхода, особенно в острой фазе лечения.
На сегодня нет определенного принятого алгоритма лечения, поскольку рандомизированное контролируемое исследование невозможно для ССД/TЭН. Самым важным шагом в лечении является быстрое обнаружение и прекращение приема препарата и начало поддерживающей терапии. Пациентам с более 10 % отслоения ППТ требуется наблюдение в условиях палаты интенсивной терапии. В дополнение к уходу за кожей пациенты должны получать коррекцию сопутствующей терморегуляторной дисфункции, потери жидкости, электролитного дисбаланса, питания, состояния кожи и системной инфекции. Иммуномодулирующая терапия включает системные ГКС, внутривенный иммуноглобулин (IVIG), циклоспорин, и ингибиторы фактора некроза опухоли-альфа (ФНО-альфа) в зависимости от клинической ситуации [10][12].
В настоящем исследовании баллы по шкале SCORTEN у пациентов с ТЭН (группа 3) варьировали от 2 до 4 (средний балл 2,39 ± 0,59). При этом летальность составила 3,8 % (4/105 пациента). По данным литературы показатели смертности варьируют от 9,5 до 38 % [23–27]. В ряде исследований значение SCORTEN было сообщено как средние 2,4 [20], 1,9 [21], 2,52 [25] и 2,9 [26] у пациентов с ТЭН. Показано, что смертность от ССД/TЭН ниже у детей, чем у взрослых [28]. Низкая летальность в настоящем исследовании объясняется быстрой диагностикой — всем пациентам диагноз был выставлен в кротчайшие сроки, была срочная отмена причинно-значимого препарата, все пациенты были госпитализированы в стационар и получали комплексное лечение. Авторы полагают, что факторы, которые влияют на разброс показателей смертности в литературных источниках, обусловлены различиями в дизайне исследований, величине выборки, значимыми гендерными и возрастными отличиями групп исследования.
ЗАКЛЮЧЕНИЕ
Синдром Стивенса — Джонсона и токсический эпидермальный некролиз — это состояния с высокой заболеваемостью и смертностью, которые могут манифестировать в любом возрасте, однако риск возрастает у лиц старше 40 лет, у ВИЧ-позитивных пациентов и с онкологическими заболеваниями. Чем старше возраст пациента, серьезнее сопутствующее заболевание и обширнее площадь поражения кожи, тем хуже прогноз заболевания. Причиной заболевания чаще всего являются лекарственные средства и вирусы, иногда этиологию установить не удается. По результатам проведенного исследования лекарственные средства и вирусная инфекция были этиологически более значимы для ТЭН, чем для ССД и ССД/ТЭН. При ТЭН симптомы чаще развивались на 1-й неделе после приема лекарственного препарата. Однако летальность пациентов составила 4 %, и была намного ниже расчетной (21,38 %) согласно системе оценки SCORTEN, что может быть обусловлено быстрой диагностикой заболевания и своевременным оказанием медицинской помощи в условиях стационара.
1 Российское общество дерматовенерологов и косметологов. Федеральные клинические рекомендации по ведению больных синдромом Стивенса — Джонсона/токсическим эпидермальным некролизом. 2015.
2 Интерпретация результатов оценки приводится по «SCORTEN: a severity-of-illness score for toxic epidermal necrolysis» (2000).
Список литературы
1. Hasegawa A, Abe R. Stevens-Johnson syndrome and toxic epidermal necrolysis: Updates in pathophysiology and management. Chin Med J (Engl). 2024;137(19):2294–2307. https://doi.org/10.1097/CM9.0000000000003250
2. Schwartz RA, McDonough PH, Lee BW. Toxic epidermal necrolysis: Part I. Introduction, history, classification, clinical features, systemic manifestations, etiology, and immunopathogenesis. J Am Acad Dermatol. 2013:173.e1–13; quiz 185–186. https://doi.org/10.1016/j.jaad.2013.05.003
3. Cabañas Weisz LM, Miguel Escuredo I, Ayestarán Soto JB, García Gutiérrez JJ. Toxic epidermal necrolysis (TEN): Acute complications and long-term sequelae management in a multidisciplinary follow-up. J Plast Reconstr Aesthet Surg. 2020;73(2):319–327. https://doi.org/10.1016/j.bjps.2019.07.015
4. Hama N, Aoki S, Chen CB, Hasegawa A, Ogawa Y, Vocanson M, Asada H, Chu CY, Lan CE, Dodiuk-Gad RP, Fujiyama T, Hsieh TS, Ito K, Jerschow E, Mizukawa Y, Nakajima S, Nakamura K, Nicolas JF, Satoh TK, Shiohara T, Takahashi H, Tohyama M, Ueda T, Ura K, Watanabe H, Yamaguchi Y, Nordmann TM, Chung WH, Naisbitt D, Pincelli C, Pichler WJ, French LE, Phillips E, Abe R. Recent progress in Stevens-Johnson syndrome/toxic epidermal necrolysis: diagnostic criteria, pathogenesis and treatment. Br J Dermatol. 2024;192(1):9–18. https://doi.org/10.1093/bjd/ljae321
5. Creamer D, Walsh SA, Dziewulski P, Exton LS, Lee HY, Dart JK, Setterfield J, Bunker CB, Ardern-Jones MR, Watson KM, Wong GA, Philippidou M, Vercueil A, Martin RV, Williams G, Shah M, Brown D, Williams P, Mohd Mustapa MF, Smith CH. U.K. guidelines for the management of Stevens-Johnson syndrome/toxic epidermal necrolysis in adults 2016. Br J Dermatol. 2016;174(6):1194–1227. https://doi.org/10.1111/bjd.14530
6. Gupta LK, Martin AM, Agarwal N, D’Souza P, Das S, Kumar R, Pande S, Das NK, Kumaresan M, Kumar P, Garg A, Singh S. Guidelines for the management of Stevens-Johnson syndrome/toxic epidermal necrolysis: An Indian perspective. Indian J Dermatol Venereol Leprol. 2016;82(6):603–625. https://doi.org/10.4103/0378-6323.191134
7. Сакания Л.Р., Плиева К.Т., Денисова Е.В., Корсунская И.М. Острые состояния в дерматологии: токсические реакции и их терапия. Consilium Medicum. 2021;23(8):668–671. https://doi.org/10.26442/20751753.2021.8.201180
8. Owen CE, Jones JM. Recognition and Management of Severe Cutaneous Adverse Drug Reactions (Including Drug Reaction with Eosinophilia and Systemic Symptoms, Stevens-Johnson Syndrome, and Toxic Epidermal Necrolysis). Med Clin North Am. 2021;105(4):577–597. https://doi.org/10.1016/j.mcna.2021.04.001. PMID: 34059239.
9. Dodiuk-Gad RP, Chung WH, Valeyrie-Allanore L, Shear NH. Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis: An Update. Am J Clin Dermatol. 2015;16(6):475–493. https://doi.org/10.1007/s40257-015-0158-0
10. Harr T, French LE. Stevens-Johnson syndrome and toxic epidermal necrolysis. Chem Immunol Allergy. 2012;97:149–166. https://doi.org/10.1159/000335627
11. de Jesus LE, Dekermacher S, Manhães CR, Faria LM, Barros ML. Acquired labial sinechiae and hydrocolpos secondary to Stevens-Johnson syndrome. Urology. 2012;80(4):919–921. https://doi.org/10.1016/j.urology.2012.06.051
12. Zimmermann S, Sekula P, Venhoff M, Motschall E, Knaus J, Schumacher M, Mockenhaupt M. Systemic Immunomodulating Therapies for Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis: A Systematic Review and Meta-analysis. JAMA Dermatol. 2017;153(6):514–522. https://doi.org/10.1001/jamadermatol.2016.5668
13. Bastuji-Garin S, Fouchard N, Bertocchi M, Roujeau JC, Revuz J, Wolkenstein P. SCORTEN: a severity-of-illness score for toxic epidermal necrolysis. J Invest Dermatol. 2000;115(2):149–153. https://doi.org/10.1046/j.1523-1747.2000.00061.x
14. Strużyna J, Surowiecka A, Korzeniowski T, Korulczyk P, Drozd L, Stachura A, Torres K, Krajewski A. Accuracy of SCORTEN in predicting mortality in toxic epidermal necrolysis. BMC Med Inform Decis Mak. 2022;22(1):273. https://doi.org/10.1186/s12911-022-02013-2
15. Frantz R, Huang S, Are A, Motaparthi K. Stevens-Johnson Syndrome and Toxic Epidermal Necrolysis: A Review of Diagnosis and Manag ment. Medicina (Kaunas). 2021;57(9):895. https://doi.org/10.3390/medicina57090895
16. Жерносек В., Дюбкова Т. Синдром Стивенса–Джонсона — токсический эпидермальный некролиз у детей. Часть I. Определение, этиология, патогенез, клинические проявления, системное лечение. Педиатрическая фармакология. 2011;8(1):30–38.
17. Лепехова А.А., Духанин А.С., Теплюк Н.П., Шимановский Н.Л., Юдин А.А. Оценка распространенности HLA аллелей II класса (DRB1 и DQB1) у больных буллезным пемфигоидом, синдромом Стивенса–Джонсона и токсическим эпидермальным некролизом в российской популяции. Российский журнал кожных и венерических болезней. 2024;27(3):249–261. https://doi.org/10.17816/dv625526
18. Sekula P, Dunant A, Mockenhaupt M, Naldi L, Bouwes Bavinck JN, Halevy S, Kardaun S, Sidoroff A, Liss Y, Schumacher M, Roujeau JC; RegiSCAR study group. Comprehensive survival analysis of a cohort of patients with Stevens-Johnson syndrome and toxic epidermal necrolysis. J Invest Dermatol. 2013;133(5):1197–1204. https://doi.org/10.1038/jid.2012.510
19. Medeiros MP, Carvalho CHC, Santi CG, Avancini J. Stevens-Johnson syndrome and toxic epidermal necrolysis — retrospective review of cases in a high complexity hospital in Brazil. Int J Dermatol. 2020;59(2):191–196. https://doi.org/10.1111/ijd.14544
20. Zhang AJ, Nygaard RM, Endorf FW, Hylwa SA. Stevens-Johnson syndrome and toxic epidermal necrolysis: retrospective review of 10- year experience. Int J Dermatol. 2019;58(9):1069–1077. https://doi.org/10.1111/ijd.14409
21. Carrasquillo OY, Santiago-Vazquez M, Cardona R, Cruz-Manzano M, Figueroa LD. Stevens-Johnson syndrome and toxic epidermal necrolysis: a retrospective descriptive study. Int J Dermatol. 2019;58(11):1293– 1299. https://doi.org/10.1111/ijd.14493
22. Weinand C, Xu W, Perbix W, Lefering R, Maegele M, Rathert M, Spilker G. 27 years of a single burn centre experience with Stevens-Johnson syndrome and toxic epidermal necrolysis: analysis of mortality risk for causative agents. Burns. 2013;39(7):1449–1455. https://doi.org/10.1016/j.burns.2013.03.011
23. Nizamoglu M, Ward JA, Frew Q, Gerrish H, Martin N, Shaw A, Barnes D, Shelly O, Philp B, El-Muttardi N, Dziewulski P. Improving mortality outcomes of Stevens Johnson syndrome/toxic epidermal necrolysis: A regional burns centre experience. Burns. 2018;44(3):603– 611. https://doi.org/10.1016/j.burns.2017.09.015
24. Firoz BF, Henning JS, Zarzabal LA, Pollock BH. Toxic epidermal necrolysis: five years of treatment experience from a burn unit. J Am Acad Dermatol. 2012;67(4):630–635. https://doi.org/10.1016/j.jaad.2011.12.014
25. Krajewski A, Mazurek MJ, Mlynska-Krajewska E, Piorun K, Knakiewicz M, Markowska M. Toxic Epidermal Necrolysis Therapy with TPE and IVIG-10 Years of Experience of the Burns Treatment Center. J Burn Care Res. 2019;40(5):652–657. https://doi.org/10.1093/jbcr/irz073
26. Papp A, Sikora S, Evans M, Song D, Kirchhof M, Miliszewski M, Dutz J. Treatment of toxic epidermal necrolysis by a multidisciplinary team. A review of literature and treatment results. Burns. 2018;44(4):807–815. https://doi.org/10.1016/j.burns.2017.10.022
27. McCullough M, Burg M, Lin E, Peng D, Garner W. Steven Johnson Syndrome and Toxic Epidermal Necrolysis in a burn unit: A 15- year experience. Burns. 2017;43(1):200–205. https://doi.org/10.1016/j.burns.2016.07.026
28. McPherson T, Exton LS, Biswas S, Creamer D, Dziewulski P, Newell L, Tabor KL, Wali GN, Walker G, Walker R, Walker S, Young AE, Mohd Mustapa MF, Murphy R. British Association of Dermatologists’ guidelines for the management of Stevens-Johnson syndrome/toxic epidermal necrolysis in children and young people, 2018. Br J Dermatol. 2019;181(1):37–54. https://doi.org/10.1111/bjd.17841
29. Van Batavia JP, Chu DI, Long CJ, Jen M, Canning DA, Weiss DA. Genitourinary involvement and management in children with Stevens-Johnson syndrome and toxic epidermal necrolysis. J Pediatr Urol. 2017;13(5):490.e1–490.e7. https://doi.org/10.1016/j.jpurol.2017.01.018
Об авторах
Г. М. НуртдиноваРоссия
Нуртдинова Гузель Масхутовна - кандидат медицинских наук, доцент кафедры пропедевтики внутренних болезней,
ул. Ленина, д. 3, г. Уфа, 450008
Е. С. Галимова
Россия
Галимова Елена Станиславовна - доктор медицинских наук, профессор кафедры пропедевтики внутренних болезней,
ул. Ленина, д. 3, г. Уфа, 450008
О. И. Кучер
Россия
Кучер Ольга Ивановна - заведующий отделением аллергологии и иммунологии,
пр-д Лесной, д. 3, г. Уфа, 450071
Д. Д. Газизова
Россия
Газизова Динара Даниловна — ассистент кафедры пропедевтики внутренних болезней,
ул. Ленина, д. 3, г. Уфа, 450008
А. Ф. Галяутдинов
Россия
Галяутдинов Альфред Фиданович - лаборант-исследователь лаборатории аддитивных технологий,
ул. Ленина, д. 3, г. Уфа, 450008
З. Р. Хисматуллина
Россия
Хисматуллина Зарема Римовна - доктор медицинских наук, профессор, заведующая кафедрой дерматовенерологии
с курсами дерматовенерологии и косметологии,
ул. Ленина, д. 3, г. Уфа, 450008
Н. Ш. Загидуллин
Россия
Загидуллин Науфаль Шамилевич - доктор медицинских наук, профессор, заведующий кафедрой пропедевтики внутренних болезней,
ул. Ленина, д. 3, г. Уфа, 450008
Дополнительные файлы
Рецензия
Для цитирования:
Нуртдинова Г.М., Галимова Е.С., Кучер О.И., Газизова Д.Д., Галяутдинов А.Ф., Хисматуллина З.Р., Загидуллин Н.Ш. Клинические особенности синдрома Стивенса — Джонсона и токсического эпидермального некролиза: обсервационное когортное ретроспективное исследование. Кубанский научный медицинский вестник. 2025;32(4):49-61. https://doi.org/10.25207/1608-6228-2025-32-4-49-61
For citation:
Nurtdinova G.M., Galimova E.S., Kucher O.I., Gazizova D.D., Galyautdinov A.F., Khismatullina Z.R., Zagidullin N.Sh. Clinical features of Stevens — Johnson syndrome and toxic epidermal necrolysis: An observational cohort retrospective study. Kuban Scientific Medical Bulletin. 2025;32(4):49-61. (In Russ.) https://doi.org/10.25207/1608-6228-2025-32-4-49-61
JATS XML








































