Перейти к:
Возможности персонализированного подбора топических антибактериальных средств у больных микробной экземой на основе данных полногеномного секвенирования: проспективное сравнительное рандомизированное исследование
https://doi.org/10.25207/1608-6228-2025-32-4-18-32
Аннотация
Введение. Микробиота кожи каждого человека уникальна и включает разнообразное резидентное и транзиторное сообщество, композиция которого определяется строго индивидуально. Данное исследование направлено на идентификацию геномов микроорганизмов кожи у пациентов с хронической микробной экземой.
Цель исследования: оценить клиническую эффективность комплексной терапии больных микробной экземой с персонализированным подбором топических антибактериальных средств с учетом определения антибиотикорезистентности методом полногеномного секвенирования.
Методы. В проспективном сравнительном рандомизированном исследовании приняли участие 60 больных микробной экземой в стадии обострения, которые случайным образом были разделены на две группы по 30 человек: основную и сравнения. В группе сравнения (группа 2, n = 30) пациентам проводили терапию согласно Федеральным клиническим рекомендациям. В основной группе (группа 1, n = 30) пациентов также проводилась традиционная терапия, при этом топические антибактериальные средства были подобраны персонализировано на основе данных антибиотикорезистентности. На 21-й день терапии пациентам обеих групп в схему лечения был добавлен эмолент с пробиотическим компонентом. Больные проходили терапию, наблюдение и обследование на базе кафедры дерматовенерологии федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации. Клиническое исследование выполнено в период с декабря 2023 по декабрь 2024 года. Сроки наблюдения в исследовании были разделены на несколько этапов: до начала терапии, на 14-й, 21-й дни и спустя 6 месяцев после лечения. В работе проводился сравнительный анализ микробиома пораженных участков кожи у больных и оценивалось влияние топического антибактериального препарата, подобранного на основе данных полногеномного секвенирования. Лабораторный этап настоящего исследования выполнен на двух базах: клинико-диагностическая лаборатория «CL Lab» (общество с ограниченной ответственностью «СЛ Медикалгруп») г. Краснодара и генетическая лаборатория «Сербалаб» (общество с ограниченной ответственностью «Сербалаб») в г. Санкт-Петербурге. Для оценки кожного патологического процесса использовали индекс площади поражения и тяжести атопического дерматита (Eczema Area and Severity Index, EASI). Статистическая обработка данных производилась с использованием статистического пакета Statistica 12.0 (StatSoft, США) и Microsoft Exel 2010 (Microsoft, США). Статистическое описание количественных показателей осуществлялось с помощью медианы и квартилей (Me (Q1; Q3)) и среднего со стандартным отклонением (М ± SD). Статистически значимыми различия считали при уровне ошибки р < 0,05.
Результаты. Во время обострения у больных хронической микробной экземой наблюдалось смещение микробного равновесия в сторону увеличения микроорганизмов Staphylococcus aureus, Clostridioides diffi cile, Klebsiella pneumoniae, Pseudomonas aeruginosa, Escherichia coli, присутствующих на пораженных участках кожи, при этом количество функциональных бактерий было ограничено. Уже на 14-й день была отмечена более выраженная тенденция к восстановлению здорового микробиома у пациентов основной группы. К 6-му месяцу лечения у пациентов основной группы наблюдалось большее снижение микробной колонизации в очагах поражения микробной экземы, чем в группе сравнения, а доля функционалов Bifi dobacterium и Lactobacillus была увеличена по сравнению со значениями до лечения в 2,31 и 2,10 раза соответственно. При этом в основной группе рецидив заболевания произошел у 2 пациентов (против 5 в группе сравнения), что может говорить о большей эффективности предложенного в исследовании метода терапии.
Заключение. Метод полногеномного секвенирования позволяет определить таксономическое разнообразие микробиома. Персонализированное применение топического антибактериального средства в комплексной терапии в основной группе пациентов способствует более быстрому восстановлению здорового микробиома кожи, чем в группе сравнения.
Ключевые слова
Для цитирования:
Лазарев В.В., Тлиш М.М., Шавилова М.Е. Возможности персонализированного подбора топических антибактериальных средств у больных микробной экземой на основе данных полногеномного секвенирования: проспективное сравнительное рандомизированное исследование. Кубанский научный медицинский вестник. 2025;32(4):18-32. https://doi.org/10.25207/1608-6228-2025-32-4-18-32
For citation:
Lazarev V.V., Tlish M.M., Shavilova M.E. Personalized selection of topical antibacterial agents in patients with microbial eczema based on whole genome sequencing data: A prospective сomparative randomized study. Kuban Scientific Medical Bulletin. 2025;32(4):18-32. https://doi.org/10.25207/1608-6228-2025-32-4-18-32
ВВЕДЕНИЕ
Хроническая микробная экзема (МЭ) — это распространенное рецидивирующее воспалительное заболевание кожи, которое значительно ухудшает качество жизни пациентов [1][2]. У генетически предрасположенных лиц с нарушениями врожденного и адаптивного иммунитета данное заболевание может быть спровоцировано экзогенными и эндогенными факторами. Еще одним фактором, поддерживающим хроническое воспаление на коже при микробной экземе, является дисбиоз и скудное физиологическое разнообразие микробиоты кожи. Тяжесть течения заболевания коррелирует с преобладанием на коже пациентов вирулентных штаммов Staphylococcus aureus, заражение которыми происходит вследствие недостатка антимикробных пептидов и дисрегуляции врожденного иммунитета. Это сопровождается нарушением целостности эпидермального кожного барьера, активацией работы протеаз кожи и синтеза суперантигенов (SEA (staphylococcal enterotoxin A), SEB (staphylococcal enterotoxin B), SEC (staphylococcal enterotoxin C) и токсин-1 синдрома токсического шока (TSST 1; toxic shock syndrome toxin)). Последние активируют Th-лимфоциты (Th2) без предварительной презентации на поверхности антигенпредставляющих клеток и запускают выброс цитокинов (IL36 (interleukin), IL17, IL31, TSLP (тимический стромальный лимфопоэтин; thymic stromal lymphopoietin)), избыток которых приводит к системной токсичности и подавлению адаптивного иммунного ответа, что создает благоприятную среду для патогенных микроорганизмов [3–5].
Микробная экзема склонна к обострениям, что связано с увеличением количества условно-патогенных и патогенных микроорганизмов на коже. Последнее создает предпосылки для развития аутоаллергического компонента и перехода заболевания в хроническую форму. В период обострения для острого воспаления кожи характерны зуд, сухость, шелушение, а также образование везикул, быстро превращающихся в мокнущие эрозии (серозные колодцы) или серозные корки. На фоне длительного течения заболевания пациенты испытывают стресс, что является дополнительным триггером для манифестации воспалительных реакций и активации условно-патогенной флоры. [6][7]
Микробиом кожи при хронической микробной экземе претерпевает дисбиотические изменения, характеризующиеся увеличением доли микроорганизмов различных условно-патогенных семейств: Staphylococcus aureus, Pseudomonas aeruginosa, Clostridioides difficile, Klebsiella pneumoniae, Escherichia coli, которые заменяют представителей функциональной флоры (Staphylococcus epidermidis, Bifidobacterium, Lactobaccilus)1 [8]. Также в патогенезе МЭ описана роль неспецифических возбудителей, таких как Proteus vulgaris, Neisseria meningitidis, Neisseria gonorrhoeae, Cl. perfringens, Cl. histolyticum, Cl. septicum [9][10].
Этиопатогенетические механизмы развития микробной экземы обусловливают необходимость назначения антибактериальных препаратов. Курсы системной и наружной антибактериальной терапии у пациентов с хронической МЭ позволяют снизить обсемененность представителями бактериальной патогенной флоры. Это может сопровождаться снижением воспалительных процессов и улучшением клинической картины экземы [10].
Все более актуальной в последнее время становится проблема нарастающей устойчивости патогенов к антибактериальным препаратам. Их нерациональное использование может приводить к потенциальному развитию резистентности к системным и топическим антибактериальным лекарственным средствам [11]. Развитие антибиотикорезистентности обусловлено генетическими механизмами: приобретением новой генетической информации или изменением уровня экспрессии собственных генов [12][13].
Перспективным направлением является использование молекулярно-генетических методов диагностики для выявления антибиотикорезистентности. Новый молекулярно-генетический метод полногеномного секвенирования (WGS; whole genome sequencing) способствует углубленному анализу состава микробиома. Этот метод используется для идентификации и геномной характеристики архей, бактерий, грибов, паразитов и вирусов без необходимости предварительной идентификации конкретного патогена непосредственно из клинических образцов. WGS дает оценку антибиотикорезистентности, генов токсичности и рекомендации по пробиотической коррекции для лечащего врача. Без учета этих данных, полученных в ходе WGS, лечение микробной экземы может быть неэффективным и приводить к увеличению числа рецидивов и ухудшению клинической картины заболевания. Таким образом, учитывая чувствительность патогенов к антибактериальным препаратам, очень важным является вопрос персонализации терапии [14][15].
Современные методы лечения больных хронической МЭ кортикостероидами, иммуномодуляторами и антибактериальными средствами часто оказываются недостаточно эффективными и могут иметь побочные эффекты, включая дополнительное нарушение их микробиома. Это подчеркивает необходимость поиска новых методов терапии, направленных не только на устранение симптомов заболевания, но и на восстановление нарушенного микробиома. В последнее время изучается возможность оптимизации терапии микробной экземы путем коррекции микробиома с помощью пробиотиков, что может привести к повышению эффективности лечения и достижению более стойкой ремиссии [16].
Bifida Ferment Lysate и Lactobacillus Ferment — наиболее часто используемые компоненты в средствах для ухода за кожей, относящиеся к категории «пробиотиков». Они представляют собой продукты ферментации, полученные из бактерий Bifida и Lactobacillus соответственно. В наружных пробиотиках, в отличие от системных, используются лизаты (продукты распада) этих бактерий, восстанавливают микробиом, укрепляя кожный барьер, и оказывают успокаивающее и антимикробное действие [17]. Это диктует необходимость включения топических пробиотиков в комплексную терапию микробной экземы.
Таким образом, проведение настоящего исследования позволит оптимизировать терапию больных МЭ, направленную на коррекцию микробиома, что, в свою очередь, повысит эффективность лечения данной патологии.
Цель исследования: оценить клиническую эффективность комплексной терапии больных микробной экземой с персонализированным подбором топических антибактериальных средств с учетом определения антибиотикорезистентности методом полногеномного секвенирования.
МЕТОДЫ
Дизайн исследования
Исследование выполнено в соответствии с дизайном проспективного сравнительного рандомизированного исследования с участием 60 больных с хронической микробной экземой в стадии обострения, проходивших терапию, наблюдение и обследование на базе кафедры дерматовенерологии федерального государственного бюджетного образовательного учреждения высшего образования «Кубанский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО КубГМУ Минздрава России).
Критерии соответствия
Критерии включения
Диагноз «хроническая микробная экзема» (длительность заболевания не менее 6 месяцев); отсутствие других заболеваний кожи; возраст от 18 до 70 лет; отсутствие в течение последнего месяца системной и/или местной антибактериальной терапии; подписанное информированное добровольное согласие.
Критерии невключения
Наличие злокачественных новообразований; наличие в анамнезе хронических соматических заболеваний или заболеваний неопластического характера; диагноз «острая микробная экзема»; наличие в анамнезе заболеваний, связанных с иммунокомпрометированным состоянием пациентов.
Критерии исключения
Отказ от дальнейшего участия в исследовании, отказ от динамического наблюдения.
Условия проведения исследования
Исследование проведено на кафедре дерматовенерологии ФГБОУ ВО КубГМУ Минздрава России. Испытуемые лица проходили курс лечения в соответствии с Федеральными клиническими рекомендациями (ФКР)2. Лабораторный этап настоящего исследования выполнен на двух базах: клинико-диагностическая лаборатория «CL Lab» (общество с ограниченной ответственностью «СЛ Медикалгруп») г. Краснодара и генетическая лаборатория «Сербалаб» (общество с ограниченной ответственностью «Сербалаб») в г. Санкт-Петербурге.
Продолжительность исследования
Набор и распределение пациентов по группам, клиническое исследование, включая лабораторный этап, выполнены в период с декабря 2023 по декабрь 2024 года. Наблюдение испытуемых проводилось в течение 6 месяцев.
Медицинские вмешательства
Все испытуемые лица выступали в качестве доноров биоматериала (соскоб с пораженных участков кожи) для проведения лабораторного этапа исследования. Выполнялись осмотр врачом дерматовенерологом, сбор анамнеза, проведение микроскопического и бактериологического исследования покровов кожи, анкетирование.
Пациентам обеих групп проводили традиционную терапию согласно ФКР3: 1) антигистаминные препараты (цетиризин 10 мг/сутки вечером в течение 14 дней); 2) системные антибактериальные препараты (азитромицин 500 мг/сут в 1-е сутки, затем 250 мг 1 раз в сутки в течение 4 дней); 3) наружно применялись растворы анилиновых красителей (метилтиониния хлорид 1 % водный раствор 2 раза в день на зону поражения в течение 7 дней); 4) дезинтоксикационные препараты (натрия тиосульфат 30 % раствор внутривенно 5,0–10,0 мл 1 раз в сутки 10 дней).
В группе сравнения применялись топические глюкокортикостероиды в комбинации с антибактериальным средством (бетаметазон + гентамицин 0,1 % + 0,1 % крем для наружного применения 2 раза в сутки на пораженные участки кожи в течение 14 дней).
Исходя из цели исследования в основной группе пациентов топические антибактериальные средства были подобраны персонализировано на основе данных антибиотикорезистентности, полученных в ходе WGS (бетаметазон + фузидовая кислота, крем для наружного применения, 1 раз в сутки в течение 14 дней с утра и фузидовая кислота 2 %, крем для наружного применения, 1 раз в сутки 14 дней).
На 21-й день терапии всем пациентам обеих групп в схему лечения был добавлен эмолент с пробиотическим компонентом.
Исходы исследования
Основной исход исследования
Конечной точкой исследования считали завершение периода лечения и наблюдения в течение 6 месяцев. Оценивали эффективность персонализированного применения топических антибиотиков в комплексной терапии согласно ФКР4. Анализировали тяжесть течения хронической микробной экземы на основе индекса EASI. В различные сроки наблюдения рассматривали таксономический микробный профиль поражений кожи пациентов сравниваемых групп.
Дополнительные исходы исследования
Исследованием не предусмотрены.
Методы регистрации исходов
В исследовании использовался метод WGS с интерпретацией, который позволяет выделить таксономический профиль кожи, оказывающий влияние на течение заболевания. Забор биоматериала у пациентов с хронической МЭ проводили с пораженных участков кожи до начала терапии, на 14-й, 21-й дни и спустя 6 месяцев после лечения. Образцы из очагов поражения для молекулярно-генетического исследования собирали с помощью мазка, взятого одноразовыми стерильными тампонами с ватным наконечником. Тампоны предварительно смачивали стерильным буферным раствором и плотно втирали в течение 20 секунд в пораженную кожу. Затем образцы с ватных палочек хранили в пробирке, заполненной стерильным буферным раствором. Геномную ДНК выделяли из образцов, подвергнутых гомогенизации в лизирующем растворе. Гомогенизация проводилась с последующей экстракцией ДНК методом сорбентной колонки (Qiagen, Germantown, MD, USA) в соответствии с рекомендациями производителя. Гены ДНК различных регионов были амплифицированы с использованием праймера из вариабельных регионов 3–4, что делает таксономический охват исследования более широким. Результат анализа WGS представляли в условных единицах измерения. Условная единица измерения была равна количеству случаев чтения последовательности нуклеотидов определенного микроорганизма среди ста случаев чтения всех последовательностей нуклеотидов одного образца биоматериала пациента.
Для оценки кожного патологического процесса использовали индекс площади поражения и тяжести атопического дерматита (Eczema Area and Severity Index, EASI) [18, 19]. Степень тяжести заболевания, отражающая клинические признаки заболевания (эритему, отек, экскориации, лихенификацию), оценивалась в баллах: легкая — 0,1–1,0; умеренная — 1,1–7,0; средняя — 7,1–21,0; тяжелая — 21,1–50,0; очень тяжелая — 50,1–72,0.
Рандомизация
Для объективности исследования был применен метод «конвертов». Суть заключалась в случайном распределении пациентов по группам отдельно для мужчин (30 больных) и для женщин (30 больных). Были подготовлены два пакета, содержащих по 30 непрозрачных конвертов, в которых находились карточки, 15 из которых содержали цифру «1» и остальные 15 — цифру «2», цифры означали номер группы исследования. После этого пациентом извлекался из пакета для мужчин один конверт с указанием номера группы и пациенткой извлекался из пакета для женщин один конверт, номер на карточке определял, в какую группу попадет больная. Такой подход детерминировал равенство групп по полу и гарантировал случайное распределение участников при формировании групп.
Обеспечение анонимности данных
Получение и последующая обработка данных пациентов проводились обезличенно. Был введен специальный ключевой код для каждого больного без привязки к персональным данным.
Статистические процедуры
Принципы расчета размера выборки
Предварительный расчет размера выборок не проводился.
Статистические методы
У каждого пациента основной группы (группа 1) и группы сравнения (группа 2) оценивалась обсемененность кожи различными микроорганизмами в условных единицах. Первичные данные по микробиому для статистического анализа представляли собой распределения встречаемости изучаемых патологических и непатологических микроорганизмов, измеренных для каждого таксона и для каждого пациента в условных единицах.
Статистическая обработка первичных данных производилась с использованием статистического пакета программы Statistica 12.0 (StatSoft, США) и Microsoft Exel 2010 (Microsoft, США).
Статистическое описание количественных показателей по каждому пациенту в основной группе и группе сравнения осуществлялось с помощью медианы (Me) и первого и третьего квартилей (Q1; Q3) в виде записи (Me (Q1; Q3)), если при проверке на нормальность с помощью критериев Колмогорова, Смирнова, Шапиро — Уилка гипотеза о нормальности распределения отклонялась. Для сравнения таких показателей у независимых групп использовался непараметрический критерий Манна — Уитни. Сравнение показателей одной клинической группы, но в разные сроки наблюдения производилось с помощью непараметрического парного критерия Вилкоксона.
Статистическое описание количественных показателей по каждому пациенту в группах 1 и 2 осуществлялось с помощью среднего арифметического (M) и стандартного отклонения (SD) в виде записи (M ± SD), если при проверке на нормальность с помощью критериев Колмогорова, Смирнова, Шапиро — Уилка гипотеза о нормальности распределения не отклонялась. Для сравнения таких показателей у независимых групп использовался параметрический критерий Стьюдента. Сравнение показателей одной клинической группы, но в разные сроки наблюдения производилось с помощью параметрического парного критерия Стьюдента.
Сравнение структурных показателей или качественных показателей между разными клиническими группами производилось с помощью критерия Хи-квадрат Пирсона или точного критерия Фишера при малых количествах членов выборки. Статистически значимыми различия считали при уровне ошибки р < 0,05.
РЕЗУЛЬТАТЫ
Формирование выборки (групп) исследования
Принцип формирования выборок и общий дизайн исследования представлены на блок-схеме (рис. 1). Испытуемые лица двух групп выступали в роли доноров биоматериала (был проведен соскоб с пораженных участков кожи) для проведения лабораторных исследований. Общее количество больных было сформировано за счет включения пациентов с хронической микробной экземой в соответствии с критериями включения пациентов в исследование. Случайный способом были сформированы две группы: основная (группа 1) и сравнения (группа 2). Больные группы сравнения (n = 30) получали стандартную терапию согласно ФКР. В основной группе (n = 30) также проводилась традиционная терапия, но при этом топические антибактериальные средства были подобраны персонализированно на основе данных антибиотикорезистентности, полученных в ходе WGS.
Характеристики выборки (групп) исследования
Случайно отобранные пациенты в исследуемые группы по различным показателям до лечения были сопоставимы. Рассмотрим антропометрические показатели (табл. 1).
В обеих группах под наблюдением находились по 15 женщин (15/30, 50,00 %) и по 15 мужчин (15/30, 50,00 %), т. е. по половому составу групп было полное совпадение. Средний возраст больных в группе 1 составил 37,50 ± 13,71 года, а в группе 2 — 41,43 ± 16,14 года, при этом статистической значимости различий среднего значения возраста не выявлено (р = 0,313), т. е. до начала лечения группы сопоставимы. Значения среднего роста в группах 1 и 2 также были сопоставимы. В группе 1 средний рост был равен 171 ± 9 см, а в группе 2 — 170 ± 8 см, различия были не значимы (р = 0,832). По массе пациентов средние значения отличались. Так, в группе 1 средняя масса была 70,10 ± 14,20 кг, а в группе 2 — 67,50 ± 13,80 кг, но статистической значимости не установлено (р = 0,475).
Показатели индекса массы тела так же, как и вышеуказанные антропометрические показатели, имели отличия для средних значений групп, однако эти отличия статистически не значимы (р = 0,35). Следовательно, по полу, возрасту, росту, массе, ИМТ группы сопоставимы.
Рассмотрим сопоставимы ли группы, исследуя микробный профиль больных сравниваемых групп (табл. 2).
Микробиота кожи до начала лечения у пациентов обеих групп характеризовалась следующими особенностями: в большей степени выделялись P. aeruginosa и E. coli со значениями медиан, равными 7,04 (5,53; 8,43) у. е. и 9,39 (8,34; 9,75) у. е. соответственно в группе 1 среди общего числа выделенных бактерий в области высыпаний. Аналогично выделялись P. aeruginosa и E. coli со значениями медиан 7,04 (5,52; 8,42) у. е. и 9,49 (8,34; 9,84) у. е. соответственно в группе 2 среди общего числа выделенных бактерий в области высыпаний. Сравнение медиан показателей между группами не выявило статистически значимого различия ни для P. aeruginosa (р = 0,929), ни для E. coli (р = 0,717). Кроме того, на участках кожи секвенировались S. aureus (медиана и квартили были равны 2,05 (1,86; 2,44) у. е.) и K. pneumonia (медиана и квартили были равны 4,44 (4,01; 5,95) у. е.) у пациентов группы 1 (основной). У пациентов группы 2 (сравнения) также секвенировались S. aureus (медиана и квартили были равны 2,04 (1,84; 2,44) у. е.) и K. pneumonia (медиана и квартили были равны 4,43 (4,01; 5,94) у. е.). Различия не значимы (р = 0,988 для S. aureus и р = 0,994 для K. pneumonia). В микробном патогенном сообществе также были выявлены: C. difficile (1,97 (1,51; 2,14) у. е.), M. tuberculosis (0,94 (0,79; 1,08) у. е.) у больных группы 1. Аналогично были выявлены: C. difficile (1,96 (1,50; 2,13) у. е.), M. tuberculosis (0,93 (0,78; 1,07) у. е.) у больных группы 2. Для двух этих микроорганизмов различия между группами не значимы (р > 0,05). Малые значения показателей наблюдались в обеих группах и для функциональных бактерий, у которых также не выявлено значимых различий (табл. 2).
Таким образом, по микробиомному профилю группы сопоставимы.
Рассмотрим, сопоставимы ли группы по некоторым клиническим показателям для больных сравниваемых групп (табл. 3).
В основной группе до начала лечения по значениям индекса EASI течение микробной экземы средней степени тяжести наблюдалось у 17/30 (56,67 %) человек, тяжелой степени — у 13/30 (43,33 %), при этом медианное значение данного индекса составило 17,94 (10,51; 29,10) балла. В группе сравнения у 19/30 человек (63,33 %) установлена средняя степень тяжести МЭ, у 11/30 человек (36,67 %) — тяжелое течение заболевания. Различие долей больных со средней степенью тяжести и тяжелой степени заболевания в группах сравнения статистически не значимо (р = 0,599). Медианное значение индекса в группе 2 было равно 18,03 (11,32; 29,59) балла, что было сопоставимо со значением индекса в основной группе больных (p > 0,05).
Длительность заболевания варьировала от 6 до 36 месяцев.
Так, клинические показатели: индекс EASI, длительность заболевания, доли больных с разными степенями тяжести заболевания до начала лечения в группах 1 и 2 были сопоставимы.
Итак, по антропометрическим характеристикам, по микробиомному профилю, по клиническим показателям обе группы больных были близки по значениям до начала вмешательства, т. е. различных методов лечения, настоящего исследования.
Основные результаты исследования
Перед проведением лечения в основной группе пациентов была определена резистентность бактерий к антибиотикам. Всего выявлено 21 наименование, доли разных видов среди всех выявленных (21 наименование) показаны на рисунке 2.
По пациентам основной группы распределение было следующим: у 11/30 (36,67 %) больных резистентность не выявлена, для 9/30 (30,00 %) пациентов резистентность только к аминогликозидам, только к макролидам — у 4/30 (13,33 %), только к диаминопиримидинам — у 1/30 (3,33 %), к оксазолидинонам — у 1/30 (3,33 %), к фторхинолонам — у 2/30 (6,67 %) больных. У 2/30 (6,67 %) больных установлена резистентность одновременно к двум аминогликозидам, у каждого к диаминопиримидинам и к макролидам, и к аминогликозидам.
Для исследования в основной группе пациентов выбрано топическое антибактериальное средство с фузидовой кислотой, которая оказывает бактерицидное действие. Она подавляет синтез белка за счет ингибирования фактора, необходимого для транслокации белковых субъединиц и элонгации пептидной цепи, что приводит в дальнейшем к гибели возбудителя.
В процессе лечения первоначально рассмотрим изменения показателя распространенности микроорганизмов в различные сроки наблюдения для пациентов основной группы (группа 1) и группы сравнения (группа 2).
У всех пациентов до начала лечения были выделены условно-патогенные бактерии со средним и высоким значением микробного показателя в условных единицах измерения: S. aureus, P. aeruginosa, E. coli, K. pneumoniae, C. difficile, M. tuberculosis. Также секвенировались функциональные бактерии с очень низкими значениями показателя: Lactobacillus, Bifidobacterium и S. epidermidis.
На 14-й день терапии у пациентов группы 1 показатель для S. aureus на коже снизился по сравнению с ситуацией до лечения до 1,82 (1,70; 2,00) у. е., а в группе 2 этот показатель был больше и составил 2,02 (1,84; 2,39) у. е., что говорит о статистически значимом различии (р = 0,004). При этом в основной группе обсемененность P. aeruginosa уменьшилась до 4,84 (2,99; 5,94) у. е., в группе сравнения значение было больше и соответствовало 5,31 (3,83; 6,52) у. е., но статистически не значимо (p = 0,246 по сравнению с результатами основной группы для этого срока наблюдения). Для E. coli пациенты группы 1 имели показатель на 14-й день лечения меньше, чем до лечения, и меньше, чем в группе 2. Так, для группы 1 показатель был равен 5,52 (4,90; 5,73) у. е., а в группе 2–8,49 (7,58; 8,94) у. е. при р < 0,001, т. е. различие медиан на величину, равную 2,97 у. е., статистически значимо. В случае срока наблюдения в 14-дней для микроорганизмов K. pneumonia значимых различий показателей обсемененности для групп 1 и 2 не установлено (р = 0,877). Аналогично не выявлено различий такого же показателя для групп 1 и 2 и для микроорганизмов с таксонами C. difficile (р = 0,751) и M. tuberculosis (р = 0,912).
Среди функциональных бактерий для 14-го дня лечения на пораженной коже у пациентов основной группы по сравнению с показателями до начала лечения отмечено незначительно большее значение показателя для Bifidobacterium и Lactobacillus. Однако сравнение показателей для групп 1 и 2 на 14-й день от начала лечения для функциональных бактерий не дало статистически значимого различия в медианах, полученных в основной группе и группе сравнения (табл. 4).
На 21-й день лечения у пациентов также наблюдалась отрицательная динамика обсемененности патогенов на участках кожи. Так, если на 14-й день лечения наблюдалось отличие только для двух патогенов, то на 21-й день выявлено отличие в изменениях уже для трех патогенов и одной функциональной бактерии. Меньшее значение показателя в основной группе по сравнению с группой 2 было для бактерий E. coli (р < 0,001), K. pneumonia (p = 0,041), M. tuberculosis (p = 0,017) и большее значение для Bifidobacterium (р < 0,001).
Также отмечено меньшее количество прочтений из 100 прочтений в выделенном образце биоматериала пациента для S. Aureus, равное 0,99 (0,81; 1,07) у. е. в основной группе, по сравнению с группой 2 с медианой, равной 1,05 (0,80; 1,86) у. е. (р = 0,050).
Незначимые изменения показателей между группами сравнения на 21-й день лечения наблюдались для остальных бактерий, P. aeruginosa, C. Difficile, и функциональных бактерий, S. epidermidis, Lactobacillus.
Через 6 месяцев после начала лечения установлено, что у 7 из 9 наблюдаемых бактерий медианы показателей распространенности статистически значимо отличаются для основной группы и группы сравнения (табл. 6). Значения медиан показателей для бактерий E. coli и S. aureus в группах 1 и 2 были близки. Значения медиан показателей для бактерий P. aeruginosa, K. pneumonia, C. difficile и M. tuberculosis в группе 1 были значимо меньше, чем в группе 2, а для бактерий S. epidermidis, Lactobacillus, Bifidobacterium в группе 1 были значимо больше, чем в группе 2.
В основной группе уже через 14 дней показатель распространенности двух патогенных бактерий E. coli и S. aureus был значимо меньше по сравнению с группой сравнения. Через 21 день показатель распространенности значимо меньше уже был у четырех бактерий патологического процесса и больше у одной функциональной бактерии.
К сроку в 6 месяцев уже для семи бактерий (четырех из патологического пула и трех из функционального пула) значения показателей в группе 1 были ближе к значениям для выздоровления, чем значения аналогичных показателей в группе 2.
Спустя 6 месяцев терапии у пациентов основной группы в очагах поражения установлено статистически значимое снижение показателя P. aeruginosa до 1,16 (1,02; 1,67) у. е. (p < 0,001 в сравнении со значениями до начала терапии), когда как в группе сравнения значения оказались на 0,46 у. е. (1,62 (1,22; 1,98) у. е.) больше (p < 0,001 в сравнении со значениями в основной группе) (табл. 6).
При этом K. pneumonia и C. difficile имели показатель, равный 1,05 (0,97; 1,43) у. е. и 0,09 (0,06; 0,32) у. е. соответственно в основной группе (p < 0,001 в сравнении со значениями до начала терапии и для K. pneumonia, и для C.difficile), в группе сравнения показатель был выше на 0,94 у. е. (1,99 (1,75; 2,09) у. е.) (p < 0,001 по сравнению с основной группой) и на 0,21 у. е. больше (0,30 (0,13; 0,79) у. е.) соответственно (p = 0,003 по сравнению с основной группой).
В очагах поражения у пациентов с персонализированным наружным антибиотиком среди функциональных видов рода Staphylococcus были секвенированы участки метагенома S. epidermidis (0,30 (0,24; 0,33) у. е.). В группе сравнения показатель был на 0,13 у. е. (0,17 (0,15; 0,27) у. е.) меньше (p = 0,001 в сравнении с результатом основной группы).
Показатель у представителей функциональной флоры, Bifidobacterium и Lactobacillus, был увеличен по сравнению со значениями до лечения в 2,31 и 2,10 раза соответственно (p < 0,001 с началом лечения) в группе 1, когда как в группе 2 их количество увеличилось лишь в 1,80 и 1,67 раза соответственно (p < 0,001 в сравнении с основной группой) (табл. 6 и 7). Так как лечение проводили для пациентов обеих групп, то с помощью непараметрического парного (для зависимых выборок) критерия Вилкоксона установили, что для всех бактерий и для всех сроков наблюдения в обеих группах происходило статистически значимое изменение показателя распространенности (с высокой статистической значимостью р < 0,01) по сравнению со значениями показателя до лечения. Эти изменения были направлены в сторону уменьшения для патогенных бактерий и в сторону увеличения для функциональных бактерий. Отношение значений показателей до лечения и через 6 месяцев после начала лечения приведено в таблице 7. Так, отношения показателей для группы сравнения для большинства бактерий (кроме двух, E. coli и S. aureus) значимо меньше аналогичных отношений для основной группы. Уменьшение показателя распространенности E. coli и S. aureus примерно одинаково: в 5,49 раза меньше в группе 1 и в 5,18 раза меньше в группе 2 (табл. 7).
Для анализа эффективности терапии с помощью непараметрического критерия Манна — Уитни (для независимых выборок) сравнивали значения микробных показателей между группами. Группировка статистически значимых изменений в разные сроки наблюдения и для разных микроорганизмов позволила выявить три типа ответа на разные методы терапии (табл. 8).
Первый тип поведения бактерий при лечении в обеих группах соответствовал бактериям E. coli и S. aureus, у которых к сроку в 14 дней от начала лечения уменьшение микробного показателя в группе пациентов с персонализированным наружным антибиотиком было бóльшим, чем в группе 2. Такой же эффект наблюдался и в срок 21 день от начала лечения. К сроку в 6 месяцев от начала лечения показатели для этих микроорганизмов были примерно одинаковы, т. к. различия не значимы (p = 0,290 и p = 0,176 между группами 1 и 2). Значения медиан в разные сроки наблюдения в обеих группах для первого типа поведения на примере E. coli приведены на рисунке 3.
Второй тип ответной реакции бактерий на лечение в обеих группах соответствовал бактериям K. pneumonia и M. tuberculosis, у которых только к сроку в 21 день от начала лечения уменьшение микробного показателя в группе пациентов с персонализированным наружным антибиотиком было значимо бóльшим, чем в группе сравнения. К сроку в 6 месяцев от начала лечения показатели для этих микроорганизмов были значимо разными. В основной группе он был меньше, чем в группе 2 (для K. pneumonia р < 0,001 и для M. tuberculosis р = 0,018). Значения медиан в разные сроки наблюдения в обеих группах для второго типа поведения на примере K. pneumonia приведены на рисунке 4.
Третий тип поведения бактерий при лечении в обеих группах соответствовал бактериям P. aeruginosa и C. difficile, у которых только к сроку в 6 месяцев от начала лечения различие микробного показателя с меньшим значением медиан в группе 1 по сравнению с группой 2 статистически значимо (для P. aeruginosa р = 0,011 и для C. difficile р = 0,003). Значения медиан в разные сроки наблюдения в обеих группах для третьего типа поведения на примере P. aeruginosa приведены на рисунке 5.
Поведение функциональных бактерий похоже на второй тип (для Bifidobacterium) и третий тип (для S. epidermidis и Lactobacillus).
Динамика индекса EASI на фоне предложенной терапии менялась следующим образом: до лечения значения медиан для групп практически совпадали (р = 0,706) (табл. 9); в основной группе на 14-й день терапии медианное значение индекса EASI составило 3,05 (1,64; 5,33) балла, а в группе сравнения — 5,53 (4,14; 9,88) балла (p < 0,001 по сравнению с показателями в основной группе); на 21-й день терапии в основной группе медианное значение индекса EASI составило 1,00 (0,53; 1,25) балла, а в группе сравнения — 1,84 (0,77; 4,22) балла (p = 0,006 по сравнению с основной группой).
К концу наблюдения (6-й месяц) индекс EASI в основной группе снизился от начала терапии и составил 0,70 (0,24; 1,00) балла против 1,00 (0,77; 4,22) в группе сравнения при р < 0,001. Значение медианы для основной группы уменьшилось в 25,63 раза по сравнению с показателем до лечения. Уменьшение в группе сравнения медианы индекса EASI было только в 18,03 раза, что доказывает большую эффективность терапии пациентов с персонализированным наружным антибиотиком. Уменьшение в группе сравнения медианы индекса EASI было только в 18,03 раза, что доказывает бóльшую эффективность терапии пациентов с персонализированным наружным антибиотиком.
Еще одним доказательством эффективности лечения больных в основной группе является доли пациентов с рецидивом и различными степенями тяжести остаточного заболевания. При этом легкая степень течения заболевания наблюдалась у 25/30 (83,33 %) человек, умеренная — у 3/30 (10,00 %), а средняя — у 2/30 (6,67 %). Среди пациентов основной группы у 2 пациентов произошел рецидив заболевания. Они жаловались на эритему и отек. В группе сравнения легкое течение микробной экземы было установлено у 16/30 (53,33 %) пациентов, умеренное — у 9/30 (30,00 %), а среднее — у 5/30 (16,67 %). При этом у 5 больных произошел рецидив с жалобами на эритему, единичные папулезные элементы, лихенификацию и зуд. С помощью кросс-табуляционного анализа и точного критерия Фишера в виде четырехпольной таблицы рассмотрим статистически значимое отличие долей больных с различными степенями тяжести заболевания в сравниваемых группах (табл. 10).
Доля пациентов с легкой степенью заболевания в основной группе, равная 83,33 %, статистически значимо превышает аналогичную долю пациентов в группе сравнения, равную 53,33 %, что указывает на бóльшую эффективность метода терапии в основной группе.
Дополнительные результаты исследования
В ходе выполнения работы дополнительные результаты не получены.
Нежелательные явления
Нежелательных явлений зарегистрировано не было.
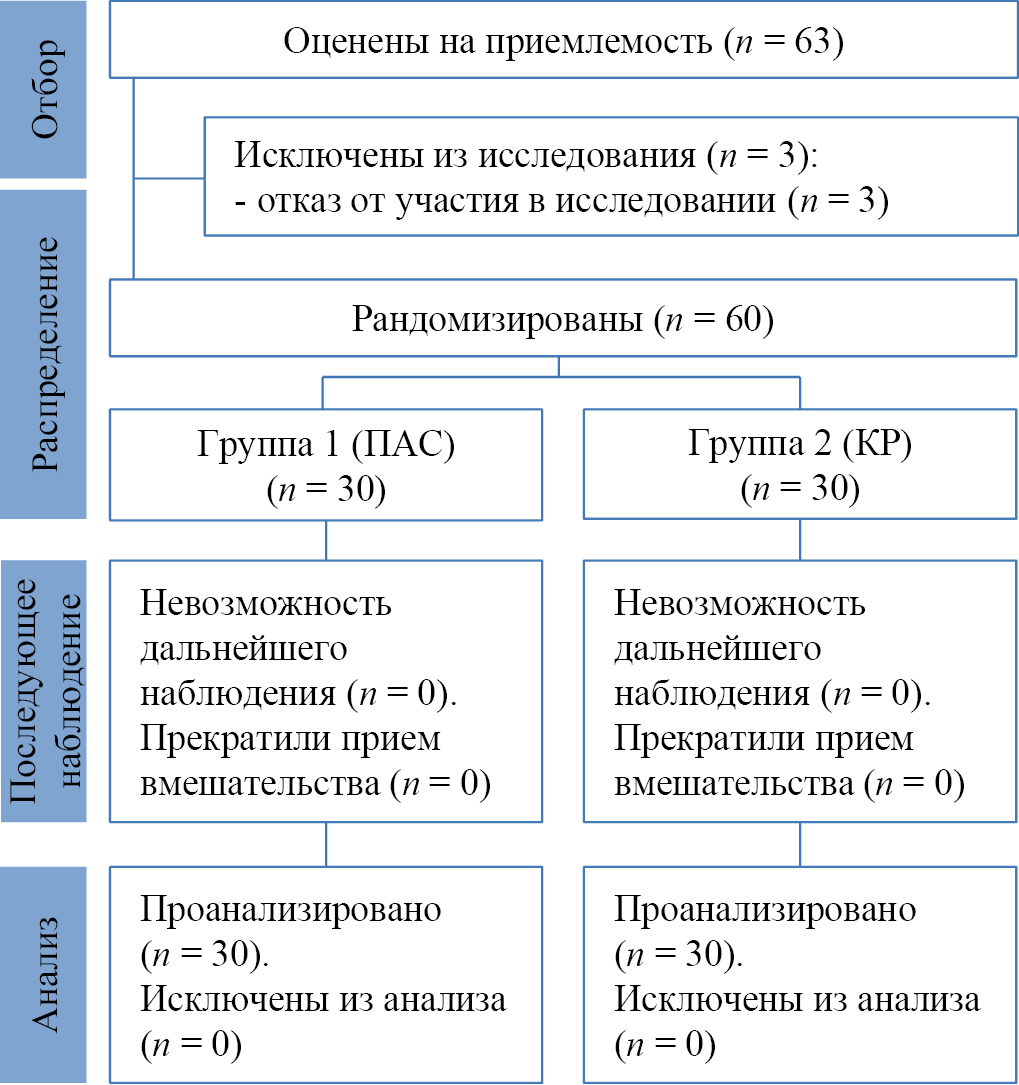
Рис. 1. Блок-схема дизайна исследования
Примечание: блок-схема выполнена авторами (согласно рекомендациям CONSORT). Сокращения: КР — терапия согласно клиническим рекомендациям; ПАС — терапия с персонализированным подбором антимикробного средства.
Fig. 1. Block diagram of the study design
Note: the block diagram was created by the authors (according to STROBE recommendations). Abbreviations: КР — therapy according to clinical guidelines; ПАС — therapy with personalized selection of antimicrobial agents.
Таблица 1. Антропометрические характеристики исследуемых групп больных
Table 1. Anthropometric characteristics of the studied groups of patients
|
Показатель |
Группа 1 (n = 30) |
Группа 2 (n = 30) |
Уровень значимости р |
|
Пол, (n)муж/(n)жен |
15/15 |
15/15 |
|
|
Возраст, лет |
37,50 ± 13,71 |
41,43 ± 16,14 |
0,313 |
|
Рост, см |
171 ± 9 |
170 ± 88 |
0,832 |
|
Масса, кг |
70,1 ± 14,2 |
67,5 ± 13, |
0,475 |
|
ИМТ, кг/м 2 |
23,6 ± 2,9 |
22,9 ± 3,1 |
0,354 |
Примечание: таблица составлена авторами. Сокращение: ИМТ — индекс массы тела.
Note: the table was compiled by the authors. Abbreviation: ИМТ — body mass index.
Таблица 2. Микробиомный профиль в виде Ме (Q1; Q3) у больных в исследуемых группах до лечения
Table 2. Microbiome profile (Me (Q1; Q3) in patients in the studied groups before treatment
|
Микробиом |
Группа 1 (n = 30) |
Группа 2 (n = 30) |
Уровень значимости р |
|
E. coli |
9,39 (8,34; 9,75) |
9,49 (8,34; 9,84) |
0,717 |
|
P. aeruginosa |
7,04 (5,53; 8,43) |
7,04 (5,52; 8,42) |
0,929 |
|
K. pneumonia |
4,44 (4,01 5,95) |
4,43 (4,01 5,94) |
0,994 |
|
S. aureus |
2,05 (1,86; 2,44) |
2,04 (1,84; 2,44) |
0,988 |
|
C. difficile |
1,97 (1,51; 2,14) |
1,96 (1,50; 2,13) |
0,994 |
|
M. tuberculosis |
0,94 (0,79; 1,08) |
0,93 (0,78; 1,07) |
0,993 |
|
S. epidermidis |
0,03 (0,02; 0,05) |
0,02 (0,01; 0,05) |
0,631 |
|
Lactobacillus |
1,01 (0,88; 1,27) |
1,02 (0,86; 1,27) |
0,906 |
|
Bifidobacterium |
0,35 (0,32; 0,39) |
0,35 (0,30; 0,38) |
0,848 |
Примечания: таблица составлена авторами; показатели результатов секвенирования представлены в условных единицах.
Notes: the table was compiled by the authors; the sequencing results are presented in arbitrary units.
Таблица 3. Клинические показатели у больных в исследуемых группах
Table 3. Clinical parameters in patients in the studied groups
|
Показатель |
Группа 1 (n = 30) |
Группа 2 (n = 30) |
Уровень значимости р |
|
Индекс EASI, баллов |
17,94 (10,51; 29,10) |
18,03 (11,32; 29,59) |
0,706 |
|
Длительность заболевания, мес. |
18,5 (9,5; 29,3) |
18,0 (12,0; 29,8) |
0,871 |
|
Степень тяжести заболевания |
|||
|
Средняя, количество/доля |
17/0,57 |
19/0,63 |
0,599 |
|
Тяжелая, количество/доля |
13/0,43 |
11/0,37 |
0,599 |
Примечание: таблица составлена авторами. Сокращение: EASI (Eczema Area and Severity Index) — индекс площади поражения и тяжести атопического дерматита.
Note: the table was compiled by the authors. Abbreviation: EASI — Eczema Area and Severity Index.
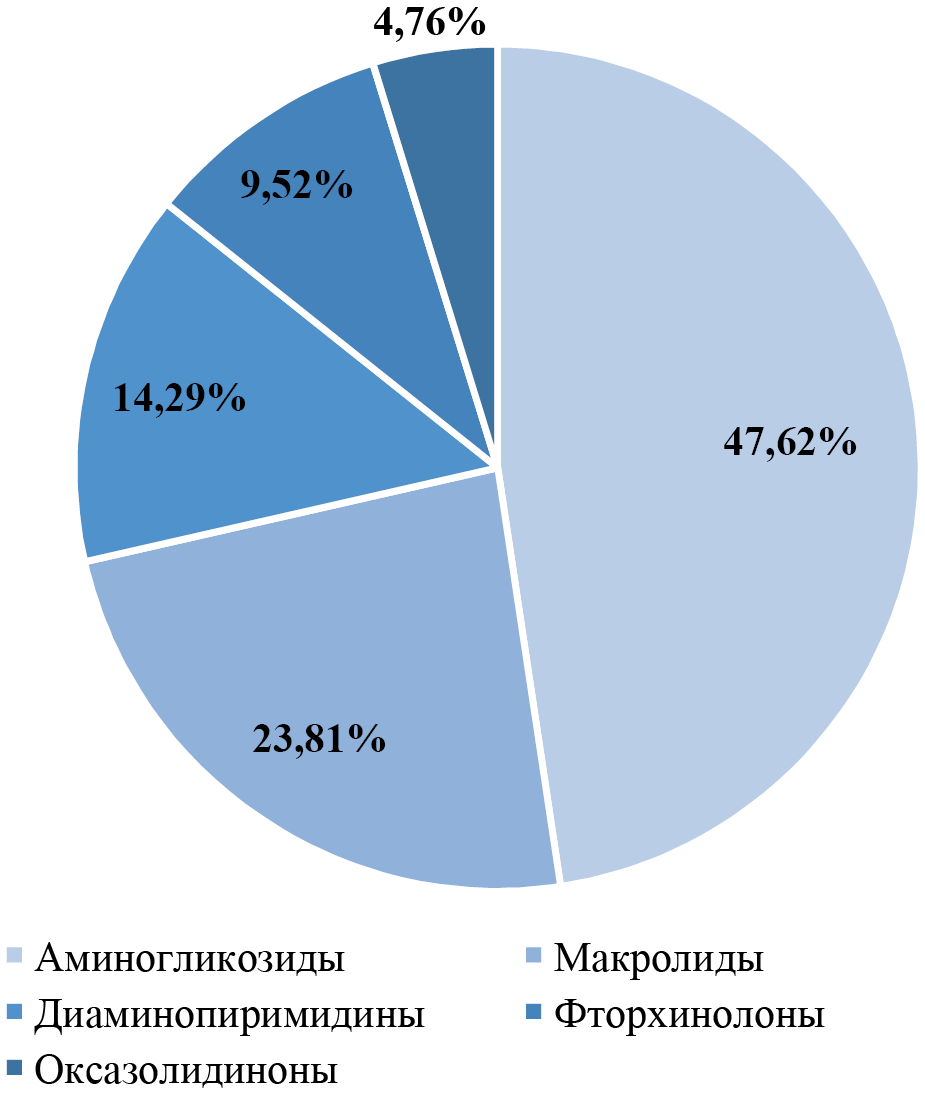
Рис. 2. Группы антибиотиков, к которым резистентна Staphylococcus aureus
Примечание: рисунок выполнен авторами.
Fig. 2. Groups of antibiotics to which Staphylococcus aureus is resistant
Note: the figure was created by the authors.
Таблица 4. Микробиомный профиль в виде Ме (Q1; Q3) у больных в исследуемых группах на 14-й день
Table 4. Microbiome profile (Me (Q1; Q3) in patients in the study groups on day 14
|
Микробиом |
Группа 1 (n = 30) |
Группа 2 (n = 30) |
Уровень значимости р* |
|
E. coli |
5,52 (4,90; 5,73) |
8,61 (7,58; 8,94) |
<0,001 |
|
P. aeruginosa |
4,84 (2,99; 5,94) |
5,31 (3,83; 6,51) |
0,245 |
|
K. pneumonia |
4,44 (4,00; 5,72) |
4,43 (4,01; 5,94) |
0,876 |
|
S. aureus |
1,82 (1,65; 1,98) |
2,02 (1,84; 2,39) |
0,003 |
|
C. difficile |
1,95 (1,51; 2,10) |
1,96 (1,50; 2,14) |
0,750 |
|
M. tuberculosis |
0,93 (0,78; 1,06) |
0,93 (0,79; 1,08) |
0,911 |
|
S. epidermidis |
0,04 (0,03; 0,05) |
0,04 (0,03; 0,05) |
0,773 |
|
Lactobacillus |
1,11 (0,95; 1,40) |
1,02 (0,88; 1,27) |
0,125 |
|
Bifidobacterium |
0,39 (0,34; 0,43) |
0,38 (0,33; 0,41) |
0,399 |
Примечания: таблица составлена авторами; р* — по критерию Манна — Уитни; показатели результатов секвенирования представлены в условных единицах.
Notes: the table was compiled by the authors; p* — by the Mann — Whitney criterion; the sequencing results are presented in arbitrary units.
Таблица 5. Микробиомный профиль в виде Ме (Q1; Q3) у больных в исследуемых группах на 21-й день лечения
Table 5. Microbiome profile (Me (Q1; Q3) in patients in the studied groups on day 21 of treatment
|
Микробиом |
Группа 1 (n = 30) |
Группа 2 (n = 30) |
Уровень значимости р* |
|
E. coli |
4,60 (4,08; 4,77) |
6,32 (5,55; 6,53) |
<0,001 |
|
P.aeruginosa |
4,50 (2,98; 5,49) |
5,00 (3,79; 5,79) |
0,442 |
|
K. pneumonia |
3,42 (3,02; 4,05) |
3,94 (3,22; 4,93) |
0,041 |
|
S. aureus |
0,99 (0,81; 1,07) |
1,05 (0,80; 1,86) |
0,050 |
|
C. difficile |
1,53 (1,11; 1,96) |
1,38 (1,01; 1,97) |
0,853 |
|
M. tuberculosis |
0,63 (0,51; 0,75) |
0,72 (0,62; 0,83) |
0,017 |
|
S. epidermidis |
0,10 (0,08; 0,11) |
0,09 (0,06; 0,12) |
0,214 |
|
Lactobacillus |
1,13 (0,96; 1,42) |
1,03 (0,89; 1,27) |
0,131 |
|
Bifidobacterium |
0,55 (0,47; 0,59) |
0,40 (0,35; 0,43) |
<0,001 |
Примечания: таблица составлена авторами; р* — по критерию Манна — Уитни; показатели результатов секвенирования представлены в условных единицах.
Notes: the table was compiled by the authors; p* — by the Mann — Whitney criterion; the sequencing results are presented in arbitrary units.
Таблица 6. Микробиомный профиль в виде Ме (Q1; Q3) у больных в исследуемых группах на 6-й месяц лечения
Table 6. Microbiome profile (Me (Q1; Q3) in patients in the studied groups on the 6th month of treatment
|
Микробиом |
Группа 1 (n = 30) |
Группа 2 (n = 30) |
Уровень значимости р* |
|
E. coli |
1,71 (1,04; 2,17) |
1,83 (1,23; 2,41) |
0,290 |
|
P. aeruginosa |
1,16 (1,02; 1,67) |
1,62 (1,22; 1,98) |
0,011 |
|
K. pneumonia |
1,05 (0,97; 1,43) |
1,99 (1,75; 2,09) |
<0,001 |
|
S. aureus |
0,65 (0,46; 0,80) |
0,69 (0,61; 0,90) |
0,176 |
|
C. difficile |
0,09 (0,06; 0,32) |
0,30 (0,13; 0,79) |
0,003 |
|
M. tuberculosis |
0,38 (0,27; 0,50) |
0,50 (0,38; 0,60) |
0,018 |
|
S. epidermidis |
0,30 (0,24; 0,33) |
0,17 (0,15; 0,27) |
0,001 |
|
Lactobacillus |
2,12 (1,83; 2,67) |
1,70 (1,46; 2,10) |
<0,001 |
|
Bifidobacterium |
0,81 (0,72; 0,89) |
0,63 (0,57; 0,68) |
<0,001 |
Примечания: таблица составлена авторами; р* — по критерию Манна — Уитни; показатели результатов секвенирования представлены в условных единицах.
Notes: the table was compiled by the authors; p* — by the Mann — Whitney criterion; the sequencing results are presented in arbitrary units.
Таблица 7. Отношения медианных значений показателей распространенности бактерий до лечения и через 6 месяцев после начала лечения в исследуемых группах больных
Table 7. Median values of bacterial prevalence rates before treatment and 6 months after the start of treatment in the studied groups of patients
|
Микробиом |
Группа 1 (n = 30) |
Группа 2 (n = 30) |
Уровень значимости р* |
|
E. coli |
5,49 |
5,18 |
0,290 |
|
P. aeruginosa |
6,07 |
4,35 |
0,011 |
|
K. pneumonia |
4,23 |
2,23 |
<0,001 |
|
S. aureus |
3,15 |
2,96 |
0,176 |
|
C. difficile |
21,89 |
6,53 |
0,003 |
|
M. tuberculosis |
2,47 |
1,86 |
0,018 |
|
S. epidermidis |
10,00 |
8,50 |
0,001 |
|
Lactobacillus |
2,10 |
1,67 |
<0,001 |
|
Bifidobacterium |
2,31 |
1,80 |
<0,001 |
Примечания: таблица составлена авторами; р* — по критерию Манна — Уитни.
Notes: the table was compiled by the authors; p* — by the Mann — Whitney criterion.
Таблица 8. Значения уровней статистической значимости различий медианных значений микробных показателей больных по типу ответа на терапию для разных сроков наблюдения в исследуемых группах
Table 8. Statistical significance levels of differences in median values of microbial parameters of patients by type of response to therapy for different periods of observation in the studied groups
|
Микробиом |
До лечения |
Через 14 дней |
Через 21 день |
Через 6 месяцев |
|
Тип 1 поведения патогенов |
||||
|
E. coli |
0,717 |
р < 0,001 |
р < 0,001 |
p = 0,290 |
|
S. aureus |
0,988 |
p = 0,003 |
p = 0,050 |
p = 0,176 |
|
Тип 2 поведения патогенов |
||||
|
K. pneumonia |
0,994 |
p = 0,876 |
p = 0,041 |
р < 0,001 |
|
M. tuberculosis |
0,993 |
p = 0,911 |
p = 0,017 |
p = 0,018 |
|
Тип 3 поведения патогенов |
||||
|
P. aeruginosa |
0,929 |
p = 0,245 |
p = 0,442 |
p = 0,011 |
|
C. difficile |
0,994 |
p = 0,750 |
p = 0,853 |
p = 0,003 |
|
Функциональные бактерии |
||||
|
S. epidermidis |
0,631 |
p = 0,773 |
p = 0,214 |
p = 0,001 |
|
Lactobacillus |
0,906 |
p = 0,125 |
p = 0,131 |
р < 0,001 |
|
Bifidobacterium |
0,848 |
p = 0,399 |
р < 0,001 |
р < 0,001 |
Примечание: таблица составлена авторами.
Note: the table was compiled by the authors.
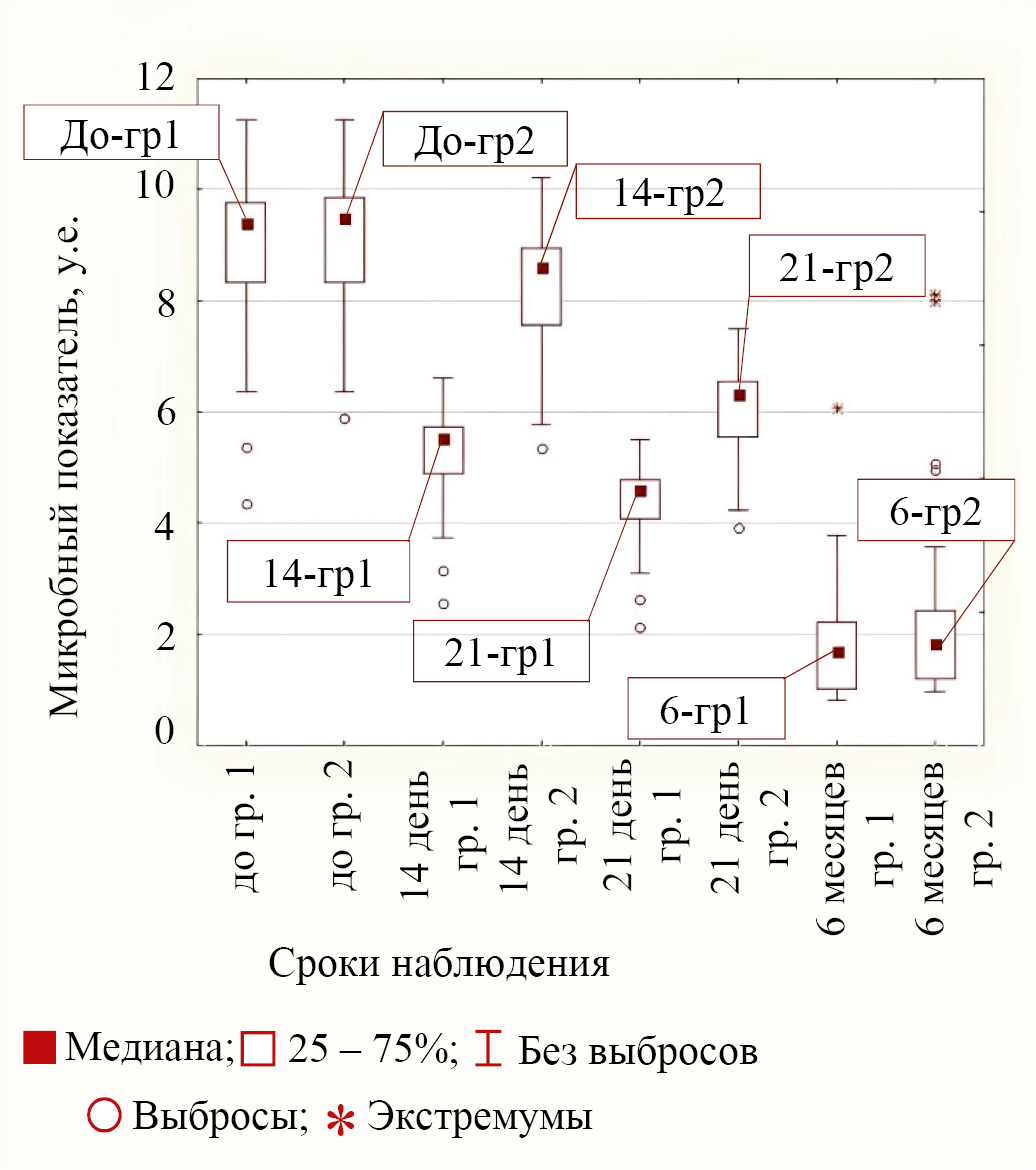
Рис. 3. Значения медиан микробного показателя для бактерии E. coli в группах (группа 1 — основная группа, группа 2 — группа сравнения) для различных сроков наблюдения
Примечание: рисунок выполнен авторами. Сокращение: гр — группа.
Fig. 3. Medians of microbial parameter values for E. coli bacteria in groups (Group 1 is the main group, Group 2 is the control group) for different observation periods
Note: the figure was made by the authors. Abbreviation: гр — group.
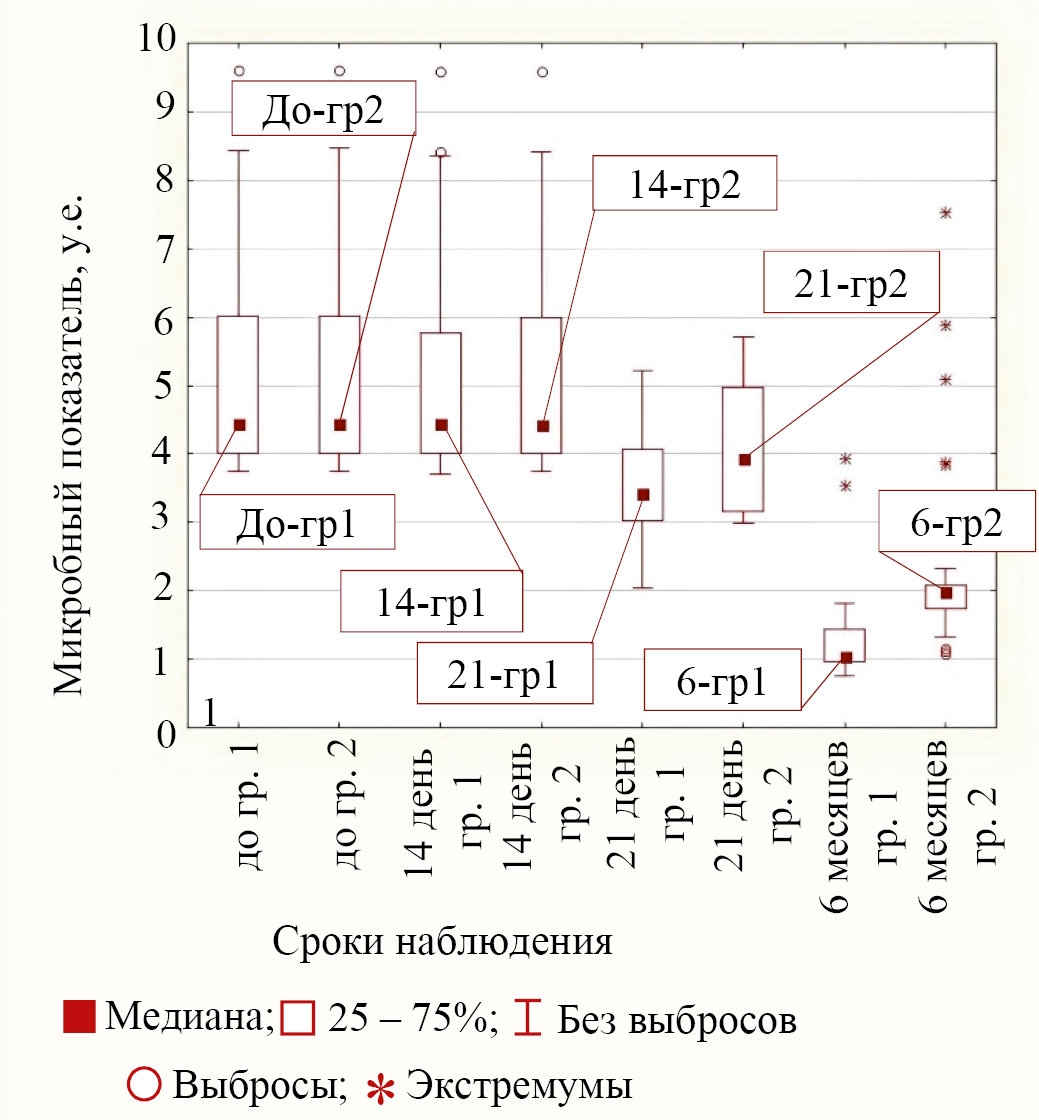
Рис. 4. Значения медиан микробного показателя для бактерии K. pneumonia в группах (группа 1 — основная группа, группа 2 — группа сравнения) для различных сроков наблюдения
Примечание: рисунок выполнен авторами. Сокращение: гр — группа.
Fig. 4. Medians of microbial parameter values for K. pneumonia bacteria in groups (Group 1 is the main group, Group 2 is the control group) for different observation periods
Note: the figure was made by the authors. Abbreviation: гр — group.
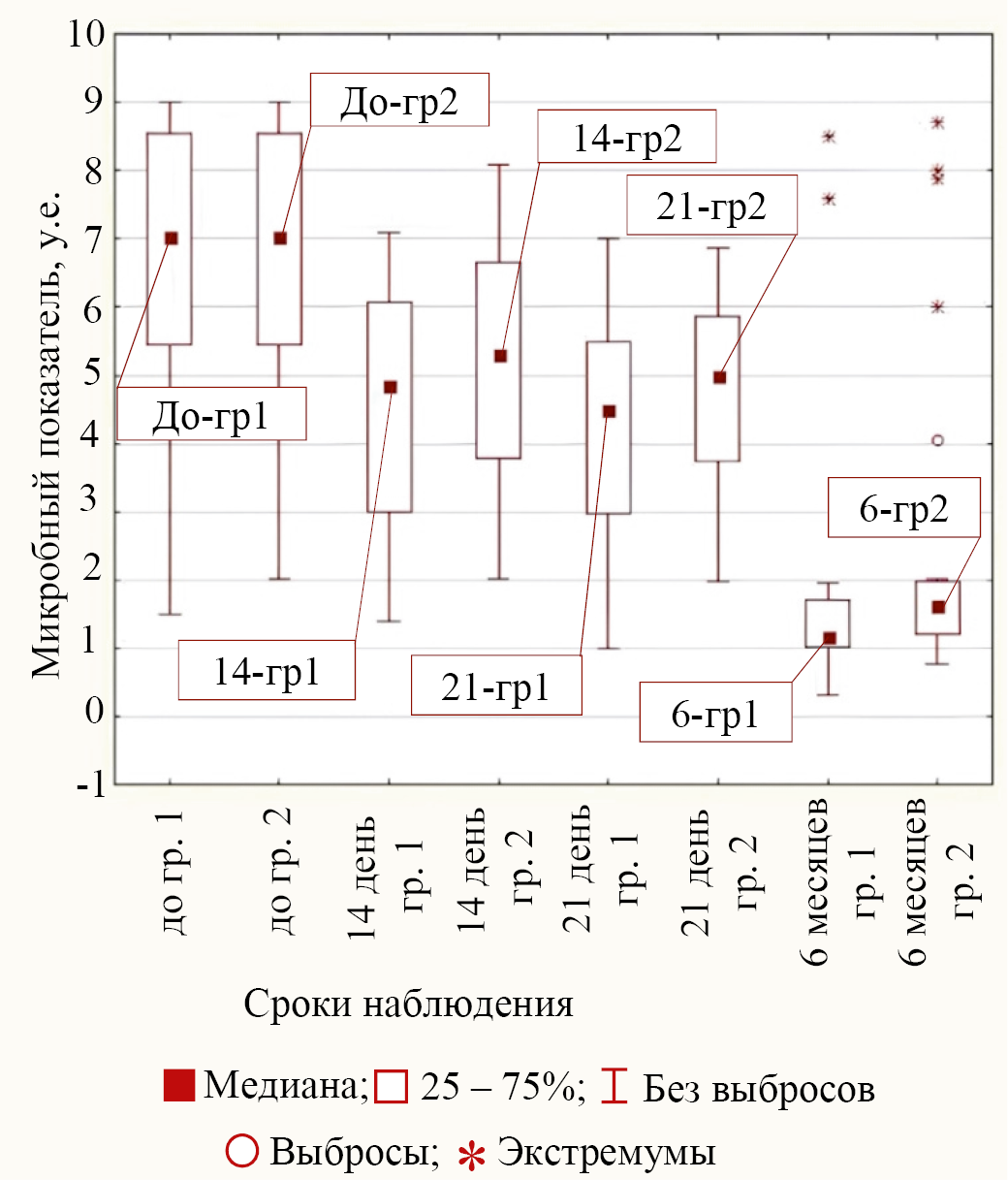
Рис. 5. Значения медиан микробного показателя для бактерии P. aeruginosa в группах (группа 1 — основная группа, группа 2 — группа сравнения) для различных сроков наблюдения
Примечание: рисунок выполнен авторами. Сокращение: гр — группа.
Fig. 5. Medians of microbial parameter values for P. aeruginosa bacteria in groups (Group 1 is the main group, Group 2 is the control group) for different observation periods
Note: the figure was made by the authors. Abbreviation: гр — group
Таблица 9. Значения медиан индекса EASI для различных сроков наблюдения в сравниваемых группах больных
Table 9. Medians of the EASI score for different observation periods in the compared groups of patients
|
Сроки наблюдения |
Группа 1 (n = 30) |
Группа 2 (n = 30) |
Уровень значимости р* |
|
До лечения |
17,94 (10,51; 29,10) |
18,03 (11,32; 29,59) |
0,706 |
|
Через 14 дней |
3,05 (1,64; 5,33) |
5,53 (4,14; 9,88) |
<0,001 |
|
Через 21 день |
1,00 (0,53; 1,25) |
1,84 (0,95; 4,01) |
0,006 |
|
Через 6 месяцев |
0,70 (0,24; 1,00) |
1,00 (0,77; 4,22) |
<0,001 |
Примечания: таблица составлена авторами; р* — по критерию Манна — Уитни. Сокращение: EASI (Eczema Area and Severity Index) — индекс площади поражения и тяжести атопического дерматита.
Notes: the table was compiled by the authors; p* — by the Mann — Whitney criterion.
Таблица 10. Количество больных и их доли с различными степенями тяжести остаточного заболевания в группах сравнения
Table 10. Number of patients and their shares with different severity of residual disease in the compared groups
|
Степень тяжести |
Группа 1 (n = 30) |
Группа 2 (n = 30) |
Уровень значимости р* |
|
Легкая, абс/отн % |
25/83,33 |
16/53,33 |
0,015 |
|
Умеренная, абс/отн % |
3/10,00 |
9/30,00 |
0,063 |
|
Средняя, абс/отн % |
2/6,67 |
5/16,67 |
0,263 |
Примечания: таблица составлена авторами; р* — по критерию хи-квадрат или по точному критерию Фишера.
Notes: the table was compiled by the authors; p* — by Chi-square test or Fisher’s exact test.
ОБСУЖДЕНИЕ
Ограничения исследования
Фактором, потенциально ограничивающим исследование, может выступать сравнительно небольшая статистическая мощность из-за ограниченного числа пациентов.
Обобщаемость/экстраполяция
Результаты настоящего исследования могут распространяться и на другие клинические и экспериментальные условия. Например, при использовании других топических антибактериальных средств, отличных от применяемых в данном исследовании, в ходе WGS может наблюдаться схожая тенденция изменения микробиома пораженных участков кожи.
Резюме основного результата исследования
В исследовании проанализирован состав микробиома пораженных участков кожи пациентов с МЭ. До начала терапии в ходе WGS установлено, что на коже преобладают условно-патогенные бактерии, а количество функциональных было ограничено. Предложенная комбинированная терапия с использованием ФКР и персонализированных топических антибактериальных средств показала высокую эффективность в терапии хронической микробной экземы, что подтверждается снижением доли патогенов в основной группе в большей степени, чем в группе сравнения, и сниженным количеством рецидивов заболевания. Так, комбинированная терапия с использованием персонализированных топических антибактериальных средств показала высокую эффективность в терапии хронической микробной экземы.
Обсуждение основного результата исследования
Сравнительный анализ результатов лечения пациентов обеих групп в конце терапии показал более высокую выраженность дисбиотических изменений на исследуемых участках кожи в группе сравнения.
Антибиотикорезистентность бактерий на коже ранее изучалась другими авторами с помощью метода серийных разведений в агаре или диффузионным методом с использованием дисков, пропитанных антибиотиками [20]. Ряд авторов отмечают, что наибольшая терапевтическая эффективность среди топических антибиотиков, действительно, наблюдается у фузидиевой кислоты и мупироцина, что согласуется с проведенным исследованием [21–25]. Другие исследователи в своих работах предпочитают комбинированные препараты, включающие два или три топических антибиотика, к которым устойчивость грамположительных и грамотрицательных бактерий развивается сравнительно медленно [26–28]. Однако ранее не исследовался метод персонализированной антибактериальной терапии кожных заболеваний с учетом данных WGS.
Проведенное с помощью метода WGS исследование подтверждает резистентность S. aureus на коже к ряду антибактериальных препаратов, а также дает возможность персонализированного подбора топических средств. Терапия, проведенная в основной группе пациентов, позволила снизить количество рецидивов в 2,5 раза.
Анализ динамики кожного патологического процесса выявил более ранний регресс и отчетливое уменьшение тяжести течения экзематозного процесса у пациентов, в схеме лечения которых был применен персонализированный топический антибиотик. Более того, уже на 14-й день доля представителей функциональной флоры у пациентов этой группы стала больше (в 1,1 раза при p < 0,001), что не было характерно для больных со стандартной терапией.
Результаты, полученные в ходе WGS, свидетельствуют о том, что предложенная в основной группе комплексная терапия с применением персонализированного топического антибактериального средства на основе фузидиевой кислоты уже с 14-го дня позволила достоверно снизить уровни S. aureus и E. coli (р < 0,001 в сравнении с показатели до начала лечения), что также могло отразиться на сниженном количестве рецидивов заболевания. В группе сравнения тенденция снижения числа этих условно-патогенных бактерий была ниже (р < 0,001 по сравнению с результатами основной группы). Подтверждением также является более низкое значение индекса EASI у пациентов основной группы (p < 0,001).
На 6-й месяц терапии наблюдалось восстановление микробиома кожи, о чем говорит бóльшая доля функциональных микроорганизмов (Bifidobacterium, Lactobacillus и S. epidermidis) у пациентов обеих групп. Это может свидетельствовать об эффективности применения эмолента с пробиотическим компонентом в терапии микробной экземы.
Таким образом, можно сделать вывод, что персонализированный подбор топических антибактериальных средств способствует более качественному восстановлению кожного барьера: количество рецидивов в основной группе пациентов на 6-й месяц терапии в 2,5 раза меньше (2 рецидива против 5). Однако для сведения частоты рецидивов к нулю необходим более комплексный подход, в частности персонализированное применение системных антибактериальных препаратов.
ЗАКЛЮЧЕНИЕ
Проведена оценка состояния микробиома кожи у пациентов с хронической микробной экземой и определено, что биоценоз пораженных участков характеризовался высокой степенью обсемененности представителями условно-патогенной микрофлоры, при этом количество представителей функциональной флоры было ограничено. Установлено, что дисбаланс микрофлоры способствует хронизации воспалительного процесса и повышает риск рецидивов. Применение стандартной терапии в сочетании с персонализированным подбором топических антибактериальных средств позволило снизить долю рецидивов заболевания и нормализовать состав микрофлоры кожи у пациентов основной группы. Полученные данные подтверждают важность индивидуального подхода в лечении, учитывающего особенности микробного состава кожи. Научное значение результатов заключается в том, что они демонстрируют возможность оптимизации лечения больных с хронической микробной экземой с помощью WGS, что открывает перспективы для разработки более эффективных терапевтических стратегий. В дальнейших исследованиях целесообразно изучить взаимосвязь между микробиомом кожи и кишечника («ось кожа — кишечник») для достижения долгосрочного результата лечения, поскольку их состояние и особенности могут играть ключевую роль в патогенезе заболевания.
1 Общероссийская общественная организация «Российское общество дерматовенерологов и косметологов». Клинические рекомендации. Экзема. 2024. 56 с.
2 Общероссийская общественная организация «Российское общество дерматовенерологов и косметологов». Клинические рекомендации. Экзема. 2024. 56 с.
3 Там же.
4 Общероссийская общественная организация «Российское общество дерматовенерологов и косметологов». Клинические рекомендации. Экзема. 2024. 56 с.
Список литературы
1. Силина Л.В., Шварц Н.Е. Микробиом кожи при микробной экземе. Клиническая дерматология и венерология. 2019;18(1):49–55. https://doi.org/10.17116/klinderma20191801149
2. Hülpüsch C, Rohayem R, Reiger M, Traidl-Hoffmann C. Exploring the skin microbiome in atopic dermatitis pathogenesis and disease modification. J Allergy Clin Immunol. 2024;154(1):31–41. https://doi.org/10.1016/j.jaci.2024.04.029
3. Salem I, Ramser A, Isham N, Ghannoum MA. The Gut Microbiome as a Major Regulator of the Gut-Skin Axis. Front Microbiol. 2018;9:1459. https://doi.org/10.3389/fmicb.2018.01459
4. Widhiati S, Purnomosari D, Wibawa T, Soebono H. The role of gut microbiome in inflammatory skin disorders: A systematic review. Dermatol Reports. 2021;14(1):9188. https://doi.org/10.4081/dr.2022.9188
5. Ahmad F, Alam MA, Ansari AW, Jochebeth A, Leo R, Al-Abdulla MN, Al-Khawaga S, AlHammadi A, Al-Malki A, Al Naama K, Ahmad A, Buddenkotte J, Steinhoff M. Emerging Role of the IL-36/IL-36R Axis in Multiple Inflammatory Skin Diseases. J Invest Dermatol. 2024;144(2):206–224. https://doi.org/10.1016/j.jid.2023.11.004
6. Роживанова Т.А., Полеско И.В., Щербакова М.Ю. Современные представления о микробиоценозе кожи и кишечника у больных экземой и метаболическим синдромом. Клиническая дерматология и венерология. 2015;14(2):11–16. https://doi.org/10.17116/klinderma201514211-16
7. Kobayashi T, Nagao K. Host-microbial dialogues in atopic dermatitis. Int Immunol. 2019;31(7):449–456. https://doi.org/10.1093/intimm/dxz026
8. Ковалева Ю.С., Комкина Н.Г. Микробная экзема — триггерные точки воздействия. Медицинский совет. 2023;17(2):37–44. https://doi.org/10.21518/ms2022-031.
9. Baviera G, Leoni MC, Capra L, Cipriani F, Longo G, Maiello N, Ricci G, Galli E. Microbiota in healthy skin and in atopic eczema. Biomed Res Int. 2014;2014:436921. https://doi.org/10.1155/2014/436921
10. Murzina E, Kaliuzhna L, Bardova K, Yurchyk Y, Barynova M. Human Skin Microbiota in Various Phases of Atopic Dermatitis. Acta Dermatovenerol Croat. 2019;27(4):245–249.
11. Кузнецов К.О., Тукбаева Л.Р., Казакова В.В., Мирзоева К.Р., Богомолова Е.А., Салахутдинова А.И., Пономарева Д.Ю., Гарипова А.Р., Муцольгова М.С.-М., Галимханов А.Г., Сахибгареев М.И., Гужвиева Э.Р. Влияние COVID-19 на антибиотикорезистентность в педиатрической популяции. Педиатрическая фармакология. 2022;19(6):503–513. http://dx.doi.org/10.15690/pf.v19i6.2465
12. Shah RA, Hsu JI, Patel RR, Mui UN, Tyring SK. Antibiotic resistance in dermatology: The scope of the problem and strategies to address it. J Am Acad Dermatol. 2022;86(6):1337–1345. https://doi.org/10.1016/j.jaad.2021.09.024
13. Miller AC, Adjei S, Temiz LA, Tyring SK. Antibiotic Resistance in Dermatology Part 1: Mechanisms of Resistance. Skin Therapy Lett. 2023;28(1):7–10
14. Stracy M, Snitser O, Yelin I, Amer Y, Parizade M, Katz R, Rimler G, Wolf T, Herzel E, Koren G, Kuint J, Foxman B, Chodick G, Shalev V, Kishony R. Minimizing treatment-induced emergence of antibiotic resistance in bacterial infections. Science. 2022;375(6583):889–894. https://doi.org/10.1126/science.abg9868
15. Bin L, Malley C, Taylor P, Preethi Boorgula M, Chavan S, Daya M, Mathias M, Shankar G, Rafaels N, Vergara C, Potee J, Campbell M, Hanifin JM, Simpson E, Schneider LC, Gallo RL, Hata T, Paller AS, De Benedetto A, Beck LA, Ong PY, Guttman-Yassky E, Richers B, Baraghoshi D, Ruczinski I, Barnes KC, Leung DYM, Mathias RA. Whole genome sequencing identifies novel genetic mutations in patients with eczema herpeticum. Allergy. 2021 Aug;76(8):2510–2523. https://doi.org/10.1111/all.14762
16. Олисова О.Ю., Свитич О.А., Поддубиков А.В., Вартанова Н.А., Потапова М.Б. Микробиологическая оценка эффективности стандартной терапии при атопическом дерматите. Вестник дерматологии и венерологии. 2023;99(3):44–52. https://doi.org/10.25208/vdv1364
17. Fölster-Holst R. The role of the skin microbiome in atopic dermatitis - correlations and consequences. J Dtsch Dermatol Ges. 2022;20(5):571– 577. https://doi.org/10.1111/ddg.14709
18. Тлиш М.М., Кузнецова Т.Г., Наатыж Ж.Ю, Псавок Ф.А. Микробная экзема: возможности коррекции на современном этапе. Вестник дерматологии и венерологии. 2018;94(4):60–67. https://doi.org/10.25208/0042-4609-2018-94-4-60-67
19. Hanifin JM, Baghoomian W, Grinich E, Leshem YA, Jacobson M, Simpson EL. The Eczema Area and Severity Index-A Practical Guide. Dermatitis. 2022;33(3):187–192. https://doi.org/10.1097/DER.0000000000000895
20. Муравьева А.С., Лыков И.Н. Медико-экологические аспекты антибиотикорезистентности микробиома кожи у членов семьи. Проблемы региональной экологии. 2023;3:27–31. https://doi.org/10.24412/1728-323X-2023-3-27-32
21. Пирузян АЛ, Невозинская ЗА, Корсунская ИМ. Кожные бактериальные инфекции— всегда актуальная проблема. Медицинский Совет. 2021;8:63–66. https://doi.org/10.21518/2079-701X-2021-8-63-66
22. Тараско А.Д. Хроническая глубокая рецидивирующая пиодермия в амбулаторной практике хирурга. Амбулаторная хирургия. 2021;18(2):144–150. https://doi.org/10.21518/1995-1477-2021-18-2-144-150
23. Тлиш М.М., Попандопуло Е.К. Оценка эффективности применения ультратонотерапии у больных микробной экземой. Вопросы курортологии, физиотерапии и лечебной физической культуры. 2022;99(5):48–53. https://doi.org/10.17116/kurort20229905148
24. Mlynarczyk-Bonikowska B, Kowalewski C, Krolak-Ulinska A, Marusza W. Molecular Mechanisms of Drug Resistance in Staphylococcus aureus. Int J Mol Sci. 2022;23(15):8088. https://doi.org/10.3390/ijms23158088
25. Xie J, Li M, Yang S, Dong Q. Topical administration of mupirocin ointment and fusidic acid in bacterial infection-induced skin diseases. Postepy Dermatol Alergol. 2025;42(1):42–46. https://doi.org/10.5114/ada.2024.145185
26. Chu DK, Chu AWL, Rayner DG, Guyatt GH, Yepes-Nuñez JJ, Gomez-Escobar L, Pérez-Herrera LC, Díaz Martinez JP, Brignardello-Petersen R, Sadeghirad B, Wong MM, Ceccacci R, Zhao IX, Basmaji J, MacDonald M, Chu X, Islam N, Gao Y, Izcovich A, Asiniwasis RN, Boguniewicz M, De Benedetto A, Capozza K, Chen L, Ellison K, Frazier WT, Greenhawt M, Huynh J, LeBovidge J, Lio PA, Martin SA, O’Brien M, Ong PY, Silverberg JI, Spergel JM, Smith Begolka W, Wang J, Wheeler KE, Gardner DD, Schneider L. Topical treatments for atopic dermatitis (eczema): Systematic review and network meta-analysis of randomized trials. J Allergy Clin Immunol. 2023;152(6):1493–1519. https://doi.org/10.1016/j.jaci.2023.08.030
27. Коцур Ю.М., Черных Т.Ф., Флисюк Е.В., Наркевич И.А. Разработка состава топической формы производного тиадиазола. Разработка и регистрация лекарственных средств. 2024;13(4):121–128. https://doi.org/10.33380/2305-2066-2024-13-4-1931
28. Lax SJ, Van Vogt E, Candy B, Steele L, Reynolds C, Stuart B, Parker R, Axon E, Roberts A, Doyle M, Chu DK, Futamura M, Santer M, Williams HC, Cro S, Drucker AM, Boyle RJ. Topical Anti-Inflammatory Treatments for Eczema: A Cochrane Systematic Review and Network Meta-Analysis. Clin Exp Allergy. 2024;54(12):960–972. https://doi.org/10.1111/cea.14556
Об авторах
В. В. ЛазаревРоссия
Лазарев Вениамин Викторович - ассистент кафедры дерматовенерологии,
ул. им. Митрофана Седина, д. 4, г. Краснодар, 350063
М. М. Тлиш
Россия
Тлиш Марина Моссовна - доктор медицинских наук, профессор, заведующая кафедрой дерматовенерологии,
ул. им. Митрофана Седина, д. 4, г. Краснодар, 350063
М. Е. Шавилова
Россия
Шавилова Марина Евгеньевна - кандидат медицинских наук, ассистент кафедры дерматовенерологии,
ул. им. Митрофана Седина, д. 4, г. Краснодар, 350063
Дополнительные файлы
Рецензия
Для цитирования:
Лазарев В.В., Тлиш М.М., Шавилова М.Е. Возможности персонализированного подбора топических антибактериальных средств у больных микробной экземой на основе данных полногеномного секвенирования: проспективное сравнительное рандомизированное исследование. Кубанский научный медицинский вестник. 2025;32(4):18-32. https://doi.org/10.25207/1608-6228-2025-32-4-18-32
For citation:
Lazarev V.V., Tlish M.M., Shavilova M.E. Personalized selection of topical antibacterial agents in patients with microbial eczema based on whole genome sequencing data: A prospective сomparative randomized study. Kuban Scientific Medical Bulletin. 2025;32(4):18-32. https://doi.org/10.25207/1608-6228-2025-32-4-18-32
JATS XML








































