Перейти к:
Характеристика патогенной микрофлоры при гнойно-септических осложнениях послеродового периода: ретроспективное когортное исследование
https://doi.org/10.25207/1608-6228-2023-30-3-15-24
Аннотация
Введение. Гнойно-септические осложнения послеродового периода занимают лидирующие позиции в структуре причин материнской смертности. Информация о характеристике патогенной микрофлоры при различных формах осложнений и анализ ее резистентности к антибактериальным препаратам определяют выбор рациональной терапии при данной патологии.
Цель исследования — оценить высеваемую патогенную микрофлору у родильниц с гнойно-септическими осложнениями послеродового периода.
Методы. Работа выполнена по дизайну ретроспективного когортного исследования на базе кафедры акушерства и гинекологии № 2 федерального государственного бюджетного образовательного учреждения высшего образования «Омский государственный медицинский университет» Министерства здравоохранения Российской Федерации и гинекологического отделения бюджетного учреждения здравоохранения Омской области «Областная клиническая больница» и включало больных, пролеченных с января 2013 по декабрь 2022 г. В исследование включено 123 родильницы после операции кесарева сечения, которые были разделены на 3 группы: А — с неосложненным течением послеродового эндометрита, n = 55; В — с осложненными формами послеродового эндометрита, n = 48: В1 — с локальными осложнениями (несостоятельность шва после операции кесарева сечения, параметрит), n = 29, В2 — с пельвиоперитом, n = 19; С — с септическими осложнениями после критических акушерских состояний, n = 20. Проводилась оценка патогенной микрофлоры полости матки, брюшной полости, определялась степень обсемененности возбудителем и чувствительности к антибактериальным препаратам. Выделенные микроорганизмы идентифицировали с использованием бактериологического анализатора MicroTax (Австрия), Vitek2 Compact (Франция) и с использованием рутинных методов, для определения чувствительности микроорганизмов к антибактериальным препаратам использовался диско-диффузионный метод. Проведение расчетов проводилось при помощи пакета лицензионных программ Microsoft Office Excel 2013, Statistica 10 (StatSoftInc., США). Сравнение непараметрических качественных данных проводилось при помощи критерия хи-квадрат Пирсона с определением p-значения.
Результаты. Среди патогенной микрофлоры превалировали S. epidermidis, E. faecalis, E. coli, E. faecium. В 2018–2022 гг. произошло статистически значимое уменьшение высеваемости S. epidermidis (р = 0,016), E. faecalis (р < 0,001), E. faecium (р = 0,05). Наибольшую резистентность S. epidermidis проявлял к цефалоспоринам (30,16%); E. faecalis — к фторхинолонам (33,33%); E. coli — к цефалоспоринам (65,91%) и ингибитор-защищенным пенициллинам (40,91%); E. faecium — к аминопенициллинам (64,10%) и фторхинолонам (50,0%); А. baumannii — к фторхинолонам, цефалоспоринам, карбапенемам (100%) и аминогликозидам (84,2%). При оценке степени контаминации в 60,53% выявлялся высокий титр высеваемых микроорганизмов. В сравнении с неосложненным эндометритом при пельвиоперитоните статистически достоверно чаще высевались S. еpidermidis (р < 0,001), E. faecium (р = 0,01), A. baumannii (р = 0,02); при гнойно-септических осложнениях вследствие критических акушерских состояний — S. еpidermidis (р < 0,001), E. coli (р = 0,04), E. faecium (р = 0,005), A. baumannii (р < 0,001), K. рneumoniae (р = 0,04).
Заключение. Антибиотикорезистентность патогенных микроорганизмов требует разработки новых технологий органно-системной поддержки и применение методов, обладающих способностью сорбировать микроорганизмы и их токсины в очаге воспаления.
Ключевые слова
Для цитирования:
Лазарева О.В., Баринов С.В., Шифман Е.М., Попова Л.Д., Шкабарня Л.Л., Тирская Ю.И., Кадцына Т.В., Чуловский Ю.И. Характеристика патогенной микрофлоры при гнойно-септических осложнениях послеродового периода: ретроспективное когортное исследование. Кубанский научный медицинский вестник. 2023;30(3):15-24. https://doi.org/10.25207/1608-6228-2023-30-3-15-24
For citation:
Lazareva O.V., Barinov S.V., Shifman E.M., Popova L.D., Shkabarnya L.L., Tirskaya Yu.I., Kadtsyna T.V., Chulovsky Yu.I. Characterization of Pathogenic Microflora Causing Suppurative Septic Postpartum Complications: a Retrospective Cohort Study. Kuban Scientific Medical Bulletin. 2023;30(3):15-24. https://doi.org/10.25207/1608-6228-2023-30-3-15-24
ВВЕДЕНИЕ
Одна из главных проблем современного акушерства связана с высоким уровнем гнойно-септических осложнений послеродового периода, частота которых остается ведущей в структуре причин материнской смертности, несмотря на развитие новых технологий в медицине [1]. Вероятность развития инфекционных осложнений послеродового периода определяется характером патогенной микрофлоры, общим состоянием здоровья женщины, наличием хронических заболеваний, осложнениями беременности и родоразрешения, величиной кровопотери, оперативным родоразрешением [2]. Массовое использование антибиотиков и устойчивость, выработанная микроорганизмами, являются наиболее важными вопросами, с которыми мы имеем дело в течение последних десятилетий при лечении воспалительных осложнений [3].
Степень тяжести гнойно-септических послеродовых заболеваний определяется тремя основными компонентами: инфекцией, ответной реакцией организма на инфекцию и органной дисфункцией. Широкий ряд патогенов может вызвать опасные для жизни реакции во многих органах, следовательно, гнойно-септические осложнения имеют разнообразный спектр клинических проявлений. Физиологические, иммунологические и механические изменения во время беременности делают женщин более восприимчивым к инфекциям по сравнению с небеременными, особенно в послеродовом периоде [4].
Клинические проявления гнойно-септических послеродовых осложнений варьируют от легких до тяжелых форм и не всегда соответствуют активности инфекционного процесса, что нередко приводит к их поздней диагностике и генерализации процесса [5]. Гнойно-септические осложнения после оперативного родоразрешения имеют более тяжелое течение в сравнении с естественными родами. Во всем мире в последние годы отмечается стойкая тенденция к увеличению частоты оперативного родоразрешения, связанная с перинатальной направленностью акушерства. Несмотря на совершенствование техники операции, использование современных шовных материалов и антибактериальных препаратов, кесарево сечение остается сложной операцией и создает дополнительный риск для возникновения послеродовых послеоперационных осложнений, среди которых превалируют воспалительные процессы. Риск развития инфекционных осложнений после кесарева сечения в 20 раз выше, чем после естественных родов [6][7]. Наиболее частым септическим осложнением после кесарева сечения является эндометрит, который при прогрессировании инфекционного процесса может привести к несостоятельности послеоперационного шва, параметриту, пельвиоперитониту, сепсису [8].
В последние десятилетия изменилась структура возбудителей гнойно-септических послеродовых заболеваний, что связано с селекцией микроорганизмов под действием антибиотиков. В «доантибиотическую» эру произошла замена стрептококка на золотистого стафилококка по причине активного применения бензилпенициллина. В дальнейшем применение бета-лактамных антибиотиков вызвало повышение этиологической значимости грамотрицательных микроорганизмов. Послеродовой эндометрит в большинстве случаев развивается в результате воздействия аэробов, как грампозитивных (β-гемолитический Streptococcus группы А, коагулазоположительный Staphylococcus aureus, Streptococcus группы В, Streptococcus pneumoniae, Enterococcus faecalis, Listeriamono cytogenes), так и грамнегативных (Escherichia coli, Haemophilus influenza, Klebsiella species, Proteus species, Pseudomonas species, Serrata species, Gardnerella vaginalis, Bacteroides fragilis). Реже эндометрит развивается вследствие инфекций, передаваемых половым путем, такими как Neisseria gonorrhoeae, Chlamydia trachomatis [9].
Нерациональное применение антибиотиков в акушерской практике создало условия для селекции штаммов с приобретенной устойчивостью к антибиотикам из нескольких фармакологических групп, используемых для лечения родильниц с септическими осложнениями: амоксициллину, амоксициллин/клавулановой кислоте, пиперациллин-тазобактаму, гентамицину. Имеются данные последних лет об увеличении этиологической значимости представителей рода энтерококков за счет формирования устойчивости к цефалоспоринам [9][10].
Таким образом, несмотря на значительный объем информации об этиологии и клинико-патогенетических вариантах гнойно-септических осложнений послеродового периода, она требует постоянного изучения и анализа.
Цель исследования — оценить высеваемую патогенную микрофлору у родильниц с гнойно-септическими осложнениями послеродового периода.
МЕТОДЫ
Дизайн исследования
Проведено ретроспективное когортное исследование (анализ медицинской документации) 123 родильниц с гнойно-септическими осложнениями послеродового периода. Собраны анамнестические, клинические и лабораторные данные.
Условия проведения исследования
Исследование проведено на базе кафедры акушерства и гинекологии № 2 федерального государственного бюджетного образовательного учреждения высшего образования «Омский государственный медицинский университет» Министерства здравоохранения Российской Федерации (ФГБОУ ВО ОмГМУ Минздрава России) и гинекологического отделения бюджетного учреждения здравоохранения Омской области «Областная клиническая больница» (БУЗОО «Областная клиническая больница»). Анализ осложнений после оперативного родоразрешения проводился согласно данным медицинской карты стационарных больных (история болезни) родильниц с гнойно-септическими осложнениями послеродового периода, пролеченных с января 2013 по декабрь 2022 г.
Критерии соответствия
Критерии включения
Наличие гнойно-септического осложнения после оперативного родоразрешения, подтвержденного клиническими и лабораторными методами диагностики в течение 42 дней после родов.
Критерии невключения
Активное течение специфических инфекционных (туберкулез, вирусные гепатиты B, C) и венерических (сифилис, гонорея) заболеваний; злокачественные опухоли; тяжелая экстрагенитальная патология.
Описание критериев соответствия (диагностические критерии)
Диагноз гнойно-септических послеродовых осложнений устанавливался на основании критериев, отраженных в клинических рекомендациях Министерства здравоохранения Российской Федерации «Септические осложнения в акушерстве» от 10.01.2017 г.1 В базу данных исследования были включены результаты бактериологического исследования аспирата полости матки, отделяемого брюшной полости, полученные у родильниц, зафиксированные в медицинской документации.
Подбор участников в группы
На основе анализа 7204 историй родов пациенток, родоразрешенных путем операции кесарева сечения, было выявлено 123 родильницы с гнойно-септическими осложнениями послеродового периода, развившимися в течение 42 суток после родоразрешения: эндометрит, несостоятельность послеоперационного шва, параметрит, пельвиоперитонит (МКБ-10 О86.8 «Другие уточненные послеродовые инфекции», О86.0 «Инфекция хирургической акушерской раны»). Данные послеродовые инфекции были сгруппированы для оценки характеристики ведущей патогенной микрофлоры при различных видах осложнений, определения ее резистентности к антибактериальным препаратам, что должно способствовать проведению целенаправленной рациональной терапии. На основании анамнестических, клинических, лабораторных и инструментальных данных было сформировано 3 группы: группа А — с неосложненным течением послеродового эндометрита; группа В — с осложненными формами послеродового эндометрита: В1 — с локальными осложнениями (несостоятельность шва после операции кесарева сечения, параметрит), В2 — с пельвиоперитом; группа С — с септическими осложнениями после критических акушерских состояний (массивное акушерское кровотечение, тяжелая преэклампсия).
Целевые показатели исследования
Основной показатель исследования
Оценивали характеристику патогенной микрофлоры полости матки, брюшной полости родильниц с различными формами гнойно-септических осложнений на первые сутки поступления в стационар, до начала эмпирической антибактериальной терапии.
Дополнительные показатели исследования
С целью определения этиологической значимости микроорганизмов в развитии послеродового эндометрита определяли их количественный показатель. Для оценки степени обсемененности использовались критерии, где низкой степени соответствовали результаты 102–103 КОЕ/мл, средней — 104 КОЕ/мл, высокой — 105 КОЕ/мл и выше.
Методы измерения целевых показателей
Проведен анализ 171 бактериологического исследования, полученных от 123 родильниц с различными формами гнойно-септических осложнений. Материал из полости матки забирали в асептических условиях с помощью одноразового стерильного аспирационного устройства, предварительно введенного в цервикальный канал, что исключало контаминацию взятого образца микробиотой цервикального канала и влагалища (n = 103). Для аспирации использовали стерильные одноразовые силиконовые катетеры, вводимые в цервикальный канал и исключающие возможность загрязнения пробы вагинальной и цервикальной микрофлорой. Вакуум-аспирацию проводили с использованием одноразового стерильного шприца-аспиратора, помещали в стерильный контейнер с транспортной средой. Забор материала из брюшной полости в области раны был выполнен интраоперационно (n = 68). В бактериологической лаборатории для выделения аэробной и микроаэрофильной флоры использовался количественный посев на 5%-ный кровяной агар. Для выделения энтеробактерий — агар Эндо. Для выделения стафилококков — среда ЖСА (желточно-солевой агар). Грибы рода Candida выращивали на агаре Сабуро. В качестве среды обогащения использовалась тиогликолевая среда. Облигатные анаэробы культивировали на агаре Schaedler с добавлением 5%-ной крови или на тиогликолевой среде. Выделенные микроорганизмы идентифицировали с использованием бактериологического анализатора MicroTax (Австрия) (с 2018 г. Vitek2 Compact, Франция) и с использованием рутинных методов. Микроорганизмы идентифицировались по роду и виду, а также определялась степень обсемененности возбудителем. Для определения чувствительности микроорганизмов к антибактериальным препаратам использовался диско-диффузионный метод согласно рекомендациям Европейского комитета по определению чувствительности к антимикробным препаратам (European Committeeon Antimicrobial Susceptibility Testing — EUCAST).
Переменные (предикторы, конфаундеры, модификаторы эффекта)
При проведении исследования были рассмотрены потенциальные предикторы риска: анемия, острые и обострение хронических инфекционных заболеваний во время беременности, хоринамнионит, кесарево сечение на фоне вагинита, длительный безводный промежуток, увеличение числа повторных кесаревых сечений, интервал между родами менее 1 года, гипоксия плода и наличие мекониальных околоплодных вод.
Статистические процедуры
Принципы расчета размера выборки
Предварительный расчет выборки не проводился.
Статистические методы
Математическая и статистическая обработка данных проводилась при помощи пакета лицензионных программ Microsoft Office Excel 2013, Statistica 10 (StatSoft Inc., США). Качественные показатели представлены в абсолютных и относительных величинах (%). Для сравнения непараметрических качественных данных в двух независимых группах проводился расчет показателя хи-квадрат Пирсона с определением p-значения. Различия считались статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
Формирование выборки исследования
Из 7204 женщин после операции кесарева сечения у 1,7% (n = 123) развились гнойно-септические осложнения: 44,7% (n = 55/123) — послеродовый эндометрит, 39,0% (n = 48/123) — осложнения послеродового эндометрита (23,6% (n = 29/123— несостоятельность шва и параметрит, 15,4% (n = 19/123) — пельвиоперитонит, 16,3% (n = 20/123) — септические осложнения после критических акушерских состояний (массивные акушерские кровотечения, преэклампсия) (рис. 1).
Блок-схема дизайна исследования представлена на рисунке 2.
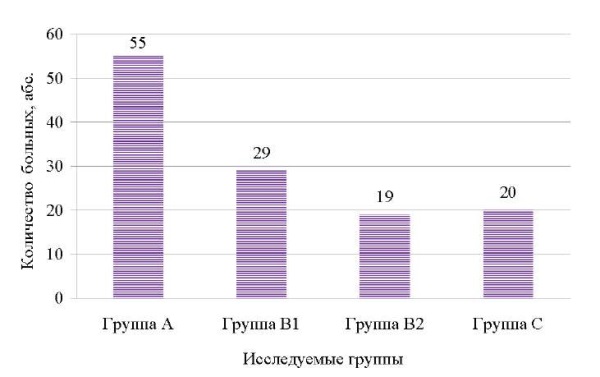
Рис. 1. Структура гнойно-септических послеродовых осложнений после операции кесарева сечения.
Примечание: рисунок выполнен авторами.
Fig. 1. Structure of suppurative septic postpartum complications following a cesarean section.
Note: The figure was created by the authors.
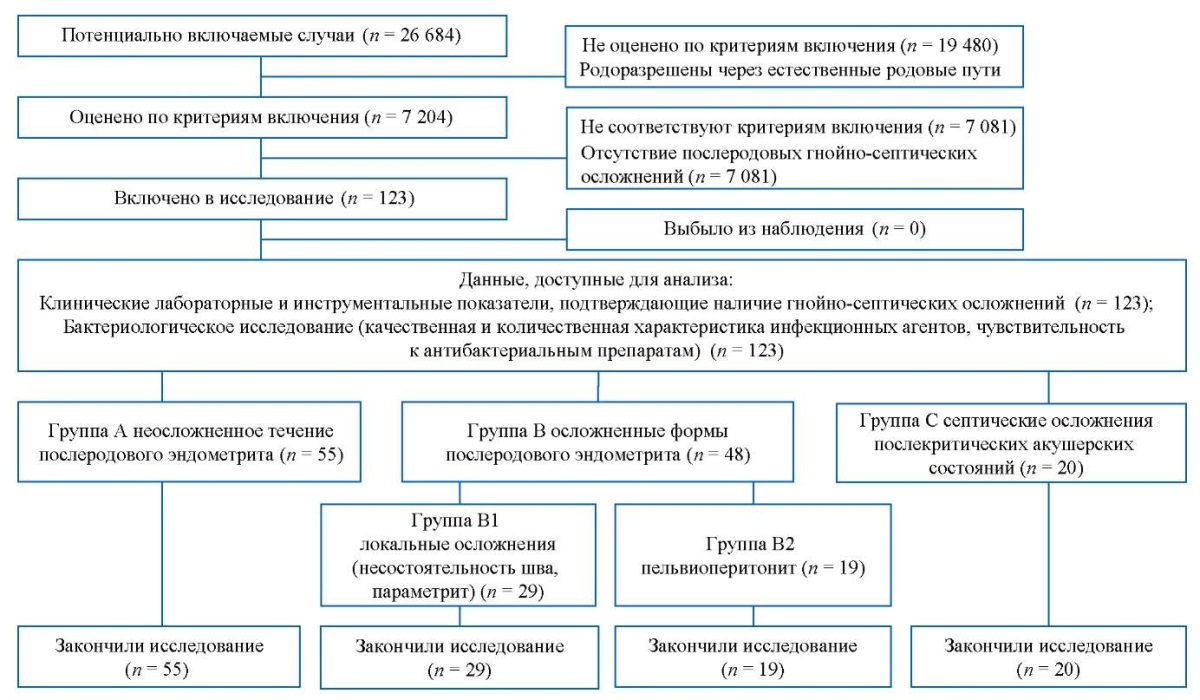
Рис. 2. Блок-схема дизайна исследования.
Примечание: блок-схема выполнена авторами (согласно рекомендациям STROBE).
Fig. 2. Block diagram of the study design.
Note: The block diagram was created by the authors (as per STROBE recommendations).
Характеристики выборки (групп) исследования
Основные анамнестические, клинические и технические факторы родоразрешения представлены в таблице 1.
Таблица 1. Характеристика пациенток, включенных в исследование (n; %)
Table 1. Characteristics of patients included in the study (n; %)
|
Параметры |
ГСО осложнения после кесарева сечения, n = 123 |
Отсутствие ГСО после кесарева сечения, n = 7204 |
p * р < 0,05 |
|
Средний возраст (лет) |
28,0 ± 4,8 |
27 ± 3,6 |
- |
|
Гестационный срок (недели) |
35,0 ± 2,1 |
38 ± 1,6 |
- |
|
Гестационный срок <35 недель |
31,0 (25,2) |
360 (4,9) |
<0,001* |
|
ИМТ |
29,5 ± 2,1 |
27 ± 1,7 |
- |
|
Кесарево сечение в предыдущих родах |
25,0 (20,3) |
920 (12,8) |
0,02* |
|
Аборты в анамнезе |
37,0 (30,1) |
2140 (29,7) |
0,99 |
|
Хроническая соматическая и гинекологическая патология |
|||
|
Экстрагенитальные хронические инфекционные заболевания |
81 (65,8) |
4234 (58,8) |
0,14 |
|
Хроническая анемия |
56 (45,5) |
867 (12,0) |
0,25 |
|
Гинекологические заболевания |
35 (28,5) |
2875 (39,9) |
0,01* |
|
Течение беременности |
|||
|
Угроза прерывания |
38 (30,9) |
2154 (29,9) |
0,89 |
|
Плацентарные нарушения |
18 (14,6) |
1453 (20,2) |
0,16 |
|
Анемия беременных |
92 (74,8) |
4105 (56,9) |
<0,001* |
|
Преэклампсия |
34 (27,6) |
923 (12,8) |
<0,001* |
|
Острые респираторные инфекции |
87 (70,7) |
5870 (81,5) |
0,004* |
|
Вагиниты |
97 (78,9) |
6457 (89,6) |
<0,001* |
|
Гестационный сахарный диабет |
5 (4,1) |
231 (3,2) |
0,78 |
|
Хорионамнионит |
6 (4,9) |
121 (1,7) |
0,02* |
|
Выполнение кесарева сечения |
|||
|
По неотложным показаниям |
102 (82,9) |
3457 (47,9) |
<0,001* |
|
Плановая операция |
21 (17,1) |
3747 (52,1) |
<0,001* |
|
Показания к кесареву сечения |
|||
|
Дистресс плода |
39 (31,7) |
2032 (28,2) |
0,45 |
|
Аномалии родовой деятельности |
18 (14,6) |
957 (13,3) |
0,76 |
|
Клинически узкий таз |
11 (8,9) |
832 (11,5) |
0,45 |
|
Преэклампсия |
19 (15,4) |
634 (8,8) |
0,02* |
|
Отслойка плаценты |
15 (12,2) |
284 (3,9) |
<0,001* |
|
Предлежание плаценты |
4 (3,3) |
654 (9,1) |
0,04* |
|
Рубец на матке |
16 (13,0) |
1811 (25,1) |
0,003* |
|
Особенности операции |
|||
|
Продолжительность (минут) |
79 ± 23 |
38 ± 18 |
- |
|
Кровопотеря (мл) |
860 ± 320 |
540 ± 120 |
- |
|
Гемотрансфузия |
46 (37,4) |
760 (10,5) |
<0,001* |
Примечания: таблица составлена авторами; * — статистически значимые различия между группами (р < 0,05). Сокращения: ИМТ — индекс массы тела; ГСО — гнойно-септические осложнения.
Notes: The table was compiled by the authors; * — statistically significant difference between groups (р < 0.05); Abbreviations: BMI — body mass index; SSC — suppurative septic complications.
Основные результаты исследования
Проведен анализ высеваемой микрофлоры у пациенток с гнойно-септическими осложнениями послеродового периода за 2013–2022 гг. Результаты сравнительного анализа за периоды 2013–2017 и 2018–2022 гг. представлены в таблице 2.
Таблица 2. Результаты бактериологического исследования пациенток с гнойно-септическими осложнениями послеродового периода
Table 2. Results of bacteriological examination of patients with septic complications of the puerperium
|
Верифицированные возбудители |
2013–2017 гг., n = 65 |
2018–2022 гг. n = 58 |
Критерий хи-квадрат |
Уровень значимости р |
||
|
абс. |
% |
абс. |
% |
|||
|
Staphylococcus epidermidis, n = 63 |
40 |
61,54 |
23 |
39,66 |
5,87 |
0,016* |
|
Enterococcus faecalis, n = 48 |
35 |
53,85 |
13 |
22,41 |
12,77 |
<0,001* |
|
Escherichia coli, n = 48 |
23 |
35,38 |
25 |
43,10 |
0,77 |
0,38 |
|
Enterococcus faecium, n = 39 |
20 |
30,77 |
9 |
15,51 |
3,96 |
0,05* |
|
Acinetobacter baumannii, n = 15 |
9 |
13,85 |
6 |
10,34 |
0,35 |
0,55 |
|
Candida albicans, n = 9 |
6 |
9,23 |
3 |
5,17 |
0,74 |
0,39 |
|
Klebsiella pneumoniae, n = 15 |
9 |
13,85 |
6 |
10,34 |
0,35 |
0,55 |
|
Staphylococcus haemolyticus, n = 11 |
5 |
7,69 |
6 |
10,34 |
0,26 |
0,61 |
|
Corynebacterium amycolatum, n = 6 |
2 |
3,08 |
4 |
6,90 |
0,96 |
0,33 |
|
Peptostreptococcus spp., n = 2 |
2 |
3,08 |
- |
- |
1,81 |
0,18 |
|
Streptococcus anginosus, n = 2 |
2 |
3,08 |
- |
- |
1,81 |
0,18 |
|
Staphylococcus warneri, n = 3 |
2 |
3,08 |
1 |
1,72 |
0,24 |
0,63 |
|
Pantoea agglomerans, n = 1 |
1 |
1,54 |
- |
- |
0,90 |
0,34 |
|
Pseudomonas aeruginosa, n = 1 |
1 |
1,54 |
- |
- |
0,90 |
0,34 |
Примечания: таблица составлена авторами; * — статистически значимая разница между группами (р < 0,05).
Notes: The table was compiled by the authors; * — statistically significant difference between groups (р < 0.05).
В 2013–2017 гг. среди высеваемой патогенной микрофлоры на первом месте был S. epidermidis, на втором — E. faecalis, на третьем — E. coli и E. faecium; в 2018–2022 гг. на первом месте — S. epidermidis, на втором — E. coli, на третьем — E. faecalis.
Согласно рисунку 3, в 2018–2022 гг. произошло статистически значимое уменьшение высеваемости S. epidermidis (р = 0,016), E. faecalis (р < 0,001), в 2,0 раза — E. faecium, в 1,3 — А. baumannii, в 1,8 раза — С. albicans. Однако отмечено увеличение E. coli в 1,2 раза, S. haemolyticus — в 1,3 раза, C. аmycolatum — в 2,2 раза.
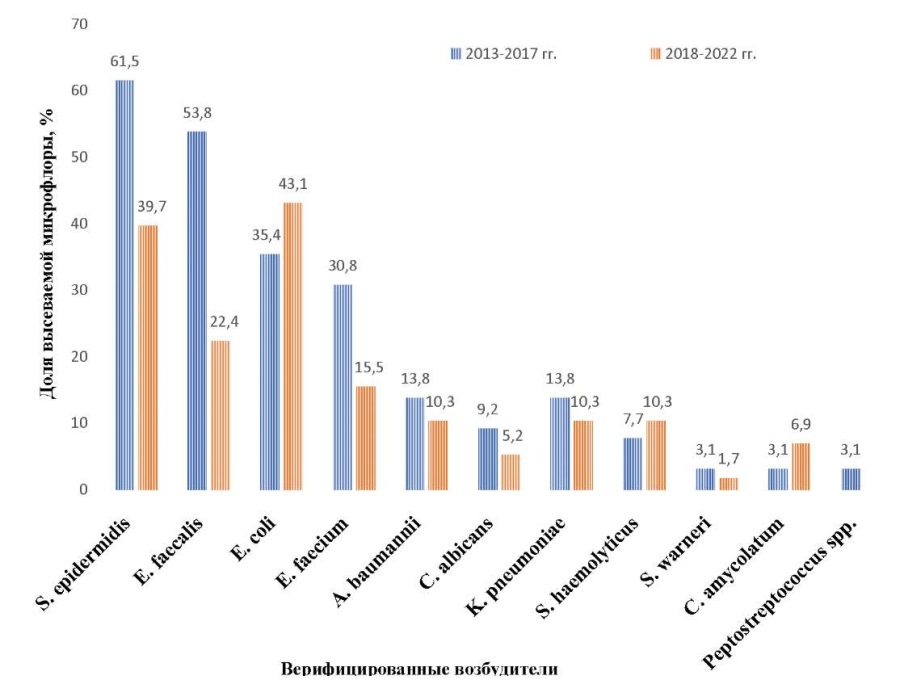
Рис. 3. Сравнительный анализ патогенной микрофлоры за 2013–2017 и 2018–2022 гг.
Примечание: рисунок выполнен авторами.
Fig. 3. Comparative analysis of pathogenic microflora for 2013–2017 and 2018–2022.
Note: The figure was created by the authors.
При оценке резистентности патогенной микрофлоры к антибактериальным препаратам были получены следующие данные. S. epidermidis проявлял резистентность к цефалоспоринам — в 30,16%, к клиндамицину — в 22,22%, к аминопенициллинам — в 11,11%, к карбапенемам — в 11,11% случаев. E. faecalis был нечувствителен к фторхинолонам в 33,33%, к аминопенициллинам — в 6,25%, к ингибитор-защищенным пенициллинам (амоксициллин клавуланат) — 4,17%, к цефалоспоринам — в 4,17% случаев. Резистентность E. coli к цефалоспоринам выявлялась в 65,91%, к ингибитор-защищенным пенициллинам (амоксициллин клавуланат) — в 40,91%, к аминогликозидам — в 27,23%, к пенициллинам — в 18,18%, к фторхинолонам — в 15,91%, к карбапенемам — в 2,27% случаев. E. faecium был резистентен к аминопенициллинам — в 64,10%, к фторхинолонам — в 50,0%, к карбапенемам — в 20,51%, к ванкомицину — в 7,69%, к ингибитор-защищенным пенициллинам (амоксициллин клавуланат) — в 5,13% случаев. А. baumannii проявлял резистентность к фторхинолонам, цефалоспоринам, карбапенемам в 100%, к аминогликозидам — в 84,2%.
Анализ патогенной микрофлоры, высеваемой при различных формах септических осложнений, представлен в таблице 3.
Таблица 3. Результаты бактериологического исследования родильниц при различных формах гнойно-септических осложнений послеродового периода
Table 3. Results of bacteriological examination in obstetric patients with various forms of suppurative septic postpartum complications
|
Верифицированные возбудители |
Группа А, n = 55% |
Группа В1, n = 29% |
Группа В2, n = 19% |
Критерий хи-квадрат, значение рА-В2 |
Группа С, n = 20% |
Критерий хи-квадрат, значение рА-С |
|
S. epidermidis |
25,45 |
75,86 |
68,42 |
<0,001* |
70,00 |
<0,001 |
|
E. faecalis |
32,73 |
58,62 |
36,84 |
0,74 |
30,00 |
0,82 |
|
E. coli |
34,55 |
55,17 |
57,90 |
0,07 |
10,00 |
0,04* |
|
E. faecium |
10,91 |
62,07 |
36,84 |
0,01* |
40,00 |
0,005* |
|
A. baumannii |
1,82 |
17,24 |
15,90 |
0,02* |
30,00 |
<0,001* |
|
C. albicans |
3,64 |
1,82 |
15,90 |
0,07 |
15,00 |
0,08 |
|
K. pneumoniae |
7,27 |
6,90 |
21,05 |
0,09 |
25,00 |
0,04* |
|
S. haemolyticus |
10,91 |
10,34 |
- |
0,13 |
10,00 |
0,91 |
|
P. agglomerans |
- |
- |
- |
5,00 |
0,09 |
|
|
С. amycolatum |
7,27 |
6,90 |
- |
0,23 |
- |
0,22 |
|
Peptostreptococcus spp. |
- |
- |
10,53 |
0,01* |
- |
- |
|
S. anginosus |
1,82 |
1,82 |
- |
0,55 |
- |
0,54 |
|
S. warneri |
1,82 |
6,90 |
- |
0,55 |
- |
0,54 |
|
P. aeruginosa |
- |
- |
- |
5,00 |
0,09 |
Примечания: таблица составлена авторами, рА-В2 — значение критерия р между группой А и В2; рА-С — значение критерия р между группой А и В2; * — статистически значимая разница между группами (р < 0,05).
Notes: The table was compiled by the authors; рА-В2 — p-value between Groups A and B2; рА-С — p-value between Groups A and C; * — statistically significant difference between groups (р < 0.05).
Согласно таблице 3, в сравнении с неосложненным эндометритом при пельвиоперитоните статистически значимо чаще высевался S. еpidermidis, E. faecium, A. baumannii, при септических осложнениях вследствие критических акушерских состояний — S. еpidermidis, E. coli, E. faecium, A. baumannii, K. рneumoniae.
Дополнительные показатели исследования
При оценке степени обсемененности выделялись микроорганизмы в высоком титре в 60,53%, в среднем — в 11,84%, в низком — в 27,63% случаев.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Проведенное нами исследование качественной и количественной характеристики патогенной микрофлоры при различных формах гнойно-септических осложнений послеродового периода, а также оценка ее чувствительности к основным видам антибактериальных препаратов, используемых в клинической практике, позволит улучшить результаты лечения родильниц с данной патологией за счет выбора адекватной терапии уже при постановке диагноза до получения результатов бактериологического исследования и расширить поиск новых методов лечения, основанных на воздействии на патогенную микрофлору в очаге инфицирования.
Ограничения исследования
Ограничение ретроспективного исследования связано с определенной «предвзятостью» документации. Это исследование с небольшим количеством пациентов, что может повлиять на конечные результаты.
Интерпретация результатов исследования
Проведенное исследование показало, что среди патогенной микрофлоры, вызывающей гнойно-септические осложнения послеродового периода, превалируют S. epidermidis, E. faecalis, E. coli, E. faecium. В 2018–2022 гг. произошла смена патогена — E. coli заняла второе место вместо E. faecalis. Данные микроорганизмы удерживают лидирующие позиции в течение последних 5–7 лет, что подтверждается рядом исследований [10–13]. Их активация обусловлена снижением иммунологической реактивности организма родильниц во время беременности, родов, оперативного вмешательства [14][15].
Мы предполагаем, что статистически значимое уменьшение высеваемости S. epidermidis (р = 0,016), E. faecalis (р < 0,001), E. faecium (р = 0,05) в 2018–2022 гг. связано с широким использованием ингибитор-защищенного пенициллина (амоксициллин клавуланат), карбапенемов для лечения родильниц с гнойно-септическими послеродовыми осложнениями, к которым у патогенов пока отмечается низкая резистентность. Однако в медицине имеется реальная проблема, связанная с биологической устойчивостью бактерий к антибиотикам, что заставляет искать новые методы для воздействия на очаг инфицирования [13][16][17]. При анализе микробного агента в зависимости от вида гнойно-септических осложнений было показано, что S. epidermidis, E. faecalis, E. coli, E. faecium занимают лидирующие позиции, независимо от формы осложнений. Имеются данные литературы о ведущей роли грамположительных бактерий в развитии акушерского перитонита, а также ассоциаций грамположительной и грамотрицательной микрофлоры у значительной части заболевших женщин [18–21], что подтверждается нашим исследованием.
При оценке степени контаминации микрофлорой у более чем половины обследуемых нами родильниц (60,53%) выявлялся высокий титр. Степень контаминации зависит от состояния здоровья родильницы, характеристики микроорганизмов и их вирулентности и позволяет дифференцировать патогенных возбудителей от микроорганизмов-контаминантов [22]. В современных условиях выросла частота осложнений, вызванных неферментирующими грамотрицательными бактериями (P. aeruginosa и Acinetobacter spp.), которые являются возбудителями сепсиса у пациентов отделений реанимации и интенсивной терапии [23]. По результатам нашего исследования P. аeruginosa была выявлена только у родильниц с септическими осложнениями после критических акушерских состояний (5,00%). У обследуемых нами родильниц A. baumannii выявлялся в 8,7 раза чаще при пельвиоперитоните (р = 0,02), а при осложнениях вследствие критических акушерских осложнений — в 16,5 раза (р < 0,001) в сравнении с неосложненными эндометритом. Инфицирование A. baumannii может привести к летальному исходу от инфекционно-токсического шока и полиорганной недостаточности [11].
Крайне неблагоприятным феноменом является панрезистентность — устойчивость ко всем, рекомендованным для терапии антибактериальным препаратам [24][25]. Прежде всего это относится к A. baumannii, обладающему крайне высокой способностью к экспрессии генов, реализующих механизмы устойчивости, что было показано в нашем исследовании. Определенный интерес представляла высеваемость K. рneumoniae, которая в 2,9 раза чаще определялась у пациенток с акушерским перитонитом и в 3,4 раза — после критических акушерских состояний в сравнении с неосложненным эндометритом. Присутствие данных микроорганизмов часто сопровождается тяжелыми септическими осложнениями.
Нерациональное использование антибиотиков в клинической практике является основным условием формирования бактерий с множественной лекарственной устойчивостью или даже абсолютной резистентностью к любым препаратам, так называемых супербактерий ESCAPE [9][26].
ЗАКЛЮЧЕНИЕ
В этиологии и развитии гнойно-септических заболеваний послеродового периода на протяжении последних 10 лет прослеживается роль конкретных возбудителей, доминирующими из которых являются S. epidermidis, E. faecalis, E. coli, E. faecium. Нерациональное использование антибиотиков в медицине создает условия для формирования множественной лекарственной устойчивости. Это требует внедрения новых технологий органно-системной поддержки, соответствующего инфекционного контроля и разработки новых методов, в том числе широкого использования формованных углеродных сорбентов с различными модификаторами, обладающих способностью сорбировать микроорганизмы и их токсины в очаге воспаления.
1. Письмо Минздрава России от 06.02.2017 № 15-4/10/2-728 «О направлении клинических рекомендаций «Септические осложнения в акушерстве» (вместе с «Клиническими рекомендациями (протоколом лечения)…», утверждены Российским обществом акушеров-гинекологов 10.01.2017, Обществом акушерских анестезиологов-реаниматологов 09.01.2017). Available: http://uklcrb.ru/doc/010419_1505.pdf
Список литературы
1. Иванников Н.Ю., Митичкин А.Е., Димитрова В.И., Слюсарева О.А., Хлынова С.А., Доброхотова Ю.Э. Современные подходы в лечении послеродовых гнойно-септических заболеваний. Медицинский совет. 2019; 7: 58–69. DOI: 10.21518/2079-701X-2019-7-58-69
2. Axelsson D., Brynhildsen J., Blomberg M. Postpartum infection in relation to maternal characteristics, obstetric interventions and complications. J. Perinat. Med. 2018; 46(3): 271–278. DOI: 10.1515/jpm-2016-0389
3. Contro E., Jauniaux E. Puerperal sepsis: what has changed since Semmelweis’stime. BJOG. 2017; 124(6): 936. DOI: 10.1111/1471-0528.14377
4. Bonet M., Nogueira Pileggi V., Rijken M.J., Coomarasamy A., Lissauer D., Souza J.P., Gülmezoglu A.M. Towards a consensus definition of maternal sepsis: results of a systematic review and expert consultation. Reprod. Health. 2017; 14(1): 67. DOI: 10.1186/s12978-017-0321-6
5. Woodd S.L., Montoya A., Barreix M., Pi L., Calvert C., Rehman A.M., Chou D., Campbell O.M.R. Incidence of maternal peripartum infection: A systematic review and meta-analysis. PLoS Med. 2019; 16(12): e1002984. DOI: 10.1371/journal.pmed.1002984
6. Singh N., Sethi A. Endometritis — Diagnosis,Treatment and its impact on fertility — A Scoping Review. JBRA Assist.Reprod. 2022; 26(3): 538–546. DOI: 10.5935/1518-0557.20220015
7. Shi M., Chen L., Ma X., Wu B. The risk factors and nursing countermeasures of sepsis after cesarean section: a retrospective analysis. BMC Pregnancy Childbirth. 2022; 22(1): 696. DOI: 10.1186/s12884-022-04982-8
8. Zeng S., Liu X., Liu D., Song W. Research update for the immune microenvironment of chronic endometritis. J. Reprod. Immunol. 2022; 152: 103637. DOI: 10.1016/j.jri.2022.103637
9. Жилинкова Н.Г. Современные представления о пуэрперальных инфекциях в связи с антибактериальной резистентностью и завершением эры антибиотиков. Акушерство и гинекология: новости мнения, обучение. 2019; 7(3): 70–75. DOI: 10.24411/2303-9698-2019-13010
10. Abu Shqara R., Bussidan S., Glikman D., Rechnitzer H., Lowenstein L., Frank Wolf M. Clinical implications of uterine cultures obtained during urgent caesarean section. Aust. N Z J Obstet. Gynaecol. 2022. DOI: 10.1111/ajo.13630
11. Zejnullahu V.A., Isjanovska R., Sejfija Z., Zejnullahu V.A. Surgical site infections after cesarean sections at the University Clinical Center of Kosovo: rates, microbiological profile and risk factors. BMC Infect. Dis. 2019; 19(1): 752. DOI: 10.1186/s12879-019-4383-7
12. Li L., Cui H. The risk factors and care measures of surgical site infection after cesarean section in China: a retrospective analysis. BMC Surg. 2021; 21(1): 248. DOI: 10.1186/s12893-021-01154-x
13. Ahmed S., Kawaguchiya M., Ghosh S., Paul S.K., Urushibara N., Mahmud C., Nahar K., Hossain M.A., Kobayashi N. Drug resistance and molecular epidemiology of aerobic bacteria isolated from puerperal infections in Bangladesh. Microb.Drug. Resist. 2015; 21(3): 297–306. DOI: 10.1089/mdr.2014.0219
14. Sáez-López E., Guiral E., Fernández-Orth D., Villanueva S., Goncé A., López M., Teixidó I., Pericot A., Figueras F., Palacio M., Cobo T., Bosch J., Soto S.M. Vaginal versus Obstetric Infection Escherichia coli Isolates among Pregnant Women: Antimicrobial Resistance and Genetic Virulence Profile. PLoS One. 2016; 11(1): e0146531. DOI: 10.1371/journal.pone.0146531
15. Malmir M., Boroojerdi N.A., Masoumi S.Z., Parsa P. Factors Affecting Postpartum Infection: A Systematic Review. Infect. Disord.Drug.Targets. 2022; 22(3): e291121198367. DOI: 10.2174/1871526521666211129100519
16. Society for Maternal-Fetal Medicine (SMFM). Electronic address: pubs@smfm.org; Plante L.A., Pacheco L.D., Louis J.M. SMFM Consult Series #47: Sepsis during pregnancy and the puerperium. Am. J. Obstet. Gynecol. 2019; 220(4): B2–B10. DOI: 10.1016/j.ajog.2019.01.216
17. Faure K., Dessein R., Vanderstichele S., Subtil D. Endométrites du post-partum. RPC infections génitaleshautes CNGOF et SPILF [Postpartum endometritis: CNGOF and SPILF Pelvic Inflammatory Diseases Guidelines]. Gynecol. Obstet. Fertil. Senol. 2019; 47(5): 442–450. French. DOI: 10.1016/j.gofs.2019.03.013
18. Баринов С.В., Лазарева О.В., Медянникова И.В., Тирская Ю.И., Кадцына Т.В., Леонтьева Н.Н., Шкабарня Л.Л., Чуловский Ю.И., Грицюк М.Н. К вопросу о выполнении органосохраняющих операций при послеродовом эндометрите после операции кесарева сечения. Акушерство и гинекология. 2021; 10: 67–75. DOI: 10.18565/aig.2021.10.76-84
19. Phillips C., Walsh E. Group A Streptococcal Infection During Pregnancy and the Postpartum Period. Nurs. Womens. Health. 2020; 24(1): 13–23. DOI: 10.1016/j.nwh.2019.11.006
20. Getaneh T., Negesse A., Dessie G. Prevalence of surgical site infection and its associated factors after cesarean section in Ethiopia: systematic review and meta-analysis. BMC Pregnancy Childbirth. 2020; 20(1): 311. DOI: 10.1186/s12884-020-03005-8
21. Pavoković D., Cerovac A., Ljuca D., Habek D. Post-Cesarean Peritonitis Caused by Hysterorrhaphy Dehiscence with Puerperal Acute Abdomen Syndrome. Z. Geburtshilfe. Neonatol. 2020; 224(6): 374–376. DOI: 10.1055/a-1203-0983
22. Смирнова С.С., Егоров И.А., Голубкова А.А. Гнойно-септические инфекции у родильниц. Часть 2. Клинико-патогенетическая характеристика нозологических форм, этиология и антибиотикорезистентность (обзор литературы). Журнал микробиологии, эпидемиологии и иммунобиологии. 2022; 99(2): 244–259. DOI: 10.36233/0372-9311-227
23. Bitew Kifilie A., Dagnew M., Tegenie B., Yeshitela B., Howe R., Abate E. Bacterial Profile, Antibacterial Resistance Pattern, and Associated Factors from Women Attending Postnatal Health Service at University of Gondar Teaching Hospital, Northwest Ethiopia. Int. J. Microbiol. 2018; 2018: 3165391. DOI: 10.1155/2018/3165391
24. Гельфанд Б.Р., Руднов В.А., Галстян Г.М., Гельфанд Е.Б., Заболотских И.Б., Золотухин К.Н., Кулабухов В.В., Лебединский К.М., Левит А.Л., Нехаев И.В., Николенко А.В., Проценко Д.Н., Щеголев А.В., Ярошецкий А.И. Сепсис: терминология, патогенез, клинико-диагностическая концепция. Вопросы гинекологии, акушерства и перинатологии. 2017; 16(1): 64–72. DOI: 10.20953/1726-1678-2017-1-64-72
25. Igwemadu G.T., Eleje G.U., Eno E.E., Akunaeziri U.A., Afolabi F.A., Alao A.I., Ochima O. Single-dose versus multiple-dose antibiotics prophylaxis for preventing caesarean section postpartum infections: A randomized controlled trial. Womens Health (Lond). 2022; 18: 17455057221101071. DOI: 10.1177/17455057221101071
26. Moulton L.J., Lachiewicz M., Liu X., Goje O. Endomyometritis after cesarean delivery in the era of antibiotic prophylaxis: incidence and risk factors. J. Matern. Fetal.Neonatal.Med. 2018; 31(9): 1214–1219. DOI: 10.1080/14767058.2017.1312330
Об авторах
О. В. ЛазареваРоссия
Лазарева Оксана Вячеславовна — кандидат медицинских наук, доцент кафедры акушерства и гинекологии № 2.
Ул. Ленина, д. 12, Омск, 644099
С. В. Баринов
Россия
Баринов Сергей Владимирович — доктор медицинских наук, профессор, заведующий кафедрой акушерства и гинекологии № 2.
Ул. Ленина, д. 12, Омск, 644099
Е. М. Шифман
Россия
Шифман Ефим Муневич — доктор медицинских наук, профессор кафедры анестезиологии и реаниматологии.
Ул. Щепкина, д. 61/2, г. Москва, 129090
Л. Д. Попова
Россия
Попова Лариса Дмитриевна — заведующая бактериологической лабораторией.
Ул. Березовая, д. 3, Омск, 644111
Л. Л. Шкабарня
Россия
Шкабарня Людмила Леонидовна — заведующая гинекологическим отделением.
Ул. Березовая, д. 3, Омск, 644111
Ю. И. Тирская
Россия
Тирская Юлия Игоревна — доктор медицинских наук, доцент, профессор кафедры акушерства и гинекологии № 2.
Ул. Ленина, д. 12, Омск, 644099
Т. В. Кадцына
Россия
Кадцына Татьяна Владимировна — кандидат медицинских наук, доцент кафедры акушерства и гинекологии № 2.
Ул. Ленина, д. 12, Омск, 644099
Ю. И. Чуловский
Россия
Чуловский Юрий Игоревич — кандидат медицинских наук, доцент кафедры акушерства и гинекологии № 2.
Ул. Ленина, д. 12, Омск, 644099
Дополнительные файлы
Рецензия
Для цитирования:
Лазарева О.В., Баринов С.В., Шифман Е.М., Попова Л.Д., Шкабарня Л.Л., Тирская Ю.И., Кадцына Т.В., Чуловский Ю.И. Характеристика патогенной микрофлоры при гнойно-септических осложнениях послеродового периода: ретроспективное когортное исследование. Кубанский научный медицинский вестник. 2023;30(3):15-24. https://doi.org/10.25207/1608-6228-2023-30-3-15-24
For citation:
Lazareva O.V., Barinov S.V., Shifman E.M., Popova L.D., Shkabarnya L.L., Tirskaya Yu.I., Kadtsyna T.V., Chulovsky Yu.I. Characterization of Pathogenic Microflora Causing Suppurative Septic Postpartum Complications: a Retrospective Cohort Study. Kuban Scientific Medical Bulletin. 2023;30(3):15-24. https://doi.org/10.25207/1608-6228-2023-30-3-15-24
JATS XML








































